猪囊尾蚴半胱氨酸蛋白酶TsCL-1结构的同源模建*1
杨 琳,赵琴平,杨力权(.武汉大学基础医学院,湖北 武汉 43007;2.云南省大理白族自治州血吸虫病防治研究所,云南 大理 67000;3.大理大学农学与生物科学学院,云南 大理 67003)
猪囊尾蚴半胱氨酸蛋白酶TsCL-1结构的同源模建*1
杨琳1,2,赵琴平1,杨力权3*
(1.武汉大学基础医学院,湖北 武汉 430071;2.云南省大理白族自治州血吸虫病防治研究所,云南 大理 671000;3.大理大学农学与生物科学学院,云南 大理 671003)
通过同源模建方法构建猪囊尾蚴半胱氨酸蛋白酶TsCL-1的三维结构模型,并对其结构进行分析。结果表明,TsCL-1的结构模型具有半胱氨酸蛋白酶CA族典型的α/β折叠模式,结构骨架主要由两个不同的结构域组成。结构模型具有保守的半胱氨酸催化三聚体 (Cys25-His163-Asn183),催化三聚体位于两个结构域的表面,结构模型中存在3对二硫键。研究结果将为进一步深入研究TsCL-1的结构和功能关系奠定结构基础。
半胱氨酸蛋白酶TsCL-1;结构模型;同源模建;结构功能研究
。
猪囊尾蚴病 (Cysticercosis cellulosae)又称猪囊虫病。它是由猪带绦虫 (Taenia solium)的幼虫——猪囊尾蚴 (Cysticercus cellulose)寄生于中间宿主体内而引起的一种人兽共患寄生虫病[1,2]。在人体内,猪带绦虫与两个明显的感染阶段有关,即:肠道感染 (由于成虫在宿主肠道寄生所致,也称绦虫病)和肌肉或组织感染 (由于囊尾蚴进入宿主肌肉或组织内所致,也称囊尾蚴病)[3]。由于猪囊尾蚴幼虫寄生于人体的位置和数量不同,可导致不同的临床症状,给人类健康带来严重危害[4],尤以脑囊尾蚴病为甚。
近年研究表明,由寄生虫分泌的半胱氨酸蛋白酶 (Cysteine Protease,CP)在寄生虫入侵宿主、寄生虫免疫逃避机制及寄生虫治疗中发挥了重要作用,得到了广泛的关注[3,5,6]。半胱氨酸蛋白酶TsCL-1是由猪囊尾蚴分泌的一种半胱氨酸蛋白酶,属于半胱氨酸蛋白酶CA蛋白酶中的C1族蛋白酶。研究表明,在酸性环境中,它是降解宿主IgG的主要酶,而宿主IgG可能是T.solium幼虫的主要氨基酸来源,因此它被认为是入侵宿主的重要因子之一[3,7]。目前,通过基因工程技术,TsCL-1的氨基酸序列已经被测定,对其蛋白酶的生物化学特性和反应优化条件等也进行了一定研究[3]。但由于其晶体结构未被测定,因此对其与宿主相互作用机制还未进行广泛深入的研究。本文通过同源模建技术构建猪囊尾蚴半胱氨酸蛋白酶TsCL-1的三维结构模型并对其结构进行分析,为在分子水平上揭示猪囊尾蚴虫半胱氨酸蛋白酶与宿主的相互作用机制和致病机理奠定基础。
1.材料和方法
1.1原理
同源模建[8]是基于序列-结构相似性原则,通过模板蛋白构建待测蛋白质的三维结构模型。当蛋白质序列的一致性大于30%,便可以利用模板蛋白的结构来建立靶蛋白的三维结构[8]。同源模建的原理基于两点:蛋白质的结构由其氨基酸序列唯一决定;蛋白质的结构在进化中更稳定,结构变化比序列变化要慢得多,因此序列上的相似性导致同源蛋白具有相似的三维结构,并且进化上距离较远的相关序列仍可折叠成相似的结构。
1.2序列比对和模板蛋白
猪囊尾蚴半胱氨酸蛋白酶TsCL-1的序列在UniProtKB数据库中获得 (序列号为Q6R3Q1),去掉信号肽和先导肽残基,得到包含216个氨基酸残基的成熟TsCL-1序列。在Biology Workbench生物平台中[9,10],以成熟TsCL-1序列作为查询序列,使用PSI-BLAST[10]进行序列搜寻和比对,得到的最接近序列为PDB编号1CS8的序列。TsCL-1与1CS8的序列比对结果显示 (图1),序列一致性达到57% (Identities=127/220(57%),Positives=156/220(70%),Gaps= 6/220(2%))。1CS8是一种来源于人类的半胱氨酸蛋白酶,同样属于CA蛋白酶中的C1族蛋白酶。鉴于TsCL-1与1CS8具有较好的序列一致性,选取1CS8的晶体结构作为模板蛋白。

图1 TsCL-1与1CS8序列比对结果
TsCL-1与1CS8序列比对结果,Query序列为TsCL-1序列,Sbjct序列为1CS8序列。
1.3同源模建及能量优化
本文采用Modeller9.11[11]同源模建软件包来构建半胱氨酸蛋白酶TsCL-1结构模型。模建时使用自行编写的Modeller脚本文件“align2d.py”对靶序列 (TsCL-1序列)与模板序列 (1CS8序列)进行序列比对,比对后进行手工调整使两者的保守位置尽量对齐,以保证模建结构的准确。随后用自行编写的Modeller脚本文件“model-single.py”,生成5个TsCL-1结构模型,采用模拟退火算法对结构进行能量优化,采用分子概率密度函数molpdf对模型进行评估。
2.结果和讨论
2.1模建结构模型的评估
把能量最小化后的TsCL-1分子结构模型用Procheck[12]进行模建结构的评价。得到了相应的评价结果和Ramachandran图 (图2)。结果显示,其中85.6%的氨基酸处于最适区,12.2%处于较合适区,1.1%处于可接受区,1.1%处于不合理区。由此可见,98.9%的氨基酸残基分布在Ramachandran图的二面角合理区域,也就是说98.9%的氨基酸构象是可以接受的,说明模建的结构合理。
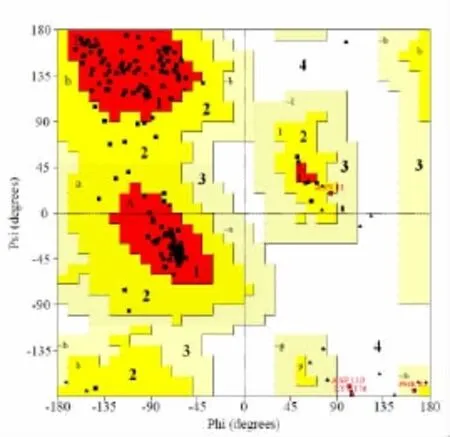
图2 TsCL-1结构模型的Ramachandran图
此图通过Procheck得到,区域1代表最适区域;区域2为较合适区域;区域3为可接受区域;区域4为不合理区域。
2.2半胱氨酸蛋白酶TsCL-1结构模型分析
半胱氨酸蛋白酶TsCL-1的结构模型主要包含两个不同的结构区域 (图3),一个结构域以α-螺旋为主要结构,另一个以反平行的β片层为主要结构。催化三聚体由Cys25,His163和Asn183组成,催化三聚体位于两个结构域的表面。在TsCL-1结构模型中存在3对二硫键,分别由Cys22和Cys65、Cys56和Cys97、Cys156和Cys205构成。
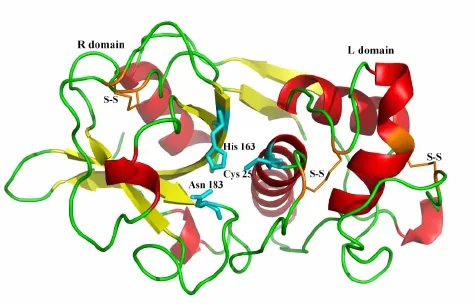
图3 半胱氨酸蛋白酶TsCL-1的结构模型
半胱氨酸蛋白酶TsCL-1的结构模型。结构中的R区域、L区域、催化三聚体残基、二硫键已在图上标注;催化三聚体残基用棍状模型表示。
整体上看,半胱氨酸蛋白酶TsCL-1的结构模型具备半胱氨酸蛋白酶CA族典型的α/β折叠模式,即结构骨架主要由两个不同的结构域所组成,一个以α-螺旋为主要结构的L区 (L domain),另一个以反平行β片层为主要结构的R区 (R domain),催化三聚体 (Cys25-His163-Asn183)位于两个结构域的表面[13,14]。其催化三聚体的催化机制主要是:Cys25充当进攻底物的亲核基团,Cys25在His163的作用下发生去质子化,而Asn183的作用是帮助His163中的咪唑环定位,使得去质子化可以发生;Cys25亲核攻击肽主链上的羰基碳,形成酰基-酶四面体中间体;接着酶与一个水分子作用,发生去酰基化,并释放肽链的羰基末端[15]。结构模型中包含有3对二硫键,以往研究表明,多种因素共同维系和影响着蛋白酶结构的稳定,如二硫键和氢键等都在保证其整体结构的稳定性上有着重要作用[16,17]。本文的研究结果将为进一步深入研究TsCL-1的结构和功能关系奠定结构基础。
[1]Prasad K N,Prasad A,Verma A,et al.Human cysticercosis and Indian scenario:a review [J].Journal of Biosciences,2008,33(4):571—582.
[2]Héctor H G,Armando E G,Carlton AW E,et al.Taenia solium cysticercosis[J].Lancet,2003,362(1):547—556.
[3]Li A H,Moon SU,Park Y K,et al.Identification and characterization of a cathepsin L—like cysteine protease from Taenia solium metacestode[J].Veterinary Parasitology,2006,141(3—4):251—259.
[4]Willingham A L,Engels D.Control of Taenia solium cysticercosis/taeniosis[J].Advances in Parasitology,2006,61:509—566.
[5]Berasaín P,Goii F,McGonigle S,et al.Proteinases secreted by Fasciola hepatica degrade extracelullarmatrix and basement membrane components[J].The Journal of Parasitology,1997,83 (1):1—5.
[6]Hotez P,Haggerty J,Hawdon J,et al.Metalloproteases of infective Ancylostoma hookworm larvae and their possible functions in tissue invasion and ecdysis[J].Infection and Immunity,1990,58 (12):3883—3892.
[7]White A C,Baig S,Chappell C L.Characterization of a cysteine proteinase from Taenia crassiceps cysts[J].Molecular And Biochemical Parasitology,1997,85(2):243—253.
[8]Martí-Renom M A,Stuart A C,Fiser A,et al.Comparative protein structuremodeling of genes and genomes[J].Annual Review Of Biophysics And Biomolecular Structure,2000,29(1):291—325.
[9]Bairoch A,Apweiler R,Wu C H,et al.The universal protein resource(UniProt)[J].Nucleic Acids Research,2005,33(suppl 1):154—159.
[10]Subramaniam S.The Biology Workbench—a seam less database and analysis environment for the biologist[J].Proteins:Structure,Function,and Bioinformatics,1998,32(1):1—2.
[11]Sali A,Blundell T L.Comparative proteinmodelling by satisfaction of spatial restraints[J]. Journal of Molecular Biology,1993,234(3):779—815.
[12]Laskowski R A,MacArthur M W,Moss D S,et al.PROCHECK:a program to check the stereochemical quality of protein structures[J].Journal of Applied Crystallography,1993,26(2):283—291.
[13]Nth J,Jansonius JN,Koekoek R,et al.The structure of papain[J].Advances in Protein Chemistry,1971,25:79—115.
[14]Light A,Smith E L.Current Status of the Structure of Papain:The Linear Sequence,Active Sulfhydryl Group,and the Disulfide Bridges[J].Proceedings of the National Academy of Sciences of the United States of America,1964,52(5):1276—1283.
[15]Buller A R,Townsend C A.Intrinsic evolutionary constraints on protease structure,enzyme acylation,and the identity of the catalytic triad[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(8):653—661.
[16]Wedemeyer W J,Welker E,Narayan M,et al.Disulfide bonds and protein folding[J].Biochemistry,2000,39(23):7032.
[17]Hogg P J.Disulfide bonds as switches for protein function[J].Trends in Biochemical Sciences,2003,28(4):210—214.
(责任编辑徐成东)
Structure Homology Modeling of Cysticercus Cellulose Cysteine Protease TsCL-1
YANG Lin1,2,ZHAO Qinping1&YANG Liquan3
(1.School of Basic Medical Sciences,Wuhan University,Wuhan,430071,Hubei Province;2.Dali Institute of Schistosomiasis Prevention and Control,Dali,671000,Yunnan Province;3.College of Agriculture and Biological Science,Dali University,Dali,671003,Yunnan Province)
In this article,structuralmodel of Cysticercus cellulose cysteine protease TsCL-1 is constructed and analyzed.The results show that the structuralmodel of TsCL-1 has the commonα/βscaffold characteristics of the clan CA proteases of Cysteine Protease,which contains twomain structural domains. The catalytic triad residues Cys,His and Asn are completely conserved(Cys25-His163-Asn183).The structuralmodel has three disulfide bonds.The results of this article will provide a solid basis for further studying the relationship between structure and function of TsCL-1
Cysteine protease TsCL-1;structuralmodel;homologymodeling;structure and function relationship
Q556.9
A
1671-7406(2016)03-0037-04
2016-01-13
杨琳 (1980—),女,硕士研究生,主要从事寄生虫诊治方面的工作和研究。
杨力权 (1980—),男,博士,副教授,主要从事结构生物学方面的研究。

