难处理低品位铜钴矿的微生物浸出
刘媛媛,杨洪英,陈国宝,佟琳琳,金哲男,肖发新
(东北大学冶金学院,沈阳110819 )
(School of Metallurgy,Northeastern University,Shenyang 110819)
难处理低品位铜钴矿的微生物浸出
刘媛媛,杨洪英,陈国宝,佟琳琳,金哲男,肖发新
(东北大学冶金学院,沈阳110819 )
以赞比亚某典型难处理低品位氧化铜钴矿为研究对象,配入适量硫化铜钴矿,采用人工调配的高效微生物浸矿菌群对铜钴矿进行微生物浸出,同时分别与摇瓶酸浸、搅拌酸浸和柱浸进行了对比.结果表明,采用微生物浸出难处理铜钴矿,随着温度升高和时间延长,铜浸出率增大.浸出温度为40 ℃时,微生物浸出铜浸出率为90.7%,高于摇瓶酸浸和搅拌酸浸浸出结束时浸出率(69.4%~73.2%)以及柱浸结束时浸出率(约85%).由于微生物浸出群落对该难处理铜钴矿作用时间周期较长,适用于堆浸生产.细菌的存在使得铁离子不断的在二价与三价间循环,通过具有强氧化性的Fe3+与硫化矿物相互作用,使得矿物分解,提高浸出率.
难处理;低品位铜钴矿;微生物浸出
(School of Metallurgy,Northeastern University,Shenyang 110819)
钴是一种重要的战略金属,钴及其合金广泛应用于航空航天、国防军工、化工、机电和新能源等工业.自然界单独成矿的钴资源很少,绝大多数为共伴生矿[1].其中次生氧化铜钴矿为典型的钴伴生矿之一,其可选性差,有价金属品位低,难以采用传统的工艺进行处理.铜钴矿的冶炼方法主要有电炉还原熔炼、加压浸出、微生物浸出、搅拌酸浸、堆浸等[2].其中,电炉还原熔炼法有价金属回收率高、处理量大、工艺成熟,但对高SiO2低CaO的矿样,为降低炉渣的熔点和黏度,需要配入大量的CaO造渣,而且电炉的投资相对较大.搅拌酸浸通常是在装有搅拌浸出装置的浸出槽中采用稀释的H2SO4溶液浸出氧化铜矿,适合处理品位较高的矿石[3].低品位铜钴矿浸出方法采用加压浸出或微生物浸出.其中加压氧化浸出具备浸出率高、速率快的优势,但也存在加压设备要求苛刻,投资大,成本高的弊端.微生物浸出,是利用浸矿细菌或其代谢产物对矿物和元素所发生的氧化、还原、溶解、吸收(吸附)等作用,将金属从矿石中溶浸出来的一种冶金工艺[3].目前,生物冶金技术取得了产业化的突破,已相继在铜[4-6]、铀[7-9]、金[10-12]、镍[13-15]、锌[16,17]、钴[18-20]等行业实现产业化应用.
前期研究表明,在难处理氧化铜钴矿堆浸过程中引入浓硫酸熟化工艺可以促进该矿物中铜的溶解,提高铜的浸出率,但其对其中硫化矿浸出效果不显著.本文针对赞比亚某难处理低品位铜钴矿,在前期成功开发对硫化矿物具有独特的氧化能力的浸矿细菌基础上,采用微生物浸出难处理低品位矿,考察其对铜矿物浸出的影响,同时进行酸性浸出对比实验.
1 试验材料
试验用矿石取自赞比亚某铜矿,破碎筛分制样后进行化学元素、矿石中铜矿物物相和MLA工艺矿物学分析,结果表明,该矿石主要铜矿物为含铜叶腊石、硅孔雀石和含铜黏土,还含有少量硫化铜矿(如辉铜矿、黄铜矿、斑铜矿)及少量氧化铜矿物(如孔雀石、赤铜矿、水胆矾等).矿石中易泥化矿物(如高岭土、含铜黏土和绿泥石)的含量较低,合计仅为3.38%.矿石的铜矿物相分析结果如表1所示.由表1可知,矿样中氧化铜矿物比例高达89.90%,而硫化铜矿物比例较低,说明该矿石属于氧化铜矿.为了对比微生物浸出的效果,本实验配入按照 1∶1 比例配入硫化铜钴矿,配好之后的铜钴矿成分见表2.
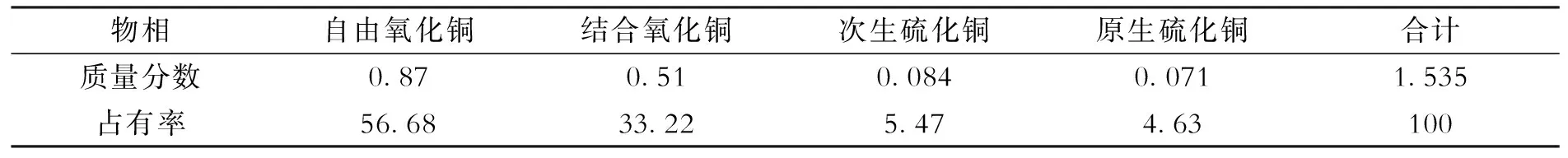
表1 矿石的铜矿物相分析结果

表2 铜钴矿部分元素分析
2 试验方法
2.1摇瓶酸浸与微生物浸出对比试验
为考察该矿微生物浸出的可行性,进行了不同温度摇瓶酸浸与微生物浸出对比实验.将原矿破碎细磨至粒径为0.074 mm,溶浸液体积为300 mL,矿浆浓度(浸出液体积与矿物质量比,以下相同)为5%,转速为170 r/min.酸浸体系pH值为1.7,微生物浸出体系pH值为2.0.
2.2搅拌酸浸与微生物浸出对比试验
搅拌浸出液体积为3 L,矿浆浓度为15%,矿石粒径为0.074 mm,搅拌速度为300 r/min.酸浸体系浸出温度为65 ℃,pH为1.7;微生物浸出体系浸出温度为40 ℃,pH值为2.0.平行做三组重复实验,考察浸出结果的重现性.
2.3柱浸试验装置与实验方法
柱浸实验所用浸出柱有效高度为 0.77 m,内径 16 cm.实验所用的矿石总铜品位为0.56%,酸溶铜品位为0.29%.酸浸柱矿石装柱量为 18.00 kg,微生物浸出柱矿石装柱量为 17.28 kg.浸出实验分为两个阶段,第一阶段为酸浸段,两个体系喷淋液均为萃余液(硫酸质量浓度为24 g·L-1),喷淋制度采用每次喷淋换新液的喷淋方式.当金属浸出率基本不再增长后,酸浸柱维持喷淋液不变,微生物浸出柱更换喷淋液为培养至稳定初期的菌液,喷淋制度改为5 d一个周期更换新液.每次换液期间进行浸出液及喷淋液中的铜离子含量测定,记录数据,最终计算浸出率变化趋势.
3 试验结果分析与讨论
3.1摇瓶酸浸与微生物浸出对比试验研究
3.1.1浸出电位变化分析
酸性浸出体系和微生物浸出体系电位变化分别如图1和图2所示.

图1 不同温度下酸性浸出体系电位变化

图2 不同温度下微生物浸出体系电位变化
由图1可见,酸浸体系的电位呈逐渐下降趋势,并且浸出体系温度越高,电位下降越快;在微生物浸出实验中,浸出温度为20、30、40 ℃实验组的电位呈稳定上升趋势,浸出结束时电位在610~630 mV 之间.浸出温度为50 ℃实验组电位呈先下降后缓慢上升的趋势,这是因为在高温条件下,细菌未完全适应环境生长,故电位先下降,后期缓慢回升.同时,通过对比可见,浸出温度越高,浸出结束时体系电位越低.
3.1.2摇瓶浸出铜浸出率变化分析
酸性浸出体系和微生物浸出体系的铜浸出率变化趋势分别如图3和图4所示.由图可见,在酸浸体系中,铜浸出率随温度升高而升高,浸出接近9 h时铜浸出率趋于稳定.浸出结束时,浸出温度为50 ℃实验组的铜浸出率为74.3%,浸出温度为40 ℃实验组的铜浸出率为69.4%.在微生物浸出体系,铜浸出率随温度升高而升高,浸出120~130 h铜浸出率接近稳定.浸出结束时,浸出温度为50 ℃实验组的铜浸出率为95.3%,浸出温度为40 ℃实验组的铜的浸出率为90.7%,浸出温度为30 ℃实验组的铜的浸出率为85.1%,均高于酸浸体系.可见,微生物浸出可提高该矿的铜浸出率,但由于细菌作用较为温和,浸出时间较长,宜采用堆浸工艺浸铜.

图3 不同温度下酸浸体系铜浸出率变化
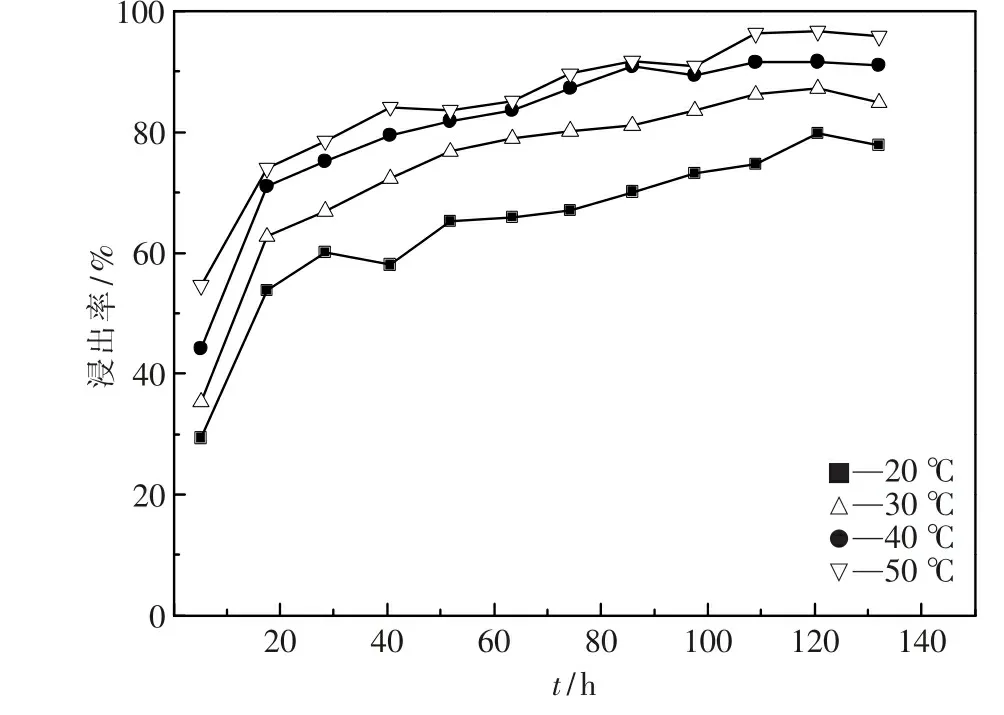
图4 不同温度下微生物浸出体系浸出率变化
3.2搅拌酸浸与微生物浸出对比试验研究
3.2.1浸出过程电位变化
浸出过程发现中,浸出体系氧化还原电位呈逐渐下降趋势,浸出10 h后稳定在400 mV;而生物体系的电位呈逐渐上升的趋势,浸出结束时稳定至670 mV.
3.2.2浸出过程铜浸出率变化
搅拌酸浸体系与微生物浸出体系铜浸出率变化趋势分别如图5和图6所示.

图5 搅拌酸浸体系铜浸出率变化

图6 微生物浸出体系铜浸出率变化
由图5和图6可知,两种浸出体系的铜浸出率均随浸出时间的延长呈逐渐上升趋势.酸浸体系中,浸出21 h铜浸出率为64.3%(以溶液中铜浓度计,以下相同),浸出结束时铜浸出率为73.1%;微生物浸出体系中,浸出16 h铜浸出率为50.7%,浸出287 h后铜浸出率趋于稳定,浸出结束时铜浸出率为90.1%.通过对比可见,微生物浸出体系的累积铜浸出率高于酸浸体系,与上述摇瓶浸出对比实验结果一致.
3.3柱浸酸浸与微生物浸出对比试验研究
酸性浸出体系和微生物浸出体系铜浸出率变化趋势如图7所示.
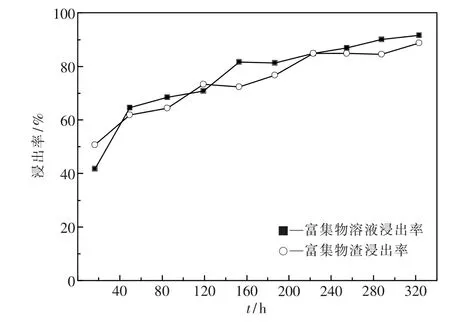
图7 柱浸和微生物浸的铜浸出率
实验浸出周期分为两个阶段,第一阶段为前19 d,主要是酸浸快速浸出过程.酸浸实验组的累积铜浸出率为75.6%,微生物浸出实验组的铜累积浸出率为68.4%.在此阶段,酸浸实验组的累积铜浸出率比微生物浸出实验组高出7.1%.从第20 d开始进入浸出周期的第二阶段,微生物浸出实验组开始更换菌液为喷淋液.由图可见,从加入高效浸矿细菌群落开始,至第23 d为适应期,此期间微生物的作用并未开始显现,铜浸出率依旧平稳并未有明显提升.但是从第24 d开始,微生物的作用开始显现,微生物浸出组的累积铜浸出率开始逐渐上升.浸出结束时,酸浸实验组的累积铜浸出率为84.8%,而微生物浸出实验组的累积铜浸出率为90.6%,提高5.9%.实验结果说明,对于五号堆矿石,筛选构建的高效微生物浸出群落浸出效果显著,但是需要一定的运行周期才能体现出来.
3.4浸出机理
一般来说硫化铜矿的无菌浸出反应如下所示:
MeS+l/2O2+2H+→Me2++S0+H2O
(1)
以上反应是在无细菌作用下发生的,从热力学角度分析此过程是能够发生的,但是反应的速度非常缓慢,在实际的工业生产作业中这种方式是不被采纳的,所以在整个体系中引入了细菌,从而加快了整个反应的速度,细菌使得反应体系中的Fe2+氧化为Fe3+.反应如下(2)和(3)所示:
细菌作用于体系:
(2)
(3)
因此,三种典型硫化铜矿在有菌作用下发生如下反应:
黄铜矿:
(4)
斑铜矿:
(5)
辉铜矿:
(6)
由反应(2)及(4)-(6)可知,细菌的存在使得Fe离子不断的在二价与三价间循环,然后通过具有强氧化性的Fe3+去与硫化矿物相互作用,使得矿物分解,矿物中的金属元素以离子形式进入浸出液中.Fe3+氧化矿物后又被还原为Fe2+,Fe2+在细菌的作用下又被氧化为Fe3+,此过程一直保持循环,从而使矿物被间接氧化和分解,此过程中细菌不仅从整个体系中不断地获得能量,同时也使得整个体系保持高的电位,体系中也存在大量的具有高的强氧化性的Fe3+,细菌在整个反应中所起的作用相当于催化剂,使得整个反应速度得到提升,这个过程就是本实验所涉及的化学反应过程.因此,整个反应体系能够在维持细菌生存的前提下自发的加快整个反应的速率,提高了硫化铜钴矿的浸出率.
4 结 论
(1)采用人工调配的高效微生物浸矿菌群对低品位铜钴矿进行微生物浸出,同时分别与摇瓶酸浸、搅拌酸浸和柱浸进行了对比.结果表明,采用微生物浸出方式浸出难处理铜钴矿,随着温度升高和时间延长,铜浸出率增大.浸出温度为40 ℃时,微生物浸出铜浸出率为90.7%,高于摇瓶酸浸和搅拌酸浸浸出结束时浸出率(69.4%~73.2%)以及柱浸结束时浸出率(约85%).
(2)高效微生物浸出群落对该难处理铜钴矿作用时间周期较长,适用于堆浸生产.应用于实际生产中时,需要对现有的堆浸生产流程进行优化,进而来匹配各车间的生产现状.
[1]李海军,杨洪英,陈国宝,等.低品位硫铜钴矿生物浸出液中铜的分离[J].东北大学学报(自然科学版),2014,35(3):391-396.
(Li Haijun,Yang Hong ying,Chen Guo bao,etal.Separation and recovery of copper from bio-leaching solution of low-grade carrollite[J].Journal of Northeastern University(Natural Science),2014,35(3): 391-396.)
[2]刘大学,王云,袁朝新,等.某铜钴矿的硫酸还原浸出研究[J].有色金属: 冶炼部分,2013(6): 18-21.
(Liu Daxue,Wang Yun,Yuan Chaoxin,etal.Study on sulfuric acid reduction leach on copper-cobalt ore [J].Nonferrous Metals(Extractive Metallurgy),2013(6): 18-21.)
[3]李伟涛.生物浸出铜钴矿试验研究[D].沈阳:东北大学,2011.
Li Weitao.Bioleaching copper cobalt ore experimental studies [D].Shenyang: Northeastern University,2011.
[4]Hiroyoshi N,Kitagawa H,Tsunekawa M.Effect of solution composition on the optimum redox potential for chalcopyrite leaching in sulfuric acid solution[J].Hydrometallurgy,2008,91(1-4): 144-149.
[5]Bevilaqua D,Acciari H A,Arena F A,etal.Utilization of electrochemival impendance spectroscopy for monitoring bornite(Cu5FeS4)oxidation by Acidithiobacillus ferrooxidans[J].Minerals Engineering,2009,22(3): 254-262.
[6]Vilcáez J,Yamada R,Inoue C.Effect of pH reduction and ferric ion addition on the leaching of chalcopyrite at thermophilic temperatures[J].Hydrometallurgy,2009,96(1-2): 62-71.
[7]Eisapour M,Keshtkar A,Moosavian M A,etal.Bioleaching of uranium in batch stirred tank reactor: Process optimization using Box-Behnken design[J].Annals of Nuclear Energy,2013,54(4): 245-250.
[8]Amin M M,Elaassy I E,EI-Feky M G,etal.Effect of mineral constituents in the bioleaching of uranium from uraniferous sedimentary rock samples,Southwestern Sinai,Egypt[J].Journal of Environmental Radioactivity,2014,134(8): 76-82.
[9]Zokaei-Kadijani S,Safdari J,Mousavian M A,etal.Study of oxygen mass transfer coef cient and oxygen uptake rate in a stirred tank reactor for uranium ore bioleaching[J].Annals of Nuclear Energy,2013,53(3): 280-287.
[10]Olson G J,Brierley J A,Brierley C L.Bioleaching review part B: Progress in bioleaching: applications of microbial processes by the minerals industries [J].Appl Microbial Biotechnol,2003,63(3): 249-257.
[11]周吉奎,钮因健.硫化矿物生物冶金研究进展[J].金属矿山,2005(4): 24-30.
Zhou Jikui,Niu yinjian.Advance in research of biological metallurgy of sulfide ore[J].Metal Mine,2005(4): 24-30.
[12]Brierley C L.How will biomining be applied in future [J].Transactions of Nonferrous Metals Society of Chian,2008,18(6): 1302-1310.
[13]Cruz F L S,Oliveira V A,Guimarães D,etal.High-temperature bioleaching of nickel sulfides: thermodynamic and kinetic implications[J].Hydrometallurgy,2010,105(1-2): 103-109.
[14]Cameron R A,Lastra R,Gould W D,etal.Bioleaching of six nickel sulphide ores with differing mineralogies in stirred-tank reactors at 30℃[J].Minerals Engineering,2013,49(8): 172-183.
[15]Zhen S J,Yan Z Q,Zhang Y S,etal.Column bioleaching of a low grade nickel-bearing sulfide ore containing high magnesium as olivine,chlorite and antigorite[J].Hydrometallurgy,2009,96(4): 337-341.
[16]Jiang K Q,Guo Z H,Xiao X Y,etal.Effect of moderately thermophilic bacteria on metal extraction and electrochemical characteristics for zinc smelting slag in bioleaching system[J].Transactions of Nonferrous Metals Society of Chian,2012,22(12): 3120-3125.
[17]Mehrabani J V,Shafaei S Z,Noaparast M,etal.Bioleaching of sphalerite sample from Kooshk leadízinc tailing dam[J].Transactions of Nonferrous Metals Society of Chian,2013,23(12): 3763-3769.
[18]Yang C R,Qiu W Q,Lai S S,etal.Bioleaching of a low grade nickel-copper-cobalt sulfide ore[J].Hydrometallurgy,2011,106(1-2): 32-37.
[19]Zeng G S,Luo S L,Deng X R,etal.Inuence of silver ions on bioleaching of cobalt from spent lithium batteries[J].Minerals Engineering,2013,49(1): 40-44.
[20]Zeng G S,Deng X R,Luo S L,etal.A copper-catalyzed bioleaching process for enhancement of cobalt dissolution from spent lithium-ion batteries[J].Journal of Hazardous Materials,2012,199-200(15): 164-169.
Bioleaching of refractory low grade copper-cobalt ore
Liu Yuanyuan,Yang Hongying,Chen Guobao,Tong Linlin,Jin Zhenan,Xiao Faxin
A typical refractory low grade copper-cobalt ore from Zambia added a proper amount of sulfurized copper-cobalt ore was bioleached with a bacteria group of an artificial microbial leaching bacteria.The specimens were compared with sharked,stirred and column leached ones by acid.The results showed that the leaching efficiency of copper increases with temperature and time.The end leaching efficiency of copper is 90.7% with bioleaching method at 40 ℃,which is higher than that(69.4%~73.2%)with sulfuric acid leaching method and that(about 85%)with column leaching.Owing to the longer operation time,it is suggested that a heap leaching process is favorable for the bioleaching method in an industrial practice.Bacteria make the Fe ions circulate between bivalent and trivalent ions.The authors believe that a strong oxidant Fe3+can promote the ore decomposition and increase the leaching rate.
refractory;low grade copper-cobalt ores;bacterial leaching
10.14186/j.cnki.1671-6620.2016.02.003
TF 811
A
1671-6620(2016)02-0092-05

