TNFAIP1对肝癌细胞HepG2细胞增殖及凋亡的影响
莫莉桦,刘 宁,寻 禹,胡 翔,何自力,向双林
(湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,中国 长沙 410081)
TNFAIP1对肝癌细胞HepG2细胞增殖及凋亡的影响
莫莉桦,刘宁,寻禹,胡翔,何自力*,向双林*
(湖南师范大学生命科学学院,蛋白质化学与发育生物学教育部重点实验室,中国 长沙410081)
为了深入探讨肝癌的发生机制并寻找肝癌的潜在治疗手段,研究了TNFAIP1基因对肝癌细胞HepG2的细胞增殖及细胞凋亡产生的影响.MTT实验发现过表达TNFAIP1基因或干扰TNFAIP1的表达可以显著地抑制或促进HepG2细胞的生长,这表明TNFAIP1基因对肝癌细胞的增殖具有抑制作用.而流式细胞技术则证实过表达TNFAIP1能显著地促进肝癌细胞HepG2的细胞凋亡.
TNFAIP1;HepG2;细胞增殖;细胞凋亡
肝细胞肝癌(hepatocellular carcinoma, HCC)是目前最常见的恶性肿瘤之一,严重威胁着人类的生命健康[1-2].肝癌的死亡率常年居高不下,虽然近年来我国的医护工作者一直致力于肝癌的研究,但由于其高复发率和转移率,对于肝癌患者来说手术治疗后长期的预后工作仍然是一个很大的挑战[3-4].肿瘤坏死因子α诱导蛋白1 (Tumor necrosis factor-alpha-induced protein 1,TNFAIP1),又称为B12,是最早被鉴定受肿瘤坏死因子α (tumor necrosis factor α, TNFα) 诱导的蛋白[5].研究表明,TNFAIP1基因在人类[5]、小鼠[5]、大鼠[6]及线虫[7]等多个物种中分布广泛,并且在人体内各个组织器官中也有广泛表达,如在脑组织和心脏组织中其表达量非常丰富[5],暗示TNFAIP1可能在这两种器官的发育过程中扮演了重要的角色.TNFAIP1可能与神经发育相关,有实验证实TNFAIP1在小鼠海马中表达量很高,同时发现雌激素可以调节其中TNFAIP1的表达,由于海马和雌激素在阿尔兹海默症(AD)中至关重要,因此该结果表明,TNFAIP1与海马相关疾病(如AD)之间的潜在联系可能会受到雌激素水平的影响[8].在TNFAIP1对乙肝病毒(Hepatitis B Virus, HBV)免疫性的调查中发现,HBV先天免疫的人群其TNFAIP1的表达水平明显高于普通人群,这表明TNFAIP1在对HBV的先天免疫中可能扮演了重要的角色[9].TNFAIP1还可能参与了调控多种肿瘤的发生发展过程.在紫杉醇耐药性研究中发现,TNFAIP1与紫杉醇竞争性地结合β-tubulin,因此可以抑制紫杉醇诱导的微管蛋白聚合,使细胞周期停滞并最终导致细胞死亡.在异种移植的小鼠模型中发现,增强TNFAIP1的表达能降低紫杉醇对肿瘤的作用,反之,抑制TNFAIP1的表达则可以增强紫杉醇对肿瘤的作用[10-12].还有研究证明RhoB能够直接与TNFAIP1相互作用并促进HeLa细胞的凋亡,说明TNFAIP1可能参与调控宫颈癌的发展过程[13].总之,以上这些研究结果共同表明TNFAIP1可能在器官发育和肿瘤发生过程中发挥了重要的作用.
然而,对于TNFAIP1在肝细胞肝癌的发生发展过程中是否具有调控作用,目前并未有文献进行明确报道.因此,本文以HepG2细胞系为研究对象,探讨TNFAIP1对其细胞增殖及细胞凋亡的影响.
1 实验部分
1.1实验材料
HepG2细胞系,pCMV-Myc质粒,pCMV-Myc-TNFAIP1质粒均为本实验室保存.NC siRNA及TNFAIP1 siRNA由上海生工生物工程股份有限公司合成.DMEM培养液、胎牛血清FBS购自Hyclone公司,转染试剂脂质体LipofectamineTM2000购自Invitrogen公司.抗Myc-tag的单克隆抗体及抗β-actin的单克隆抗体均购自Santa Cruz公司,抗TNFAIP1的多克隆抗体购自上海萨博生物有限公司公司.凋亡检测试剂盒购自美国BD公司.其他常规试剂均购自上海生工公司.
1.2实验方法
1.2.1细胞培养及转染细胞于含10%胎牛血清(FBS)的DMEM完全培养基中进行培养,当细胞长至80%~90%后,用0.2%胰酶消化传代,于含5%CO2的细胞培养箱中37 ℃培养过夜.若转染质粒,当细胞密度长至80%~90%时,用LipofectamineTM2000说明书提供的步骤,转染前2 h将培养基换成不含血清及抗生素的培养液.用等体积的opti-MEM分别稀释脂质体和质粒,充分混匀,然后将脂质体溶液逐滴加入稀释的质粒中,充分混匀后静止20 min.将混合溶液滴加入培养皿中,培养4~6 h后换成含血清的完全培养基继续培养.若转染RNA,当细胞长至50% 左右时用同样的方法转染,但操作时要使用RNA-Free的枪头及EP管.
1.2.2Western Blot分析首先按照实验室提供的浓缩胶和分离胶的配方配好所需浓度的聚丙烯酰胺凝胶,待用.然后用胰酶消化收集细胞,用1×PBS洗两遍,4 ℃,800 g离心2 min,弃上清.沉淀用RIPA裂解液 (含1% Triton X-100, 150 mmol/L NaCl, 50 mmol/L Tris-HCl(pH 7.2), 1%Sodium Dexycholate, 0.1% SDS, 1 mmol/L PMSF) 重悬裂解细胞,4 ℃,13 000 r/min离心15 min,将上清置于一新的EP管中.蛋白定量后加入6×SDS点样缓冲液,105 ℃金属浴煮10 min,保存待用.将电流设置为每块胶15~20 mA, 上样后接通电源跑电泳,采用湿转法转膜将蛋白转移到PVDF膜上,牛奶封闭后孵育稀释好的一抗工作液 (TNFAIP1抗体按1∶300稀释,β-actin抗体按1∶2 000稀释,Myc抗体按1∶300稀释).用TTBS洗膜10 min×3次后孵育二抗 (稀释比例为1∶2 000).用TTBS洗膜10 min×4次后显影,拍照后记录数据并分析.
1.2.3MTT法检测细胞增殖24孔板中按浓度梯度分别为每孔0,0.2,0.4,0.6 μg转染Myc-TNFAIP1质粒(用pCMV-Myc空载体补平以保证转染质粒的量相同),另一组则转染1 μL的NC siRNA或TNFAIP1 siRNA [1 μL siRNA (15 pmol)∶1.5 μL脂质体].每组均设3个平行组.转染6 h后换成含10% FBS的完全培养基继续培养.培养24 h后每孔加50 μL MTT溶液(浓度为5 g/L)继续孵育4 h,然后终止培养,小心吸去孔内培养基,每孔加900 μL DMSO,置于摇床上避光震荡10 min,使结晶充分溶解.选择570 nm (630 nm校准) 的波长,用酶标仪测定每孔的OD值,记录结果并分析数据.
1.2.4流式细胞技术(FACS)检测细胞凋亡6孔板中分别转染pCMV-Myc空质粒或Myc-TNFAIP1质粒2.5 μg,6 h后换成完全培养基继续培养.24 h后,用不含EDTA的胰酶消化收集细胞.4 ℃,500 g离心5 min,弃培养基.用预冷的PBS洗涤2次,1 000 g离心3 min收集细胞.按照凋亡检测试剂盒提供的步骤,首先用300 μL 1×Binding Buffer悬浮细胞,然后在细胞悬液中加入3 μL Annexin V-FITC,轻轻混匀后置于冰上避光孵育15 min.再加入3 μL PI后轻柔混匀,置于冰上避光孵育5 min.最后用流式细胞仪检测细胞是否凋亡,记录数据并分析.
1.2.5统计学分析所得数据用SPSS11.5统计学软件进行统计分析,均用平均值±标准差的形式表示,两组之间平均值的差异采用t检验,显著水平定为p<0.05.
2 实验结果
2.1过表达TNFAIP1能显著抑制肝癌细胞的增殖
分别转染0,0.2,0.4,0.6 μg的Myc-TNFAIP1质粒进入HepG2细胞中(用pCMV-Myc空载体补平以确保转染的质粒量相同),使其过表达TNFAIP1蛋白,首先用Western Blot方法检测了外源TNFAIP1的表达情况,以β-actin为内参,分别用Myc单抗和β-actin单抗检测.接下来MTT实验结果显示TNFAIP1过表达的HepG2细胞的生存率呈下降趋势,且转染0.6 μg Myc-TNFAIP1质粒的HepG2细胞的生存率明显低于对照组,这表明TNFAIP1过表达可以抑制肝癌细胞的增殖(图1).
2.2干扰TNFAIP1能促进肝癌细胞的增殖
为了进一步证明TNFAIP1对肝癌细胞增殖的影响,作者转染了TNFAIP1 siRNA进入HepG2细胞中以抑制TNFAIP1的表达,同时转染阴性对照siRNA (NC siRNA)作为对照组.首先用Western Blot方法检测内源的TNFAIP1的表达,以β-actin为内参,分别用TNFAIP1多抗和β-actin单抗检测.然后通过MTT实验检测发现TNFAIP1 siRNA组可显著地促进细胞的增殖(图2).
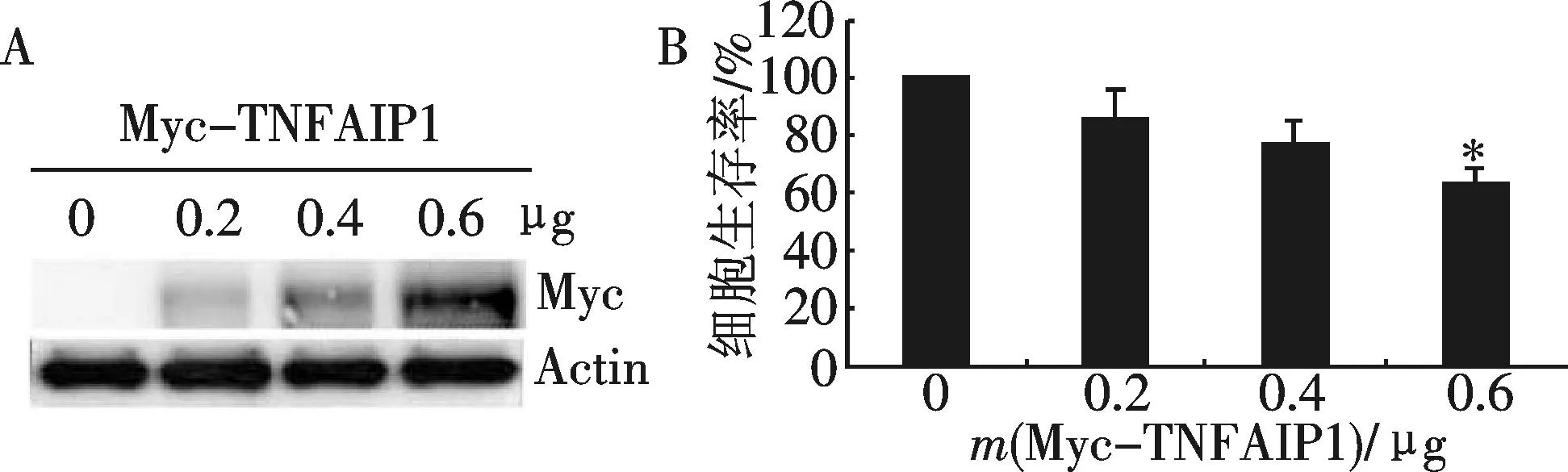
注:与对照组相比,*p<0.05.图1 过表达TNFAIP1能抑制肝癌细胞增殖(A. Western Blot 检测外源TNFAIP1的表达;B. MTT实验检测不同浓度梯度的TNFAIP1对肝癌细胞的增殖的影响)Fig.1 Overexpression of TNFAIP1 could inhibit cell proliferation of HepG2(A. Western Blot assay was used to detect the expression levels of exogenous TNFAIP1; B. MTT assay was applied to detect the effect of overexpression of TNFAIP1 in a dose-dependent manner on the cell proliferation of HepG2 cell line)

注:与对照组相比,*p<0.05.图2 干扰TNFAIP1的表达能促进肝癌细胞增殖 (A. Western Blot 检测TNFAIP1的表达情况;B. MTT实验检测干扰TNFAIP1对肝癌细胞的增殖的影响)Fig.2 Knockdown of TNFAIP1 could promote cell proliferation of HepG2 (A. Western Blot assay was used to detect the expression levels of endogenous TNFAIP1; B. MTT assay was applied to detect the effect of knockdown of TNFAIP1 on the cell proliferation of HepG2 cell line)
2.3TNFAIP1对肝癌细胞的凋亡具有促进作用
在六孔板中分别转染2 μg pCMV-Myc空质粒或等量的Myc-TNFAIP1质粒到HepG2细胞中,用流式细胞仪检测TNFAIP1基因对肝癌细胞的凋亡的影响.结果发现,转染Myc空载体后细胞凋亡的比例为2.73%,而转染了Myc-TNFAIP1质粒后,其凋亡比例上升到18.62%,并且统计学分析发现结果具有显著意义.因此,相对于转染了Myc空载体的对照组,Myc-TNFAIP1能明显促进HepG2细胞的凋亡(图3).这说明TNFAIP1具有促进肝癌细胞凋亡的作用.
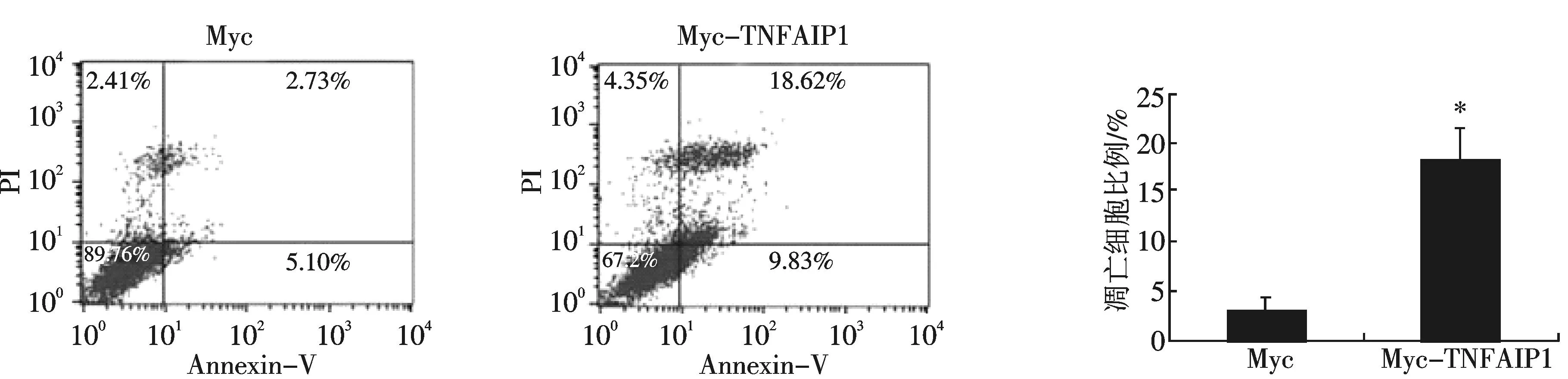
注:与对照组相比,*p<0.05.图3 流式细胞技术证明TNFAIP1可以促进细胞凋亡Fig.3 FACS assay showed overexpression of TNFAIP1 induced cell apoptosis in HepG2
3 讨论
TNFAIP1是一个重要的肿瘤抑制因子,是首个被确定为受TNFα诱导的蛋白,它的合成同时也受IL-6的诱导[5].TNFAIP1在脑组织和心脏组织中的表达量非常丰富,并且实时定量PCR证明它在其他组织如胃、肝、宫颈等中均有表达.前人的研究发现,TNFAIP1在肝癌细胞系HepG2中的表达量很低[14],这暗示TNFAIP1可能参与了肝癌的发展过程.结构研究发现TNFAIP1分子中包含非常保守的结构域[4],这表明TNFAIP1可能在肿瘤的发生发展过程中起到非常重要的作用.此外,还有实验证实TNFAIP1在骨肉瘤组织中的表达水平显著增加,而抑制TNFAIP1的表达能抑制骨肉瘤细胞的增殖及侵袭能力并促进细胞凋亡[15].这说明TNFAIP1基因在肿瘤发展过程中的作用具有组织特异性,然而该特异性的分子机制尚有待进一步研究.目前对于TNFAIP1在癌症发生作用中的分子机制的研究尚不明确,并且对于它在肝癌发生过程中的作用也并未有文献进行明确报道.
因此,本文主要从细胞增殖及细胞凋亡的角度,研究TNFAIP1基因对肝癌细胞系HepG2作用.从MTT及流式细胞技术这一系列实验分析发现,TNFAIP1能够显著地抑制HepG2细胞的增殖并促进其细胞凋亡,而其抑制增殖并促进凋亡的分子机制尚有待进一步研究.这些实验结果与TNFAIP1作为潜在的肿瘤抑制因子的结论相符,这一发现也有助于揭示肝癌的发生机制,为肝细胞癌的临床分子诊断提供新的理论依据并为肝癌的治疗提供新的策略.
[1]JEMAL A, SIEQEL R, XU J,etal. Cancer statistics, 2010 [J]. CA Cancer J Clin, 2010,60(5):277-300.
[2]范莎莎, 李爱民, 李荣,等. IL-17在肝癌患者血清中表达增高对肝癌诊断的研究 [J]. 湖南师范大学自然科学学报, 2014,37(3):19-23.
[3]TANG Z Y. Hepatocellular carcinoma-cause, treatment and metastasis [J]. World J Gastroenterol, 2001,7:445-454.
[4]TANG Z Y. Hepatocellular carcinoma surgery-review of the past and prospects for the 21st century [J]. J Surg Oncol, 2005,91(2):95-96.
[5]WOLF F W, MARKS R M, SARMA V,etal. Characterization of a novel tumor necrosis factor-alpha-induced endothelial primary response gene [J].J Biol Chem, 1992,267(2):1317-1326.
[6]ZHOU J, HU X, XIONG X,etal. Cloning of two rat PDIP1 related genes and their interactions with proliferating cell nuclear antigen [J]. J Exp Zoolog A Comp Exp Biol, 2005,303(3):227-240.
[7]LINK C D, TAFT A, KAPUKLIN V,etal. Gene expression analysis in a transgenic Caenorhabditis elegans Alzheimer’s disease model [J]. Neurobiol Aging, 2003,24(3):397-413.
[8]LIU H, YANG L, ZHAO Y,etal. Estrogen is a novel regulator ofTnfaip1 in mouse hippocampus [J]. Int J Mol Med, 2014,34(1):219-227.
[9]LIN M C, LEE N P, ZHENG N,etal. Tumor necrosis factor-alpha-induced protein 1 and immunity to hepatitis B virus [J]. World J Gastroenterol, 2005,11(48):7564-7568.
[10]STORDAL B, HAMON M, MCENEANEY V,etal. Resistance to paclitaxel in a cisplatin-resistant ovarian cancer cell line is mediated by P-glycoprotein [J]. PLoS One, 2012,7(7):1-13.
[11]YIN S, BHATTACHARYA R, CABRAL F. Human mutations that confer paclitaxel resistance [J]. Mol Cancer Ther, 2010,9(2):327-335.
[12]ZHU Y, YAO Z, WU Z,etal. Role of tumor necrosis factor alpha-induced protein 1 in paclitaxel resistance [J]. Oncogene, 2014,33(25):3246-3255.
[13]KIM D M, CHUNG K S, CHOI S J,etal. RhoB induces apoptosis via direct interaction withTNFAIP1 in HeLa cells [J]. Int J Cancer, 2009,125(11):2520-2527.
[14]杨利平,周爱冬,李红,等.TNFAIP1基因在常见细胞系中的表达 [J]. 遗传, 2006, 28(8):918-922.
[15]ZHANG C L, WANG C, YAN W J,etal. Knockdown ofTNFAIP1 inhibits growth and induces apoptosis in osteosarcoma cells through inhibition of the nuclear factor-κB pathway [J]. Oncol Rep, 2014,32(3):1149-1155.
(编辑WJ)
The Role of TNFAIP1 in the Cell Proliferation and Apoptosis to HepG2
MO Li-hua, LIU Ning, XUN Yu, HU Xiang, HE Zi-li*, XIANG Shuang-lin*
(Key Laboratory of Protein Chemistry and Development Biology, Ministry of Education of China,College of Life Science, Hunan Normal University, Changsha 410081, China)
To investigate the molecular mechanisms of hepatocellular carcinoma(HCC) progression and develop novel potential therapeutic method for treatment of HCC, in the study, the role ofTNFAIP1 in the cell proliferation and apoptosis to HepG2 cells was determined. MTT assay showed that overexpression and knockdown ofTNFAIP1 gene could significantly inhibit and promote cell growth of HepG2 cell lines, respectively. These results imply thatTNFAIP1 is involved in the inhibition of cell proliferation in HCC. Moreover, FACS assay indicated that overexpression ofTNFAIP1 significantly induced cell apoptosis in HepG2 cell lines.
TNFAIP; HepG2; cell proliferation; cell apoptosis
10.7612/j.issn.1000-2537.2016.03.003
2015-09-29基金项目:国家自然科学基金面上项目(81372157);中国博士后基金面上资助项目(2014M552139);湖南省自然科学基金资助项目(13JJ6037);湖南省教育厅优秀青年基金资助项目(14B114);湖南省教育厅科技计划资助项目(2014RS4008)*通讯作者,E-mail:xshlin@hunnu.edu.cn;2005hzl@163.com
R735.7
A
1000-2537(2016)03-0014-04

