荧光定量法分析液体发酵中杂菌污染的实验设计
汤海峰, 姜 丹, 孟令军, 王 迪, 王彦峰, 刘 艳
(吉林大学 生命科学学院, 吉林 长春 130012)
荧光定量法分析液体发酵中杂菌污染的实验设计
汤海峰, 姜丹, 孟令军, 王迪, 王彦峰, 刘艳
(吉林大学 生命科学学院, 吉林 长春130012)
设计了利用荧光定量PCR法检测基因工程菌液体发酵过程中杂菌污染的实 验方法。实验结果表明,与纯培养相比,在由重组大肠杆菌JM109、枯草芽孢杆菌和少量未知杂菌组成的多元共培养体系中,重组大肠杆菌JM109的生长和枯草芽孢杆菌的生长均被抑制。在发酵终点两种菌体在发酵液中的总量与大肠杆菌的初始接种量具有显著的相关性。通过将核酸快速提取、荧光定量PCR和微生物生长特性分析等多项实验技术有机结合,形成一个综合性实验项目并应用于本科生实验教学,提高了本科生生物学综合实验技能。
染菌检测; 荧光定量; 液体发酵
人们对生物活性物质的需求不断提高,通过天然成分的分离提取已经难以满足巨大的市场需求。基因工程菌发酵技术通过定向改造微生物或动植物细胞并进行大规模发酵培养,实现了生物活性物质的生产以满足市场需求。目前,基因工程菌发酵技术已经被用来生产人胰岛素、人细胞白介素、人干扰素、人溶菌酶以及各种人用或动植物用疫苗[1-6]。
在生物活性物质的发酵生产过程中防范和控制杂菌污染是重要环节之一。发酵过程中杂菌会抑制目标细胞的生长从而降低活性物质的产量、增加生产成本。目前,在发酵过程中检测杂菌污染的手段主要有镜检、液体培养、固体培养、异常观察等[7],但这些方法只能进行定性分析,而不能进行定量检测。
荧光定量PCR技术是由美国Applied Biosystems 公司推出的一种定量检测技术。该技术由于反应快速、重复性好、灵敏度高、特异性强、结果清晰而被广泛应用于疾病诊断和食品安全检测等领域[8]。该技术在基因的差异表达研究中也具有明显优势。但由于操作复杂、实验周期长、对操作人员和实验室环境要求较高等因素,该技术很难进行本科生课内实验教学。为了使学生能够掌握先进的分析手段,加强学生实践能力和对知识的综合应用能力的培养,本研究设计了一个利用相对定量法分析基因工程菌发酵过程中杂菌污染后目标菌体和杂菌生长特性的实验方法。
1 实验材料与试剂
1.1菌株
测试菌:大肠杆菌JM109,已导入含有白介素-18基因的重组PUC-18质粒。
背景菌:枯草芽孢杆菌。
以上菌株由本实验室保藏。
1.2引物
实验所用引物由生工生物工程(上海)股份有限公司合成并给出Tm(溶解温度)值。
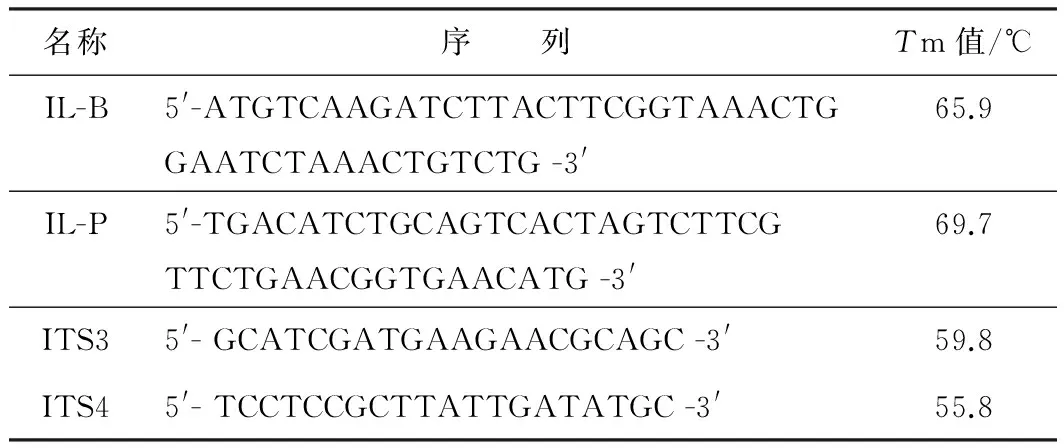
表1 引物序列与Tm值
1.3其他试剂
iTag University SYBR Green Supermix购自美国Biorad公司;氯化钠购自北京化工厂;蛋白胨和酵母浸粉购自英国OXOID公司;晶芯®通用型细菌DNA快速提取试剂盒购自北京博奥生物集团有限公司。
2 实验仪器
荧光定量PCR仪(美国Biorad公司);核酸快速提取仪(北京博奥生物集团有限公司);迷你高速离心机(美国Eppendorf公司);迷你离心机(美国Wealtec公司);微量移液器(美国Eppendorf公司);恒温摇床(美国NBS公司);恒温水浴锅(上海精宏实验设备有限公司);752N型分光光度计(上海精密科学仪器有限公司)
3 实验方法
3.1大肠杆菌液体培养
配制液体LB培养基(10 g/L 蛋白胨,5 g/L 酵母浸粉,10 g/L 氯化钠),精确分装于100 mL三角瓶中,每瓶40 mL;将过夜培养的背景菌种子液按体积分数2%接种量接种于液体LB培养基中,37 ℃、150 r/min培养50~60 min,至菌液稍有浑浊;按表2 的梯度接种过夜培养的测试菌种子液,37 ℃、150 r/min培养4~5 h,至样品A在波长600 nm处的光吸收处于0.6~0.8之间(对数生长期)。
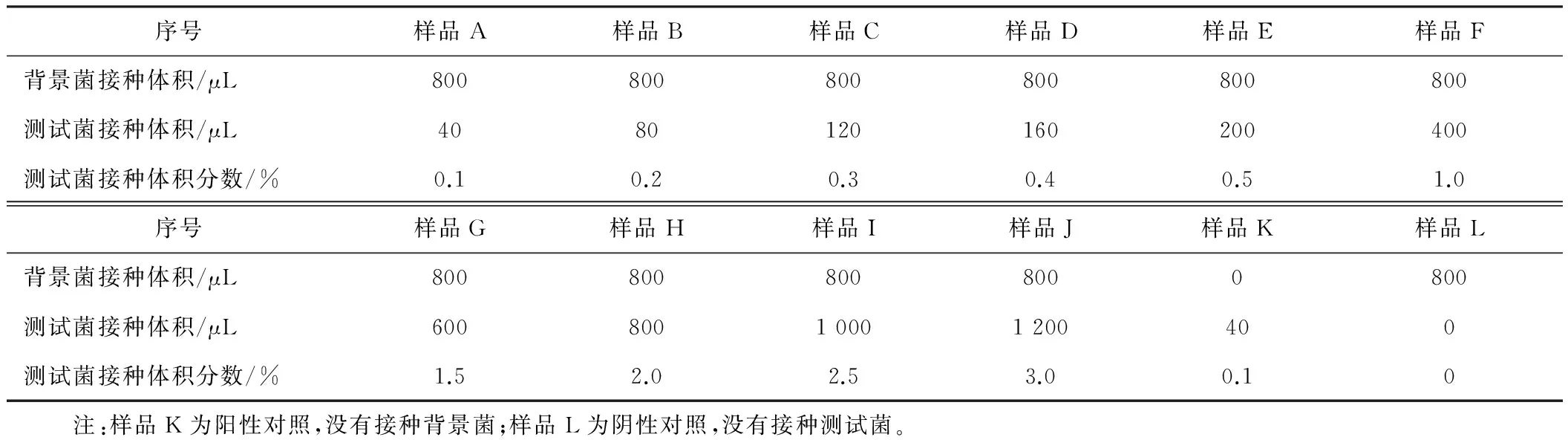
表2 背景菌与测试菌的接种量
3.2基因组DNA提取
培养完毕后,分别于各样品中取0.5 mL培养液,12 000 r/min离心5 min,弃上清,利用细菌DNA快速提取试剂盒提取基因组DNA。具体步骤:(1) 加50 μL提取液悬浮菌体后转入提取管中;(2)将提取管放入核酸快速提取仪中,最大转速震荡5 min;(3)将提取管放入95 ℃水浴中保温5 min;(4)12 000r/min离心5 min,取上清稀释,备用。
3.3荧光定量分析
分别利用引物对IL-B/IL-P扩增测试菌中白介素-18基因[9],利用引物对ITS3/ITS4扩增各菌体成分的rDNA-ITS2区[10](见表1)。按比例配制反应体系(见表3),离心后进行荧光定量扩增。荧光定量扩增反应程序:(1) 95 ℃ 预变性5 min;(2)95 ℃变性10 s;(3)60 ℃扩增60 s;(4)读板;(2)~(4)进行40个循环。

表3 荧光定量PCR反应体系
4 结果与分析
4.1共培养体系中大肠杆菌生长特性分析
大肠杆菌因其遗传背景清楚、培养操作简单、转化和转导效率高、生长繁殖快、培养成本低廉而被广泛应用于构建重组蛋白表达系统[11]。本研究中使用含有重组PUC-18/白介素-18质粒的大肠杆菌JM109作为测试菌株,接种量设置了不同的梯度(见表2)。发酵结束时白介素-18基因的拷贝数与测试菌菌体总量具有线性相关性。因此通过定量白介素-18基因可以确定各样品中测试菌的菌体总量。利用引物对IL-B/IL-P对白介素-18 基因进行荧光定量扩增时所得到的Ct值(循环阈值)随测试菌初始接种量的梯度增加呈梯度下降趋势(见表4)。将各样品Ct值与测试菌初始接种量的常用对数进行线性拟合得到了很好的线性关系(R2=0.924,见图1)。结果表明:培养结束后各样品中菌体总量与接种量呈线性相关。由此可见,荧光定量PCR技术可以用于对液体发酵中微生物生长情况进行定量分析。本实验采用了相对定量法,即对不同初始接种量的各样品在发酵终点时测试菌的相对数量进行了比较分析。如果在实验过程中制作“Ct值-菌体浓度”标准曲线,则可以进行绝对定量分析。
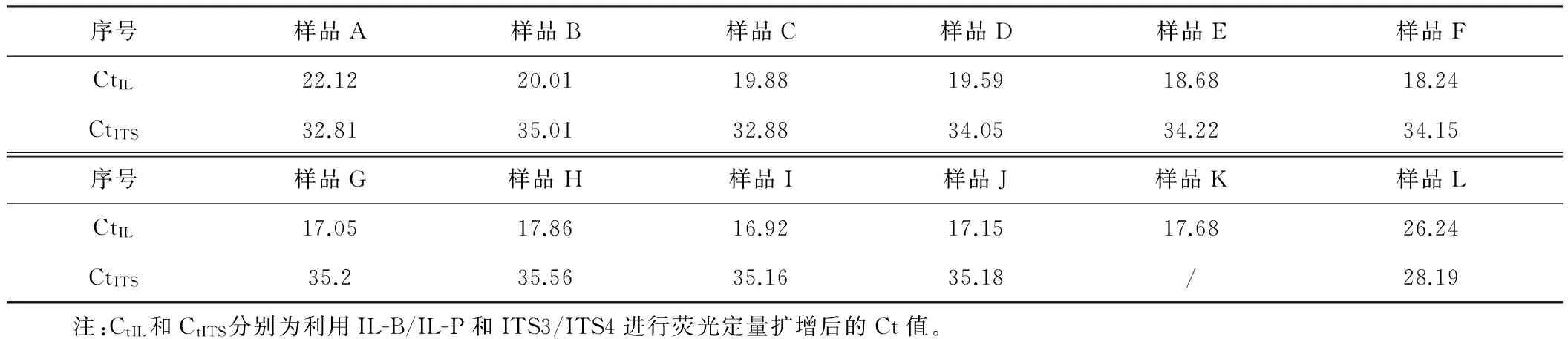
表4 利用引物对IL-B/IL-P和ITS3/ITS4进行荧光定量扩增后的Ct值
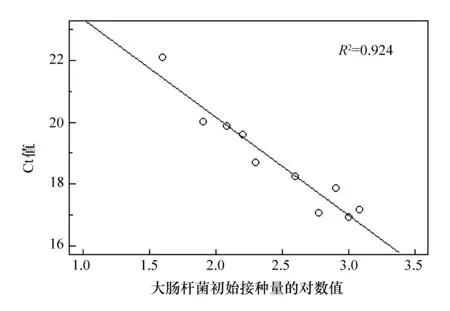
图1 利用引物对IL-B/IL-P扩增后各样品的Ct值与测试菌初始接种量对数值的线性关系
样品A与样品K同为40 μL的接种量,但是样品A预先接种背景菌而样品K作为对照没有预先接入背景菌。二者的Ct值分别为22.12和17.68。可见,样品A中白介素-18基因拷贝数要明显少于样品K。这是由于样品A中的背景菌抑制了测试菌的生长,导致培养结束后菌液中测试菌总量低于样品K。本研究选取自然界中普遍存在且易与其他微生物共存的枯草芽孢杆菌作为背景菌,其在生长过程中会产生多种抗生素而抑制其他微生物的生长[12-13]。因此各样品中的测试菌由于受到了背景菌的抑制而生长缓慢。但是由于背景菌的浓度相同,各样品所受的抑制程度相同,因此各样品中测试菌的总量依然与初始接种量具有正向线性关系。样品K的Ct值与样品H近似相等(分别为17.68和17.86),而样品H接种量为800 μL,可见在有背景菌的情况下800 μL的接种量相当于没有或有较少杂菌时40 μL的接种量在发酵终点所产生的测试菌总量。因此可以初步推测本实验体系中背景菌对目标菌的抑制率约为95%。
样品L为阴性对照,但荧光定量扩增结果显示其含有测试菌。这是由于培养基未进行灭菌处理,相关操作也没有在无菌室中进行,而本实验长期培养该重组菌,致使该菌通过实验器材等进入到了阴性对照培养基中。其Ct值为26.24,低于其他各样品,可见其含量较低。
4.2共培养体系中背景菌的生长特性分析
由于ITS区在微生物中广泛存在并具有一定的保守性,因此可以通过利用通用引物对扩增ITS区来检测微生物的存在。引物对ITS3/ITS4扩增的是微生物的rDNA-ITS2区[10](见图2)。因为重组大肠杆菌JM109没有该引物对的扩增位点,所以该引物对可以用来检测该菌发酵时的杂菌污染。
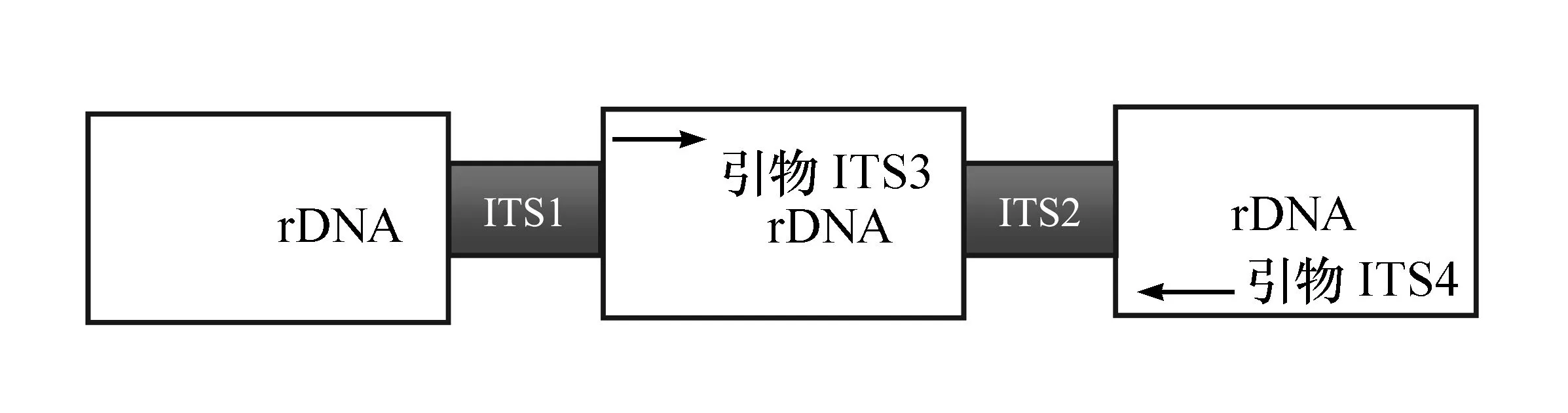
图2 引物对ITS3/ITS4扩增位点示意图
利用引物对ITS3/ITS4对各样品进行荧光定量PCR扩增后所得到的Ct值与大肠杆菌的接种量具有正向相关(见表4)。可见随着测试菌接种量的提高背景菌的Ct值亦升高,即背景菌的总量降低。由此可见,测试菌对背景菌具有一定的抑制作用,而且抑制强度随测试菌初始接种量的增加而加强。将Ct值与测试菌初始接种量的常用对数进行线性拟合可以得到明显的正向相关趋势(见图3)。
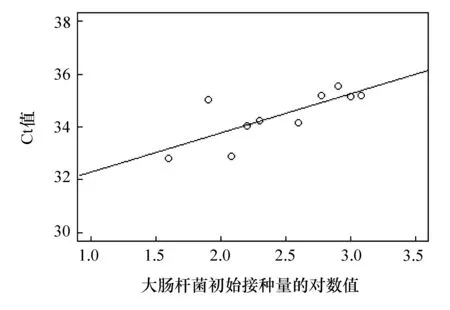
图3 利用引物对ITS3/ITS4扩增后各样品的Ct值与测试菌初始接种量对数值的线性关系
样品L作为阴性对照只接种了背景菌,没有接种测试菌,其Ct值明显低于其他样品的Ct值。可见样品L中背景菌的总量要高于其他样品,进一步证明了测试菌对杂菌的抑制作用。由于共培养时,培养基中的成分消耗速度较纯培养快,导致培养基迅速达到寡营养状态,从而抑制了共培养体系中各菌体组分的生长[13]。
4.3测试菌中白介素-18基因与背景菌rDNA-ITS2区的拷贝数
利用引物对IL-B/IL-P扩增白介素-18基因时,各样品的Ct值处于17.68与22.12之间,而利用引物对ITS3/ITS4扩增rDNA-ITS2区时,各样品的Ct值处于28.19至35.18之间。两组Ct值相差10个循环左右。若每个目的DNA片段都是单拷贝,两组Ct值的差异显示发酵终点时各样品中测试菌的数量要明显多于背景菌的数量。但在该实验体系下背景菌对测试菌具很强的抑制作用,显然在任一样品中(样品K除外)测试菌的数量不可能多于背景菌。因此可以判断白介素-18基因在测试菌中一定是多拷贝的。本实验所用的克隆载体为PUC-18质粒,属松弛型质粒,每个菌体中至少含有10~15个拷贝。所以在各样品中虽然目标菌的数量较少,但由于菌体中多拷贝的白介素-18基因导致其Ct值远低于背景菌。
导致白介素-18基因的Ct值降低的另一个原因是扩增效率。引物对IL-B/IL-P的Tm值分别为65.9 ℃和69.7 ℃,而引物对ITS3/ITS4的Tm值分别为59.8 ℃和55.8 ℃。最佳的退火温度一般比Tm值低5 ℃左右。而本实验采用两步法进行荧光定量扩增,退火温度和扩增温度同为60 ℃。所以引物对IL-B/IL-P有更高的扩增效率。
5 教学实践
本实验项目是吉林大学国家级生物实验教学示范中心为本科生设计的实验项目之一。项目承接分子生物学实验和生物科学(技术)专业实验两门课程,是其内容的延伸。在前两门实验课程中,本科生分别构建了重组人白介素-18克隆载体和表达载体并转化到了受体菌中,通过PCR、诱导表达和免疫印迹进行了鉴定。本实验项目是利用以上实验成果继续进行发酵培养及杂菌污染检测分析,使学生了解并掌握基因工程的中下游实验技术,完善了学生的知识体系。该实验项目在教学过程中可以按照8个学时来组织教学(见表5)。
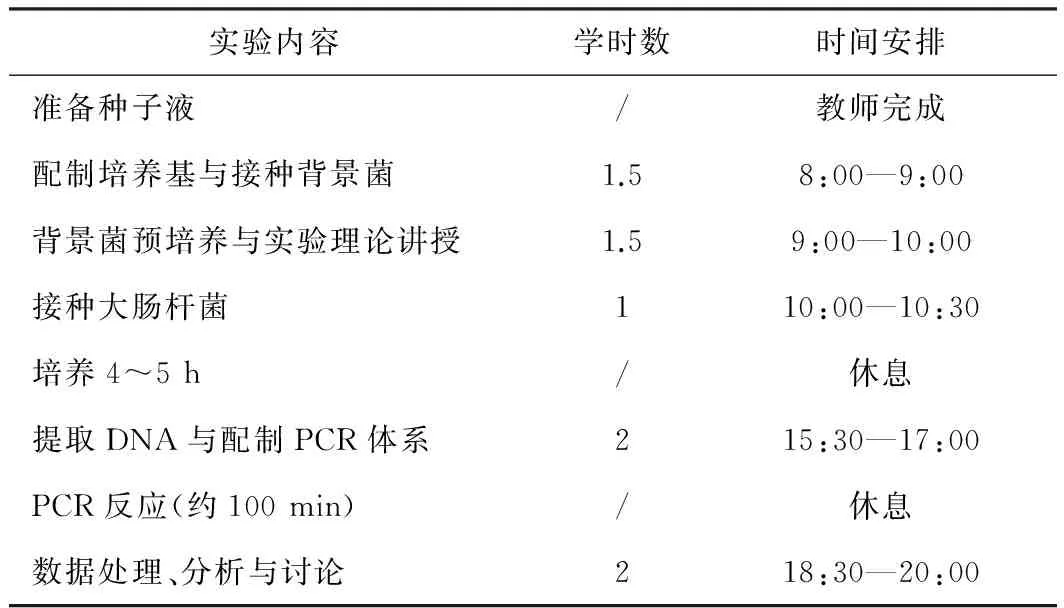
表5 本项目的学时分配与教学安排
测试菌和背景菌种子液制备时需要过夜培养,由教师完成。学生从配制培养基开始,培养基不需要灭菌,实验全程也无需无菌操作。接种背景菌的目的是人为产生发酵前期染菌的状态。由于培养基没有灭菌,所以也可以不接种背景菌,但需要较长的预培养时间,否则大肠杆菌由于生长迅速会在短时间内占据优势,并抑制背景菌生长。本实验背景菌选用枯草芽孢杆菌,其生长速度虽然较测试菌慢,但能明显抑制测试菌生长,其与测试菌组成的共培养体系很好地反应了发酵染菌后的各菌体成分的生长特性。
为了节省实验学时,实验原理讲授安排在预培养等待期间进行。测试菌的接种量梯度要合理设置,以保证荧光定量分析时Ct值具有明显的梯度差,利于数据分析。在DNA提取时,本实验采用高通量核酸快速提取仪,每个样本只需15~20 min,一次可以同时提取36个样本,既节省了实验时间,又使学生掌握了核酸快速提取方法。
6 结论
(1) 本研究建立了利用荧光定量PCR法检测基因工程菌液体发酵过程中杂菌污染的实验方法。该方法的关键是合理确定两个参比DNA片段。在测试菌中两条参比DNA片段的拷贝数要具有一定的稳定性。利用荧光定量法确定两条参比DNA片段在测试菌中拷贝数,并将其比值作为基数。染菌后发酵液菌体中提取的DNA按相同的方法进行定量分析后,若两条参比DNA片拷贝数比值偏离基数一定值则可判断染菌。两条参比DNA片段在测试菌中拷贝数的比值与在杂菌中拷贝数的比值差异越大,检测的灵敏度越高。本实验选择了重组DNA片段和rDNA-ITS2区作为两条参比DNA片段。重组DNA片段扩增时背景菌显示为阴性,利用引物对ITS3/ITS4扩增rDNA-ITS2区时测试菌显示为阴性。选择的两条DNA片段的拷贝数不但稳定而且分别在测试菌和背景菌中具有唯一性。
(2) 本项目通过人为接种枯草芽孢杆菌的方法制造了发酵过程中杂菌污染的状态。通过荧光定量分析发现:在利用大肠杆菌作为载体进行基因工程菌发酵时以枯草芽孢杆菌为主的杂菌污染会明显抑制大肠杆菌的生长。但是由于大肠杆菌的代时短、竞争力强,其生长并不能被完全抑制。同时大肠杆菌的生长也对杂菌表现出了一定的抑制作用。
(3) 该实验融合了核酸快速提取技术、荧光定量分析技术、共培养技术和微生物生长特性分析等方面的技能点,培养了学生对多学科知识的综合运用能力,加强了学生的实践技能和创新能力。
(4) 本研究利用微生物繁殖速度快的优势设计了简化的相对定量模型,简化了实验流程,缩短了实验周期,降低了实验成本,使其适合本科生实验教学,使本科生有机会在实验课堂上学习荧光定量操作技术,开阔了学生的视野,激发了学生参与实验、参加科研的积极性和主动性。
References)
[1] 黄秀梅,叶子坚,李鹤宾,等.重组人胰岛素原基因高效表达和纯化的研究[J].江西农业大学学报,2014,36(2):418-421.
[2] 李民,杨立宏,任红玉,等.高密度培养大肠杆菌YK537/pSBHL-11生产重组人细胞白介素-3[J].生物工程学报,1999,15(4):470-476.
[3] 王晓沁,闫玉清,赵滨强,等.人γ-干扰素生产工艺研究[J].生物工程学报,1998,14(2):203-207.
[4] 陈晶晶,陈劲春.巴斯德毕赤酵母发酵生产重组人溶菌酶[J].北京化工大学学报,2006,33(6):34-37.
[5] 王宁,刘颖,李媛媛,等.复制型重组豆苗活载体疫苗生产工艺研究[J].中国生物制品学杂志,2008,21(2):131-132,138.
[6] 唐雨德,顾志香,刘玉,等.猪囊虫病基因工程苗的生产工艺研究[J]. 中国兽医科技,2000,30(10):8-11.
[7] 郝常明,赵建锋,黄雪菊.生物发酵染菌问题的探讨[J].医药工程设计,2007,28(2):11-15.
[8] 任广睦,刘季,王英元.实时荧光定量PCR技术应用于核酸定量检测的研究进展及展望[J].山西医科大学学报,2006,37(9):973-976.
[9] 赵向阳.人白介素-18的基因合成、原核表达与生物学活性初步研究[D].长春:吉林大学,2009.
[10] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RAN genes for phylogenetics[M]//PCR-protocols and applications-A Laboratory manual.New York: Academic Press,1990:315-322.
[11] Nuc P,Nuc K.Recombinant protein production in Escherichia coli[J].Postepy Biochem,2006,52(4):448-456.
[12] 李春凤,林显华,谷巍.枯草芽孢杆菌在饲料生产及环境防治中的应用[J].中国饲料,2013(1):10-12,17.
[13] 黄兵,刘宁,黄英,等.放线菌与枯草芽孢杆菌的共培养及其对活性次生代谢产物的影响[J].生物工程学报,2009,25(6):932-940.
Design of experiment to analyze characteristics of microorganism growing in contaminated environment using Q-PCR technique
Tang Haifeng, Jiang Dan, Meng Lingjun, Wang Di, Wang Yanfeng, Liu Yan
(School of Life Sciences,Jilin University,Changchun 130012, China)
This work designed an experimental work flow detecting the contamination using Q-PCR technique during fermenting genetically engineered bacterium. By analyzing the better fitting between Ct value and initial inoculum dosage of Escherichia coli JM109,the conclusion could be drawn that microorganism will inhibit each others in co-culture system. By performing this work flow in teaching,the practical ability of undergraduates will be improved,because this work flow can integrate the fast extracting nucleic acid technique,Q-PCR technique and analyze characteristics of microorganism growing in contaminated environment.
detecting contamination; Q-PCR; liquid fermentation
DOI:10.16791/j.cnki.sjg.2016.06.014
2015-10-02修改日期:2016-02-17
吉林大学实验技术项目资助“Q-PCR实时检测液体发酵杂菌污染功能的开发”
汤海峰(1980—),男,吉林长春,在读博士研究生,工程师,主要从事分子生物学实验课程的教学研究
E-mail:tanghf@jlu.edu.cn
刘艳(1975—),女,吉林长春,博士,高级工程师,主要从事实践教学研究.
TQ920.1;G642.0
A
1002-4956(2016)6-0050-05

