阔叶林改种毛竹(Phyllostachyspubescens)后土壤固氮细菌nifH基因多样性的变化
沈秋兰, 何冬华, 徐秋芳, 程 敏, 毛新伟, 李永春, 陈俊辉
(浙江农林大学环境与资源学院,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安 311300)
阔叶林改种毛竹(Phyllostachyspubescens)后土壤固氮细菌nifH基因多样性的变化
沈秋兰, 何冬华, 徐秋芳*, 程 敏, 毛新伟, 李永春, 陈俊辉
(浙江农林大学环境与资源学院,浙江省森林生态系统碳循环与固碳减排重点实验室,浙江临安 311300)
【目的】毛竹是喜氮植物,土壤氮素水平对毛竹生长至关重要。生物固氮是土壤氮素的重要来源,因此,探索阔叶林改种毛竹后土壤固氮细菌和土壤氮素的变化具有重要意义。【方法】选择立地条件相近的毛竹林(100多年前由阔叶林改种而来)和阔叶林,每种林地在东北坡向位置随机选择4个10 m×10 m标准样地,每个标准样地选取5个采样点,分层采集0—20 cm(表层)和20—40 cm(次表层)土壤样品,分析了土壤pH、有机碳、碱解氮、有效磷、速效钾和含水量等常规理化性质; 采用引物对AQER和PolF,以土壤总DNA为模板扩增了固氮细菌功能基因(nifH)片段,应用变性梯度凝胶电泳(DGGE)和实时荧光定量PCR(Real-time PCR),分析了固氮细菌群落结构、多样性以及丰度(nifH基因拷贝数)变化; 通过基因克隆测序对土壤固氮细菌进行初步鉴定。【结果】阔叶林改种毛竹后土壤pH显著(P<0.05)提高; 毛竹林土壤的含水量、碱解氮以及表层土壤的速效钾显著高于(P<0.05)同层的阔叶林土壤,而有效磷则显著(P<0.05)低于同层的阔叶林土壤。总体来说,阔叶林改种毛竹后土壤养分含量明显提高; 阔叶林土壤固氮细菌DGGE条带数以及多样性指数(Shannon-Wiener index)都高于毛竹林; 基于DGGE条带信息的聚类分析和主成分分析(PCA)结果表明,阔叶林和毛竹林区分为2个类群,而同一林分的不同土层之间差异较小; 实时荧光定量PCR结果显示,毛竹林土壤的固氮细菌nifH基因丰度显著(P<0.05)高于阔叶林土壤; 通过克隆测序,14个阳性克隆分别属于2个不同的菌属,其中13个均为Bradyrhizobium,1个为Azohydromonaslata,条带序列与已知序列的相似度为93%98%。【结论】阔叶林改种毛竹后土壤固氮细菌的种类减少,而功能基因丰度却明显增加; 土壤氮素水平明显提高,这可能是土壤固氮能力增强的结果。
毛竹; 土壤固氮细菌; 氮素
毛竹(Phyllostachyspubescens)是禾本科刚竹属(Phyllostachys),主要分布于热带和亚热带地区,是我国一种重要的森林资源[1]。20世纪70年代以来,许多研究者通过毛竹开展了氮磷钾三要素最佳配比的肥料试验。黄当亮[2]认为2 ∶1 ∶1的比例对毛竹出笋效果最好; 郭晓敏等[3]报道N ∶P ∶K为1 ∶0.68 ∶0.49时,出笋率和成竹率为最佳; 郑蓉等[4]指出氮的比例相对较高,说明氮素对毛竹生长具有十分重要的作用。然而,毛竹在立地条件较好(如由花岗岩发育而来的土壤)的粗放经营(不施肥)环境中也能良好生长,说明毛竹林生态系统自身有能力保证氮素的供应。对于不施肥的粗放经营森林生态系统,生物固氮是土壤氮素的主要来源,生物固氮量为非生物固氮量的两倍多[5],是地球上最大规模的天然氮肥工厂。由此,本研究提出科学假设: 阔叶林改种毛竹后可能影响生态系统氮素循环和固氮微生物的活动。
土壤中许多固氮微生物是非培养的,因此通过分子生物技术能更全面地了解土壤固氮微生物的特性。编码固氮酶铁蛋白组分的结构基因nifH基因是固氮细菌最为保守的功能基因,常用来证明固氮菌的存在[6-9],同时,也用以揭示固氮菌群落结构与环境的关系[10]。目前对于竹林生态系统固氮微生物的研究甚少,侯伟等[11-12]对广东刺竹植株体内的固氮菌多样性进行了研究,并通过接种实验证明固氮菌株对植物生长有一定的促进作用; 而且,对毛竹林土壤固氮菌的研究只有早期顾小平和吴晓丽两位学者的3篇报道[13-15]。他们应用传统的平板培养法,从毛竹根际分离得到36个固氮菌,发现其固氮活性随温度和pH变化而变化,不同碳源也会对固氮活性产生一定的影响。本研究以纯自然未被改种的阔叶林为毛竹林的对照,结合土壤常规理化分析,应用nifH基因的特异引物对,利用DGGE和荧光定量PCR等方法,着重研究2种土壤的固氮细菌和氮素特征,旨在揭示阔叶林改为毛竹林后不同土层固氮微生物nifH基因多样性与土壤氮素的变化。该研究结果对指导毛竹林经营和持续发展具有重要的指导意义。
1 材料与方法
1.1土壤样品采集与处理
研究区位于浙江省西北部的临安市青山镇(30°14′ N, 119°42′ E),属中亚热带季风气候区,平均降水量为1628.6 mm,年平均气温16.4℃,日照时数1847.3 h,无霜期237.0 d。土壤为砂页岩发育的红壤,两种林地分布在相邻的两个山体,每个山体的面积为0.35公顷左右,海拔60140 m,坡度为25°。
纯自然的阔叶林主要优势树种有苦槠(Castanopsissclerophylla)、木荷(Schimasuperba)、青冈(Cyclobalanopsisglauca)等,林下灌木种类有山胡椒(Linderaglauca)、山苍子(Litseacubeba)等,覆盖度为70%。毛竹林则为100多年前由阔叶林改种而来,竹林立竹密度为28003200株/hm2,平均胸径为30 cm左右。毛竹林主要采用冬季劈除林下杂灌、不翻耕施肥的粗放经营措施,林下仅少量杂草; 毛竹每隔一年出笋长新竹(称大年),大年时挖去部分春笋,保留一定数量的新竹,小年(不长新竹)时砍伐6年生的成熟毛竹。
于2013年5月,每种林地在东北坡向的不同位置,随机选取4个10 m×10 m标准样地,每个标准样地选取5个采样点,分层采集0—20 cm(表层)和20—40 cm(次表层)土壤,将每个标准样地同一土层的土壤充分混匀形成一个混合样品,每种林地得8个混合样品(2个土层,4个重复),2种林地共计16个样品(2种林地,2个土层,4个重复)。样品过2 mm钢筛、充分混匀,从中取出部分样品装入小塑料瓶后放入备好的冰盒,带回实验室后置于-70℃保存,土样经冷冻干燥后提取DNA,其余部分带回实验室风干后用于土壤理化性质的测定。
1.2分析方法
1.2.1 土壤理化性质参照鲁如坤等[16]方法对土壤理化性质进行分析。其中,土壤pH值采用1 ∶2.5土水质量比,用复合电极测定; 有机碳含量采用重铬酸钾-油浴外加热法测定; 碱解氮采用碱解扩散法; 有效磷采用Bray法,盐酸-氟化铵溶液浸提,钼锑抗比色法测定; 速效钾采用醋酸铵提取,火焰分光光度计测定。
1.2.2 土壤总DNA的提取采用Power SoilTMTotal DNA Isolation Kit试剂盒(美国Mo Bio公司)提取土壤总DNA,称取0.5 g于-70℃保存的土壤样品,按试剂盒说明书进行土壤DNA提取,通过1.2%琼脂糖凝胶电泳对DNA提取效果进行鉴定,提取后的DNA样品保存于-40℃。
1.2.3 土壤固氮细菌的PCR扩增使用BIO-RAD公司的PCR仪对固氮细菌特异性nifH基因进行扩增,表1为反应步骤和对应的引物[17]序列(上海生物工程有限公司)。20 μL反应体系如下: Premix 10 μL,引物各 0.2 μL,BSA 0.2 μL,模板0.2 μL,H2O 9.2 μL。第一轮反应, 94℃预变性3 min,94℃变性1 min,55℃退火1 min,72℃延伸2 min,30个循环,最后72℃延伸5 min; 第二轮反应, 以第一轮产物为模板,94℃预变性3 min,94℃变性1 min,48℃退火1 min,72℃延伸2 min,35个循环,最后72℃延伸5 min[17]。取4 mL PCR反应产物用1.2%的琼脂糖凝胶进行电泳,确认其片段大小,并用于DGGE分析。
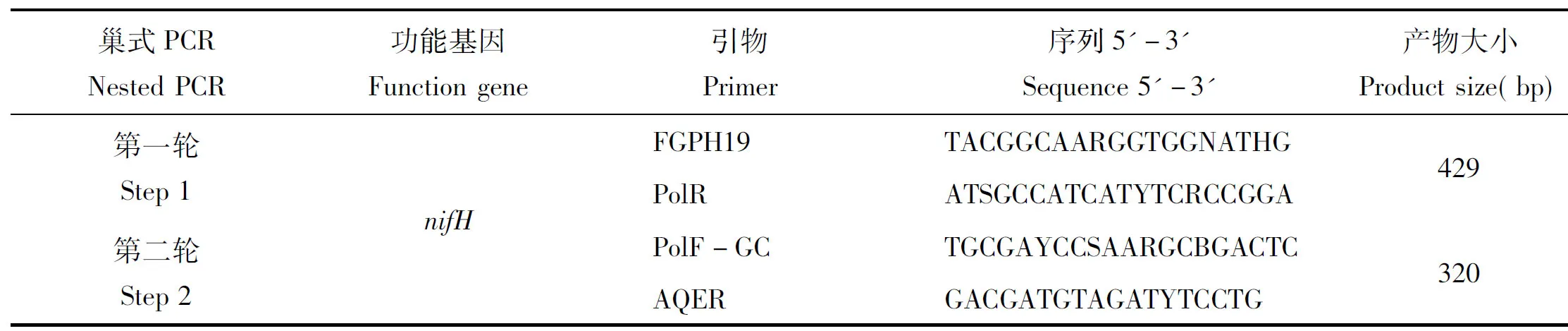
表1 PCR扩增所用引物
注(Note): R=A/G; N=A/G/C/T; H=T/C/A; Y=C/T; S=G/C.
1.2.4 变性梯度凝胶电泳(DGGE)参照Marcia等[17]和Wartiainen等[18]的方法,改良后使用BIO-RAD基因突变仪进行变性梯度凝胶电泳,丙烯酰胺凝胶浓度为8%,电泳缓冲液为1×TAE,变性梯度为40%65%(100%变性剂为7 mol/L尿素,40%去离子甲酰胺)。在60℃、80 V条件下,电泳14 h后,用Gelred(美国Invitrogen公司)(1 ∶10000稀释)染色30 min,染色结果用Gel DocTMEQ(BIO-RAD)凝胶成像系统成像,使用Quantity One 4.4 软件(BIO-RAD)进行图像分析,确定电泳条带数、亮度和光密度。
1.2.5 固氮细菌nifH基因序列分析根据2种林地土壤样品固氮细菌nifH基因DGGE图谱结果,选取主要条带进行割胶回收,回收条带使用pEASY-T3试剂盒(北京全式金生物技术有限公司)进行克隆,菌液送生工测序,测序结果在NCBI上进行Blast比对。
1.2.6 固氮细菌nifH基因定量PCR以土壤总DNA为模板,AQER和PolF为引物(引物见表1),采用实时荧光定量PCR(Real-time PCR)法测定固氮细菌nifH基因拷贝数。20 μL反应体系组成如下: 2×SYBR Premix Ex Taq 10 μL,50 μmol/L上游和下游引物各0.2 μL,模板DNA 1 μL,无菌双蒸水8.6 μL。荧光定量PCR扩增在CFX96TMReal-Time System(BIO-RAD, USA)仪器上进行,每个样品3个重复。荧光定量PCR 程序参考文献[17]。标准曲线制作: 从测序结果中选取合适的阳性克隆子,扩增培养后提取质粒DNA,紫外吸收定量法(OD260/OD280)检测浓度,重组质粒梯度稀释(10-110-8)后作为nifH基因的荧光定量的标准样品,样品的反应程序和反应体系同标准样品测定。
1.3数据处理
采用SPSS 18.0统计软件进行数据处理,采用t检验方法,检验相同土层不同林地之间、同一林地不同土层之间的差异。利用Quantity One 4.4 软件进行图谱分析时,主要采用未加权算术平均对群法 (The unweighted pair group method with arithmetic averages, UPGMA)对DGGE图谱进行聚类分析。使用CANOCO 4.5.1软件(Microcomputer Power, Ithaca, USA)对DGGE揭示的细菌群落结构进行主成分分析(PCA)。使用多样性指数H和均匀度指数(E)来评价微生物群落的多样性[19],其计算公式为:
式中,Pi为某一条带的强度与同泳道中所有条带总强度的比值,即Pi=i/N;i是物种的个体数,在这里指条带的强度;N是所有物种的个体总数,在这里指同泳道中所有条带总强度;S为每一泳道总的条带数。
2 结果与分析
2.1土壤理化性质
阔叶林改种毛竹后,土壤pH显著(P<0.05)提高(表2); 毛竹林土壤的含水量、碱解氮以及表层土壤的速效钾,都显著高于(P<0.05)同层的阔叶林土壤,而有效磷则显著(P<0.05)低于同层的阔叶林土壤; 除阔叶林土壤有机碳含量外,同一林地的其他指标均为表层土壤大于次表层土壤,其中毛竹林表层土壤的pH、碱解氮、有效磷和速效钾含量显著(P<0.05)高于次表层。显然,阔叶林地改种毛竹后,土壤酸性减弱,有效养分含量明显提高。
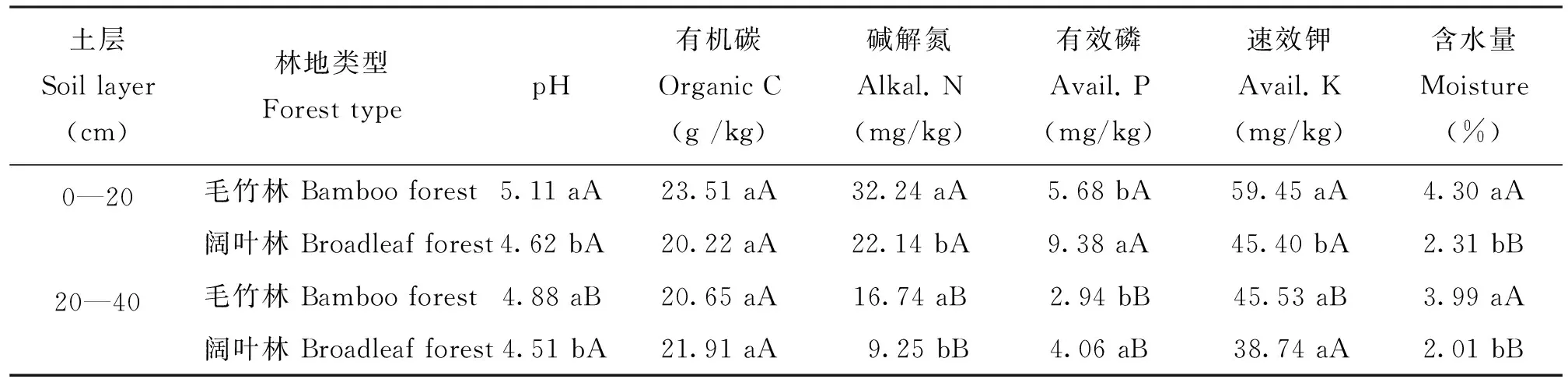
表2 阔叶林和毛竹林地土壤基本理化性质
注(Note): 同列数值后不同小写字母代表同一土层不同林地的显著性差异(P<0.05),大写字母代表同一林地不同土层的显著性差异(P<0.05)Values followed by different small letters are significantly different at the 0.05 level between different forests in the same soil layer, and followed by different capital letters are significant at the 0.05 level between different layers in the same forest.
2.2土壤微生物DNA
1.2%琼脂糖凝胶电泳图显示,DNA提取效果良好(图1)。OD260/OD280比值大部分在1.82.0之间,表明只是有轻度的RNA污染(OD260/OD280=1.8为最佳,OD260/OD280>1.9为RNA污染,OD260/OD280<1.6为蛋白质污染); OD值的大小即DNA的浓度,能大致反映土壤微生物数量[20],无论是表层还是次表层,毛竹林土壤DNA浓度均明显高于对应土层的阔叶林,说明毛竹林土壤的微生物生物量高于阔叶林。

图1 DNA 1.2%琼脂糖凝胶电泳图、浓度以及OD260 nm与OD280 nm比值Fig.1 1.2%AGE of DNA, concentration and OD260nm/OD280 nm[注(Note): M—Marker; 14—毛竹林0—20 cm土层样品Soil of Moso bamboo forest at 0-20 cm layer; 58—毛竹林20—40 cm土层样品Moso bamboo forest at 20-40 cm layer; 912—阔叶林0—20 cm土层样品Broadleaf forest at 0-20 cm layer;1316—阔叶林20—40 cm土层样品Broadleaf forest at 20-40 cm layer.
2.3固氮细菌群落结构及多样性
采用嵌套式PCR扩增技术对固氮细菌nifH基因进行扩增,经1.2%琼脂糖凝胶电泳后,获得条带清晰的400 bp左右DNA片段。PCR产物经DGGE分离出数目、强度和迁移位置不同的条带(图2)。DGGE图中不同位置的条带代表不同的细菌种群[21]; 电泳条带越多,说明细菌种群越多[22]; 条带信号越强,表示该条带代表的相应细菌数量越多。本研究的目标条带是固氮细菌,比较毛竹林和阔叶林这两种林地之间的条带发现,两种土壤的DGGE带谱差异明显,阔叶林土壤条带数和优势条带(亮度大)明显多于毛竹林。16个样品共出现21条位置不同的条带,其中阔叶林、毛竹林地分别有20条、17条条带。同一林地不同土层土壤固氮菌差异不明显。
分析比较条带特征发现,条带11为两种林地的共性条带,不仅亮度最大而且在不同土壤间差异最小,表明该种固氮细菌在两种林地中均有生长,并且为土壤固氮细菌群落中的优势种群; 共性条带12亮度较低,不同土壤样品间有明显差异; 条带20、21分别为阔叶林和毛竹林的特征条带,对应土壤表层亮度高于次表层,说明这两个条带对应的固氮细菌主要活跃于土壤表层; 毛竹林土壤中非共性条带18、19的亮度大于阔叶,而条带15、16、17则呈现出相反的趋势。
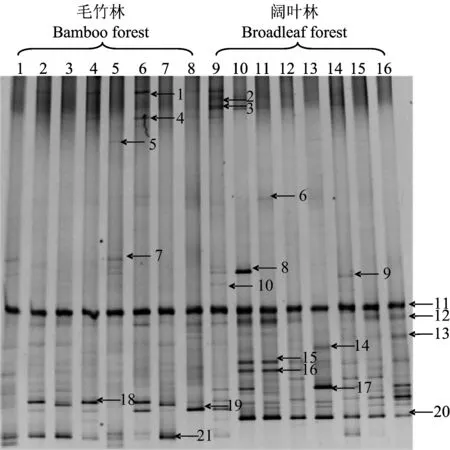
图2 nifH 基因DGGE电泳图谱Fig.2 DGGE fingerprinting of nitrogen-fixing bacteria based on nifH gene[注(Note): M—Marker; 14—毛竹林0—20 cm土层样品 0—20 cm soil layer in Moso bamboo forest; 58—毛竹林20—40 cm土层样品20—40 cm soil layer in Moso bamboo forest; 912—阔叶林0—20 cm土层样品 0—20 cm soil layer in broadleaf forest; 1316—阔叶林20—40 cm土层样品20—40 cm soil layer in broadleaf forest .]
根据固氮细菌DGGE图谱中条带位置和亮度计算多样性指数H和均匀度指数E(表3)。多样性指数H越大,说明微生物群落多样性越高; 均匀度指数E表示微生物在环境中的分布状况,各微生物数目越接近,数值越大[23]。结果表明,阔叶林多样性指数H大于对应土层的毛竹林,而土壤的均匀度指数E则正好相反,但均没有达到显著性差异。
2.4土壤固氮细菌 nifH 基因测序
根据2种林地土壤样品固氮细菌nifH基因DGGE图谱结果,选取主要的14个条带(编号分别为1、3、7、8、11、12、13、15、16、17、18、19、20、21)进行割胶回收测序。结果表明,14个阳性克隆分别属于2个不同的菌属(表4),其中13个均为Bradyrhizobium,1个为Azohydromonaslata[24],但14个条带的序列与已知序列的相似度为93%98%,相似度低于98%说明与已知的物种存在一定差异,相似度低于96%的可能是新种。阔叶林土壤的特征性条带20和毛竹林土壤特征性条带21所对应的固氮细菌,虽然也都属于慢生根瘤菌属(Bradyrhizobium),但存在一定差异,而且毛竹林土壤的21号可能是新种。
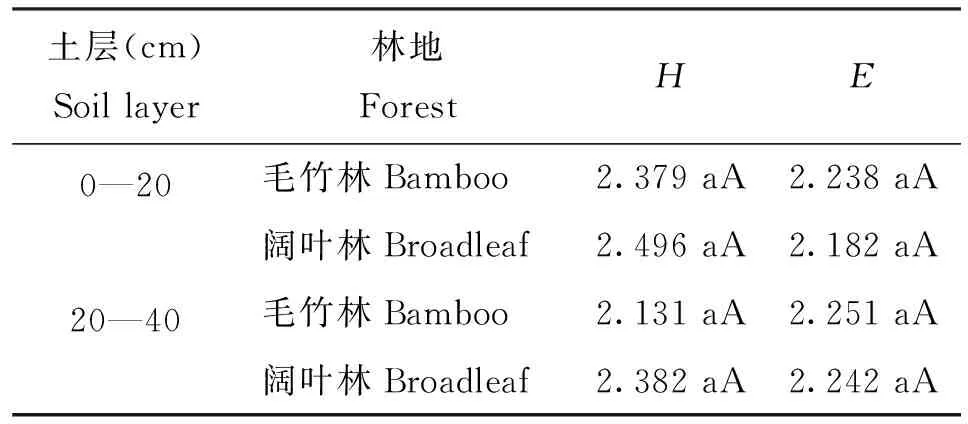
表3 土壤固氮细菌群落多样性指数
注(Note):H—多样性指数Shannon-wiener index;E—均匀度指数Pielou index; 小写字母代表同一土层不同林地的显著性差异(P<0.05),大写字母代表同一林地不同土层的显著性差异(P<0.05)The small letters mean significant difference at the 0.05 level between different forests in the same soil layer, and capital letters mean significant difference at the 0.05 level between different layers in the same forest.
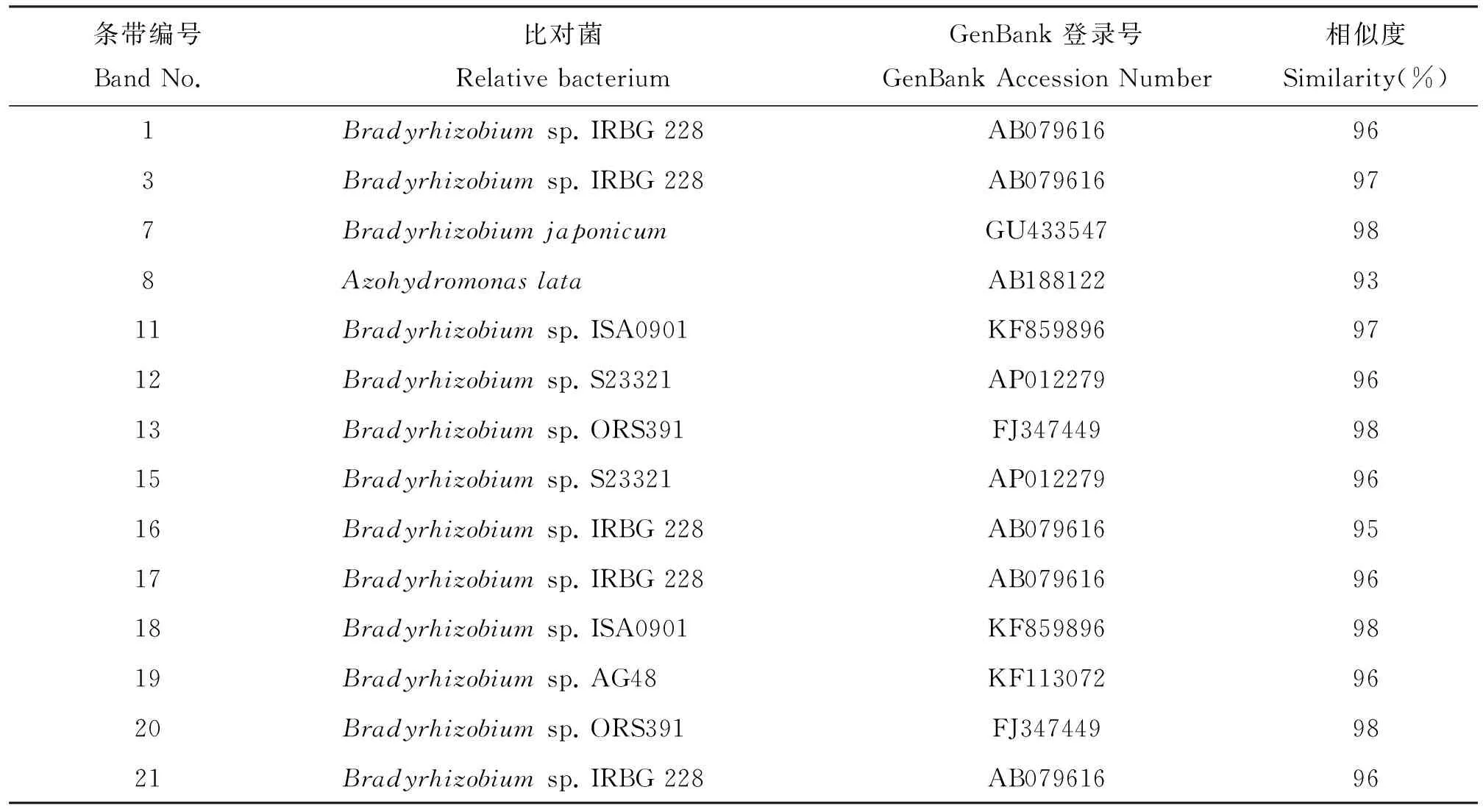
表4 DGGE条带测序比对结果
2.5聚类分析
从聚类分析图上看(图3),所有样品大致可以被归为两组(相似度低于0.4),19号为一组,1016号为另一组,除9号阔叶林土壤出现异常外,同一林地的表层和次表层样品均归为一类,说明两种林地土壤的固氮细菌群落结构存在明显差异。阔叶林土壤的表层样品(#10、11、12)和次表层样品(#13、14、16)的固氮细菌结构也存在明显差异(相似度低于0.6)。然而,毛竹林土壤则没有明显的层次差异规律。
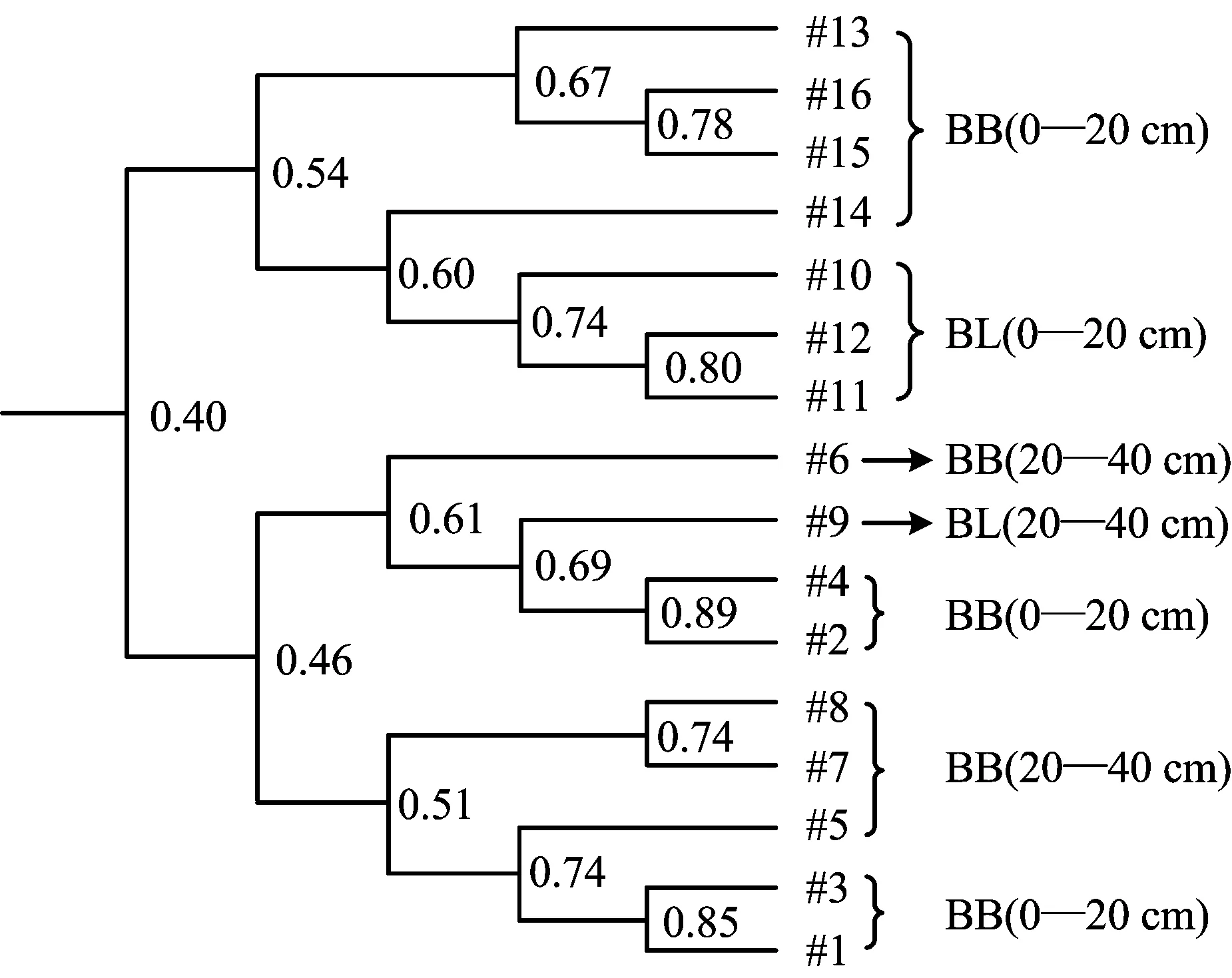
图3 土壤固氮细菌条带图谱的聚类分析Fig. 3 Cluster analysis(UPGMA)of soil nitrogen-fixing bacteria[注(Note): BB—毛竹林Bamboo; BL—阔叶林Broadleaf.]
2.6主成分分析(PCA)
为更进一步揭示土壤样品间固氮细菌群落结构的相互关系,对不同样品DGGE图谱上条带位置和亮度进行数字化处理后的主成分分析(Principal Component Analysis,PCA)结果显示,主成分1解释了样品中32.0%的变异,主成分2解释了样本中17.1%的变异,共解释了样本中49.1%的样本总变异(图4)。在PC1上,两种林地得到了较好的区分,毛竹林土壤样品除了3号外主要分布在坐标轴左侧,阔叶林土壤样品除了9号外主要分布在坐标轴右侧,表明不同林地间固氮细菌群落有明显差异; 毛竹林不同土层固氮细菌在PC1上存在差异,而阔叶林土壤固氮细菌土层间的差异主要落在PC2上; 该结果表明,不同林地的固氮细菌群落结构存在一定的差异。
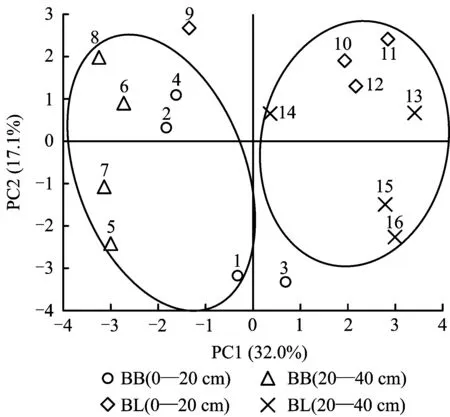
图4 固氮细菌群落的主成分分析(PCA)Fig. 4 PCA of nitrogen-fixing bacteria communities[注(Note): BB—毛竹林Bamboo; BL—阔叶林Broadleaf.]
2.7丰度分析
实验测得所提nifH基因质粒浓度为301 ng/μL,将其转换成拷贝数为8.18×1010, 10 倍稀释质粒,共稀释得8个梯度作为标准品进行荧光定量PCR,不同梯度生物重组质粒为模板进行实时荧光定量PCR标准曲线的制作。得到的标准曲线每个梯度均有呈明显“S”型的特征性扩增曲线,通过定量 PCR ,利用稀释的质粒作出Ct 值与起始拷贝数对数线性关系的标准曲线(R2=0.997,E=91.8%)。利用Real-time PCR技术获得各土壤样品nifH功能基因拷贝数,换算出每克干土nifH基因的拷贝数(图5)。结果表明,同一土层毛竹林土壤nifH功能基因拷贝数显著大于阔叶林,而同一林地表层和次表层nifH基因拷贝数则没有明显差异。说明毛竹林土壤中的固氮细菌数量明显高于阔叶林土壤。
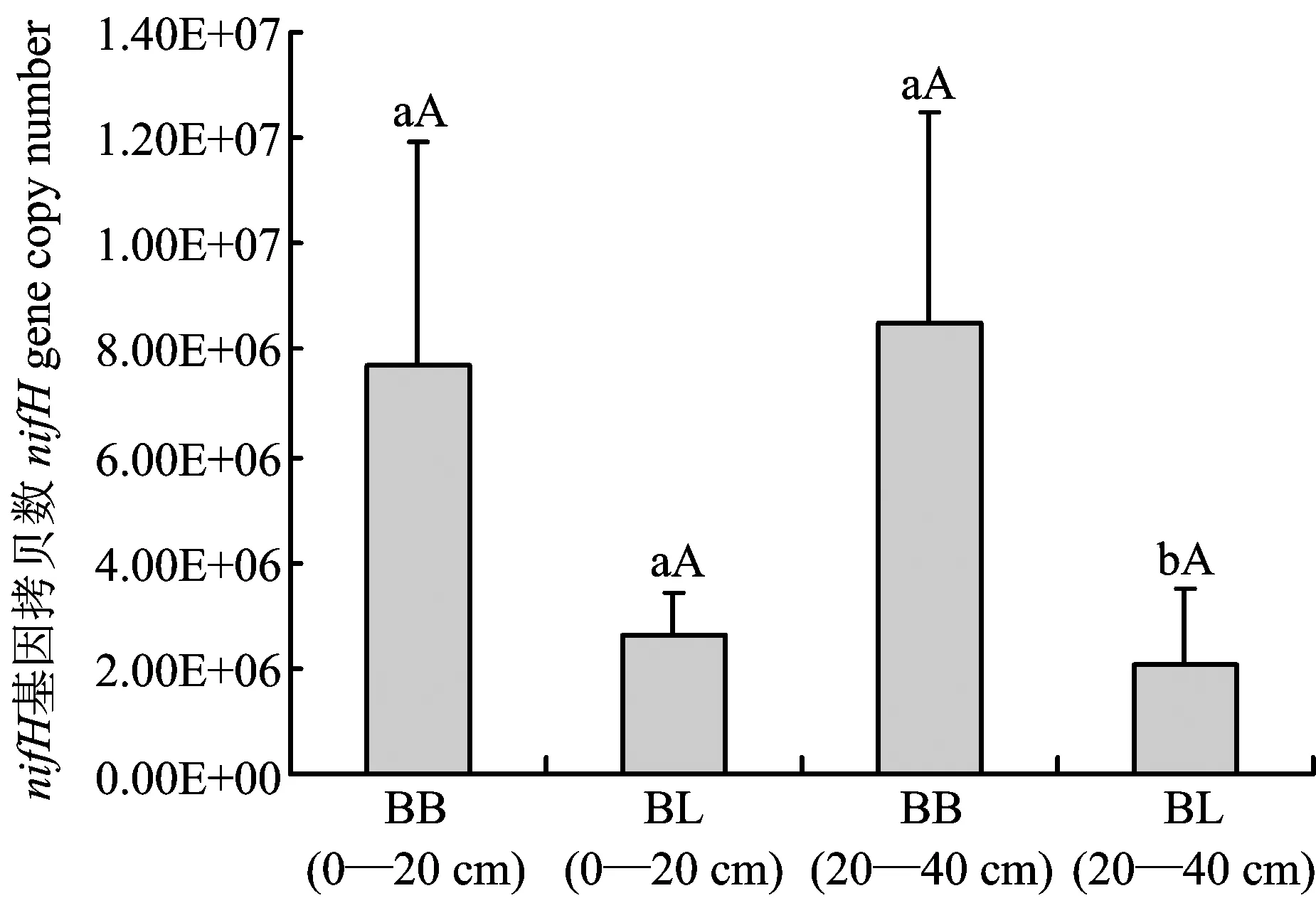
图5 nifH 基因拷贝数Fig.5 Abundance of nifH gene[注(Note): BB—毛竹林Bamboo; BL—阔叶林Broadleaf. 柱上不同小写字母表示同一土层不同林地 nifH 基因拷贝数差异达显著水平(P<0.05),不同大写字母表示同一林地不同土层 nifH 基因拷贝数差异达显著水平(P<0.05) Different small letters above the bars mean significant difference at the 0.05 level between different forests in the same soil layer, and different capital letters mean significant difference at the 0.05 level between different layers in the same forest.]
3 讨论与结论
本研究中,两种土壤固氮细菌功能基因的DGGE图谱分析结果中阔叶林土壤固氮细菌物种数量(条带数)和种群数量(亮度)以及以此为基础计算得出的多样性指数H高于毛竹林,可以推测阔叶林土壤的固氮细菌物种多样性较毛竹林丰富。影响土壤固氮微生物群落结构以及多样性的因素包括植被[25]、土地利用[9]、养分[26]、温度和pH[27-28]等,其中植被是土壤微生物赖以生存的有机营养物和能量的重要来源,影响着土壤微生物的定居环境。土壤中自生固氮菌大部分为异养,需要碳源来满足繁殖和代谢活动。因此,阔叶林植被种类丰富,改种毛竹后,群落结构变得单一,植物多样性低,植被和土壤的碳储量都减少了[29-30],这可能是导致以上差异的重要原因。
一般认为微生物种类越多,各物种的数量(individual population)越多,则功能基因的拷贝数越多。由以上一般规律推测,DGGE方法检测到条带数多——即固氮细菌种类多的阔叶土壤应该比毛竹土壤具有较高的nifH基因拷贝数。然而,定量PCR分析结果没有支持以上规律,毛竹林土壤固氮细菌的nifH基因丰度反而高于阔叶林(图5)。本研究支持毛竹林土壤固氮细菌的nifH基因丰度高的理由有两方面: 一是毛竹林土壤较高的pH更有利于固氮细菌的活动,因为大部分土壤固氮细菌数量受pH的影响较大,有其最适pH范围[31-32]; 二是毛竹林土壤除有效磷外的其它所测养分指标均优于阔叶林(表2),也有利于土壤固氮细菌活动。刘骏等[33]通过对竹林-阔叶林界面两侧土壤养分差异的研究发现,由于毛竹细根的作用,毛竹林土壤有机碳和总氮的含量分别高出阔叶林34.53%和60.35%,而毛竹林土壤全磷含量低于阔叶林25.54%,这与本文研究结果一致。Reardon等[34]研究发现,土壤微生物总生物量高的土壤nifH基因丰度高,毛竹林土壤微生物量高于阔叶林(图1)。毛竹林土壤pH和土壤养分改善的综合结果有利于土壤固氮细菌活动。
导致PCR-DGGE和定量PCR分析两种方法结果不一致有以下两种可能: 1)如果两个土壤固氮微生物群落的物种组成有差别,由于不同DNA片段扩增效率不同,出现的结果也会有差异[35], 如有的物种的扩增效率特别高,会出现条带少而基因拷贝数总数高的结果; 虽然条带数量较少但某些条带亮度特别大,也可能出现条带少而基因拷贝数总数高的结果,但这都不符合本研究的情况。两种林地土壤的固氮细菌物种(DGGE中条带位置)基本相同(图3),且阔叶林土壤大部分条带亮度比毛竹林土壤强。2)与两种分析方法的灵敏度不同有关。DGGE技术虽然克服了微生物培养过程中的一些困难,但是土壤中的微生物种群和数量的变化本身就是一个非常复杂的过程。并且,DGGE方法通常只能反映总DNA中占1%以上的菌群,数量太少的目标片段无法显示出来[36],而定量分析则能扩增微量的目标片段; 前者好比放大镜,难以清楚地观察到微小的生物,而后者好比显微镜,能检测到毛竹林土壤中存在着的低含量的目标DNA。因此,DGGE方法可能低估了土壤固氮细菌的多样性。当然这一推测需要进一步应用其它方法来证实。类似的现象也发生在雷竹(Phyllostachysviolascens)林不同施肥处理对土壤氨氧化细菌的影响试验中,不同处理土壤功能基因(amoA)的DGGE多样性差异与定量PCR正好相反[37]。
毛竹林土壤固氮细菌nifH基因丰度高意味着比阔叶林土壤固定更多的氮,虽然毛竹林通过挖笋和砍伐竹材带走了不少养分,但毛竹林土壤有效养分水平总体改善明显,而毛竹林土壤氮素水平的增加也可能是土壤固氮能力增强的结果。长此以往,土壤养分与土壤微生物相互促进,形成良性循环。
综合以上结果,阔叶林改种毛竹100多年后,土壤pH和氮、钾的有效养分有所提高; DGGE检测到的毛竹土壤固氮细菌多样性明显下降,但定量PCR检测的土壤固氮基因(nifH)丰度显著提高,定量结果与毛竹林土壤氮素水平提高结果吻合,因此,阔叶林改种毛竹后有利于土壤固氮细菌活动,从而改善土壤氮素供应。
[1]Han J G, Xia D L, Li L B,etal. Diversity of culturable bacteria isolated from root domains of moso bamboo (Phyllostachysedulis)[J]. Microbial Ecology, 2009, 58(2): 363-373.
[2]黄当亮. 毛竹施肥试验研究[ J ]. 福建林业科技, 1998, 25(4): 52-55.
Huang D L. Study on the fertilization experiment ofPhyllostachyspubescens[J]. Journal of FuJian Forestry Science and Technology, 1998, 25 (4): 52-55.
[3]郭晓敏, 李滋仁, 周桂香, 等. 毛竹平衡施肥钾肥效应研究[A]. 中国土壤学会. 面向未来的土壤科学(中册)—中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集[C]. 成都, 2012.
Guo X M, Li Z R, Zhou G X,etal. Study on effect of balanced potassium fertilization on bamboo in Yongfeng[A]. Soil Science Society of China . Essays of the 12th national member representative assembly and the ninth seminar of soil fertilizer academic exchanges across the Taiwan Straits of Soil Science Society of China[C]. Chengdu, 2012.
[4]郑蓉, 郑维鹏, 连华萍, 等. 施肥对毛竹笋材两用林土壤养分分布与肥力状况的影响[J]. 世界竹藤通讯, 2014, 12(1): 1-6.
Zheng R, Zheng W P, Lian H P,etal. Effects of fertilization on soil nutrient distribution and fertility status of shoot and timber stand ofPhyllostachysedulis[J]. World Bamboo and Rattan, 2014, 12(1): 1-6.
[5]覃丽萍, 黄思良, 李杨瑞. 植物内生固氮菌的研究进展[J]. 中国农学通报, 2005, 21(2): 150-159.
Qin L P, Huang S L, Li Y R. Research progress inEndophyticdiazotroph[J]. Chinese Agricultural Science Bulletin, 2005, 2(2): 150-159.
[6]Terakado-Tonooka J, Ohwaki Y, Yamakawa H,etal. ExpressednifHgenes of endophytic bacteria detected in field-grown sweet potatoes (IpomoeabatatasL.)[J]. Microbes and Environments, 2008, 23: 89-93.
[7]谭志远, 彭桂香, 徐培智, 等. 普通野生稻 (Oryzarufipogon) 内生固氮菌多样性及高固氮酶活性[J]. 科学通报, 2009, 13: 1885-1893.
Tan Z Y, Peng G X, Xu P Z,etal.Diversity and high nitrogenase activity of endophytic diazotrophs fromOryzarufipogon[J]. Chinese Science Bulletin, 2009, 13: 1885-1893.
[8]文都日乐, 李刚, 杨殿林, 等. 呼伦贝尔草原土壤固氮微生物nifH基因多样性与群落结构[J]. 生态学杂志, 2011, 30 (4): 790-797.
Wendu R L, Li G, Yang D L,etal.nifHgene diversity and community structure of soil nitrogen-fixing bacteria in Hulunbeier grassland, Inner Mongolia[J]. Chinese Journal of Ecology, 2011, 30 (4): 790-797.
[9]Mirza B S, Potisap C, Nüsslein K,etal. Response of free-living nitrogen-fixing microorganisms to land use change in the Amazon rainforest[J]. Applied and Environmental Microbiology, 2014, 80(1): 281-288.
[10]康文龙, 台喜生, 李师翁, 等. 祁连山高寒草原碱性土壤固氮微生物数量及固氮基因 (nifH) 群落结构研究[J]. 冰川冻土, 2013, 35(1): 208-216.
Kang W L, Tai X S, Li S W,etal. Research on the number of nitrogen-fixing microorganism and community structure ofnifHgenes in the alkali soils of alpine steppe in the Qilian Mountains[J]. Journal of Glaciology and Geocryology, 2013, 35(1): 208-216.
[11]侯伟, 彭桂香, 许志钧, 等. 广东省刺竹内生固氮菌多样性[J]. 农业生物技术学报, 2007, 15 (2): 290-294.
Hou W, Peng G X, Xu Z J,etal. Diversity of endophytic diazotrophs isolated fromBambusablumeanain Guangdong Province[J]. Journal of Agricultural Biotechnology, 2007, 15 (2): 290-294.
[12]侯伟, 彭桂香, 许志钧, 等. 广东箣竹内生固氮菌生理特性及促生效果研究[J]. 林业科学研究, 2008, 21 (1): 101-105.
Hou W, Peng G X, Xu Z J,etal. Growth promoting effects and physiological property of endophytic diazotrophs isolated from Guangdong bamboo (BambusaBlumeana)[J]. Forest Research, 2008, 21 (1): 101-105.
[13]顾小平, 吴晓丽. 毛竹及浙江淡竹根际联合固氮的研究[J]. 林业科学研究, 1994, 7 (6): 618-623.
Gu X P, Wu X L. A study on associative nitrogen fixation of bamboo rhizosphere[J]. Forest Research, 1994, 7 (6): 618-623.
[14]顾小平, 吴晓丽. 毛竹根际分离的多粘芽孢杆菌固氮特性的研究[J]. 林业科学研究, 1998, 11 (4): 377-381.
Gu X P, Wu X L. Study on several nitrogen fixation strains fromPhyllostachyspubescensroots[ J ]. Forest Research, 1998, 11 (4): 377-381.
[15]顾小平, 吴晓丽. 毛竹根际分离的地衣芽孢杆菌固氮特性研究[ J ]. 竹子研究汇刊, 1998, 17 (4): 59-63.
Gu X P, Wu X L. Study on several nitrogen fixation characters of severalBacilluslicheniformisstrains fromPhyllostachyspubescensroots[J]. Journal of Bamboo Research, 1998, 17 (4): 59-63.
[16]鲁如坤. 土壤农业化学分析方法[ M ]. 北京: 中国农业科技出版社, 2000.
Lu R K. Soil agricultural chemical analysis method[M]. Beijing: Chinese Agricultural Science and Technology Press, 2000.
[17]Coelho Marcia R R, Marriel Ivanildo E, Jenkins Sasha N. Molecular detection and quantification ofnifHgene sequences in the rhizosphere of sorghum (Sorghumbicolor) sown with two levels of nitrogen fertilizer[J]. Applied Soil Ecology, 2009, 42: 48-53.
[18]Wartiainen I, Eriksson T, Zheng W,etal. Variation in the active diazotrophic community in rice paddy—nifHPCR-DGGE analysis of rhizosphere and bulk soil[J]. Applied Soil Ecology, 2008, 39(1): 65-75.
[19]张金屯. 数量生态学[M]. 北京: 科学出版社, 2004. 153-218.
Zhang J T. Quantitative ecology[M].Beijing: Science Press, 2004, 153-218.
[20]Frostegard A, Courtois S, Ramisse V,etal. Quantification of bias related to the extraction of DNA directly from soils[J]. Applied Environmental Microbialology, 1999, 65: 5409-5420.
[21]Konstantinov S R, Zhu W Y, Williams B A,etal. Effect of fermentable carbohydrates on piglet facial bacterial communities as revealed by 16S ribosomal DNA[J]. FEMS Microbiology Ecology, 2003, 43: 225-235.
[22]Muyzer G, Smalla K. Application of denaturing gradient gel electrophoresis (DGGE) and temperature gradient gel electrophoresis (TGGE) in microbial ecology[J]. Antonie van Leeuwenhoek, 1998, 73: 127-141.
[23]谭宏伟, 杨尚东, 吴俊. 红壤区桉树人工林与不同林地土壤微生物活性及细菌多样性的比较[J]. 土壤学报, 2014, 51 (3): 147-156.
Tan H W, Yang S D, Wu J. Comparision ofEucalyptusplantation with other forests in soil microbial activity and bacterial diversity in red soil region, China[J]. Acta Pedologica Sinica, 2014, 51 (3): 147-156.
[24]Xie C H, Yokota A. Reclassification ofAlcaligeneslatusstrains IAM 12599T and IAM 12664 andPseudomonassaccharophilaasAzohydromonaslatagen. nov., comb. nov.,Azohydromonasaustralicasp. nov. andPelomonassaccharophilagen. nov., comb. Nov., respectively[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(6): 2419-2425.
[25]张于光, 王慧敏, 李迪强等. 三江源地区不同植被土壤固氮微生物的群落结构研究[J]. 微生物学报, 2005, 45(3): 420-425.
Zhang Y G, Wang H M, Li D Q,etal. The community and structure of nitrogen- fixing microorganism in Sanjiangyuan Natrual Reserve[J].Acta Microbiologica Sinica, 2005, 45(3): 420-425.
[26]李刚, 王丽娟, 李玉洁, 等. 呼伦贝尔沙地不同植被恢复模式对土壤固氮微生物多样性的影响[J]. 应用生态学报, 2013, 24(6): 1639-1646.
Li G, Wang L J, Li Y J,etal. Effects of different vegetation restoration patterns on the diversity of soil nitrogen-fixing microbes in Hulunbeier sandy land, Inner Mongolia of North China[J]. Chinese Journal of Applied Ecology, 2013, 24(6): 1639-1646.
[27]杨琼博. pH值和化合态氮对紫花苜蓿结瘤和固氮效果的影响[D]. 哈尔滨: 东北农业大学硕士学位论文, 2007.
Yang Q B. Effect of pH and combined nitrogen factors on alfalfa bunching and nitrogen fixation [D]. Harbin: MS Thesis of Northeast Agricultural University, 2007.
[28]邢永秀. 甘蔗内生物固氮细菌的分离、鉴定和生长特性[D]. 南宁: 广西大学硕士论文, 2006.
Xing Y X. Isolation and identification of endophytic nitrogen fixation in sugarcane and growth characteristics [D]. Nanning: MS Thesis of Guangxi University, 2006.
[29]杨清培, 王兵, 郭起荣, 等. 大岗山毛竹扩张对常绿阔叶林生态系统碳储特征的影响[J]. 江西农业大学学报, 2011, 33(3): 529-536.
Yang Q P, Wang B, Guo Q R,etal. Effects ofPhyllostachysedulisexpansion on carbon storage of evergreen broad- leaved forest in Dagangshan Mountain, Jiangxi[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(3): 529-536.
[30]周国模, 姜培坤. 毛竹林的碳密度和碳贮量及其空间分布[J]. 林业科学, 2004, 40(6): 20- 24.
Zhou G M, Jiang P K. Density, storage, and spatial distribution of carbon inPhyllostachysedulisforest[J]. Scientia Silvae Sinicae, 2004, 40(6): 20- 24.
[31]周移国, 代青莉, 凌敏, 等. 菌肥微生物在不同pH 茶园土壤中存活模式的研究[J]. 中国农学通报, 2013, 29 (7): 121-126.
Zhou Y G, Dai Q L, Ling M,etal. A study of bacterial microorganisms survival patterns in tea plantation soils with different pH value[J].Chinese Agricultural Science Bulletin, 2013, 29 (7): 121-126.
[32]张萍华. 模拟酸雨对土壤的理化性质, 微生物和生物活性及中药的影响[D]. 杭州: 浙江大学硕士论文, 2004.
Zhang P H. Effect of simulated acid rain on physical-chemical properties, microorganisms, biological activities in soil and Chinese medicine herbs [D]. Hangzhou: MS Thesis of Zhejiang University, 2004.
[33]刘骏, 杨培清, 余定坤, 等. 细根对竹林-阔叶林界面两侧土壤养分异质性形成的贡献[J]. 植物生态学报, 2013, 37(8): 739-749.
Liu J, Yang P Q, Yu D K,etal. Contribution of fine root to soil nutrient heterogeneity at two sides of the bamboo and broadleaved forest interface[J]. Chinese Journal of Plant Ecology, 2013, 37 (8): 739-749.
[34]Reardon C L, Gollany H T, Wuest S B. Diazotroph community structure and abundance in wheat-fallow and wheat-pea crop rotations[J]. Soil Biology and Biochemistry, 2014, 69: 406-412.
[35]马俊孝, 季明杰, 孔健. PCR-DGGE技术在微生物物种多样性研究中的局限性及其解决措施[J]. 食品科学, 2008, 29(5): 493-497.
Ma J X, Ji M J, Kong J. Overview of limitation and improving methods of PCR-DGGE in microbial diversity study[J]. Food Science, 2008, 29(5): 493-497.
[36]刘淮德, 王雷, 王宝杰, 等. 应用 PCR-DGGE 分析南美白对虾肠道微生物多样性[J]. 饲料工业, 2008, 29 (20): 55-58.
Liu H D, Wang L, Wang B J,etal. Analysis of diversity of microbial with PCR-DGGE method from intestinal of white shrimp in South America[J]. Feed Industry, 2008, 29 (20): 55-58.
[37]郭帅. 雷竹林集约经营措施对土壤 CO2, N2O 排放及氨氧化微生物的影响[J]. 浙江临安: 浙江农林大学硕士论文, 2013.
Guo S. Effects of intensive management on soil CO2, N2O emission and ammonia-oxidizing inPhyllostachysPraecoxf.Prevelnalisforest [D]. Linan, Zhejiang: MS Thesis of Zhejiang A & F University, 2013.
Variation ofnifHgene diversity of soil nitrogen-fixing bacteria in Moso bamboo(Phyllostachyspubescens)plantation converted from broadleaf forest
SHEN Qiu-lan, HE Dong-hua, XU Qiu-fang*, CHENG Min, MAO Xin-wei, LI Yong-chun, CHEN Jun-hui
(CollegeofEnvironmentandResource,ZhejiangA&FUniversity/ZhejiangProvincialKeyLaboratoryofCarbonCyclinginForestEcosystemsandCarbonSequestration,Linan311300,China)
【Objectives】 Nitrogen plays an important role in promoting the growth of Moso bamboo, the major source of nitrogen in forest soil is derived from biological nitrogen fixation. However, little is known about the impact of conversion of broadleaf forest to bamboo (Phyllostachyspubescens) plantation on changes in soil nitrogen contents and soil nitrogen-fixing bacterial community structure.【Methods】 Two plots of broadleaf forest and Moso bamboo stands with the same site condition were selected. And 4 standard areas (10 m×10 m) were chosen randomly on the northeast slope in each plot. Soil samples were collected from the topsoil (0-20 cm) and subsoil (20-40 cm) layers separately. Soil pH, organic matter, available N, available P and readily available K were analyzed. The structure and abundance of nitrogen-fixing bacterial community were measured with primers AQER and PolF via denaturing gradient gel electrophoresis(DGGE) and qPCR based onnifHgene. Preliminary identifying of soil nitrogen-fixing bacteria was sequenced by cloning. 【Results】The results showed that compared to the broadleaf forest, Moso bamboo stands had significant higher pH, moisture, contents of available N in both topsoil and subsoil and readily available K in topsoil, while the soil available P was much lower. The DGGE profiles indicated that Moso bamboo stands had lower numbers of band and Shannon-Wiener index (H). Both cluster analysis and principal components analysis (PCA) of the DGGE profiles showed the separation of the two soils clearly, and there was little difference between topsoil and subsoil for the same treatment. The real-time PCR analysis revealed that copy number ofnifHgene in Moso bamboo was higher than that in broadleaf forest. Sequencing of 14 DGGE bands isolated revealed that 13 of them were affiliated withBradyrhizobiumand 1 withAzohydromonas, with the similarities ranging from 93% to 98% in known species of Gene Bank.【Conclusions】 This results showed that the conversion of broadleaf forest to bamboo plantation decreased the diversity of nitrogen-fixing bacterial community, but increased its abundance and nitrogen contents, indicating an enhanced nitrogen-fixing ability of soil.
Phyllostachyspubescens; soil nitrogen-fixing bacteria; nitrogen
2015-01-14接受日期: 2015-03-31网络出版日期: 2015-12-11
国家自然科学基金项目(41271274); 浙江省高等学校访问学者教师专业发展项目(FX2013057)资助。
沈秋兰(1989—),女,浙江海宁人,硕士研究生,主要从事土壤生物与生物化学研究。 E-mail: lynnsql@163.com
E-mail: xuqiufang@zafu.edu.cn
S154.38+1; S795
A
1008-505X(2016)03-0687-10
——固氮微生物

