饲粮营养水平对绒山羊小肠感应因子mRNA相对表达量、血液理化指标及激素含量的影响
张 霞 孙海洲 桑 丹 赵存发 李胜利艳 城 凌树礼 珊 丹 任晓萍
(1.内蒙古富源牧业有限责任公司,呼和浩特010070;2.内蒙古农牧业科学院,动物营养与饲料研究所,呼和浩特010031)
饲粮营养水平对绒山羊小肠感应因子mRNA相对表达量、血液理化指标及激素含量的影响
张霞1,2孙海洲2*桑丹2赵存发2李胜利2艳城2凌树礼2珊丹2任晓萍2
(1.内蒙古富源牧业有限责任公司,呼和浩特010070;2.内蒙古农牧业科学院,动物营养与饲料研究所,呼和浩特010031)
本试验旨在适当降低饲粮氮水平条件下,通过饲粮添加N-氨甲酰谷氨酸(NCG)及小肠灌注葡萄糖,研究其对绒山羊小肠感应因子mRNA相对表达量、血液理化指标及激素含量的影响。选用27只体况良好、装有永久性瘤胃和十二指肠瘘管的内蒙古白绒山羊羯羊,按年龄和体重相近原则随机分成9组,每组3只。饲粮分为3个处理:低氮[粗蛋白质(CP)10.5%]、低氮+NCG(0.20 g/d)和高氮(CP 13.5%);每个处理的山羊分别进行3个水平的十二指肠葡萄糖灌注:0、20和40 g/d。饲养试验(15 d预试期、15 d正试期)结束后,屠宰取空肠和十二指肠组织,通过实时定量PCR法测定营养感应因子mRNA相对表达量,测定血液理化指标、血清和空肠相关激素含量。结果表明:1)在基础饲粮条件(无葡萄糖灌注)下,随着饲粮氮水平的下降,空肠和十二指肠钠-葡萄糖共转运载体1(SGLT1)的mRNA相对表达量,血浆尿素氮、葡萄糖含量,血清瓜氨酸、胰岛素含量,血清和空肠胰高血糖素样肽1(GLP-1)、胰高血糖素样肽2(GLP-2)和促胰岛素肽(GIP)含量减少,而空肠和十二指肠溶质载体家族7成员9(SLC7A9)、溶质载体家族7成员1(SLC7A1)的mRNA相对表达量增加。2)增加适宜过瘤胃葡萄糖后,随着饲粮氮水平的下降,SGLT1、味觉受体1型1、味觉受体1型2、味觉受体1型3 mRNA相对表达量呈增加趋势。3)低氮饲粮条件下灌注20 g/d葡萄糖,额外饲喂NCG能够缓解饲粮氮水平降低引起的空肠和十二指肠SGLT1 mRNA相对表达量,血浆尿素氮、葡萄糖含量,血清瓜氨酸含量,血清和空肠GLP-1、GLP-2和GIP含量的下降。结果提示,适当降低饲粮氮水平,补饲NCG和增加过瘤胃葡萄糖(十二指肠灌注20 g/d)对绒山羊机体代谢及肠道营养物质感应均有促进作用。
山羊;肠道营养感应因子;葡萄糖;N-氨甲酰谷氨酸
肠道的耗氧量占整个机体的25%,是动物消化食物、吸收营养的主要场所;是一个可以调节控制胃肠道功能的独立整合系统,故有“第二大脑”之称。同时,肠道也被作为化学传感接口,负责将胃肠道管腔环境生成的信息传递到大脑和身体的其余各个部分[1]。早在1964年,Mcintyre等[2]发现口服葡萄糖比静脉注射更能有效地提高血浆胰岛素(INS)含量,从而证实胃肠道在感应和传导营养信号中起到积极作用。Lam等[3]提出了“胃肠化学感应”,指出其直接研究的意义是提高动物采食量,增强动物体内营养物质的消化与吸收,提高肠道的屏障功能,促进肠道健康,从而综合提高家畜生产力[4]。
饲粮中碳水化合物在小肠主要是以葡萄糖的形式吸收并利用。葡萄糖从小肠运送到血液主要是通过2条途径:主动运输和易化扩散[5]。主动运输的途径是指位于肠上皮细胞刷状缘膜上的钠-葡萄糖共转运载体1(SGLT1)通过位于基底外侧的钠/钾-ATP酶(Na+/K+-ATPase)所维持的电化学梯度,偶联葡萄糖或半乳糖和水,将2分子的钠从细胞腔内转运到血液中[6]。异化扩散途径是位于顶膜和基底外侧膜的一种对葡萄糖具有低亲和力的葡萄糖协助扩散转运载体2(GLUT2)来完成的[7]。
此外,存在于口腔中的味觉感应器于2002年在肠道中发现并首次报道[8]。味觉感应器是G蛋白偶联受体(GPCR)的2个类型,即味觉受体1型(T1R)和味觉受体2型(T2R)[9-10]。甜味感应器是由T1R家族中的2个成员T1R2和T1R3以异源二聚体的形式组成,主要用于检测肠道中单糖(如葡萄糖、半乳糖和果糖)[11]。而T1R1和T1R3以异源二聚体的形式用于感应鲜味(咸味),由于此二聚体形式可识别谷氨酸产生的“鲜味”,故可用于识别肠道中可利用的L-氨基酸[12]。T2R家族是苦味感应家族,至少由30个GPCR成员组成。甜味、鲜味和苦味感受器是通过GPCR的α-味导素(α-gustducin)来联系,并在A、K和L细胞中进行表达[9-10],通过分泌相关激素[胰高血糖素样肽1(GLP-1)、胰高血糖素样肽2(GLP-2)、胆囊收缩素(CCK)等]促进营养物质的吸收。
目前,低氮养殖理念已逐步深入到畜禽养殖中,但由于反刍动物较复杂的生理结构,使其在该领域相关研究进展相对较慢。而在碳水化合物对饲粮的调控技术研究和功能性氨基酸研究的层次从单一化到多方位的提升的过程中,关于饲粮中蛋白质(氨基酸)和葡萄糖互作对机体代谢的影响的基础性研究显得尤为重要。为此,本试验通过测定不同氮及葡萄糖水平且添加N-氨甲酰谷氨酸(NCG)的饲粮对绒山羊血液理化指标及相关激素含量的影响,并通过实时定量PCR就绒山羊小肠中营养物质感应因子mRNA相对表达量进行测定,旨在研究低氮水平下添加NCG并灌注适量的葡萄糖对绒山羊小肠葡萄糖吸收的影响,从而合理配制饲粮,减少资源浪费,降低饲粮成本。
1 材料与方法
1.1试验动物及饲粮
1.1.1试验设计
选用27只体况良好,体重为(50.07±5.97) kg有永久性瘤胃瘘管和十二指肠瘘管的内蒙古白绒山羊半同胞羯羊,按年龄和体重相近的原则随机分为9组,每组3只。饲粮分为3个处理:低氮[粗蛋白质(CP)10.5%]、低氮+NCG(0.20 g/d[13-14])和高氮(CP 13.5%),分别记作LN、LN+NCG、HN;每个处理的山羊分别进行3个水平的十二指肠葡萄糖灌注:0、20和40 g/d,分别记作0 g/d G、20 g/d G和40 g/d G。试验操作流程参考本团队前期的研究论文[15-18]。
试验饲粮配制参照NRC(2007)[19],其组成及其营养水平见表1。NCG购自北京优尼康生物科技有限公司,并由北京菲迪饲料科技有限责任公司进行过瘤胃包被处理(过瘤胃保护率≥92%)。
1.1.2饲养管理
将称重后的试验羊只放入饲养笼中单独饲养,于每日在07:00和16:00先粗后精等量饲喂2次,自由饮水。准确记录每日试验羊只的采食量和剩料量,试验预试期和正试期均为15 d。
1.2试验方法
1.2.1血清、血浆样品采集
连续采集正试期的第8~10天试验羊只血样,每天08:00由颈静脉采血20 mL,其中10 mL缓慢注入涂有肝素(750 IU)的离心试管(始终置于冰盒)中,在30 min内,于4 ℃ 2 000×g条件下离心15 min分离血浆样本,制备样品置于-25 ℃保存,待测血浆葡萄糖、尿素氮含量。另采取的10 mL血液于试管中,在离心力为4 500×g的离心机离心10 min,制备血清样品,吸取血清至离心管中,加盖冷藏(-20 ℃保存),待测血清GLP-1、GLP-2、葡萄糖依赖性胰岛素释放肽(GIP)和CCK、胰岛素和瓜氨酸(citrulline)的含量。结果为3 d平均值。
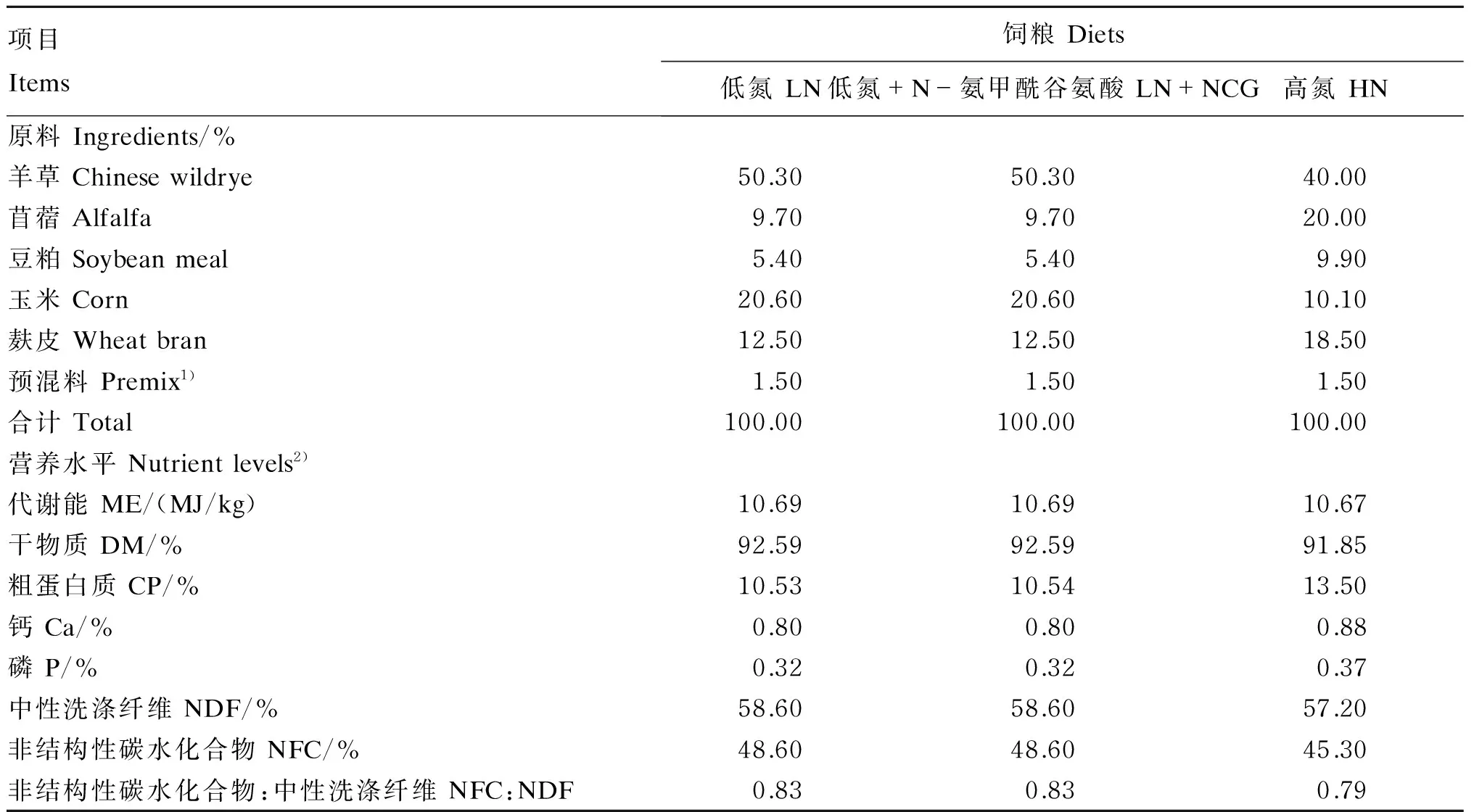
表1 试验饲粮组成及营养水平(风干基础)
1)每千克预混料含有 One kilogram of premix contains the following:Fe(FeSO4·7H2O)170 g,Cu(CuSO4·5H2O)70 g,Mn(MnSO4·5H2O)290 g,Zn(ZnSO4·7H2O)240 g,Co(CoCl2·6H2O)510 mg,KI 200 mg,NaSeO3130 mg,VA 620 000 IU,VD3324 000 IU,VE 540 IU,VK3150 mg,VB120.9 mg,VB5450 mg,泛酸钙 calcium pantothenate 750 mg,叶酸 folic acid 15 mg。
2)营养水平均为计算值,方法参考英国AFRC(1993)及美国Feedstuff饲料成分分析表(2007版)[20-21];非结构性碳水化合物=1-中性洗涤纤维-粗蛋白质-粗脂肪-粗灰分。Nutrient levels were measured in reference to AFRC(1993, British) andFeedstuffsIngredientAnalysisTableinFeedstuff,2007 ed. (USA); NFC=1-NDF-CP-EE-ash.
1.2.2测定肠道组织激素时的样品采集
饲养试验结束后,每个试验组选取具有代表性的1只羊进行屠宰,取近空肠中段约10 cm,用温生理盐水冲洗干净后,迅速将空肠分为长度约2 cm的肠段放入冻存管中,存于-80 ℃冰箱,测定相关激素含量时,取空肠组织样品,制成组织匀浆,测定GLP-1、GLP-2、GIP、CCK含量。
1.2.3实时定量PCR样品采集
按照实时定量PCR样品测定时样品采集的方法,切开腹腔取出全部小肠,剪开肠系膜,将部分十二指肠、空肠前段剖开肠管,之后并用温生理盐水冲洗干净,迅速分装后放于液氮保存,以备测定。之后分别测定不同组别羊只空肠和十二指肠中碱性氨基酸转运载体[溶质载体家族7成员9(SLC7A9)、溶质载体家族7成员1(SLC7A1)]、小肠葡萄糖转运载体(SGLT1、GLUT2)及营养感应因子(T1R1、T1R2、T1R3)的mRNA的相对表达量。
1.3样品分析
1.3.1血浆葡萄糖含量
血浆葡萄糖含量使用全自动生化分析仪(美国贝克曼-库尔特公司)进行测定。
1.3.2血清胰岛素和瓜氨酸,血清和空肠GLP-1、GLP-2、GIP、CCK含量
血清中GLP-1、GLP-2、GIP、CCK、胰岛素测定采用ELISA法测定,试剂盒由北京鑫方程生物技术有限公司提供。空肠组织样品中GLP-1、GLP-2、GIP、CCK测定,需要将空肠组织样品进行组织匀浆[每1 g样品加入9 mL磷酸缓冲盐溶液(pH为7.4),稀释倍数为10倍]后,按照测定血清中该指标方法进行。血清中瓜氨酸的含量亦采用ELISA法测定,试剂盒由江莱化学科技(上海)有限公司提供。
1.4试验仪器及试剂
酶标仪(芬兰,Labsystems Multiskan MS,352);洗板机(芬兰,Thermo Labsystems, AC8);离心机(微量高速离心机,TG16W);培养箱(隔水式恒温培养箱,GNP-9080);高速冷冻离心机(德国,Eppendorf,5417);微量紫外分光光度计(北京五洲东方科技发展有限公司,Biodropsis);低温离心机(德国,Eppendorf,5810);PCR仪(美国,Illumina Eco);凝胶成像系统;实时定量PCR仪(美国,ABI,MP3005);超低温冰箱(美国,Thermo Forma)。
反转录RCR、实时定量PCR试剂盒、Ex-Taq预混Mix均由日本TaKaRa公司生产;未特殊说明
的试剂均为分析纯。
1.5引物设计
根据GenBank中公布的SLC7A9(XM_005692243.1)、SLC7A1(XM_005687542.1)、SGLT1(NM_001009404.1)、GLUT2(XM_004003162.1)以及内参基因甘油醛-3-磷酸脱氢酶(GAPDH)的mRNA序列均由宝生物工程(大连)有限公司设计并合成,营养感应因子T1R1(XM_005690745.1)、T1R2(Gene ID:102171940)、T1R3(XM_005690861.1)利用Primer 5.0设计特异性引物,由生工生物工程(上海)股份有限公司合成。引物信息见表2。

表2 引物信息
1.6样品总RNA提取和cDNA合成
采用Trizol法提取空肠和回肠的总RNA,经紫外分光光度计测得A260/A280值在1.8~2.0,琼脂糖凝胶电泳法评价总RNA的质量。参照PrimeScript RT Master Mix反转录试剂盒说明书的操作步骤将样品总RNA都以相同浓度进行反转录,反应体系总体积为25 μL:5×PrimeScript Buffer 5 μL,PrimeScriptTMRT Enzyme Mix 1.25 μL,Oligo dT Primer 1.25 μL,Random Primer 1.25 μL,总RNA 2.5 μL, RNase-free water 13.75 μL。反应条件设置为37 ℃ 15 min,85 ℃ 5 s。
1.7实时定量PCR
参照TaKaRa试剂盒说明书,采用反应采用两步法,其条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环。获取各个基因每个样品的阈值循环(Ct),每个基因样品做3个重复。以GAPDH基因作为内参,实时定量PCR获取各基因达到荧光阈值所对应的Ct,采用2-△△Ct法计算出目的基因mRNA相对表达量。
1.8数据处理与分析
数据处理采用SAS 9.0软件的ANOVA进行单因素方差分析,用Duncan氏法进行多重比较。试验结果均以平均值±标准差表示,以P<0.05作为差异显著判断标准,以P<0.01作为差异极显著判断标准。
2 结果与分析
2.1空肠和十二指肠基因相对表达量
由表3可知,基础饲粮条件(0 g/d G)下,葡萄糖转运载体mRNA相对表达量呈现的规律如下:1组和4组山羊空肠中SGLT1的mRNA相对表达量显著低于7组(P<0.05),而这2组间差异不显著(P>0.05);而就GLUT2的mRNA相对表达量而言,空肠中4组显著高于7组和1组(P<0.05),而后2组间差异不显著(P>0.05)。而相比之下,碱性氨基酸转运载体mRNA相对表达量的规律性更为明显,1组和4组的SLC7A1和SLC7A9 mRNA相对表达量均显著高于7组(P<0.05)。1组和4组空肠中营养感应因子T1R1和T1R3 mRNA相对表达量显著高于7组(P<0.05),各组间空肠中T1R2 mRNA相对表达量无显著差异(P>0.05)。
基础饲粮条件下,山羊过瘤胃葡萄糖增加20 g/d(20 g/d G)时,2组和5组空肠中葡萄糖转运载体SGLT1和GLUT2的mRNA相对表达量均显著高于8组(P<0.05)。就碱性氨基酸转运载体而言,2组和5组空肠中的SLC7A9 mRNA相对表达量显著高于8组(P<0.05);5组空肠中SLC7A1 mRNA相对表达量显著高于2组和8组(P<0.05),且后2组间差异不显著(P>0.05)。空肠中各营养感应因子mRNA相对表达量没有呈现一致的规律性。
基础饲粮条件下,山羊过瘤胃葡萄糖增加40 g/d(40 g/d G)时,3组和6组空肠中葡萄糖转运载体SGLT1的mRNA相对表达量显著高于9组(P<0.05);而3组和6组中的GLUT2的mRNA相对表达量却显著低于9组(P<0.05)。而3组、6组氨基酸转运载体mRNA相对表达量都显著高于9组(P<0.05)。对于空肠中营养感应因子mRNA相对表达量,3组和6组中T1R1和T1R3 mRNA相对表达量显著高于9组(P<0.05);而各组间空肠中T1R2 mRNA相对表达量与T1R1和T1R3变化规律不一致。
由表4可知,基础饲粮条件下,1组和4组中山羊十二指肠中葡萄糖转运载体SGLT1 mRNA相对表达量总体呈现显著低于7组(P<0.05),而这2组间差异不显著(P>0.05);而就GLUT2 mRNA相对表达量而言,十二指肠中1组显著高于4组和7组(P<0.05)。十二指肠中碱性氨基酸转运载体及营养感应因子mRNA相对表达量呈现一致的规律性,即:1组和4组高于7组。
基础饲粮条件下,山羊过瘤胃葡萄糖增加20 g/d时,十二指肠中2组和5组葡萄糖转运载体SGLT1的mRNA相对表达量显著高于8组(P<0.05);GLUT2结果却相反,8组高于2组和5组。碱性氨基酸转运载体及营养感应因子mRNA在十二指肠中相对表达量的结果呈现一致性,即:5组显著高于2组和8组(P<0.05)。
基础饲粮条件下,山羊过瘤胃葡萄糖增加40 g/d时,3组十二指肠中葡萄糖转运载体GLUT2 mRNA相对表达量显著低于9组(P<0.05)。氨基酸转运载体3组、6组、9组间无显著差异(P>0.05)。营养感应因子T1R1、T1R2、T1R3 mRNA相对表达量6组显著高于3组、9组(P<0.05)。
2.2血液理化指标
由表5可知,基础饲粮条件下,4组的血浆尿素氮含量显著低于1组和7组(P<0.05),后2组间差异不显著(P>0.05);1组和4组血清瓜氨酸含量都有低于7组的趋势,组间差异不显著(P>0.05);而4组和7组血浆葡萄糖含量呈现高于1组的趋势,组间差异不显著(P>0.05);且4组和7组血清胰岛素含量显高于1组(P<0.05)。
而1组和4组间相比而言,4组中血浆葡萄糖、血清胰岛素含量较1组高,说明低氮水平饲喂条件下添加NCG后能促进糖异生作用加强,这可能是由于NCG的添加促进了精氨酸族氨基酸的合成,从而使血浆葡萄糖和胰岛素都有所上调。
基础饲粮条件下,山羊过瘤胃葡萄糖增加20或40 g/d时,2组、3组、5组和6组血浆葡萄糖和血清胰岛素含量都高于1组和4组,可能是由于外源葡萄糖灌注提高了血浆葡萄糖含量,进而导致血清胰岛素含量也随之升高。

表3 饲粮营养水平对山羊空肠各基因mRNA相对表达量的影响
相同葡萄糖水平、同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。表4同。
In the same column, a comparison was made between different level of G perfusion. Values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as Table 4.
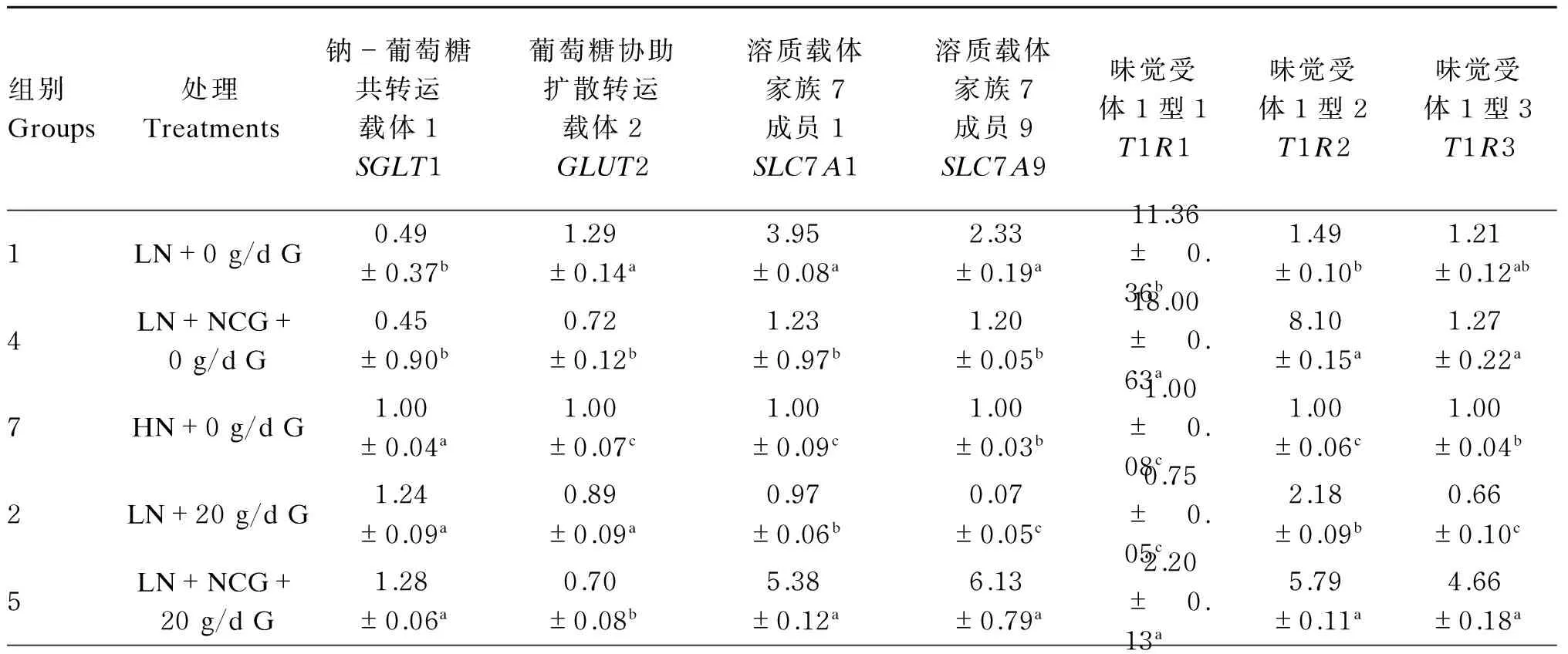
表4 饲粮营养水平对山羊十二指肠各基因mRNA相对表达量的影响

续表4组别Groups处理Treatments钠-葡萄糖共转运载体1SGLT1葡萄糖协助扩散转运载体2GLUT2溶质载体家族7成员1SLC7A1溶质载体家族7成员9SLC7A9味觉受体1型1T1R1味觉受体1型2T1R2味觉受体1型3T1R38HN+20g/dG1.00±0.05b1.00±0.03a1.00±0.06b1.00±0.09b1.00±0.09b1.00±0.07c1.00±0.04b3LN+40g/dG0.67±0.140.82±0.11b0.99±0.140.94±0.051.03±0.14b0.87±0.10c0.61±0.06c6LN+NCG+40g/dG0.88±0.080.95±0.04ab1.22±0.110.84±0.153.42±0.27a1.29±0.04a1.19±0.07a9HN+40g/dG1.00±0.051.00±0.06a1.00±0.091.00±0.011.00±0.12b1.00±0.08b1.00±0.04b

表5 饲粮营养水平对山羊血液理化指标的影响
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下表同。
In the same column, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01). The same as below.
2.3空肠和血清激素含量
由表6可知,基础饲粮条件下,与7组相比,1组和4组空肠GLP-1和GLP-2的含量显著降低,即随饲粮氮水平升高空肠GLP-1和GLP-2含量降低(P<0.05)。就空肠GIP和CCK的含量而言,并未随着饲粮氮水平的变化而呈现一定的规律性。
山羊过瘤胃葡萄糖增加20和40 g/d时,2组和3组的空肠GLP-1和GLP-2的含量都显著高于1组(P<0.05),而5组和6组GLP-1和GLP-2的含量也显著高于4组(P<0.05)。然而3组和6组结果却分别低于2组和5组。同样CCK和GIP的含量仍未随着葡萄糖灌注含量的变化而呈现一定的规律性。
3 讨 论
3.1饲粮营养水平对绒山羊营养物质转运载体与肠道感应因子mRNA相对表达量的影响
T1R2/T1R3这一异源二聚体用于感受肠道糖类和人工甜味剂的功能受体,可以检测肠道中可利用的葡萄糖,同样对于胃肠道中的GLP-1、酪酪肽(PYY)的分泌也有促进作用。研究结果表明,在高葡萄糖情况下,作为的甜味受体T1R2/T1R3可促进肠上皮顶膜GLUT2的表达,从而提高葡萄糖的吸收能力,且位于小肠肠腔中的葡萄糖可以激活肠内分泌细胞(EEC)的T1R2和T1R3,同时引起GLP-1的释放[22]。EEC激素通过上调SGLT1表达和促进肠上皮细胞顶端GLUT2表达从而影响葡萄糖吸收。因此,高碳水化合物饲粮和甜味剂能上调依赖于味蕾组织中的一种G蛋白(Gg)和T1R1的SGLT1的表达[23]。
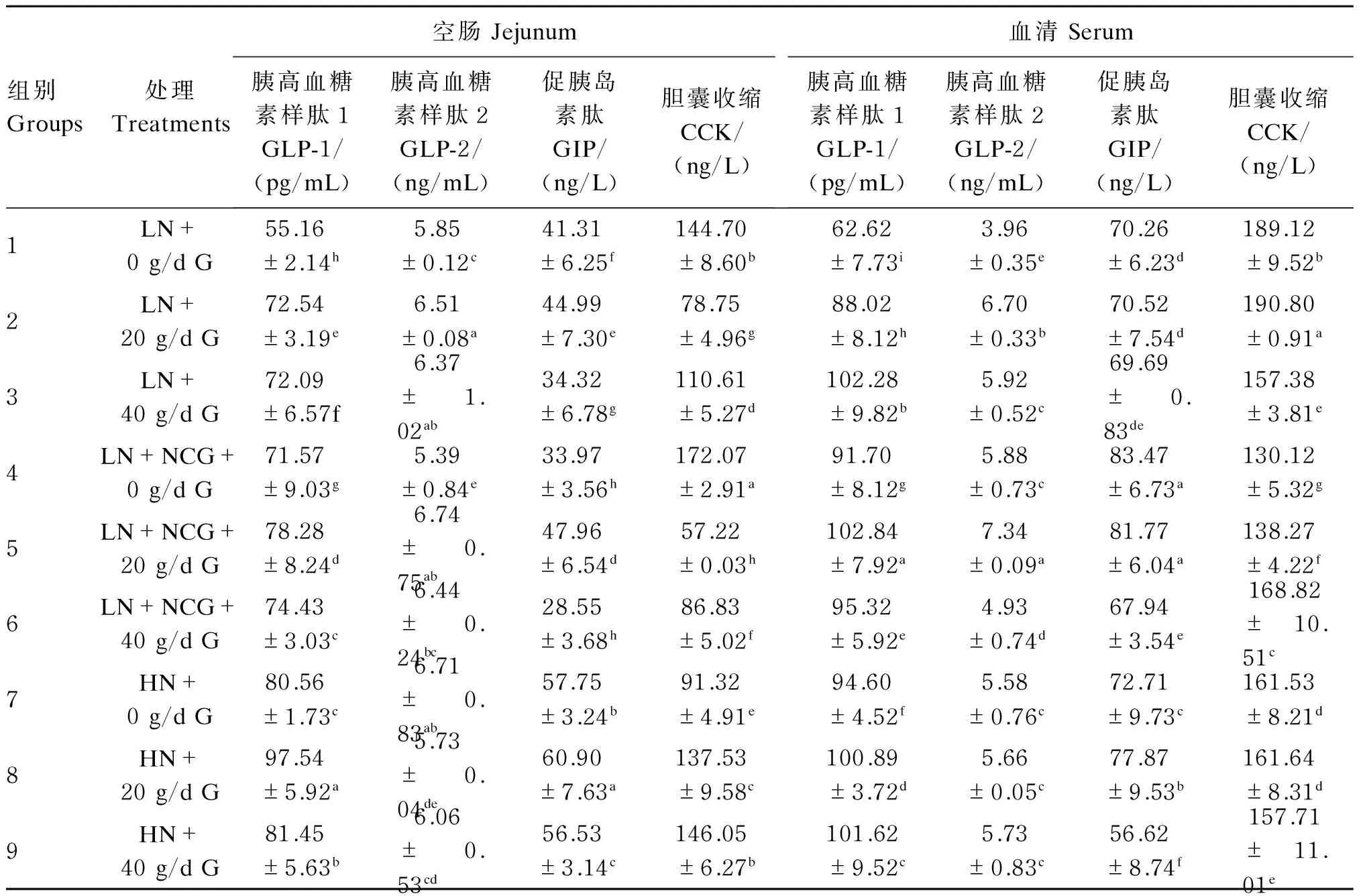
表6 饲粮营养水平对山羊空肠和血清激素含量的影响
本试验中,基础饲粮条件下,山羊十二指肠中灌注20和40 g/d葡萄糖时,山羊空肠和十二指肠中营养感应因子T1R2和T1R3 mRNA相对表达量整体呈增加的趋势。同时,葡萄糖转运载体SGLT1 mRNA相对表达量也相应有所提高,此结论与上述研究结果相似。但是,GLUT2的变化却并没有呈现一定的规律性,与上述结果不同,该不一致性可能由于动物类别的不同所致。如相关研究称,在高葡萄糖饲粮条件下,大鼠肠道内顶膜上GLUT2表达量会增加,但迄今为止,同样的高糖饲粮条件下却没有引起山羊顶膜上GLUT2表达量的增加[24]。
在动物的饲粮中,摄入的蛋白质经胃蛋白酶和胰蛋白酶水解后,并非所有的蛋白质都要水解为游离的氨基酸才能被机体所利用,许多蛋白质的代谢物都能直接通过胃肠道黏膜进入体循环。然而,此过程的实现需要蛋白质及其分解产物的感应受体和转运载体的介导。碱性氨基酸转运载体是饲粮中的碱性氨基酸从肠腔进入肠细胞及循环系统的主要通路,通过调节肠道氨基酸转运载体的表达量从而为机体提供充足的氨基酸,此途径是避免肠道吸收障碍的有效方法之一。近年来,相关报道指出饲粮氮水平或蛋白质的水解产物如氨基酸类通过复杂代谢通路调节氨基酸载体转运[25-26],这主要是说明蛋白质及其代谢产物激活了蛋白质和肽类感应器,从而使得EEC释放相关激素(CCK、GLP-1),最终刺激氨基酸转运载体活性从而促进小肠对氨基酸的吸收代谢。
T1R1/T1R3是一种异二聚体膜受体,是哺乳动物体内蛋白质及其代谢物的感应受体,又因T1R1/T1R3能识别谷氨酸产生的“鲜味”,故又被称为“鲜味感应器”[12]。目前研究表明,该受体能够感应20种L-氨基酸,但是不同物种体内的感受器对于氨基酸的种类是有特异性反应的。如鼠T1R1/T1R3对20种L-氨基酸都有反应,但人T1R1/T1R3只选择性地对谷氨酸钠(MSG)和天冬氨酸(Asp)有反应。
NCG是N-乙酰谷氨酸(NAG)的类似物,可参与到动物体内尿素循环。研究表明,NCG可以促进谷氨酰胺或脯氨酸合成瓜氨酸,进而促进精氨酸的合成[27],NCG因此也被称为精氨酸的内源激活剂。本试验在低氮饲粮中添加NCG来研究功能性氨基酸对肠道碱性氨基酸转运载体和营养感应因子表达的影响得到了较为满意结果。本试验中,基础饲粮水平下,在LN+NCG处理的山羊的十二指肠和空肠中营养感应因子T1R1和T1R3的mRNA相对表达量整体呈现高于LN处理的趋势。需要指出的是本试验只是就单一感应因子的mRNA相对表达量进行检测,而动物体内的鲜味感受器是以异源二聚体的形式才能发挥作用,此外,T1R3不仅是鲜味感受器的成分之一,同样也是肠道中甜味受体(T1R2/T1R3)中成员之一,所以本试验结果只能初步判断NCG的添加对感应因子的表达量有一定的影响,倘若需要更加准确判定,则需结合其他手段(如免疫组化法)和其他指标(如小肠上皮内分泌细胞释放的相关激素)协助完成,本试验并未进行详细论断。本试验结果同样也显示,LN和LN+NCG处理十二指肠和空肠中的碱性氨基酸转运载体SLC7A1和SLC7A9 mRNA相对表达量整体呈现高于HN处理的趋势,这主要是由于降低山羊饲粮氮水平可以促进山羊体内内源氮的合成[28],而且与减少饲粮氮水平能促进山羊氮代谢的结果相吻合。而这2个处理中LN+NCG处理在十二指肠和空肠中SLC7A1和SLC7A9 mRNA相对表达量都高于LN处理,这主要是因为感应因子T1R1和T1R3 mRNA相对表达量增加所致,作为“鲜味感应器”的T1R2/T1R3可以通过氨基酸的刺激而激活,从而促使EEC释放CCK和GLP-1等相关激素,而将信号传导到氨基酸转运载体,从而使得氨基酸转运载体表达量也随之增加。
3.2饲粮营养水平对绒山羊血液理化指标及空肠和血清激素含量的影响
本试验通过测定血浆葡萄糖和血清胰岛素的含量来粗略地推断饲喂不同氮水平、十二指肠葡萄糖不同灌注水平及NCG添加对山羊葡萄糖代谢的影响。反刍动物体内的血浆葡萄糖主要受肝脏糖异生的作用来调节,动物采食的饲粮对血浆葡萄糖含量的调节是属于次要的。本试验结果显示,十二指肠中灌注葡萄糖时,LN、LN+NCG处理山羊血浆葡萄糖和血清胰岛素含量都呈低于HN处理的趋势,这可能主要是由于肝脏糖异生作用的减弱[29]。在低氮饲粮饲喂体系中,糖异生作用的减弱主要是基于非必需氨基酸的减少,如瓜氨酸[30]。本试验中,基础饲粮条件下,LN和LN+NCG处理中的血清瓜氨酸含量呈现低于HN处理的趋势。此结果进一步说明上述推断是可能的。众所周知,瓜氨酸不仅与尿素合成途径有关,而且也参与机体的糖异生途径。大幅降低大鼠饲粮氮水平,其肝脏中瓜氨酸的合成量明显下降;同时,大鼠血液葡萄糖和胰岛素含量也呈相应的下降趋势[31-32]。此结论与人类食用严重缺乏蛋白质饮食时Lariviere等[33]的研究结果相一致。本试验中,分别在山羊十二指肠中灌注0、20和40 g/d的3个不同水平的葡萄糖,十二指肠灌注20和40 g/d葡萄糖时,2组和5组血浆葡萄糖和血清胰岛素含量整体呈现高于8组的趋势。推断得出,随着饲粮氮水平的降低,血浆中氨基酸的含量也随之减少,因而对绒山羊糖异生作用产生负面影响,而使得血浆葡萄糖含量下降,那么依赖葡萄糖的相关激素分泌也相应减少。而在低氮饲粮中添加NCG后可有效提高血浆氨基酸和相关激素的含量,进一步证实NCG可以促进机体非必需氨基酸的合成。
研究证实,甜味剂(葡萄糖、蔗糖和三氯蔗糖)以剂量依赖方式对肠道内分泌细胞株NCI-716 GLP释放有促进作用。同时肠道中GLP-1的释放依赖于SGLT1的参与[34]。在敲除T1R3基因大鼠的饲粮中添加甜味剂后,并没有引起GLP-1和GIP的分泌[23,35]。本试验结果显示,灌注20和40 g/d葡萄糖后HN、LN和LN+NCG处理中的血清GLP-1含量都较基础饲粮水平下升高,且LN+NCG+20 g/d G处理为最高。本试验结果与上述研究结果相一致,一方面可能是由于小肠葡萄糖中含量升高时,使得血浆葡萄糖含量上升,因而葡萄糖依赖性激素(GLP-1和GLP-2)也随之增加,而另一方面可能是由于该处理中山羊小肠中的SGLT1和T1R3 mRNA相对表达量最高所致。综合得出,低氮饲粮条件下,十二指肠中灌注葡萄糖可以缓解血浆葡萄糖含量的下降。然而,过量灌注葡萄糖后对机体依赖葡萄糖的相关激素的含量并未显著上升,这可能是由于机体并不能完全吸收过量的过瘤胃葡萄糖,但是适宜灌注葡萄糖可以改善低氮对机体代谢的影响。且增加适宜的过瘤胃葡萄糖后,添加NCG的对血浆葡萄糖、GLP-1、GLP-2的影响更为明显。
蛋白质的代谢产物是CCK释放强烈的刺激因子,蛋白质对CCK刺激作用远比碳水化合物更为明显[36]。蛋白质代谢产物(如肽类和氨基酸)刺激胃肠道“鲜味感应器”后,引起味觉细胞内钙离子浓度的升高,导致CCK、PYY和GLP的释放,而这些胃肠激素可以激活迷走神经和相应的靶细胞[37]。然而,本文中的结果却并未与此结论相吻合,CCK含量并未因饲粮氮水平、葡萄糖灌注水平的变化或NCG的添加而呈现一定的规律。该结果可能是由于CCK主要是在十二指肠分泌的,而本试验中所测定的是空肠组织中的含量,而关于该方面的研究目前尚未定论。
4 结 论
适当降低饲粮氮水平,补饲NCG和增加过瘤胃葡萄糖(十二指肠灌注20 g/d)对绒山羊机体代谢及肠道营养物质感应均有促进作用。
[1]RAYBOULD H E.Gut chemosensing:interactions between gut endocrine cells and visceral afferents[J].Autonomic Neuroscience,2010,153(1/2):41-46.
[2]MCINTYRE N,HOLDSWORTH C D,LEEDS M B,et al.New interpretation of oral glucose tolerance[J].The Lancet,1964,284(7349):20-21.
[3]LAM C K L,CHARI M,LAM T K T.CNS regulation of glucose homeostasis[J].Physiology,2009,24(3):159-170.
[4]LIU Y,IPHARRAGUERRE I R,PETTIGREW J E.Digestive physiology of the pig symposium:potential applications of knowledge of gut chemosensing in pig production[J].Journal of Animal Science,2013,91(5):1982-1990.
[5]HUNTINGTON G B.Starch utilization by ruminants:from basics to the bunk[J].Journal of Animal Science,1997,75(3):852-867.
[6]HARMON D L,MCLEOD K R.Glucose uptake and regulation by intestinal tissues:implications and whole-body energetics[J].Journal of Animal Science,2001,79 (E-Suppl):E59-E72.
[7]KELLETT G L,BROT-LAROCHE E,MACE O J,et al.Sugar absorption in the intestine:the role of GLUT2[J].Annual Review of Nutrition,2008,28(1):35-54.
[8]WU S V,ROZENGURT N,YANG M, et al.Expression of bitter taste receptors of the T2R family in the gastrointestinal tract and enteroendocrine STC-1 cells[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(4):2392-2397.
[9]ROZENGURT E,STERNINI C.Taste receptor signaling in the mammalian gut[J].Current Opinion in Pharmacology,2007,7(6):557-562.
[10]YOUNG R L.Sensing via intestinal sweet taste pathways[J].Frontiers in Neuroscience,2011,5:23.
[11]BURANT C F,TAKEDA J,BROT-LAROCHE E,et al.Fructose transporter in human spermatozoa and small intestine is GLUT5[J].The Journal of Biological Chemistry,1992,267(21):14523-14526.
[12]ZHAO G Q,ZHANG Y F,HOON M A,et al.The receptors for mammalian sweet and umami taste[J].Cell,2003,115(3):255-266.
[13]赵宏丽.精氨酸对细毛羊肠道蛋白质合成、氨基酸转运蛋白mRNA表达及肠道健康的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2012.
[14]李金霞.精氨酸及大豆油对细毛羊骨骼肌蛋白质合成和肌内脂肪含量变化的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2011.
[15]孙海洲.生长肥育羊葡萄糖营养整体优化规律的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,1999.
[16]韩飞.反刍动物常用饲料丙酸产量和吸收率的测定及其模型的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2001.
[17]任莹.反刍动物常用饲料过瘤胃淀粉量及其小肠消化率测定及相关技术的研究[D].硕士学位论文.南宁:广西大学,2001.
[18]王玲.内蒙古白绒山羊适宜代谢葡萄糖水平的评定[D].硕士学位论文.呼和浩特:内蒙古农业大学,2003.
[19]NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academy of Sciences,2001.
[20]ALDERMAN J.Energy and protein requirements of ruminants:an advisory manual prepared by the AFRC technical committee on responses to nutrients[M].Wallingford:CABI Publishing,1993.
[21]李玫.美国Feedstuffs饲料成分分析表(2007版)[J].饲料广角,2007(12):37-40.
[22]KOKRASHVILI Z,RODRIGUEZ D,YEVSHAYEVA V,et al.Release of endogenous opioids from duodenal enteroendocrine cells requires Trpm5[J].Gastroenterology,2009,137(2):598-606.
[23]MARGOLSKEE R F,DYER J,KOKRASHVILI Z,et al.T1R3 and gustducin in gut sense sugars to regulate expression of Na+-glucose cotransporter 1[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(38):15075-15080.
[24]KELLETT G L.The facilitated component of intestinal glucose absorption[J].The Journal of Physiology,2001,531(3):585-595.
[25]KARASOV W H,SOLBERG D H,CHANG S D, et al.Is intestinal transport of sugars and amino acids subject to critical-period programming?[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,1985,249(6):G770-G785.
[26]KARASOV W H,SOLBERG D H,DIAMOND J M.Dependence of intestinal amino acid uptake on dietary protein or amino acid levels[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,1987,252(5):G614-G625.
[27]WU G Y,KNABE D A,KIM S W.Arginine nutrition in neonatal pigs[J].The Journal of Nutrition,2004,134(10S):2783S-2390S.
[28]COLMENERO J J O,BRODERICK G A.Effect of dietary crude protein concentration on milk production and nitrogen utilization in lactating dairy cows[J].Journal of Dairy Science,2006,89(5):1704-1712.
[29]MUSCHER-BANSE A S,PIECHOTTA M,SCHRÖDER B,et al.Modulation of intestinal glucose transport in response to reduced nitrogen supply in young goats[J].Journal of Animal Science,2013,90(13):4995-5004.
[30]MARKANTONATOS X,GREEN M H,VARGA G A.Use of comsect1mental analysis to study ruminal volatile fatty acid metabolism under steady state conditions in Holstein heifers[J].Animal Feed Science and Technology,2008,143(1/2/3/4):70-88.
[31]KORITZ S B,COHEN P P.The effect of diet on citrulline synthesisinvitro[J].The Journal of Biological Chemistry,1953,200(2):551-557.
[32]MCGIVAN J D,BRADFORD N M,MENDES-MOURO J.The regulation of carbamoyl phosphate synthase activity in rat liver mitochondria[J].Biochemical Journal,1976,154(2):415-421.
[34]MACE O J,AFFLECK J,PATEL N,et al.Sweet taste receptors in rat small intestine stimulate glucose absorption through apical GLUT2[J].The Journal of Physiology,2007,582(1):379-392.
[35]JANG H J,KOKRASHVILI Z,THEODORAKIS M J,et al.Gut-expressed gustducin and taste receptors regulate secretion of glucagon-like peptide-1[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(38):15069-15074.
[36]谭碧娥,印遇龙.胃肠营养化学感应及其生理效应[J].动物营养学报,2013,25(2):231-241.
[37]SUTHERLAND K,YOUNG R L,COOPER N J,et al.Phenotypic characterization of taste cells of the mouse small intestine[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,292(5):G1420-G1428.
(责任编辑王智航)
, professor, E-mail: sunhaizhou@china.com
Effects of Dietary Nutrient Level on mRNA Relative Expression Levels of Nutrient Sensing Factors, Blood Physiochemical Indexes and Hormone Contents of Cashmere Goats
ZHANG Xia1,2SUN Haizhou2*SANG Dan2ZHAO Cunfa2LI Shengli2YAN Cheng2LING Shuli2SHAN Dan2REN Xiaoping2
(1. Inner Mongolia Fuyuan Farming Co., Ltd., Hohhot 010070, China; 2. Institute of Animal Nutrition and Feed,Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031, China)
To study the effects of N-carbamylglutamic acid (NCG) supplementation and intestinal infusion of glucose on mRNA relative expression levels of nutrient sensing factors, blood physiochemical indexes and hormone contents of cashmere goats under the condition of decreasing dietary nitrogen level. Twenty seven healthy Inner Mongolia cashmere wethers with permanent rumen fistula and duodenal cannulas were used. In accordance with the principle of similar age and body weight, twenty seven goats were divided into nine groups with three goats per group. There were 3 dietary treatments, which were low nitrogen [crude protein (CP) 10.5%], low nitrogen +NCG (0.20 g/d) and high nitrogen (CP 13.5%); meanwhile, goats in each treatment were infused glucose at 3 levels, which were 0, 20 and 40g/d. After feeding experiment (15 d of pre-experiment and 15 d of formal experiment), goats were slaughtered to collect jejunum and duodenum tissues, the mRNA relative expression levels of intestinal nutrient sensing factor were determined by real-time PCR method, and blood physiochemical indexes, and serum and jejunal hormone contents were determined. The results showed as follows: 1) under the condition of basal diet (without glucose infusion), with the decrease of dietary nitrogen level, the mRNA relative expression level of sodium-glucose cotransporter 1 (SGLT1) in jejunum and duodenum, plasma urea nitrogen (UN) and glucose contents, serum citrulline and insulin contents, and serum and jejunal contents of glucagon-likepeptide 1 (GLP-1), glucagon-likepeptide 2 (GLP-2) and glucose insulinotropic peptide (GIP) were declined, but the mRNA relative expression levels of solute carrier family 7 member 9 (SLC7A9) and solute carrier family 7 member 1 (SLC7A1) were increased. 2) After increase proper amount glucose, with the decease of dietary nitrogen level, the mRNA relative expression levels ofSGLT1, taste 1 receptor member 1 (T1R1), taste 1 receptor member 2 (T1R2) and taste 1 receptor member 3 (T1R3) tended to be increased. 3) Under the condition of low dietary nitrogen level and 20 g/d glucose infusion, extra supplementation of NCG could help relieve the decrease of the mRNA relative expression level ofSGLT1 in jejunum and duodenum, plasma UN and glucose contents, serum citrulline content, and serum and jejunal contents of GLP-1, GLP-2 and GIP induced by the decreasing dietary nitrogen level. The results indicate that under the condition of decreasing dietary nitrogen level at proper extent, NCG supplementation and increasing rumen-passed glucose (duodenal infusion 20 g/d glucose) can improve metabolism and intestinal nutrient sensing of cashmere goats.[ChineseJournalofAnimalNutrition, 2016, 28(8):2607-2618]
goat; intestinal nutrient sensing factor; glucose; N-carbamylglutamic acid
10.3969/j.issn.1006-267x.2016.08.034
2016-02-02
国家公益性行业(农业)科研专项(201303059);国家公益性行业(农业)科研专项(201303062);国家绒毛用羊产业技术体系建设(CARS-40-12);内蒙古农牧业科技创新基金项目(2013CXJJM05)
张霞(1988—),女,内蒙古呼和浩特人,硕士研究生,动物营养与饲料科学专业。E-mail: zhangxia19880818@163.com
孙海洲,研究员,硕士生导师,E-mail: sunhaizhou@china.com
S826
A
1006-267X(2016)08-2607-12

