不同绿色防控措施对辣椒疫病的控制效果
陈夕军孙佳佳陈银凤董京萍陈孝仁魏利辉黄奔立*
(1扬州大学园艺与植物保护学院,江苏扬州 225009;2扬州市邗江区植保植检站,江苏扬州 225100;3江苏省农业科学院植物保护研究所,江苏南京 210014)
不同绿色防控措施对辣椒疫病的控制效果
陈夕军1孙佳佳1陈银凤2董京萍1陈孝仁1魏利辉3黄奔立1*
(1扬州大学园艺与植物保护学院,江苏扬州 225009;2扬州市邗江区植保植检站,江苏扬州 225100;3江苏省农业科学院植物保护研究所,江苏南京 210014)
以辣椒品种卞椒1号为试材,采用太阳能消毒、添加不同比例蚯蚓粪和使用生防菌剂灌根3种方法,研究不同防控措施对辣椒疫病的控制效果。结果表明,太阳能消毒可以杀灭土壤中的疫病病菌,且处理时间越长效果越佳,但对土壤菌群中各类微生物的影响不同;添加不同比例的蚯蚓粪均对辣椒幼苗具有明显的促生作用,添加30%蚯蚓粪的育苗基质对辣椒疫病的控制效果最佳。从蚯蚓粪中分离获得两株生防菌A116和B107,均对辣椒疫病病菌有很好的拮抗作用。将太阳能消毒与生防菌剂灌根两种方法配合使用,对辣椒疫病的最高防效可达91.67%。
绿色防控措施;辣椒疫病;控制效果
辣椒 疫病是 由 辣椒疫 霉(Phytophthora capsici)引起的重要土传病害,在世界各辣椒产地均有发生,常造成辣椒的大幅减产、甚至绝收(Aragaki & Uchida,2001;马云艳 等,2015)。随着我国设施辣椒栽培面积的不断扩大,由辣椒疫病导致的连作障碍已成为制约辣椒产业发展的重要因素之一。由于辣椒采收期长,病害常在棚中快速蔓延,造成毁棚;而长期过量的使用化学农药,又容易引起农药残留(Residue)、病菌抗药性(Resistance)和再猖獗(Resurgence)等“3R”问题。因此,发展绿色防控措施,保证市民菜篮子的丰富与安全,显得尤为重要。
辣椒疫霉病菌常以卵孢子在土壤中存活,且可以侵染多种植物(Lamour et al.,2012;Gilardi et al.,2015)。而土传病害的化学防治往往用药量大且防治效果不佳。因而,经济有效、对环境友好、对人和非靶标生物安全的绿色防控措施受到了广泛关注。有机肥(李胜华 等,2009)、堆肥水浸液(Kyung et al.,2010)、 生 防 菌(Sang & Kim,2012;刘永亮 等,2013)及肥菌结合(常志州 等,2005)等都被应用于辣椒疫病的防治中,但防治效果却不尽如人意,一般情况下田间发病率的降低幅度均小于50%。本试验通过多种防治措施选择与复合使用,拟寻得高效环保的辣椒疫病绿色防控方法,为指导生产实践提供理论依据。
1 材料与方法
1.1 试验材料
试验于2009~2015年进行。辣椒疫霉病菌由扬州大学植物病理学实验室分离自江苏辣椒疫病病株。供试辣椒品种为卞椒1号,由扬州大学园艺与植物保护学院蔬菜教研室提供。供试蚯蚓粪由扬州大学环境科学与工程学院蚯蚓粪实验基地提供,为蚯蚓在牛粪中养殖所产生的代谢物。
1.2 太阳能处理对土壤菌群的影响
试验在扬州大学园艺与植物保护学院园艺学科蔬菜基地露地进行,土壤为沙壤土。将试验田深翻后整平,灌水以保持土壤湿润。灌水后24 h用两层0.1 mm厚的聚乙烯薄膜覆盖于土壤表面,边缘用土盖严,进行太阳能消毒处理,以同一地块未覆膜区作对照。分别于处理0、10、20、30 d后,在处理田块和对照田块10 cm土层随机取自然土样。将1 g土样溶于10 mL无菌水中,双层纱布过滤后,分别取100 μL溶液均匀展布于NA培养基(蛋白胨10 g,牛肉粉3 g,氯化钠5 g,琼脂17 g,水1 000 mL,pH=7.3)、马丁氏培养基(磷酸二氢钾1.0 g,硫酸镁0.5 g,蛋白胨5.0 g,葡萄糖10.0 g,琼脂17.0 g,水1 000 mL。每1 000 mL培养基中加入1.0%孟加拉红水溶液3.3 mL,使用前每1 000 mL培养基中加入1.0%链霉素0.3 mL)和高氏1号培养基(可溶性淀粉20 g,硝酸钾1 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,氯化钠0.5 g,硫酸亚铁0.01 g,琼脂17 g,水1 000 mL)表面,并分别于24、48、72 h后,计数培养基表面细菌、真菌和放线菌菌落数。每处理3次重复。试验过程中实时记录天气情况。
1.3 辣椒疫霉病菌的耐热性
1.3.1 菌丝体耐热性测定 用直径5 mm的打孔器在未产孢子囊的辣椒疫霉病菌菌落边缘打孔,菌碟置于含有5 mL蒸馏水的无菌小试管中,然后将试管置于不同温度水浴锅中处理一定时间,共设40、45、50、55、60、65 ℃ 6个温度梯度及5、10、15、20、25 min 5个时间段。处理后将菌碟取出,置于PDA平板上28 ℃培养,3 d后观察其生长情况。每处理5个平板,2次重复。
1.3.2 孢子囊(游动孢子)耐热性测定 辣椒疫病病菌于CA平板(胡萝卜200 g,琼脂20 g,水1 000 mL)上28 ℃黑暗培养7 d后,加入10 mL无菌水,完全覆盖菌丝体,将CA平板置于28 ℃光照恒温培养箱,连续光照培养120 h以上,以诱导孢子囊的产生(郑小波,1997)。用无菌水将孢子囊(游动孢子)洗出,置于无菌小试管中,设6个温度梯度、5个时间段,同1.3.1。处理后将孢子(囊)悬浮液混入PDA制成平板,3 d后观察其生长情况。每处理5个平板,2次重复。
1.4 太阳能处理对辣椒疫霉病菌的灭杀效果
将配好的辣椒疫霉病菌孢子(囊)液均匀拌入灭菌土制成病土,取30 g病土置于灭菌的培养皿中,用两层纱布封口后,分别置于5、10、15、20 cm不同深度土层。将土面平整后,覆膜条件下进行太阳能处理。于处理5、10、15、20、25 d后,分别取1 g样土溶于10 mL灭菌水中,充分搅匀后用双层纱布过滤。吸取100 μL滤液,用展棒均匀展布于OMA选择性培养基表面。72 h后计数菌落数,计算太阳能对辣椒疫霉病菌的灭杀率。以未拌入孢子(囊)液的灭菌土作对照,每处理5次重复。
1.5 蚯蚓粪对辣椒幼苗的促生作用
将辣椒种子在50~55 ℃温水中浸泡1~2 min,然后在30 ℃水中浸种6~8 h。取出种子,用湿润的纱布包好,放于28 ℃培养箱中催芽。4~5 d后,选取芽长较一致的种子,播于5 cm×10 cm规格的塑料穴盘中,每处理播20穴,3次重复。穴盘中置有蛭石混合基质与蚯蚓粪的混合物,蚯蚓粪体积比分别为30%、60%、100%,以未添加蚯蚓粪的蛭石混合基质作对照。辣椒播种后7~11 d,逐日统计出苗数,第25天测定辣椒幼苗株高、地上部鲜质量和干质量等生长指标(Chen et al.,1987;Cheryl & Eric,1996)。
1.6 蚯蚓粪对辣椒疫病的防效
将基质与不同比例的新鲜蚯蚓粪混合,蚯蚓粪所占体积比分别为10%、30%、60%和100%,以不加蚯蚓粪的基质为对照。另设一加入30%灭菌蚯蚓粪的处理。将50 mL含孢子5 000个·mL-1的辣椒疫病病菌孢子悬浮液与1 kg蚯蚓粪和基质混合物混拌均匀,制成辣椒疫病病土。每处理栽种24 株6~8叶期的辣椒幼苗,待对照植株大部分发病时开始调查,计算发病率和防效。将蚯蚓粪放置1 a后,重复上述试验。
防治效果=〔1-(处理发病率/对照发病率)〕×100%
1.7 蚯蚓粪中拮抗菌的筛选
称取1 g蚯蚓粪,向其中加入10 mL灭菌的去离子水,搅拌均匀后略静置,用吸管分别吸取200 μL水溶液均匀展布于PDA、NA和高氏1号培养基平板表面,待平板出现单菌落后,根据微生物类型挑取至相应培养基斜面。
采用平板对峙培养法测定拮抗菌活性。在28℃恒温培养4 d的辣椒疫霉病菌前沿用直径5 mm的打孔器打取菌丝块,将菌丝块接种于PDA平板中央,待病原菌菌落直径达2~3 cm时,将拮抗菌菌丝块置于平板四周,以不接拮抗菌平板作对照。28 ℃恒温培养箱中培养,至对照菌落接近培养皿边缘时,测量抑菌带大小。
1.8 运用不同绿色防控措施控制辣椒疫病
试验共设3个处理,太阳能消毒处理、菌液灌根处理、太阳能消毒+菌液灌根处理,以清水处理为对照。每100 g灭菌土中加入10 mL浓度为5 000个·mL-1的辣椒疫霉病菌孢子(囊)悬浮液,混匀后的病土装入直径10 cm的塑料盆钵,将部分盆钵埋入土中,盆钵口与土表平齐,用双层聚乙烯薄膜覆盖进行太阳能处理。25 d后,将培育好的辣椒苗移入盆钵中,部分盆钵浇灌1.7中筛选出的拮抗菌发酵液25 mL,以无菌注射器注入根部土壤。待对照大部分发病时,调查发病情况并计算防效。
1.9 数据统计分析
采用DPS v6.55软件进行数据统计分析。
2 结果与分析
2.1 太阳能处理对土壤菌群的影响
太阳能消毒处理期间,气温与常年无显著差异,白天最高均温30 ℃左右,晴天比率约80%。与对照相比,太阳能处理后土壤中放线菌数量在处理10 d后明显下降,30 d后与对照相差了近100倍(图1-A);而真菌和细菌的数量在处理10 d后比对照显著增加,且随着时间的延长增幅加大(图1-B、1-C)。土壤中不同种类微生物数量变化趋势并不一致,可能是由于不同微生物对温度的敏感性不同。
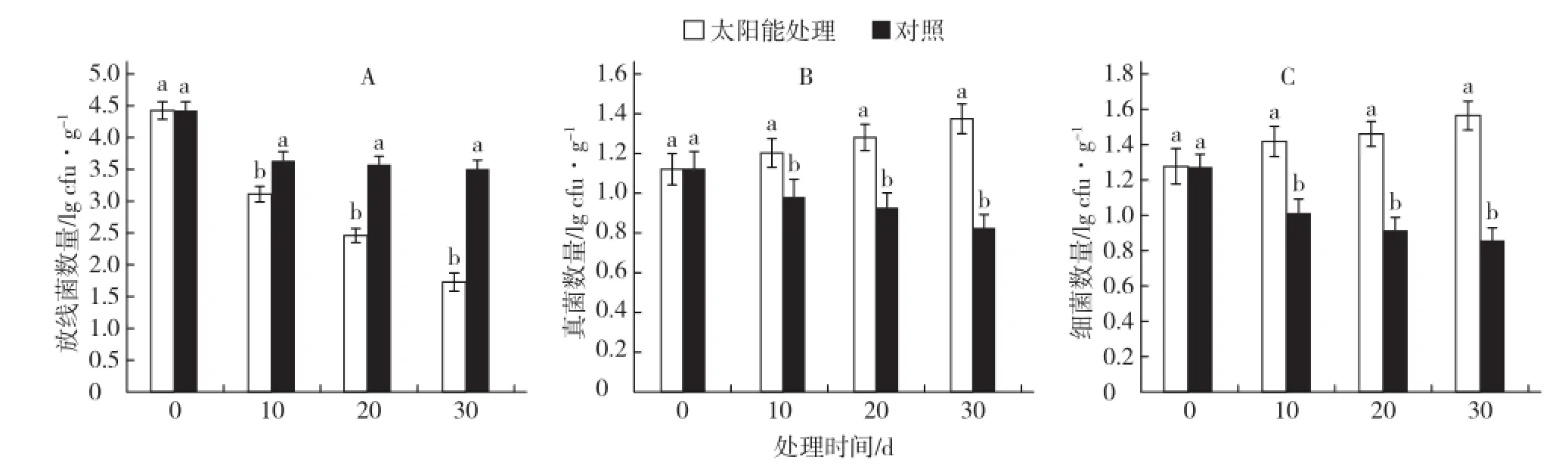
图1 太阳能处理对土壤菌群的影响
2.2 辣椒疫霉病菌的耐热性
从表1、2可以看出,辣椒疫霉病菌孢子(囊)与菌丝相比具有更强的耐热性,45 ℃下处理25 min菌丝体全部致死,而同样温度下绝大部分病菌孢子(囊)均能正常生长繁殖;50 ℃下处理10 min所有菌丝体均已死亡,而孢子(囊)在55 ℃下处理5 min仍有部分可萌发生长。
2.3 太阳能处理对辣椒疫霉病菌的灭杀效果
由图2可知,太阳能处理时间≤10 d时,不同深度土层间疫霉病菌致死率无显著差异;当处理时间≥20 d时,不同深度土层辣椒疫霉病菌致死率大多差异显著,越接近土壤表面,太阳能对病菌的杀灭效果越好;当处理25 d后,对5 cm土层土壤中辣椒疫霉病菌的灭杀效果可达52.60%。可以看出,处理时间越长对土壤病菌的杀灭效果越好。
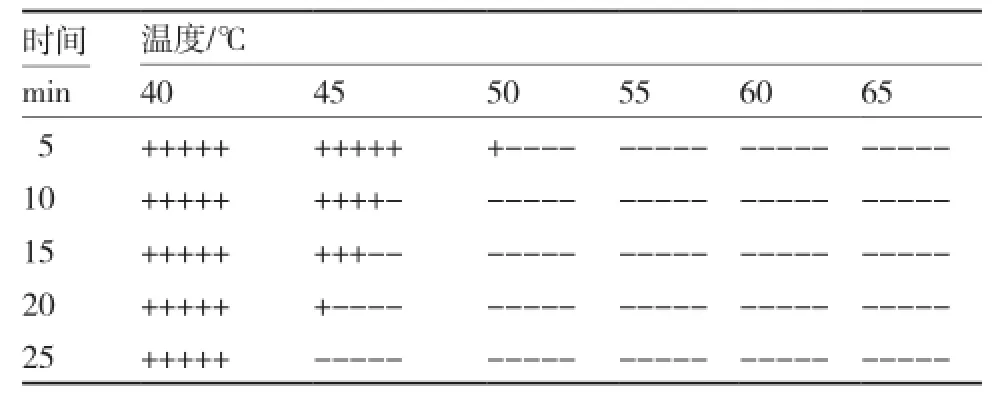
表1 辣椒疫霉病菌菌丝的耐热性
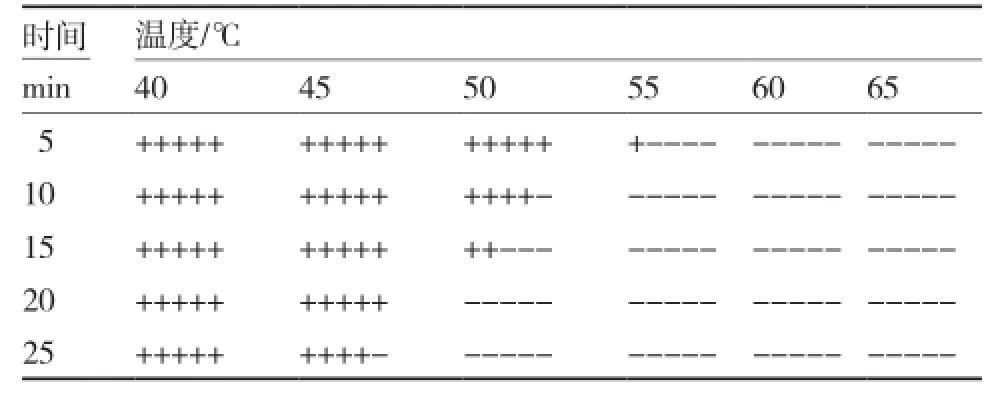
表2 辣椒疫霉病菌孢子囊(游动孢子)的耐热性
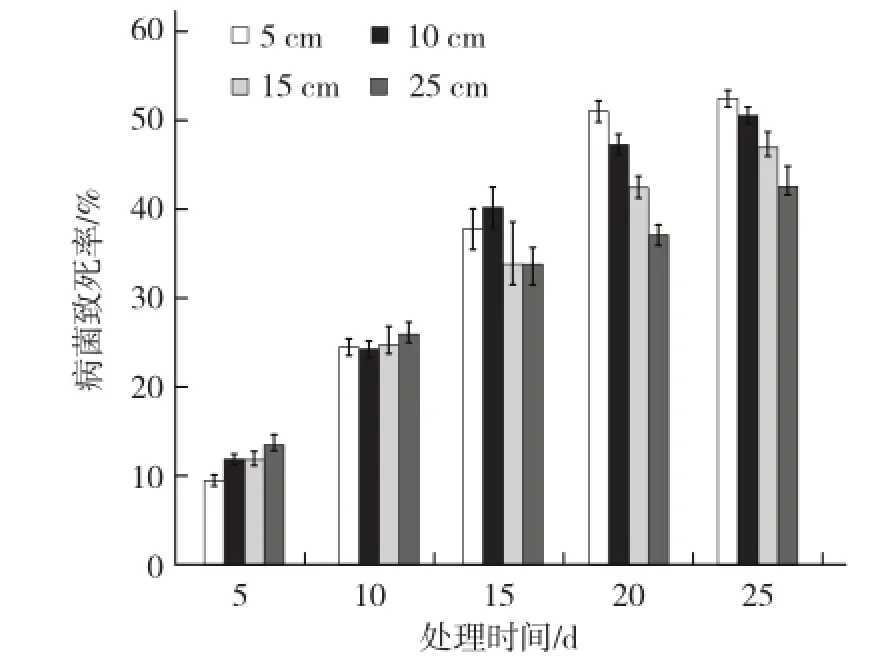
图2 太阳能消毒对土壤中辣椒疫霉病菌的灭杀效果
2.4 蚯蚓粪对辣椒幼苗的促生作用
育苗基质中添加不同比例的蚯蚓粪可以促进辣椒的出苗率,且以添加60%蚯蚓粪的复合基质出苗率最高,播种7~11 d的出苗率均显著高于对照,播种11 d后出苗率可达92.80%(表3)。
在育苗基质中添加蚯蚓粪对辣椒幼苗的生长有明显促进作用,株高、地上部鲜质量及干质量均以添加60%蚯蚓粪的复合基质处理最大(表3)。
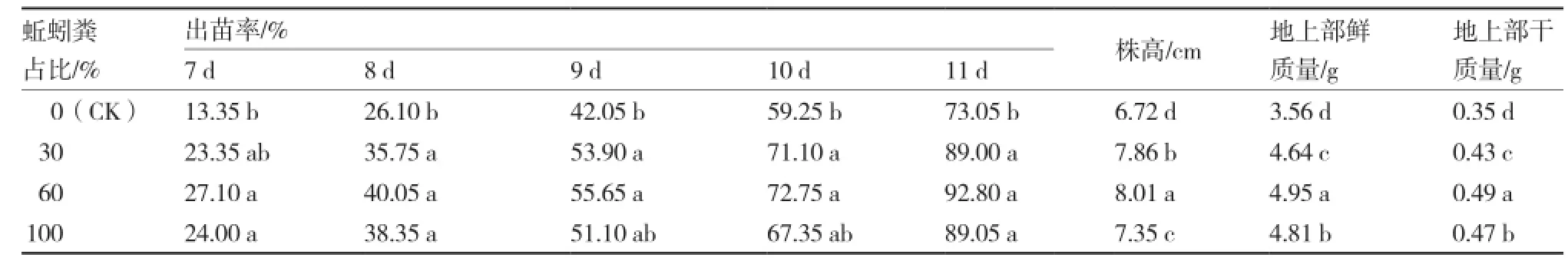
表3 添加不同比例蚯蚓粪对辣椒种子出苗率和幼苗生长的影响
2.5 蚯蚓粪对辣椒疫病的防控作用
每千克基质中加入50 mL含孢子5 000个·mL-1的辣椒疫霉病菌孢子悬浮液,辣椒苗发病率可达100%(图3)。基质中加入不同比例的新鲜蚯蚓粪后,辣椒疫病的发生均受到一定程度的抑制(表4),添加30%蚯蚓粪的复合基质对疫病的防效可达79.17%,与其他处理差异显著。蚯蚓粪经灭菌处理后,其对病害的抑制效果大幅下降,基质中添加30%灭菌蚯蚓粪,其对辣椒疫病的防效仅为20.83%。
将新鲜的蚯蚓粪放置1 a后再进行辣椒疫病的防控效果测定。结果表明(表4),长期放置会降低蚯蚓粪对病害的防控效果,其中添加100%蚯蚓粪的防控效果最好,但其对病害的抑制率也仅为20.83%。
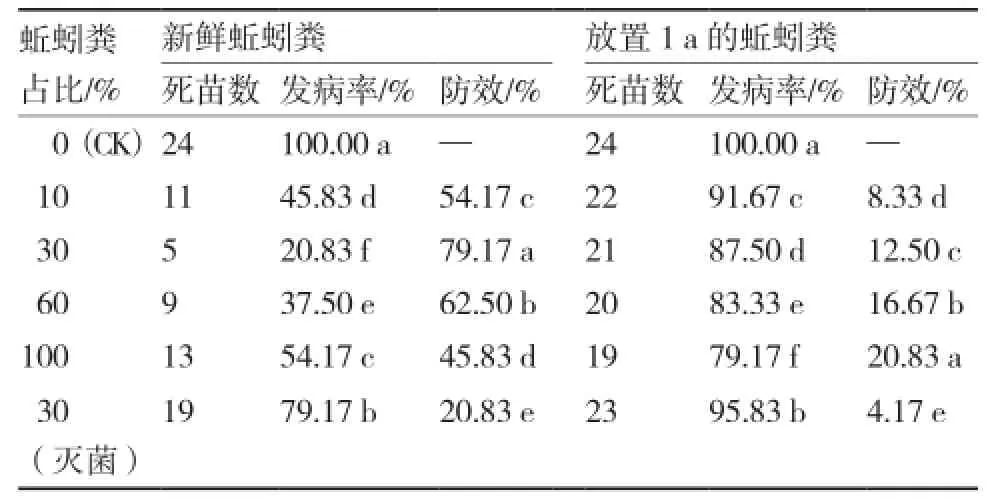
表4 蚯蚓粪对辣椒疫病的抑制作用
2.6 太阳能消毒与生防菌对辣椒疫病的控制作用
从蚯蚓粪中共分离出对辣椒疫霉病菌有拮抗活性的生防菌31株,其中真菌6株、细菌3株、放线菌22株。所有拮抗菌中以放线菌A116和细菌B107的拮抗效果最好,抑菌带大小分别为0.65 cm 和1.17 cm(图4)。

图3 辣椒疫霉病菌孢子悬浮液接种盆钵发病情况
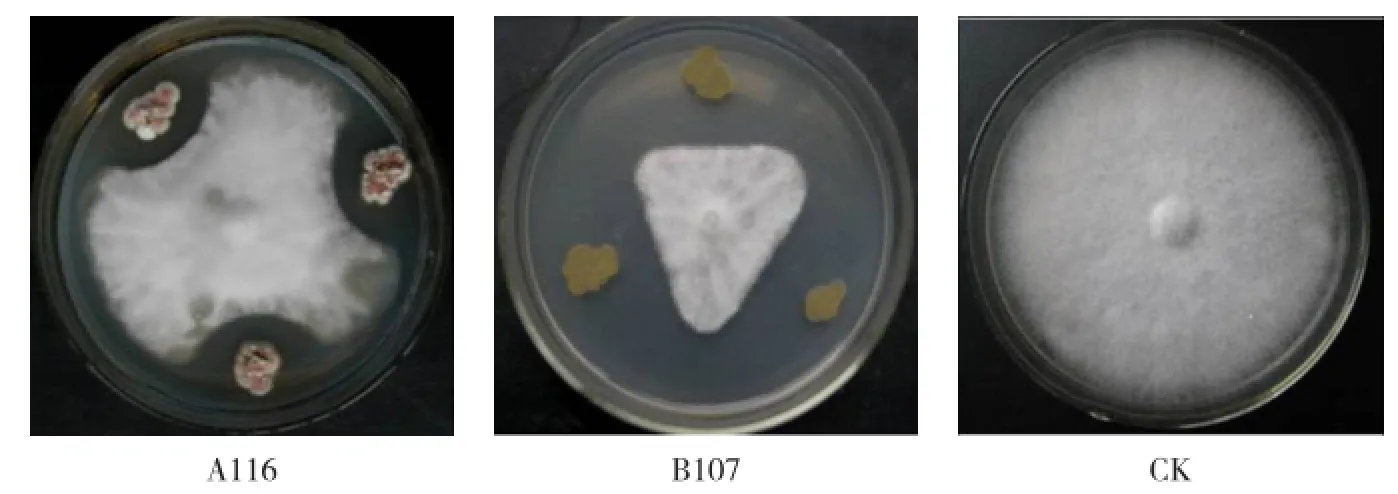
图4 蚯蚓粪中拮抗菌对辣椒疫霉病菌的抑制作用
B107发酵菌液灌根和太阳能消毒处理对辣椒疫病均有很好的控制作用,盆栽试验结果表明(表5),其防效可分别达79.16%和62.50%;而将拮抗菌液灌根与太阳能消毒结合使用,防效更是高达91.67%。

表5 太阳能消毒与菌液灌根对辣椒疫病的抑制作用
3 结论与讨论
全球范围内,每年因有害生物(病原物、害虫、杂草)危害造成的作物产量损失约35%(Popp et al.,2013)。化学防治因其快速、高效、易操作等特点而成为近年来有害生物综合治理的主要手段。但过量使用化学农药的弊端已日益显现,环境污染、人畜中毒、有害生物抗药性和再猖獗等问题日趋严重(高希武,2010;Ge et al.,2010;Jiang et al.,2012;Liang et al.,2013),特别是辣椒、番茄、黄瓜、茄子等采摘期较长的设施蔬菜,长期用药已经严重影响了果实品质(于淑晶 等,2014;Bozena et al.,2015)。2006年,在农业部召开的全国植保植检工作会议上,首次提出了“绿色植保”的理念。2011年农业部办公厅发布了关于推进农作物病虫害绿色防控的意见,提出对农作物病虫害要进行绿色防控,即用生态调控、生物防治、物理防治和科学用药等环境友好措施来控制病虫害,以达到确保我国农产品高产优质的目的。
太阳能土壤消毒对环境友好、操作简单、成本低廉、效果明显,近年来已经逐渐被应用于防治作物连作障碍,特别是设施果蔬因为土传病害而引起的连作障碍(罗桢彬 等,2013;吉沐祥 等,2015)。无论是在0~20 cm浅土层,还是在20~40 cm的深土层,太阳能消毒均可有效降低土壤中真菌、细菌和放线菌的数量(陈志杰 等,2009)。但刘耕春和程子林(2010)的研究却发现,太阳能处理可促进土壤中细菌数量的增加,这可能是由于在太阳能消毒过程中,土壤湿润、温度高,微生物呼吸十分旺盛,在覆膜封闭条件下,土壤中氧气逐渐消耗,呈缺氧还原状态,改变了土壤特性,一些嗜热、厌氧、能分解有机质的菌类大量繁殖造成的(冯忠民 等,2008)。本试验发现,太阳能处理后,田间除放线菌数量明显下降外,细菌和真菌的数量却均有显著上升,这些试验结果与前人不同,可能是因为不同田块土壤菌群种类和土壤中菌群的耐热性不同。
近年来蚯蚓粪在蔬菜育苗和栽培中已有研究应用(尚庆茂和张志刚,2005;张晓蕾 等,2010;张宁 等,2011)。蚯蚓粪作为有机废弃物,如畜禽粪便等的消化分解产物,具有很好的通气性、排水性和高持水量。蚯蚓粪中的大量细菌、真菌和放线菌不仅能使复杂的物质转变为植物易吸收的有效物质,而且还能合成一系列如糖、氨基酸和维生素等活性物质,显著促进植物生长。另外,蚯蚓粪中的大量有益菌还可以有效抑制病原菌的生长,本试验结果表明,利用太阳能可以很好地杀灭土壤中的辣椒疫霉病菌,而蚯蚓粪中的拮抗菌可明显抑制辣椒疫霉病菌的生长。将土壤消毒与生防菌液灌根结合运用,对辣椒疫病的防效可高达91.67%,高于多数化学药剂(章彦俊 等,2013)。若在育苗基质中再添加30%的蚯蚓粪,对控制该病害将更加有效。
常志州,马艳,黄红英,叶小梅,张建英.2005.辅以拮抗菌的有机肥对辣椒疫病生防效果研究.中国土壤与肥料,(2):28-30.
陈志杰,张锋,张淑莲,李英梅,梁银丽,杨兆森.2009.太阳能消毒对温室土壤环境效应及防治黄瓜根结线虫病效果.生态学报,29(12):6664-6671.
冯忠民,陈云槐,徐钦辉,吴凤姣,徐绍均.2008.利用太阳能热处理治理土壤连作障碍//浙江省植物保护学会,浙江省植物病理学会,浙江省昆虫学会.植物保护与农产品质量安全论文集.北京:中国农业科学技术出版社:152-154.
高希武.2010.我国害虫化学防治现状与发展策略.植物保护,36 (4):19-22.
吉沐祥,陈宏州,庄义庆,李国平,吴祥,杨敬辉,肖婷.2015.设施草莓土传病害无害化综合防治技术.江苏农业科学,(2):126-127.
李胜华,谷丽萍,刘可星,廖宗文.2009.有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控.植物营养与肥料学报,15(4):965-969.
刘耕春,程子林.2010.太阳能消毒改土技术在保护地芹菜生产中的应用.天津农业科学,16(1):94-96.
刘永亮,尹成林,田叶韩,刘晓光,张修国,高克祥.2013.拮抗真菌HTC的鉴定及其对辣椒疫病的生物防治潜力.植物保护学报,40(5):437-444.
罗桢彬,白剑,李芬分.2013.太阳能+石灰氮高温闷棚技术.中国果菜,(7):41-42.
马云艳,王东胜,李玉龙,薛泉宏,林雁冰.2015.辣椒疫病病株与健株根区土壤微生态研究.西北农业学报,24(4):129-137.
尚庆茂,张志刚.2005.蚯蚓粪在番茄育苗上的应用效果.中国蔬菜,(9):10-11.
于淑晶,王满意,田芳,赵卫光,边强,李宝聚.2014.黄瓜棒孢叶斑病的防治及抗药性研究进展.农药,(1):7-11.
张宁,任亚丽,史庆华,王秀峰,魏珉,杨凤娟.2011.蚯蚓粪对西瓜品质和产量的影响.中国蔬菜,(6):76-79.
张晓蕾,王波,王亦丰,赵海涛,单玉华,薛林宝.2010.蚯蚓粪复合基质氮素添加量对番茄幼苗生长的影响.中国蔬菜,(16):47-53.
章彦俊,尉文彬,马全伟,张红杰,孙卫卫.2013.四种化学药剂防治辣椒疫病盆栽药效试验.北方园艺,(2):99-100.
郑小波.1997.疫霉菌及其研究技术.北京:中国农业出版社:86-87.
Aragaki M,Uchida J Y.2001.Morphological distinctions between Phytophthora capsici and P.tropicalis sp.nov.Mycologia,93 (1):137-145.
Bozena C A,Marta M D,Malgorzata G S.2015.The effect of biological and chemical control agents on the health status of the very early potato cultivar Rosara.Journal of Plant Protection Research,55 (4):389-395.
Chen W D,Hoitink H A,Sohmitthenner A F.1987.Factors affecting suppression of Pythium damping-off in container media amended with composts.Phytopathology,77(5):755-760.
Cheryl M C,Eric B N.1996.Microbial properties of composts that suppress damping-off root rot of creeping bentgrass caused by Pythium graminicola.American Society for Microbiology,62(5):1550-1557.
Ge L Q,Wang L P,Zhao K F,Wu J C,Huang L J.2010.Mating pair combinations of insecticide-treated male and female Nilaparvata lugens Stål(Hemiptera:Delphacidae)planthoppers influence protein content in the male accessory glands(MAGs)and vitellin content in both fat bodies and ovaries of adult females.Pesticide Biochemistry and Physiology,98:279-288.
Gilardi G,Demarchi S,Gullino M L,Garibaldi A.2015.Nursery treatments with non-conventional products against crown and root rot,caused by Phytophthora capsici,on zucchini.Phytoparasitica,43(4):1-8.
Jiang L B,Zhao K F,Wang D J,Wu J C.2012.Effects of different treatment methods of the fungicide jinggangmycin on reproduction and vitellogenin gene(Nlvg)expression in the brown planthopper Nilaparvata lugens Stål(Hemiptera:Delphacidae).Pesticide Biochemistry and Physiology,102:51-55.
Kyung S M,Jeong-Gyu K,Deok K K.2010.Biocontrol activity and induction of systemic resistance in pepper by compost water extracts against Phytophthora capsici.Phytopathology,100(8):774-783.
Lamour K H,Stam R,Jupe J,Huitema E.2012.The oomycete broad-host-rang pathogen Phytophthora capsici.Molecular Plant Pathology,13(4):329-337.
Liang Y,Zhang S,Shao Z R,Gao X W.2013.Insecticide resistance in and chemical control of the cotton aphid,Aphis gossypii (Glover).Plant Protection,39(5):70-80.
Popp J,Pető K,Nagy J.2013.Pesticide productivity and food security.A review.Agronomy for Sustainable Development,33:243-255.
Sang M K,Kim K D.2012.The volatile-producing Flavobacterium johnsoniae strain GSE90 shows biocontrol activity Phytophthora capsici in pepper.Journal of Applied Microbiology,113(2):383-398.
Control Effect of Different Green Control Measures on Pepper Phytophthora Blight
CHEN Xi-jun1,SUN Jia-jia1,CHEN Yin-feng2,DONG Jin-ping1,CHEN Xiao-ren1,WEI Li-hui3,HUANG Ben-li1*
(1Horticulture and Plant Protection College,Yangzhou University,Yangzhou 225009,Jiangsu,China;2Plant Protection and Quarantine Station of Hanjiang District,Yangzhou 225100,Jiangsu,China;3Institute of Plant Protection,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,Jiangsu,China)
In order to clear the control effect of different control measures on pepper phytophthora blight,soil solarization,adding the wormcast and dripping the antagonistic bacteria suspension were adopted.Results showed that solarization could kill the pathogen of pepper phytophthora blight,the longer treating time,the better effect.But it had different effects on different kinds of microorganisms in soil.The wormcast could promote the growth of pepper seedling and had the best control effect on pepper phytophthora blight,when 30% of it was added to the cultivating substratum.A116 and B107,2 antagonistic strains were isolated from the wormcast,both of them had better antagonistic activity against Phytophthora capsici.Combining soil solarization with dripping the antagonistic bacteria suspension,the highest control effect could reach 91.67%.
Green control measure;Pepper phytophthora blight;Control effect
):黄奔立,男,副教授,主要从事蔬菜病害防控研究,E-mail:yzhbl2003@163.com
国家公益性行业(农业)科研专项(201403032),江苏省农业科技自主创新资金项目〔CX(15)1037〕
陈夕军,男,博士,副教授,主要从事农作物病害防治研究,E-mail:xjchen@yzu.edu.cn
(
2016-02-29;接受日期:2016-05-31

