3D打印技术在血管疾病诊治中的应用
黄骏咏,冯家煊,冯睿,周建,景在平
• 综述 •
3D打印技术在血管疾病诊治中的应用
黄骏咏1,冯家煊1,冯睿1,周建1,景在平1
3D打印技术被制造业誉为第三次工业革命,在21世纪已经在许多领域都展现了巨大的价值和潜力,在医学领域如骨科、口腔科、整形外科、神经外科等都得到了广泛的应用。3D打印的开展应用也为血管疾病的诊治提供了新的方法,本文综述介绍3D打印技术在血管疾病诊治中的应用现状及未来发展趋势。
1 3D打印技术的概念及种类
3D打印技术(3DP)是一种快速成型技术,原理是将计算机辅助设计出的数字模型输入3D打印机中,通过逐层累加的方式将物件制造出来。这种“做加法”的制作方式有别于传统“做减法”的制造,故又可称为增材制造技术。经过了近30年的发展,3DP已经出现了20多种不同的成型方法,主要的类型包括选择性激光烧结、选择性激光熔化成型、熔融沉积成型、光固化快速成型等。其主要工艺分类及打印材料见表1。
2 3D打印技术的主要特点及应用现状
3D打印的优势在于其无需传统制造的刀具及模具,仅需要一台3D打印机就可以快速制造出任意形状复杂的产品,理论上特别适合医学形态各异的医疗器具及辅具的个体化定制。目前在血管领域中,3DP可以应用于以下两个方面:①3D打印体外解剖模型;②3D打印体内移植物。
3 3D打印技术在血管外科诊治中的应用
目前3D打印技术在血管诊治中的应用主要在于制作个体化病变体外模型。3D打印体外模型需要经过以下几个步骤:①获取原始影像数据;②提取分割解剖区域;③数据的提取转化;④输入3D打印机进行3D打印[1]。制造体外模型的第一步是获取模型数据,需要患者的CT扫描和磁共振成像(MRI)的DICOM(data imaging and communications in medicine)格式的数据,超声[2]数据也可以被使用。对于血管,常需要使用CT血管造影(CTA)、磁共振血管造影(MRA)使其易于在影像处理软件上进行分割提取,并且层厚越薄,制作出的数字模型越真实。常用的影像生成及处理软件有Mimics(Materialise公司)、Simpleware (Simpleware公司)、3D-Doctor(Able Software公司)及Amira(Visage Imaging公司)等。利用以上软件将病变部位的图像分割提取后,需要将文件保存为SLT(standard tessellation language)格式输入3D打印机中。在选择合适的打印机、打印材料及相关参数后,即可将解剖病变模型3D打印出来。
4 3D打印技术血管移植物的现状及未来发展趋势
4.13D打印血管腔内移植物 近年来3D打印体内移植物在骨科、颌面外科、牙科等医学领域得到了巨大的发展。3D打印技术可以方便制作出各种形态和孔隙度的多孔钛实体,不仅可以与缺损部位完全匹配,且具备较好的生物力学性能[12]。对于特异性高变化大的血管疾病,临床科研人员也尝试通过3D打印的方法个体定制血管腔内移植物以更好的适用于不同形态的血管病变。Flege等[13]利用聚乳酸及聚己酸内酯粉末作为原材料,通过3D打印技术选择性激光熔化成型(SLM)制作出完全可降解冠状动脉支架原型,通过喷洒及浸泡两种方法涂层处理保证其表面光滑,经过γ射线消毒后完成支架的制作。经细胞形态、代谢及黏附活动测试,此支架生物相容性好。这为今后个体化制造可降解支架提供了基础。刘媛媛等[14]用PPDP材料利用3D打印制备支架内层,利用壳聚糖和PVA混合溶液通过静电纺丝的方法制备支架外层。这种复合型的可吸收支架的力学性能优于单纯3D打印制备的支架,且适合于细胞的粘附和增殖,可以用于血管狭窄性疾病的治疗。
4.23D打印组织工程血管 组织工程是一门融合临床医学、基础医学、生物材料学等多学科的交叉科学,旨在产生有功能的组织或器官以修复或替代损伤的组织、器官[15]。每年有成千上万冠状动脉或周围动脉狭窄的患者需要使用血管替代物行人工血管旁路术或置换术。由于自体血管的来源有限,异体血管容易引起排斥反应,以涤纶、聚四氟乙稀等合成材料制造直径在5~6mm以下的人工血管常因血栓形成和内膜增生致使移植后通畅率较低[16]。因此,寻求高度组织相容性、无血栓形成、弹性好且具有可生长性的小口径血管替代物成为急需解决的问题,血管组织工程为实现这个目标提供了可能。但是传统的组织工程支架制造方法缺乏对多孔结构的控制和复杂外形的制造能力,3D生物打印则可以制造任意复杂形状的三维实体,这为组织工程支架的仿形与仿生制造提供了可能[17]。
3D生物打印是以活细胞、生物材料及生物活性因子为原料,通过精确定位逐层堆积的方法构建具有三维仿生结构和生物活性的组织或器官[18]。经过30余年的不断发展已产生了包括皮肤、软骨、神经、血管、肝甚至心脏等组织器官原型,但距离临床实际应用还需要长时间的探索研究,相比传统固态以支架为基础的组织工程方法,3D生物打印的主要优势在于它可以同步精确定位排列不同类型的细胞,产生高细胞密度的组织,并实现厚组织的血管化[19]。Xu等[20]利用3D生物喷墨打印技术制作出一种Z型具有悬垂结构的3T3成纤维细胞管状结构。打印出后经过72 h的孵化,细胞生物活性仍有82%,这证明了这种技术能让组织工程血管拥有复杂的几何结构。Lee等[21]通过3D生物喷墨打印的方法制作出一种有功能且有可灌注管腔的体外血管通道,管腔内全部覆盖有内皮细胞层,这种将细胞与基质以预想的三维结构直接3D打印在管腔通道周围的方法为血管化组织制作提供了新的思路。
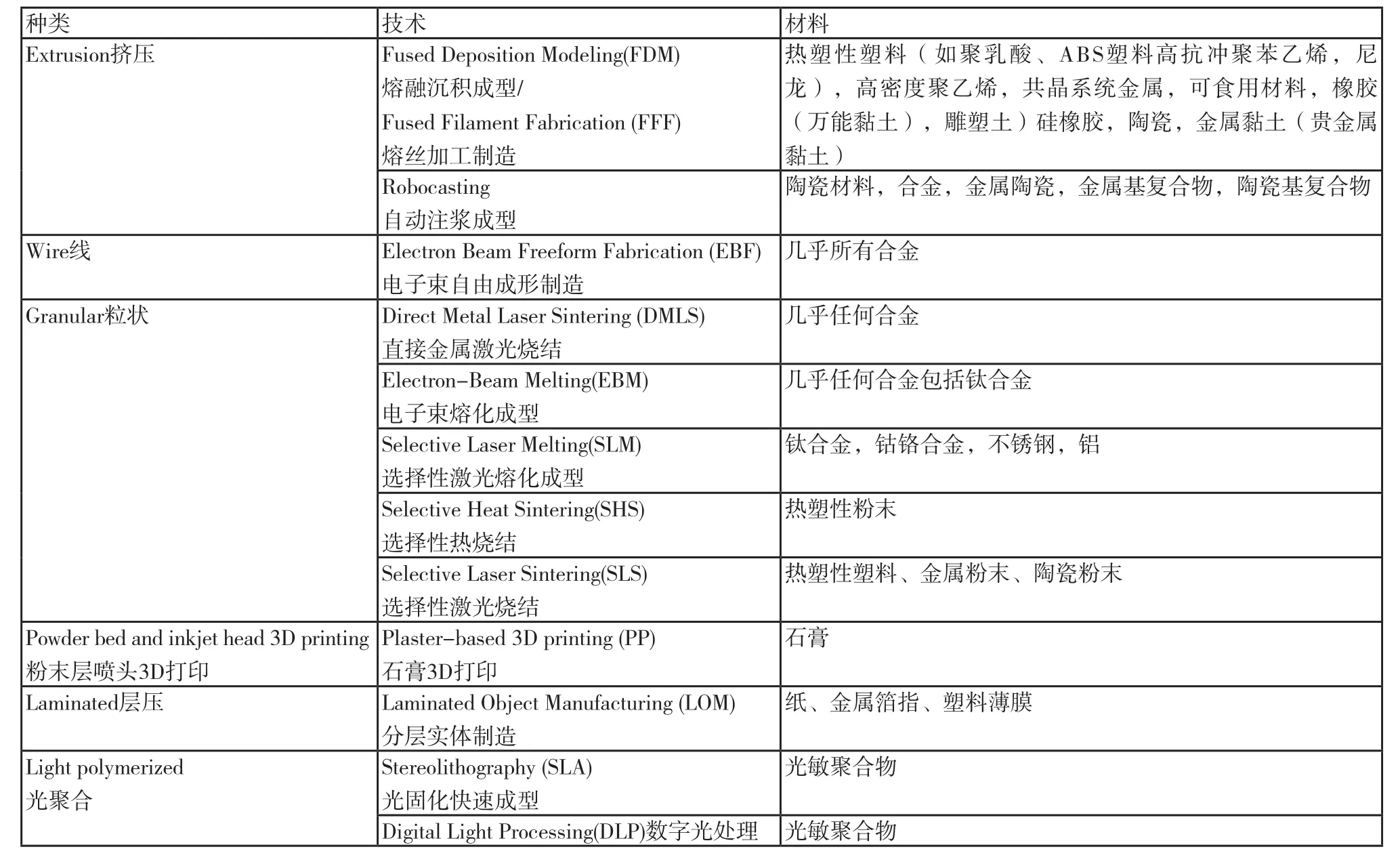
表1 3D打印技术及相关材料的种类
水凝胶3D细胞培养是在传统单层细胞培养的基础上,以水凝胶作为支架,模拟体内生长环境进行细胞培养的技术。3D细胞培养较传统2D细胞培养环境更接近细胞的体内状态,还原细胞的极性、生理功能,干细胞的有序分化,可形成微组织。Bertassoni等[22]通过3D生物打印研制出一种琼脂糖纤维模板,后用水凝胶进行覆盖,交联技术进行加固,成功构建出了具有空间化微循环组织结构。
5 3D打印技术展望
3D打印技术已经在医学的各领域展现出了巨大应用价值和潜力,目前将3D打印技术应用于血管疾病的诊治已经相当成熟,随着3D打印工艺和材料的进步,3D打印的腔内移植物、血管移植物乃至器官都将会在不久的将来实现。
[1] Marro A,Bandukwala T,Mak W. Three-Dimensional Printing and Medical Imaging: A Review of the Methods and Applications[J]. Curr Probl Diagn Radiol,2016,45(1):2-9.
[2] Farooqi KM,Sengupta PP. Echocardiography and three-dimensional printing: sound ideas to touch a heart[J]. J Am Soc Echocardiogr,2015,28(4):398-403.
[3] Valverde I,Gomez G,Coserri JF,et al. 3D printed models for planning endovascular stenting in transverse aortic arch hypoplasia[J]. Catheter Cardiovasc Interv,2015,85(6):1006-12.
[4] Itagaki MW. Using 3D printed models for planning and guidance during endovascular intervention: a technical advance[J]. Diagn Interv Radiol,2015,21(4):338-41.
[5] Sodian R,Schmauss D,Schmitz C,et al. 3-dimensional printing of models to create custom-made devices for coil embolization of an anastomotic leak after aortic arch replacement[J]. Ann Thorac Surg,2009,88(3):974-8.
[6] 左尚维,贾鑫,杜昕,等. 开窗支架型血管治疗近肾腹主动脉瘤的初步临床结果[J]. 中华老年多器官疾病杂志,2012,11(2):118-21.
[7] You JH,Kang SG,Kim BM. A novel measurement technique for the design of fenestrated stent grafts: Comparison with three-dimensional aorta models[J]. Exp Clin Cardiol,2013,18(1): 48-52.
[8] Leotta DF,Starnes BW. Custom fenestration templates for endovascular repair of juxtarenal aortic aneurysms[J]. J Vasc Surg,2015,61(6):1637-41.
[9] Koleilat I,Jaeggli M,Ewing JA,et al. Interobserver variability in physician-modified endograft planning by comparison with a threedimensional printed aortic model[J]. J Vasc Surg,2015,19.
[10] Maragiannis D,Jackson MS,Igo SR,et al. Replicating Patient-Specific Severe Aortic Valve Stenosis With Functional 3D Modeling[J]. Circ Cardiovasc Imaging,2015,8(10):e003626.
[11] O'Reilly MK,Reese S,Herlihy T,et al. Fabrication and assessment of 3D printed anatomical models of the lower limb for anatomical teaching and femoral vessel access training in medicine[J]. Anat Sci Educ,2016,9(1):71-9.
[12] Hong SB,Eliaz N,Leisk GG,et al. A new Ti-5Ag alloy for customized prostheses by three-dimensional printing (3DP)[J]. J Dent Res,2001,80(3):860-3.
[13] Flege C,Vogt F,Hoges S,et al. Development and characterization of a coronary polylactic acid stent prototype generated by selective laser melting[J]. J Mater Sci Mater Med,2013, 24(1):241-55.
[14] 刘媛媛,向科,李瑜,等. 结合生物3D打印和静电纺丝制备复合生物可吸收血管支架用于血管狭窄治疗[J]. 东南大学学报(英文版),2015,31(2):254-8.
[15] Langer R,Vacanti JP. Tissue engineering[J]. Science,1993,260(5110): 920-6.
[16] Kibbe MR,Martinez J,Popowich DA,et al. Citric acid-based elastomers provide a biocompatible interface for vascular grafts[J]. J Biomed Mater Res A,2010,93(1):314-24.
[17] 李祥,王成焘. 快速成形技术制造组织工程支架研究进展[J]. 生物工程学报,2008,24(8):1321-6.
[18] Zhang X,Zhang Y. Tissue Engineering Applications of Three-Dimensional Bioprinting[J]. Cell Biochem Biophys,2015.
[19] Mironov V,Kasyanov V,Drake C,et al. Organ printing: promises and challenges[J]. Regen Med,2008,3(1):93-103.
[20] Xu C,Chai W,Huang Y,et al. Scaffold-free inkjet printing of threedimensional zigzag cellular tubes[J]. Biotechnol Bioeng,2012,109(12): 3152-60.
[21] Lee VK,Kim DY,Ngo H,et al. Creating perfused functional vascular channels using 3D bio-printing technology[J]. Biomaterials,2014,35 (28):8092-102.
[22] Bertassoni LE,Cecconi M,Manoharan V,et al. Hydrogel bioprinted microchannel networks for vascularization of tissue engineering constructs[J]. Lab Chip,2014,14(13):2202-11.
本文编辑:姚雪莉
R543 【文献标志码】A
1674-4055(2016)05-0627-03
国家自然科学基金重点项目(81330034);国家自然科学基金面上项目(81270386);国家自然科学基金青年项目(81500369)
1200433 上海,第二军医大学长海医院血管外科
冯睿,E-mail:fengrui1588@qq.com
共同通讯作者:景在平,E-mail:xueguanky@163.com
10.3969/j.issn.1674-4055.2016.05.37
3D打印实体模型可以帮助医师更直观精确的认识病变形态特点,优化手术方案。Valverde等[3]报道了一例患有主动脉缩窄合并主动脉弓发育不良的15岁男性患者,MRA提示其主动脉弓缩窄段直径仅为9.5 mm,通过近16 h的图像分割设计及3D打印制作出了弹性和非弹性的两个1:1比例的实体模型。他们利用3D打印模型进行了球囊扩张、支架导入释放试验,从中选择了最佳的支架和球囊尺寸及释放位置,并在1 d后利用这些器具对患者成功的进行了手术,术后测得主动脉狭窄段直径增大到13.7 mm,主动脉弓压力差从35 mmHg降至7 mmHg。研究总结得出3D打印的模型能够准确重建患者解剖形态并对血管腔内手术操作的模拟非常有帮助,并且接近血管的弹性,3D打印模型能更好的还原模拟实际情况。Itagaki等[4]用透明树脂和尼龙作为材料3D打印出空心和实心的脾动脉瘤模型,分别用于术前腔内器具的测试选择和术中导航定位,这可以帮助医师更好的完成复杂的内脏动脉瘤的诊治。
3D打印实体模型可以帮助医师更精确的测量病变形态,从而可以制作和选择更合适的移植物,提高手术效率。Sodian等[5]报道了一例50岁因升主动脉夹层接受升主动脉和主动脉弓置换术后再发主动脉弓假性动脉瘤的患者。3D打印模型提示假性动脉瘤瘤口呈长条裂缝状,Amplaztype圆形弹簧圈不适合,因此他们个体定制一款镍钛合金弹簧圈,在成功的体外实验后成功的腔内栓塞了患者的假性动脉瘤,术后3个月CT扫描提示瘤腔完全血栓化无造影剂灌注。通过分别对3D打印的模型与CT数据的测量发现一致性高达98.76%,证明了利用3D打印模型将病变实体化的优势可以实现腔内移植物的定制和体外实验。
肾周型腹主动脉瘤由于没有足够的瘤颈,覆膜支架如需稳定锚定则很有可能遮蔽分支动脉(腹腔干动脉、肠系膜上动脉、双肾动脉),是腹主动脉瘤腔内治疗的难点。使用个体定制的开窗型移植物腔内治疗是一种有效的解决方法,但目前市面上只有一款商品化的开窗型支架Zenith开窗支架(Cook公司,美国),且定制周期需要2个月[6],而医师自己制作开窗型支架又会存在测量复杂,标记不准等问题,从而限制了开窗型移植物的应用。You等[7]利用FDM技术打印出实心腹主动脉瘤模型,在模型上对分支动脉的直径及之间距离的测量设计定制了对应的开窗型支架。Leotta等[8]则通过3D打印出标有分支动脉开口位置的带孔主动脉模型,仅需要将覆膜支架放入消毒过的带孔模型中,术中即可用电凝刀实现快速开窗,并可将移植物压缩入鞘中使用。因为不需要一系列精确复杂的测量,使得个体定制的开窗型覆膜支架的制作更为准确和快速。Koleilat等[9]探究传统自动生成中心线法(iNtuition影像工作站,TeraRecon公司)和3D打印模型测量法的准确性,通过3名独立观察者利用以上2种方法对7例不同病例的腹主动脉分支进行测量后发现,自动生成中心线法较3D打印模型测量法的数据差异大,而3D打印模型测量的可重复性和准确性更好,这可以减少分支动脉开口与开窗型支架对位不准导致的脏器缺血并发症发生率。
3D打印实体模型可以帮助医师研究疾病性质,也可用于年轻医师的解剖教学和临床操作培训。Maragiannis等[10]利用3D打印中的光固化成型技术制作了8例主动脉瓣狭窄(6例三叶瓣和2例二叶瓣)模型。分别利用了坚硬的材料制作钙化斑块,利用如橡胶样的弹性材料制作软组织结构如左室流出道、主动脉根部、升主动脉及未钙化动脉瓣叶。然后他们将建立好的3D打印模型连接在体外流体动力装置中,利用多普勒超声测量主动脉瓣开口面积、最大跨瓣压差、平均跨瓣压差和每搏输出量指标,与患者实际超声结果对比提示了高度的一致性,证实了3D打印模型可以仿真模拟严重主动脉狭窄的解剖结构及病变性质。O’Reilly等[11]利用3D打印技术制作了下肢血管、骨骼和皮肤,通过连接水泵和在血管内注入人造血液模拟真实血流流动,可以用于解剖、超声及血管穿刺等教学。因为可以制作所有年龄段的各种解剖形态模型,且模型价格便宜,容易量产,预计在未来的5~10年里将广泛用于临床解剖的教学。

