基于纳米金催化的血清尿酸纸芯片的构建及应用
赵甜甜, 陈雨晴, 张 敏, 王月荣, 章弘扬, 胡 坪
(1. 华东理工大学化学与分子工程学院, 上海市功能性材料化学重点实验室,2. 药学院, 上海市新药设计重点实验室, 上海 200237)
基于纳米金催化的血清尿酸纸芯片的构建及应用
赵甜甜1, 陈雨晴1, 张敏2, 王月荣1, 章弘扬1, 胡坪1
(1. 华东理工大学化学与分子工程学院, 上海市功能性材料化学重点实验室,2. 药学院, 上海市新药设计重点实验室, 上海 200237)
摘要建立了一种以纸芯片为平台, 利用纳米金(AuNPs)的过氧化物模拟酶特性对血清中尿酸(UA)含量进行快速检测的方法. 在改装的中性笔中灌注疏水性材料溶液, 直接在滤纸上绘制所需要的图案, 经干燥后形成纸芯片. 将纳米金、 四甲基联苯胺(TMB)和H2O2的混合液依次滴加于纸芯片检测区域, 无色的TMB被氧化成蓝色, 然后将待测样品滴加于蓝色区域, 氧化态TMB被还原为无色, 根据手机相机记录的检测区域灰度值计算试样中尿酸的浓度. 实验优化了纳米金在纸芯片上的用量、 反应时间和反应温度等参数, 在最优实验条件下, 检测尿酸的线性范围为10.6~125 mg/L, 检出限为4.64 mg/L, 加样回收率为94.8%~108.5%. 该方法选择性良好, 可用于测定血清样品中尿酸的含量.
关键词纸芯片; 纳米金; 尿酸
纸芯片是微流控芯片的一种, 由Whitesides等[1]于2007年首先提出, 因其成本低廉、 操作简单、 无需复杂的外围设备, 且其基底与其它化学或生物检测物具有很好的兼容性, 在临床诊断[2,3]、 环境检测[4~6]和食品质量控制[7,8]等领域被广泛应用. 目前, 纸芯片的设计方法主要包括喷墨打印法[9]、 光刻法[10]、 蜡印法[11]、 丝网印刷法[12]、 柔版印刷法[13]、 激光切割法[14]和刻蚀法[15,16]等, 这些方法存在墨盒易损坏、 芯片制作时间长、 设备昂贵及需要专业人员操作等局限性.Whitesides等[17]和Zhang等[18]分别采用绘图仪和马克笔绘制纸芯片, 但是绘图仪的笔尖部位极易堵塞, 而用马克笔制作的纸芯片疏水效果不太理想. 尿酸是人体内嘌呤代谢的最终产物, 它是一种重要的生物标志物, 其在体内的含量高低与痛风、 高尿酸血症、 肾病和高血压等多种疾病具有密切关系. 目前检测尿酸多采用色谱法[19]、 电化学方法[20]以及酶法[21,22]等. 色谱法需要昂贵的仪器, 电化学方法操作较复杂, 而传统酶法主要用到2种酶(尿酸氧化酶和过氧化物酶)和色源物质, 酶的价格昂贵且储存不方便, 并且酶的活性受外界条件影响较大(如温度,pH值, 尤其是有机溶剂), 这都限制了这些方法的应用.
本文在改装的普通中性笔中灌注疏水性材料溶液, 然后直接在滤纸上绘制纸芯片, 以此纸芯片为检测平台, 基于在纳米金的催化下[23,24], 四甲基联苯胺(TMB)易被H2O2氧化成蓝色物质, 而尿酸能将该氧化物再还原为无色TMB的原理, 建立了血清中尿酸的微流控纸芯片检测方法. 经条件优化及实际样品测定表明, 该方法简单、 快速且准确, 对于医疗资源缺乏地区的相关疾病诊断具有适用性.
1实验部分
1.1试剂与仪器
氯金酸(HAuCl4·4H2O)、 抗坏血酸、H2O2、 甲醇、 四甲基联苯胺、 正庚烷、 黄嘌呤、 次黄嘌呤、 肌酸酐、 肌苷、 葡萄糖和尿酸等均为分析纯(国药集团化学试剂有限公司); 烷基烯酮二聚体(AKD, 山东旺升新材料科技有限公司); 真空硅脂(江阴市家宝石化有限公司); 人体血清样品(九江第一人民医院); 超纯水(电阻率18MΩ·cm). 所有用试剂均为使用前配制.
涡旋混合器(美国Scilogex公司); 离心机(杭州米欧仪器有限公司); 华为荣耀3C手机(手机相机像素为800万, 深圳华为公司); 1号定性滤纸(英国Whatman公司).
1.2实验过程
1.2.1中性笔的改装与纸芯片的制作取1支普通的书写用中性笔, 用注射器吸除笔芯中的墨水, 将笔芯截断, 只保留笔尖以上约1~2cm部分, 以方便灌注疏水性溶液. 取0.15g真空硅脂和0.5g烷基烯酮二聚体加入到12.5mL正庚烷中, 充分溶解, 将此混合液作为疏水剂. 用注射器将0.05mL疏水剂注入改装笔中, 以直径为8mm的孔板为模具, 在Whatman#1滤纸上绘出圆形图案, 于100 ℃烘干3min.
1.2.2纳米金的合成参照文献[23]方法合成带有正电荷的纳米金(AuNPs). 将50μL(0.1mol/L)氯金酸和50μL(24g/L)抗坏血酸溶液加入到10mL超纯水中, 于40 ℃下搅拌2min. 溶液颜色由浅黄色快速变为亮红色, 即得带正电荷的AuNPs.
1.2.3尿酸标准溶液的配制称取0.02g尿酸标准品, 溶解在新配制的10mLNaOH(0.1mol/L)溶液中, 得到2g/L的尿酸储备液. 使用时, 分别用超纯水将其稀释成0, 25, 50, 75, 100和125mg/L的尿酸标准溶液.
1.2.4尿酸的检测尿酸的检测原理: 当无色的TMB和H2O2混合溶液遇到(+)AuNPs时, 由于(+)AuNPs具有过氧化物模拟酶特性,TMB在其催化作用下很快被H2O2氧化为蓝绿色, 加入尿酸后, 被氧化的TMB被尿酸还原为无色, 颜色变化程度与尿酸含量成正比.
尿酸的检测方法: 取浓度为0.02mol/L的TMB甲醇溶液和8.82mol/L的H2O2水溶液按体积比5∶1混合, 作为显色液. 取2μL(+)AuNPs溶液滴在纸芯片检测区域, 再滴加2μL显色液, 检测区域变为蓝色. 取不同浓度的尿酸标准溶液, 依次滴加在纸芯片各检测区域, 蓝色快速变浅, 并在1.5min时趋于稳定. 用手机对纸芯片检测区域拍照, 照片用ImageJ软件处理, 得到灰度值(蓝色越深, 灰度值越小). 以尿酸溶液浓度为横坐标, 以灰度值为纵坐标, 绘制标准曲线.
1.2.5血清样品的前处理参照文献[25,26]方法, 取0.1mL血清, 加入30μL10%(质量分数)的三氯乙酸溶液, 涡旋混合1min, 以4000r/min转速离心5min, 取上层清液, 然后加入2μL6mol/L的NaOH调节pH值, 用0.22μm滤膜过滤, 滤液待用.
1.2.6血清中尿酸的HPLC测定采用HPLC法对血清中的尿酸值进行比对分析, 色谱条件如下:ACE5AQ水性柱(250mm×4.6mm, 5μm), 检测波长254nm, 柱温25 ℃, 梯度洗脱, 流动相由pH=3的醋酸溶液(溶剂A)和乙腈(溶剂B)组成, 梯度程序为溶剂A保持20min, 然后在10min内增加溶剂B体积分数到40%并保持5min, 流速1mL/min.
2结果与讨论
2.1水笔型号的选择
常用的书写中性笔笔尖宽度多为0.3, 0.4, 0.5和0.7mm, 实验选用同一品牌(Pilot)不同型号的中性笔, 经改装灌注疏水剂后用于制作检测区域直径为8mm的纸芯片, 然后负载5μL的蓝色染料. 如图1(A)所示, 对于用笔尖宽度为0.3mm的中性笔制作的纸芯片, 染料溢出疏水边界, 疏水效果较差, 这是因为太细的笔尖导致在画纸芯片的过程中, 疏水剂流到纸上的体积太少, 疏水剂不能完全渗透整张纸, 因此0.3mm的中性笔不能满足实验要求. 而用笔尖宽度为0.4mm的中性笔制作的纸芯片[图1(B)], 能将染料完全限制在疏水边界内, 并且在纸芯片的反面, 染料也完全没有溢出, 说明其疏水效果较好. 考虑到疏水剂在纸上的扩散性, 过大的笔尖宽度会导致流到纸上的疏水剂体积过大, 使疏水界限宽度过宽, 从而降低所制作的纸芯片的分辨率, 故实验选择笔尖宽度为0.4mm中性笔作为实验用笔.
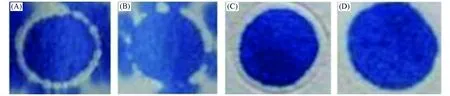
Fig.1 Front views(A, C) and back views(B, D) of two paper-based microfluidic chips fabricated by the modified pen with a nib width of 0.3 mm(A, B) and 0.4 mm(C, D)
2.2疏水剂的选择
疏水剂在纸上的扩散率对纸芯片的分辨率影响较大, 而扩散率与溶液的黏度密切相关. 以正庚烷作为溶剂配制AKD溶液, 注入改装笔后在滤纸上绘制宽度分别为3mm和2mm的通道. 从通道的一端滴加蓝色染料, 由于疏水界限的限制, 染料会往另一端流动, 结果如图2(A)所示. 可见, 通道疏水界限的宽度不均匀, 染料在通道内的流动性差, 且无法实现1mm通道的构建, 因此采用正庚烷等黏度较小的溶剂溶解疏水剂所制作的纸芯片分辨率较差, 难以满足实验要求. 为此, 在正庚烷中加入适量真空硅脂以增加溶液黏度, 绘制的通道由图2(B)所示. 可见, 通道的疏水界限的宽度较窄且均匀, 当通道宽度为1mm时, 染料的流动性仍然较好. 这是由于真空硅脂的加入有效降低了疏水剂在纸上的扩散速度, 提高了所制作纸芯片的分辨率.

Fig.2 Influence of without(A) and with(B) the addition of vacuum silicone on the resolution of paper-based microfluidic chips
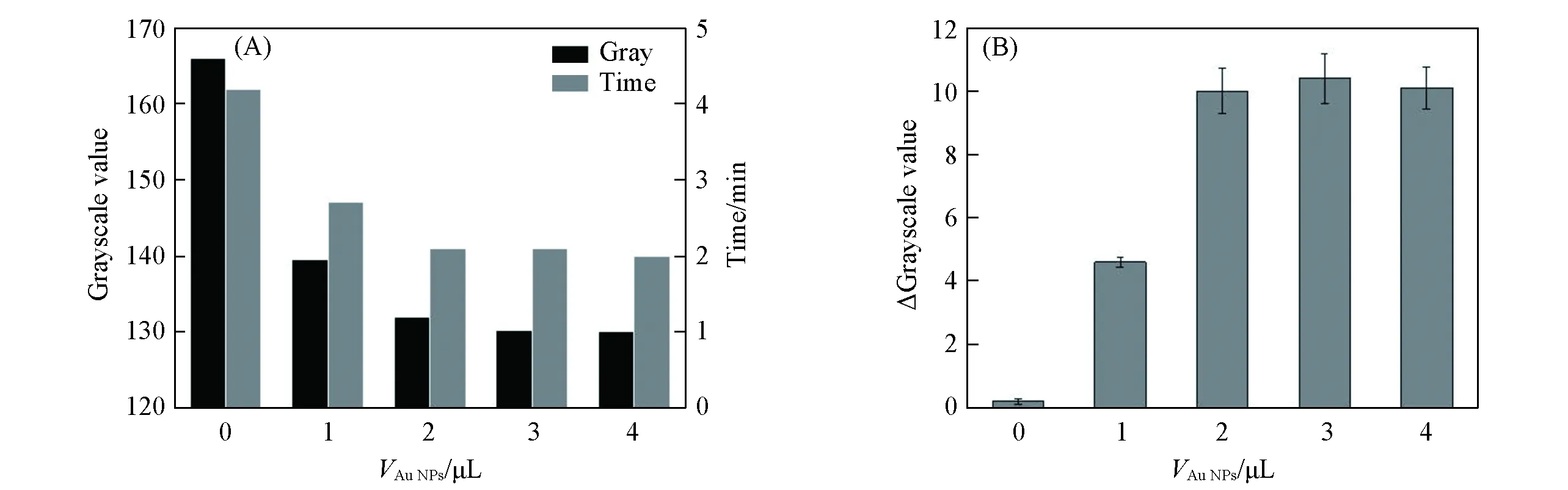
Fig.3 Effects of (+)AuNPs volume on the TMB oxidation(A) and detection of UA(n=3)(B)
2.3(+)AuNPs的加入量对尿酸检测的影响
考察了(+)AuNPs加入量对尿酸检测的影响. 将不同体积的(+)AuNPs溶液和2μL显色液滴加在纸芯片检测区域, 结果如图3(A)所示. 未滴加(+)AuNPs时, 检测区也会发生由无色到蓝色的变化, 但颜色达到稳定的时间较长, 且最终颜色较浅(灰度值较大). 而随着(+)AuNPs体积的增大, 颜色达到稳定的时间逐渐缩短, 且最终颜色逐渐变深并趋于稳定. 分别将2μL30mg/L的尿酸溶液加入到纸芯片检测区域中, 结果如图3(B)所示. 其中, 0μL(+)AuNPs检测区域的蓝色区域减少值最小, 即灰度值增幅最小, 而随着(+)AuNPs体积的增加, 检测区域的蓝色区域明显减小, 灰度值增幅增大. 这说明(+)AuNPs的加入有效促进了显色液颜色的转化, 使尿酸的检测更灵敏. 当(+)AuNPs的体积增大到2μL后, 灰度值增幅基本不再变化, 因此确定实验中所用(+)AuNPs体积为2μL.
2.4反应条件的优化
2.4.1反应时间的优化将2μL(+)AuNPs和2μL显色液滴加在纸芯片上后, 每隔30s拍照, 绘制检测区域灰度值与时间的关系曲线. 由图4可见, 检测区域灰度值随着氧化反应时间增长逐渐减小, 并在2min后颜色达到稳定的蓝色, 此时即可滴加尿酸试样. 滴加3种不同浓度的尿酸溶液后发现, 尿酸溶液的浓度对还原反应的时间影响不大, 纸芯片检测区域的灰度值均在1.5min后保持稳定, 由此确定拍照时间为滴加尿酸试样1.5min后.
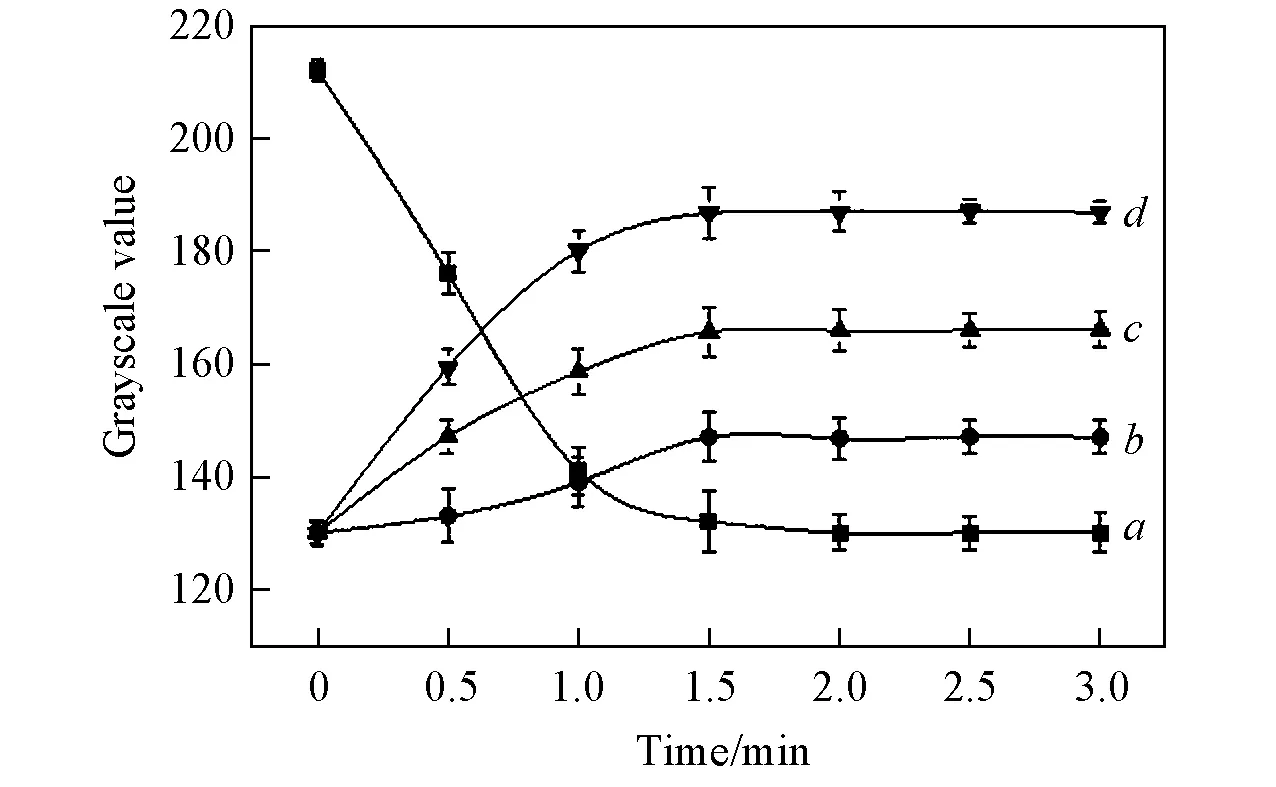
Fig.4 Imaging time for UA detection(n=3)a. TMB substrate; b. UA(25 mg/L); c. UA(50 mg/L); d. UA(75 mg/L).

Fig.5 Effect of temperature on the detection of UA(n=3)
2.4.2反应温度的优化在纸芯片上滴加2μL(+)AuNPs和2μL显色液, 分别在10, 20, 30, 40和50 ℃下反应2min, 然后滴加50mg/L的尿酸溶液, 分别在上述温度下反应1.5min, 结果如图5所示. 在10~40 ℃时, 反应后纸芯片颜色基本一致, 而在50 ℃时, 纸芯片灰度值明显降低. 这可能由于较高的温度使纸芯片纤维结构过于干燥, 导致水相还原反应进行不彻底. 因此, 本方法适合在室温下进行, 无需加热.
2.5干扰实验
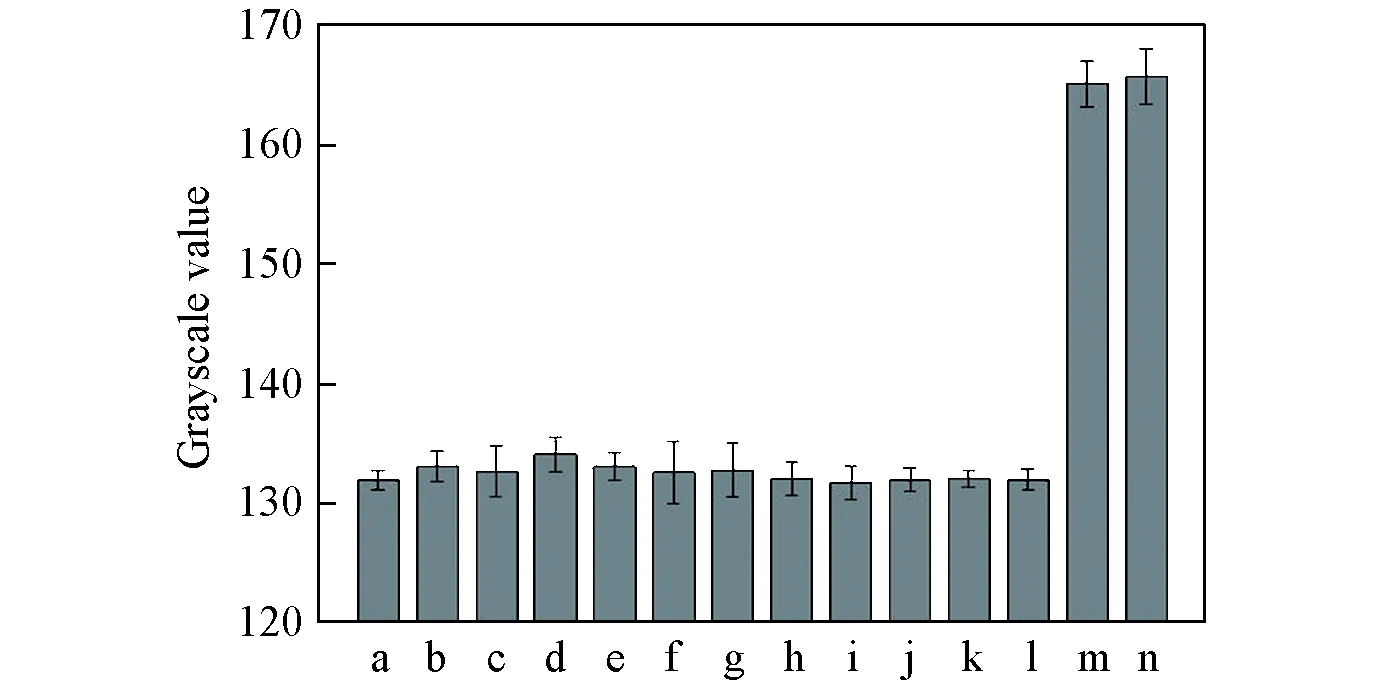
Fig.6 Effects of different substances existing in serum on the UA detection a. Blank; b.1.0 mg/L of inosine; c. 10 mg/L of creatinine; d. 7.0 mg/L of hypoxathine; e. 0.4 mg/L of xanthine; f. 1000 mg/L of glucose; g. 200 mg/L of vitamin C; h—l. 10 mg/L of NO2-, Ca2+, Na+, Cl- and Fe3+; m. 50 mg/L of UA; n. the mixture of all above(n=3).
为了将本方法应用于实际血清样品的检测, 考察了血清中与尿酸结构相近的物质, 如肌苷(Inosine)、 肌酸酐(Creatinine)、 次黄嘌呤(Hypoxanthine)、 黄嘌呤(Xanthine)、 葡萄糖(Glucose)和抗坏血酸(VitaminC)等, 以及各种离子对检测的影响. 所选干扰物的浓度均高于人体正常值[19], 其结果如图6所示. 可见, 在一定浓度下, 各种干扰物质不会与显色液发生明显还原反应, 且尿酸标准溶液及其与各种干扰物的混合溶液的检测结果基本相同, 表明血清中杂质对本方法的干扰较小.
2.6方法的回收率
采用加标回收率考察了血清中尿酸测定的准确度. 取实际血清样本(经HPLC测得尿酸浓度为39.6mg/L), 按3个不同的水平添加尿酸, 以上文中样品预处理及检测方法对加标样本进行测定, 并计算加标回收率, 结果列于表1. 可见, 方法回收率为94.8%~108.5%, 3次平行测定的RSD均小于10%, 表明该方法准确可靠, 可用于实际血清样品的检测.

Table 1 Recovery of UA in serum samples spiked with different concentration of UA standard solution(n=3)
2.7实际血清样品中尿酸的测定

Fig.7 Results of colorimetric assay of UA on paper-based microfluidic chips(A) and the calibration curve(B) #3 and #5 are samples number in Table 2.
采用建立的纸芯片检测方法对8个实际血清样品中尿酸的含量进行了测定, 标准曲线如图7所示, 测定结果列于表2. 由图7(A)可见, 检测区域的蓝色面积随着尿酸标准溶液浓度的增大而减小, 当尿酸浓度在10.6~125mg/L范围内时, 检测区域的灰度值与尿酸浓度呈良好的线性关系(y=0.7135x+129.5, R2=0.9823), 方法的检出限为4.64mg/L(3σ/slope), 低于文献[21,22]报道的酶法检出限. 由表2可见, (+)AuNPs结合显色液在纸芯片上的检测结果与HPLC检测结果基本一致, 进一步表明该方法可用于血清样品的检测.
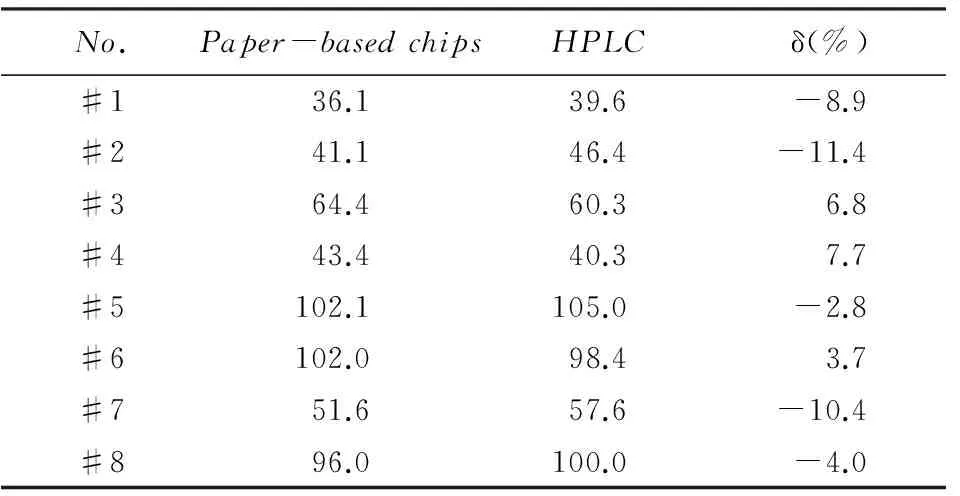
Table 2 Results of determination of UA by paper-based
3结论
利用改装中性笔灌注疏水剂的方法制作纸芯片, 并利用(+)AuNPs结合显色的方法检测人体血清中的尿酸. 与其它检测尿酸的方法相比, 纸芯片的制作方法简单, 疏水效果和分辨率都能满足实验要求; 在纸芯片上利用(+)AuNPs过氧化物模拟酶的特性催化TMB显色的方法检测尿酸, 检出限低于酶法1个数量级, 结果准确; 且该方法不需要复杂昂贵的仪器设备, 可实现多样品的同时测定.
参考文献
[1]MartinezA.W.,PhillipsS.T.,ButteM.J.,WhitesidesG.M., Angew. Chem. Int. Ed., 2007, 46, 1318—1320
[2]MuX.,XinX.L.,FanC.C.,LiX.,TianX.L.,XuK.F.,ZhengZ., Chem. Commun., 2015, 51, 6365—6368
[3]VeigasB.,JacobJ.M.,CostaM.N.,SantosD.S.,ViveirosM.,InácioJ.,MartinsR.,BarquinhaP.,FortunatoE.,BaptistaP.V., Lab on a Chip, 2012, 12, 4802—4808
[4]WangJ.P.,YangL.,LiuB.H.,JiangH.H.,LiuR.R.,YangJ.W.,HanG.M.,MeiQ.S.,ZhangZ.P., Anal. Chem., 2014, 86, 3338—3345
[5]PesentiA.,TaudteR.V.,McCordB.,DobleP.,RouxC.,BlanesL., Anal. Chem., 2014, 86, 4707—4714
[6]SicardC.,GlenC.,AubieB.,WallaceD.,Jahanshahi-AnbuhiS.,PenningsK.,DaiggerG.T.,PeltonR.,BrennanJ.D.,FilipeC.C.D., Water Reaserch, 2015, 70, 360—369
[7]SogaT.,JimboY.,SuzukiK.,CitterioD., Anal. Chem., 2013, 85, 8973—8978
[8]CholevaT.G.,KappiF.A.,GiokasD.L.,VlessidisA.G., Anal. Chim. Acta, 2015, 860, 61—69
[9]XuC.X.,CaiL.F.,ZhongM.H.,ZhengS.Y., RSC Adv., 2015, 5, 4770—4773
[10]HeQ.H.,MaC.C.,HuX.Q.,ChenH.W., Anal. Chem., 2013, 85, 1327—1331
[11]LuY.,ShiW.W.,QinJ.H.,LinB.C., Anal. Chem., 2010, 82, 329—335
[12]SameenoiY.,NongkaiP.N.,NouanthavongS.,HenrybC.S.,NacaprichaD., Analyst, 2014, 139, 6580—6588
[13]OlkkonenJ.,LehtinenK.,ErhoT., Anal. Chem., 2010, 82, 10246—10250
[14]NieJ.F.,LiangY.Z.,ZhangY.,LeS.W.,LiaD.N.,ZhangS.B., Analyst, 2013, 138, 671—676
[15]AbeK.,SuzukiK.,CitterioD., Anal. Chem., 2008, 80, 6928—6934
[16]ChitnisG.,DingZ.W.,ChangC.L.,SavranC.A.,ZiaieB., Lab on a Chip, 2011, 11, 1161—1165
[17]BruzewiczD.A.,RechesM.,WhitesidesG.M., Anal. Chem., 2008, 80, 3387—3392
[18]NieJ.F.,ZhangY.,LinL.W.,ZhouC.B.,LiS.H.,ZhangL.M.,LiJ.P., Anal. Chem., 2012, 84, 6331—6335
[19]ZhaoJ.Y.,LiangQ.L.,LuoG.A.,WangY.M.,ZuoY.J.,JiangM.,YuG.L.,ZhangT., Clinical Chemistry, 2005, 51, 1742—1744
[20]DeviaR.,ThakurbM.,PundirC.S., Biosens. Bioelectron., 2011, 26, 3420—3426
[21]DungchaiaW.,ChailapakulO.,HenryC.S., Anal. Chim. Acta, 2010, 674, 227—233
[22]TarsoG.P.,CardosoT.M.G.,GarciaC.D.,CarrilhoE.,ColtroW.K.T., RSC Adv., 2014, 4, 37637—37644
[23]KumarA.,HensA.,ArunR.K.,ChatterjeeM.,MahatoK.,LayekK.,ChandaN., Analyst, 2015, 140, 1817—1821
[24]JvY.,LiB.X.,CaoC., Chem. Commun., 2010, 46, 8017—8019
[25]LiuJ.T.,LiuZ.F.,HuaX.L.,KongL.,LiuS.P., Luminescence, 2008, 23, 1—6
[26]LiL.,LiB.X.,ChengD.,MaoL.H., Food Chemistry, 2010, 122, 895—900
(Ed.:N,K)
†SupportedbythetheNationalScienceandTechnologyMajorProjectforSignificantNewDrugsDevelopment,China(No.2013ZX09507005),theNationalNaturalScienceFoundationofChina(No.81573397)andtheFundamentalResearchFundsfortheCentralUniversities,China.
doi:10.7503/cjcu20160045
收稿日期:2016-01-18. 网络出版日期: 2016-04-15.
基金项目:国家“重大新药创制”科技重大专项课题(批准号: 2013ZX09507005)、 国家自然科学基金(批准号: 81573397)和中央高校基本科研业务费探索项目资助.
中图分类号O657
文献标志码A
FabricationofPaper-basedMicrofluidicChipsandtheApplicationontheDeterminationofUricAcidinSerumBasedon
GoldNanoparticle-assistedCatalysis†
ZHAOTiantian1,CHENYuqing1,ZHANGMin2*,WANGYuerong1,ZHANGHongyang1,HUPing1*
(1. Shanghai Key Laboratory of Functional Materials Chemistry, School of Chemistry and Molecular Engineering,2. Shanghai Key Laboratory of New Drug Design, School of Pharmacy,East China University of Science and Technology, Shanghai 200237, China)
AbstractA simple and fast method for the determiantion of uric acid(UA) in serum was developed using paper-based microfluidic chips and gold nanoparticles(AuNPs) as peroxidase mimic. The paper-based microfluidic chips were fabricated by directly drawing on filter paper with a modified gel pen filled with hydrophobic solution and then dried. When the AuNPs and the mixed solution of TMB and H2O2 were droped on the detection zone of paper-based microfluidic chips, the colorless TMB was oxidated to blue substance. Then the sample was added onto the blue zone, the blue-oxidated TMB was reducted to colorless. Finally the picture of detection zone could be captured by a mobile phone camera and the concentration of UA could be caclulated according to the gray value of the detection zone. Parameters influencing the UA determination were investigated, including volume of AuNPs, reaction time and temperature. Under the optimized conditions, the detection limit of UA could be reached to 4.64 mg/L, the linear range was from 10.6 mg/L to 125 mg/L and the recovery was from 94.8% to 108.5%. The method could be applied to determining uric acid in serum.
KeywordsPaper-based microfluidic chip; Gold nanoparticles; Uric acid
联系人简介: 胡坪, 女, 博士, 教授, 博士生导师, 主要从事药物分析方面的研究.E-mail:huping@ecust.edu.cn
张敏, 男, 博士, 副教授, 主要从事药物分析方面的研究.E-mail:zhangm@ecust.edu.cn

