外周带前列腺癌与正常组织的广延指数和单指数模型扩散加权成像的比较
张 灵,刘晓航,周良平,刘 颖,毛 健
1. 上海理工大学医疗器械与食品学院,上海 200093;2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
·专题论著·
外周带前列腺癌与正常组织的广延指数和单指数模型扩散加权成像的比较
张 灵1.2,刘晓航2,周良平2,刘 颖1,毛 健2
1. 上海理工大学医疗器械与食品学院,上海 200093;2. 复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
目的:比较前列腺外周带癌与正常组织的广延指数和单指数模型弥散加权成像(diffusionweighted imaging, DWI)参数的差异。方法:25例外周带前列腺癌确诊患者行DWI检查,b值为0、500、1 000、2 000 s/mm2。通过单指数模型计算前列腺癌和正常组织的表观扩散系数(apparent diffusion coefficient,ADC),广延指数模型计算分布扩散系数(distributed diffusion coefficient,DDC)和校正系数α值。比较癌组织与正常组织之间ADC值、DDC值和α值(范围0~1)的差异,评价各组织中ADC值与DDC值的差异和相关性,并比较前列腺癌与正常组织之间ADC值和DDC值标准化差值。结果:共30个前列腺癌病灶、34个正常外周带组织纳入研究。前列腺癌组织ADC值[(0.73±0.14)×10-3mm2/s]、DDC值[(0.62±0.20)×10-3mm2/s]和α值(0.65±0.10)均显著低于正常外周带[(1.43±0.25)×10-3mm2/s、(1.49±0.20)×10-3mm2/s、0.86±0.09;均P<0.05)]。前列腺癌组织的ADC值明显高于DDC值,正常外周带组织的ADC值低于DDC值(均P<0.05)。在前列腺癌及正常组织中,ADC值与DDC值均密切相关(R²=0.98、0.98,均P<0.05),前列腺癌组织的ADC值和DDC值的标准化差值明显高于正常组织。结论:广延指数模型DWI为鉴别前列腺癌与正常组织提供了更多信息,有助于提高前列腺癌的诊断率。
前列腺癌;扩散加权成像;广延指数模型
前列腺癌是老年男性最常见的恶性肿瘤,近年来无论在欧美还是亚洲国家,均有很高的发病率和死亡率[1]。目前,前列腺癌的诊断主要依靠经直肠超声(transrectal ultrasound,TRUS)引导下前列腺穿刺活检与常规MRI,但肿瘤检出率和诊断准确率仍有待提高[2-4]。
近年来,多项MRI新技术尤其从弥散加权成像(diffusion-weighted imaging,DWI)开始在前列腺癌诊断中推广应用,明显提高了前列腺癌的诊断水平。一系列研究已证明,DWI在前列腺癌检测和定位中具有高灵敏度和特异度[5-6]。
目前,计算前列腺组织表观扩散系数(apparent diffusion coefficient,ADC)最常用的方法是单指数模型,公式如下:
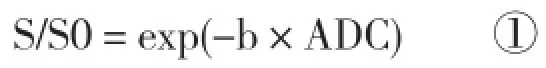
其中S是在不同b值时的信号强度,S0是b= 0 s/mm2时的信号强度,b值为扩散敏感系数。
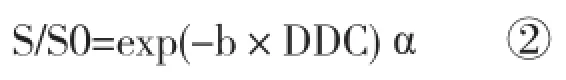
但以往研究表明,前列腺组织的信号随b值升高而发生的衰减并不遵循单指数模型。多项研究表明前列腺组织中水分子扩散包含至少两种成分[7-12],但以上成分形成的原理和机制存在一定争议[13-15]。为解决这一问题,Bennett等[16-17]引入了广延指数模型,计算公式为:
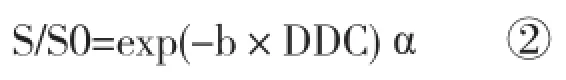
其中S为不同b值时的信号强度,S0是b=0 s/mm2时的信号强度。分布扩散系数(distributed diffusion coefficient,DDC)衡量信号随b值下降时的衰减率,不均匀性指数α描述衰减方式与单指数模型的偏差,α值取0~1之间。当α=1时,组织内水分子的信号衰减完全符合单指数模式;随着α值下降,组织内不同扩散速率的水分子种类增多;α值接近0时,信号衰减则为完全多指数模式。DDC值是常规ADC值经α值校正后的近似值,理论上表示根据所有不同扩散速率的水分子ADC值及其所占比例经加权计算得出的均值[17-19]。
由于人体组织水分子信号衰减通常表现为非单指数方式,广延指数模型仅用两个相关参数就能适用于多种已知的衰减形状,故能最简便地对组织水分子扩散进行更完整和准确的经验描述。
脑肿瘤方面的文献表明,DDC值能提供更多关于肿瘤的信息;且当α值较高时,DDC值与ADC值密切相关,而随着α值下降,DDC与ADC值的相关性也相应下降[18-20]。前列腺广延指数DWI的研究以前仅见1篇报道[12],主要针对计算和测量的可靠性和可重复性进行了研究,且只考察了正常的外周带组织。关于外周带肿瘤与正常组织之间广延指数模型DWI的差异比较国内尚未见报道,因此本研究旨在比较外周带前列腺癌与正常组织之间ADC值、DDC值和α值的差异,探讨各组织中三者的关联,研究区分前列腺癌与正常组织的可行性。
1 资料和方法
1.1 一般资料
于2013年1月—2014年6月对31例经10针穿刺活检确诊的前列腺癌患者行常规MRI+多b值DWI检查,选取25例患者,平均年龄67岁(56~73岁)。中位前列腺特异性抗原(prostate-specific antigen,PSA) 22.3 ng/mL (范围4.7~39.3 ng/mL),Gleason评分3+3~4+5,中位数4+3。
1.2 检查方法
所有患者在检查前半小时内不能排尿。根据MRI图像及穿刺结果将确认为外周带前列腺癌的患者纳入研究,由于DWI的分辨率有限,只有病灶最大径>1 cm的患者才纳入。行MRI扫描和穿刺检查的间隔时间为3~4周。
1.3 仪器和参数
使用GE公司3.0T MRI(Signa HDx)和8通道相控阵表面线圈,扫描范围包括整个前列腺、精囊和膀胱,方向包括横断位、矢状位和冠状位。
T2WI检查序列:快速恢复快速回波脉冲(fast recovery fast spin echo,FRFSE)序列[TR/TE 5 000 ms/87.9 ms,激励次数(number of excitation NEX)4次,层厚4 mm,层间距1 mm]。T1WI检查序列:快速扰相梯度回波(fast spoiled gradient echo,FSPGR)序列(TR/TE 150 ms/3 ms,层厚4 mm,层间距1 mm)。DWI检查序列:单次激发平面成像(single-shot echo-planar imaging,SS-EPI)序列(TR/TE 4 000 ms/71.9 ms,视野260 mm×260 mm,NEX=6,矩阵128×128,层厚4 mm,层间距1 mm)。b值设为0、500、1 000、2 000 s/mm2,使用换算系数为2的并行采集阵列空间敏感度编码技术(array spatialsensitivity encoding technique,ASSET),减少DWI的扫描时间,降低磁敏感伪影。
1.4 图像处理
应用GE公司AW4.6 (Milwaukee,WI)工作站处理DWI图像。由两名分别有8年和18年前列腺MRI和泌尿系统研究经验的放射科医师共同完成。使用定制软件对尿液和前列腺的ADC值、DDC值和α值进行测定。应用公式① 计算ADC值,b值为0和1 000 s/mm2;应用公式② 及扫描时用的所有b值计算DDC值和α值。
将相同温度下的尿液(膀胱内)作为水模验证实验数据,因为尿液信号的衰减方式与纯水相似,接近单指数模型0 (α≈1)。
由放射科医师结合高分辨率T2WI图像和病理结果,在b=0 s/mm2时的DWI图像上区分病灶与正常组织的边缘和形态特征,绘制感兴趣区(region of interest,ROI),有不同意见时协商解决。记录不同b值时每个样本的信号并转换为指数强度,评估信号的衰减是否符合单指数模型。由工作站自动计算组织的ADC值、DDC值和α值,所有数据均测量3次,取平均值。
当勾画尿液ROI时,ROI在膀胱内面积尽可能大,同时避开输尿管开口处尿液流入膀胱造成的涡流伪影。前列腺癌病灶的测量根据穿刺确定位置,在b=0时DWI图像上选取局灶性或弥漫性低信号区为ROI;正常组织则选取外周带完整且高信号区域。对于肿瘤和正常组织的定位,每例患者的前列腺根据常规10针前列腺穿刺活检穿刺部位划分为10个区域,分别为左右尖部、中部左右外周带及中央腺体、底部左右外周带及中央腺体。由于前列腺增生的压缩及肿瘤组织的破坏,部分外周带正常组织无法测量,共计算了34个外周带组织区域的ADC值、DDC值和α值。
1.5 统计学处理
所有数据应用STATA 10.0软件分析,前列腺癌与正常组织之间ADC值、DDC值和α值的差异采用t检验,各组织ADC值与DDC值之间的相关性采用Person相关系数评估。此外,计算各组织样本中ADC值和DDC值的标准化差值,评价不同组织标准化差值的差异,比较不同组织中ADC值与DDC值的差异大小。P<0.05为差异有统计学意义。
2 结 果
共测量和计算25例患者的膀胱内尿液,以及30个前列腺癌组织、34个正常外周带组织的数据。30个病灶大小1~5 cm,平均最大径2 cm。尿液的信号衰减与单指数模型的符合度最高(图1),α值为0.99±0.00,且平均ADC值[(2.28±0.12)× 10-3mm2/s]接近DDC值[(2.31±0.21)×10-3mm2/s]。
前列腺癌的ADC值、DDC值和α值均显著低于正常外周带(均P<0.05),外周带组织的ADC值明显低于DDC值,但前列腺癌的ADC值高于DDC值(均P<0.05)(表1、图2~3)。
所有组织中DDC值与ADC值均密切相关(R²=0.98、0.98,均P<0.05)。但相对于正常组织而言,前列腺癌ADC值与DDC值的标准化差值有增大趋势(图4)。前列腺癌ADC值与DDC值的标准化差值显著高于正常外周带组织(P<0.05)(表1)。
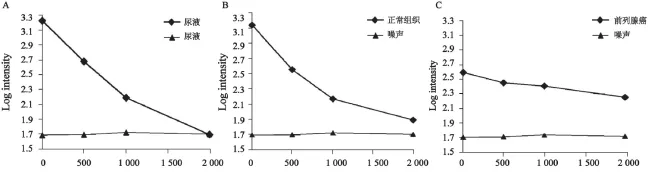
图 1 尿液及前列腺正常组织和癌组织信号(半对数形式)随b值上升的衰减曲线

表 1 前列腺癌与正常外周带组织之间ADC值、DDC值、两者标准化差值、α值的比较
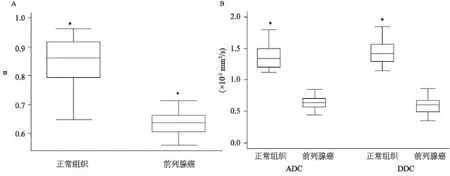
图 2 前列腺癌与正常组织之间α值、ADC值和DDC值的比较
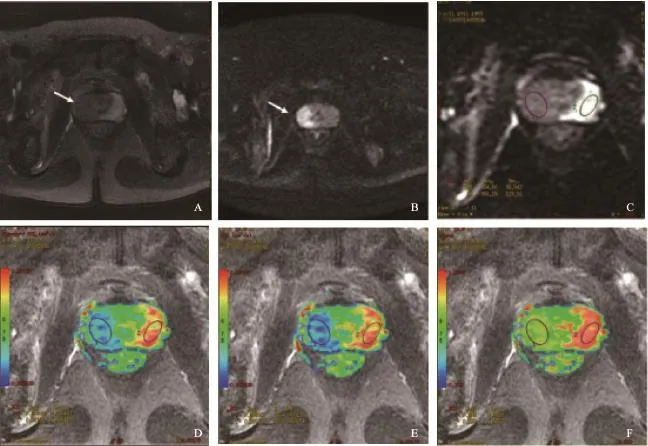
图 3 前列腺癌MRI表现
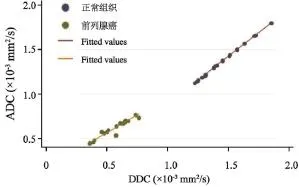
图 4 前列腺癌及正常组织中ADC值与DDC值的相关性散点图
3 讨 论
本研究初步证实了广延指数DWI在前列腺癌及正常组织中应用的可行性,同时发现前列腺癌的α值和DDC值与正常组织有显著差异。在广延指数DWI参数中,α值可定量反映组织内水分子扩散方式与单指数模式的偏差,DDC值可视为由多种不同衰减特性水分子组成的ADC值的加权总和。前列腺癌α值较低,主要原因在于组织的不均匀性。前列腺癌组织内,正常腺体结构破坏,腺泡大小不一,排列紊乱,细胞结构也具有高度异型性,这些细胞和组织内的水分子扩散性质具有更大的多样性。因此,相对于正常前列腺组织,前列腺癌有较低的α值。同时,癌组织内致密的腺体和细胞成分使组织中的水分子活动受限,DDC值降低。
前列腺癌与正常组织之间DDC值和α值的差异提示,广延指数DWI可成为诊断前列腺癌的新方法,α值本身还可独立应用于检测肿瘤内部的坏死区,如果部分区域α值接近1,则可判定内部以液性成分为主,即发生坏死囊变。在测量ADC值和DDC值时,可准确避开此类区域及其产生的误差。
本研究还发现组织DDC值与ADC值密切相关,尤其在尿液中,其DDC值接近ADC值。前列腺组织中,DDC与ADC值则有一定的差异。此外,正常组织的平均DDC值高于ADC值,但前列腺癌的DDC值低于ADC值。
本研究结果可由广延指数模型本身、正常组织和前列腺癌的生物学特性来解释。
第一,公式(1)和(2)表明,当α=1时(无论b或DDC取何值),DDC值=ADC值。尿液中α≈1,ADC值≈DDC值,因为尿液成分接近纯水,信号衰减表现出近似单指数衰减的方式。正常前列腺组织中,ADC值与DDC值也十分接近,主要由于其内部大量充满分泌液的腺体结构,组织成分以自由水为主。肿瘤由于组织结构的不均匀性和低α值,DDC值与ADC值有较大差异。
第二,公式(1)和(2)也表明,当b×DDC=1(无论α值为多少),DDC值≈ADC值 (注:b= 1 000 s/mm2时,DDC或ADC为1×10-3mm2/s,本研究中α值多数>0.6)。前列腺癌的DDC值大多<1×10-3mm2/s,当b=1 000 mm2/s时,b×DDC<1,α值明显<1,ADC值>DDC值。在正常组织和尿液样本中,ADC值与DDC值关系恰恰相反,因为正常组织和尿液的DDC值一般>1×10-3mm2/s,且 b×DDC>1,相应地ADC值<DDC值。
DDC值和ADC值在不同组织内的相对关系,可能对前列腺癌诊断和治疗带来影响。如正常组织中ADC值<DDC值,而前列腺癌中ADC值>DDC值,且具有较高的差异(9.1%),因此正常组织与前列腺癌之间ADC值差距要小于DDC值,ADC值区分肿瘤与正常组织的效能可能减低。此外,前列腺癌经有效治疗后,ADC值和DDC值上升,但治疗前后ADC值差距小于DDC值,导致治疗效果被低估。因此,引入α值来修正ADC值可提高前列腺癌检测的敏感性,且可评估治疗效果。
本研究结果与以往脑部研究较接近[19-20],肿瘤组织中ADC值与DDC值也有一定的偏离,且偏离度随α值下降而增大。但与本研究相比,这些研究中ADC值与DDC值的差值较大。原因可能主要有以下几点:首先,前列腺癌很少有严重的出血和坏死,结构比脑肿瘤组织更均匀。其次,本研究计算时使用的b值较低,当b>3 000 mm2/s时,多指数扩散衰减更显著。本研究中由于信噪比的限制,使用的最高b值仅为2 000 mm2/s,可能限制了更准确的多指数扩散数据的获取。
本研究存在一定的局限性。研究样本较小,需进一步大样本研究以验证广延指数DWI参数在前列腺癌诊断中的作用;勾画前列腺癌ROI主要以T2WI图像为参照,测量时无法避免将正常前列腺组织ROI混入,造成干扰;理论上,DDC值比ADC值更能精确描述组织中水的扩散方式,但这一结论尚未得到组织病理学相关研究的证实。
本研究初步证实了广延指数DWI在前列腺癌及正常组织中应用的可行性,同时发现前列腺癌的α值与DDC值明显低于正常组织。因此,在鉴别前列腺良恶性病变时,广延指数模型能提供更多诊断信息。此外,前列腺癌和正常组织中ADC值与DDC值密切相关,但存在不同程度的差异。
[1] JEMAL A, CENTER M M, DESANTIS C, et al. Global patterns of cancer incidence and mortality rates and trends [J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(8):1893-1907.
[2] WILKINSON B A, HAMDY F C. State-of-the-art staging in prostate cancer [J]. BJU Int, 2001, 87(5): 423-430.
[3] QUINT L E, VAN ERP J S, BLAND P H, et al. Prostate cancer: correlation of MR images with tissue optical density at pathologic examination [J]. Radiology, 1991,179(3): 837-842.
[4] IKONEN S, KIVISAARI L, TERVAHARTIALA P,et al. Prostatic MR imaging. Accuracy in differentiating cancer from other prostatic disorders [J]. Acta Radiol,2001, 42(4): 348-354.
[5] MIAO H, FUKATSU H, ISHIGAKI T. Prostate cancer detection with 3-T MRI: comparison of diffusionweighted and T2-weighted imaging [J]. Eur J Radiol,2007, 61(2): 297-302.
[6] KIM C K, PARK B K, LEE H M, et al. Value of diffusion-weighted imaging for the prediction of prostate cancer location at 3T using a phased-array coil:preliminary results [J]. Invest Radiol, 2007, 42(12): 842-847.
[7] GIBBS P, LINEY G P, PICKLES M D, et al. Correlation of ADC and T2 measurements with cell density in prostate cancer at 3.0 Tesla [J]. Invest Radiol, 2009, 44(9): 572-576.
[8] ZELHOF B, PICKLES M, LINEY G, et al. Correlation of diffusion-weighted magnetic resonance data with cellularity in prostate cancer [J]. BJU Int, 2009, 103(7):883-888.
[9] JUNG D C, LEE H J, SEO J W, et al. Diffusionweighted imaging of a prostate cancer xenograft model seen on a 7 Tesla animal MR scanner: comparison of ADC values and pathologic findings [J]. Korean J Radiol, 2012, 13(1): 82-89.
[10] LIU X, PENG W, ZHOU L, et al. Biexponential apparent diffusion coefficients values in the prostate:comparison among normal tissue, prostate cancer, benign prostatic hyperplasia and prostatitis [J]. Korean J Radiol,2013, 14(2): 222-232.
[11] MULKERN R V, BARNES A S, HAKER S J, et al. Biexponential characterization of prostate tissue water diffusion decay curves over an extended b-factor range [J]. Magn Reson Imaging, 2006, 24(5): 563-568.
[12] LIU X, ZHOU L, PENG W, et al. Differentiation of central gland prostate cancer from benign prostatic hyperplasia using monoexponential and biexponential diffusion-weighted imaging [J]. Magn Reson Imaging,2013, 31(8): 1318-1324.
[13] LE BIHAN D. The ‘wet mind’: water and functional neuroimaging [J]. Phys Med Biol, 2007, 52(7): R57-R90.
[14] THELWALL P E, GRANT S C, STANISZ G J, et al. Human erythrocyte ghosts: exploring the origins of multiexponential water diffusion in a model biological tissue with magnetic resonance [J]. Magn Reson Med,2002, 48(4): 649-657.
[15] SEHY J V, ACKERMAN J J, NEIL J J. Evidence that both fast and slow water ADC components arise from intracellular space [J]. Magn Reson Med, 2002, 48(5):765-770.
[16] BENNETT K M, HYDE J S, SCHMAINDA K M. Water diffusion heterogeneity index in the human brain is insensitive to the orientation of applied magnetic field gradients [J]. Magn Reson Med, 2006, 56(2): 235-239.
[17] BENNETT K M, SCHMAINDA K M, BENNETT R T,et al. Characterization of continuously distributed cortical water diffusion rates with a stretched-exponential model [J]. Magn Reson Med, 2003, 50(4): 727-734.
[18] KWEE T C, GALBAN C J, TSIEN C, et al. Comparison of apparent diffusion coefficients and distributed diffusion coefficients in high-grade gliomas [J]. J Magn Reson Imaging, 2010, 31(3): 531-537.
[19] KWEE T C, GALBAN C J, TSIEN C, et al. Intravoxel water diffusion heterogeneity imaging of human highgrade gliomas [J]. NMR Biomed, 2010, 23(2): 179-187.
[20] BENNETT K M, HYDE J S, RAND S D, et al. Intravoxel distribution of DWI decay rates reveals C6 glioma invasion in rat brain [J]. Magn Reson Med, 2004,52(5): 994-1004.
Comparison of stretched-exponential and monoexponential models of diffusion-weighted imaging between prostate cancer and normal tissues
ZHANG Ling1.2, LIU Xiaohang2, ZHOU Liangping2, LIU Yin1, MAO Jian2
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Department of Radiology, Fudan University Shanghai Cancer Center; Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China)
Correspondence to: ZHOU Liangping E-mail: zhoulp2003@aliyun.com
Objective: To compare the parameters of stretched-exponential and monoexponential models of diffusionweighted imaging (DWI) between prostate cancer and normal tissues. Methods: Twenty-five patients with peripheral zone prostate cancer underwent DWI exam using b-values of 0, 500, 1 000, and 2 000 s/mm2. The distributed diffusion coefficient (DDC) and α values of prostate cancer and normal tissues were obtained using stretched-exponential model and apparent diffusion coefficient (ADC) values were obtained using monoexponential model. The ADC, DDC (both in 10-3mm2/s) and α values (range 0-1) were compared between prostate cancer and normal tissues. The ADC and DDC values were compared and correlated in each tissue, and the standardized differences between DDC and ADC values were compared between prostate cancer and normal tissues. Results:Data were obtained from 30 lesions and 34 normal peripheral zone tissue. The ADC (0.73±0.14), DDC (0.62±0.20) and α values (0.65±0.10) of tumor were all significantly lower than those of the normal tissues (1.43±0.25, 1.49±0.20 and 0.86±0.09) (all P<0.05). ADC value was significantly higher than DDC value in tumor but lower than DDC value in normal tissue (all P<0.05). ADC value and DDC value were significantly correlated (R2=0.98, 0.98, respectively; P<0.05) in prostate cancer and normal tissues, and the standardized difference between ADC value and DDC value in tumor was significantly higher than that in normal tissue. Conclusion:The stretched-exponential model of DWI provides more parameters for prostate cancer and normal tissues and would improve the diagnosis of prostate cancer.
Prostate cancer; Diffusion-weighted imaging; Stretched-exponential model
R445.2
A
1008-617X(2016)02-0131-06
周良平 E-mail:zhoulp2003@aliyun.com
2015-10-18)

