利拉鲁肽联合二甲双胍对2型糖尿病合并非酒精性脂肪肝病肝脂肪变的影响
郭伟,高明松,彭聪,李伟,周杨
(湖北省武汉市第一医院 内分泌科,湖北 武汉 430022)
利拉鲁肽联合二甲双胍对2型糖尿病合并非酒精性脂肪肝病肝脂肪变的影响
郭伟,高明松,彭聪,李伟,周杨
(湖北省武汉市第一医院 内分泌科,湖北 武汉 430022)
摘要:目的探讨利拉鲁肽联合二甲双胍对2型糖尿病(T2DM)合并非酒精性脂肪肝病(NAFLD)患者血清肿瘤坏死因子-α(TNF-α)及肝脂肪变的影响。方法选取T2DM合并NAFLD患者42例,随机分为治疗组与对照组,每组各21例。治疗组予以利拉鲁肽联合二甲双胍治疗,对照组予以甘精胰岛素联合二甲双胍治疗,疗程12周。治疗前及治疗12周后,所有患者行肝脏CT检查,比较两组生化指标及TNF-α变化。结果治疗12周后,与治疗前比较,治疗组体重指数(BMI)、三酰甘油(TG)、血清总胆固醇(TC)、TNF-α均降低,治疗组总有效率高于对照组;与对照组治疗后比较,治疗组BMI、TG、TC、TNF-α降低,总有效率升高,差异有统计学意义(P<0.05)。治疗组肝脂肪变的程度与BMI、TG、TC、TNF-α呈正相关(P<0.05)。结论利拉鲁肽联合二甲双胍治疗T2DM合并NAFLD疗效明确,能降低TNF-α水平,减少肝脏脂肪变程度,且低血糖发生率低,疗效优于甘精胰岛素联合二甲双胍。
关键词:利拉鲁肽;二甲双胍;2型糖尿病;非酒精性脂肪肝病;肝脂肪变
近年来,随着人们生活质量的提高和饮食结构的改变,2型糖尿病(type 2 diabetes,T2DM)、非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)的发病率呈逐年增加的趋势。利拉鲁肽是成人2型糖尿病的治疗新药,目前国内有关利拉鲁肽治疗T2DM临床疗效的研究较多集中在降糖疗效及安全性方面,对2型糖尿病合并NAFLD的疗效观察较少。因此,本研究以甘精胰岛素为对照,采用肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等指标结合肝脏CT检查评价利拉鲁肽联合二甲双胍治疗T2DM合并NAFLD的临床疗效,为临床治疗T2DM合并NAFLD提供新的临床思路。
1 资料与方法
1.1病例资料
选取2014年1月-2015年12月湖北省武汉市第一医院内分泌科诊治的T2DM合并NAFLD患者42例。纳入标准:①符合2型糖尿病诊断标准[1],按照2010年版中国2型糖尿病防治指南的诊断标准。②符合NAFLD超声诊断标准[2],肝脏超声检查具备≥2项表现者为弥漫性脂肪肝,a.肝脏近场回声弥漫性增强,回声强于肾脏;b.肝内管道结构显示不清;c.肝脏远场回声逐渐衰减。③符合以下条件:a.年龄18~70岁;b.近3月内未使用调脂药物;c.既往未使用过胰岛素治疗,糖化血红蛋白(Hemoglobin A1c,HbA1c)8%~12%,餐后2 h血糖-空腹血糖(fasting blood glucose,FBG)的差值≤6mmo1/L;d.既往使用二甲双胍联合其他降糖药物(包括磺脲类促泌剂、非磺脲类促泌剂、糖苷酶抑制剂)≥3个月,仍血糖控制不佳者;e.患者签署知情同意书。排除标准:①病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;②糖尿病合并急性并发症;③过量酒精摄入者(饮酒量折合乙醇量:男性>140g/周,女性>70g/周);④心、肝、肾功能不全患者;⑤合并严重的高血压、冠状动脉粥样硬化性心脏病、肺源性心脏病等内科基础疾病患者;⑥妊娠期、哺乳期妇女;⑦精神病患者。随机分为治疗组和对照组。其中,治疗组21例,男性12例,女性9例;年龄42~68岁,平均(52.9±13.8)岁。对照组21例,男性13例,女性8例;年龄43~69,平均(53.2±14.1)岁。两组患者均能够生活自理,无功能障碍。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。
1.2治疗方法
治疗期间,治疗组及对照组均进行T2DM、NAFLD的健康教育。控制饮食,包括严格禁酒,总热量摄入≤125.52kJ(kg/·d)。改变饮食组分,无糖低脂的平衡膳食,中等量有氧运动,有氧运动>4次/周,累计锻炼时间150 min/周。治疗组给予利拉鲁肽注射液(商品名:诺和力,丹麦诺和诺德公司,规格:3 mg/支)0.6 mg,1周后改为1.2 mg,每晚10∶00皮下注射。对照组给予甘精胰岛素注射液(商品名:来得时,赛诺菲公司,规格:300 IU/支),起始剂量0.2u/(kg·d),每晚10∶00皮下注射。根据血糖水平调整利拉鲁肽或甘精胰岛素剂量,直至空腹血糖6~8 mmo1/L,餐后2 h血糖8~10mmol/L。两组患者均联合二甲双胍(上海施贵宝药厂,500 mg/粒,国药准字H20023370)500mg口服,3次/d,疗程为12周。每4周复诊1次,检测指尖末梢血糖,并对不良事件进行记录。
1.3观测指标
治疗前后,测量受试者的身高、体重等,计算体重指数(body mass index,BMI)。受试者均隔夜空腹12 h,清晨静脉采血5 ml,用于测FBG、三酰甘油(Triglyceride,TG)、血清总胆固醇 (serum total cholesterol,TC)、HbA1c、TNF-α。FBG测定采用氧化酶法,试剂盒购自上海科华生物工程股份有限公司;TG、TC采用酶比色法,试剂盒购自宁波瑞源生物科技有限公司;FBG、TG、TC采用美国贝克曼公司的AU2700生化分析仪进行检查;HbA1c采用高效液相色谱法,由美国伯乐公司的D10糖化血红蛋白分析仪进行检查;TNF-α测定用化学发光法,采用德国西门子Immulite 1000化学发光免疫分析仪进行检查。以上检测均由专人严格按照试剂盒说明书进行操作,试剂盒批内变异系数(coefficient variation,CV)及批间CV<10%。
1.4疗效标准
CT判断肝脂肪变的标准为肝脏密度弥漫性降低,肝脏与脾脏的CT值之比≤1.0即可诊断脂肪肝[2]。①轻度:肝/脾CT比值0.7~<1.0;②中度:肝/脾CT比值0.5~<0.7;③重度:肝/脾CT比值≤0.5。①显效:CT显示肝/脾CT比值>1.0,或由重度转为轻度。②有效:CT分度减轻一级。③无效:未达到上述显效或有效标准。总有效率=(显效例数+有效例数)/总例数×100%。
1.5安全性评价
治疗期间,于患者复诊时记录生命体征(心率、呼吸、血压、体温)、药物不良反应量表,行体格检查、实验室检查(血常规、血生化、尿常规、心脏彩超、12导联心电图等检查等),记录低血糖发生情况(指尖血糖≤3.9mmol/L),计算低血糖发生率,低血糖发生率=(低血糖发生例数/总例数)×100%。
1.6统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,计数资料以率表示,用χ2检验,相关性分析用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1一般情况和生化指标比较
治疗前,对照组和治疗组所有数据比较,差异无统计学意义(P>0.05)。对照组FBG、HbA1c、TG、TC、TNF-α与治疗前比较,经t检验,差异有统计学意义(P<0.05),对照组FBG、HbA1c、TG、TC、TNF-α较治疗前降低。治疗组BMI、FBG、HbA1c、TG、TC、TNF-α与治疗前比较,经t检验,差异有统计学意义(P<0.05),治疗组BMI、FBG、HbA1c、TG、TC、TNF-α较治疗前降低。治疗12周后,治疗组BMI、TG、TC、TNF-α与对照组比较,经t检验,差异有统计学意义(P<0.05),治疗组BMI、TG、TC、TNF-α均降低。治疗12周后,两组FBG、HbA1c比较,经t检验,差异无统计学意义(P>0.05)。见表1。
表1 两组临床指标治疗前后比较 (n=21±s)
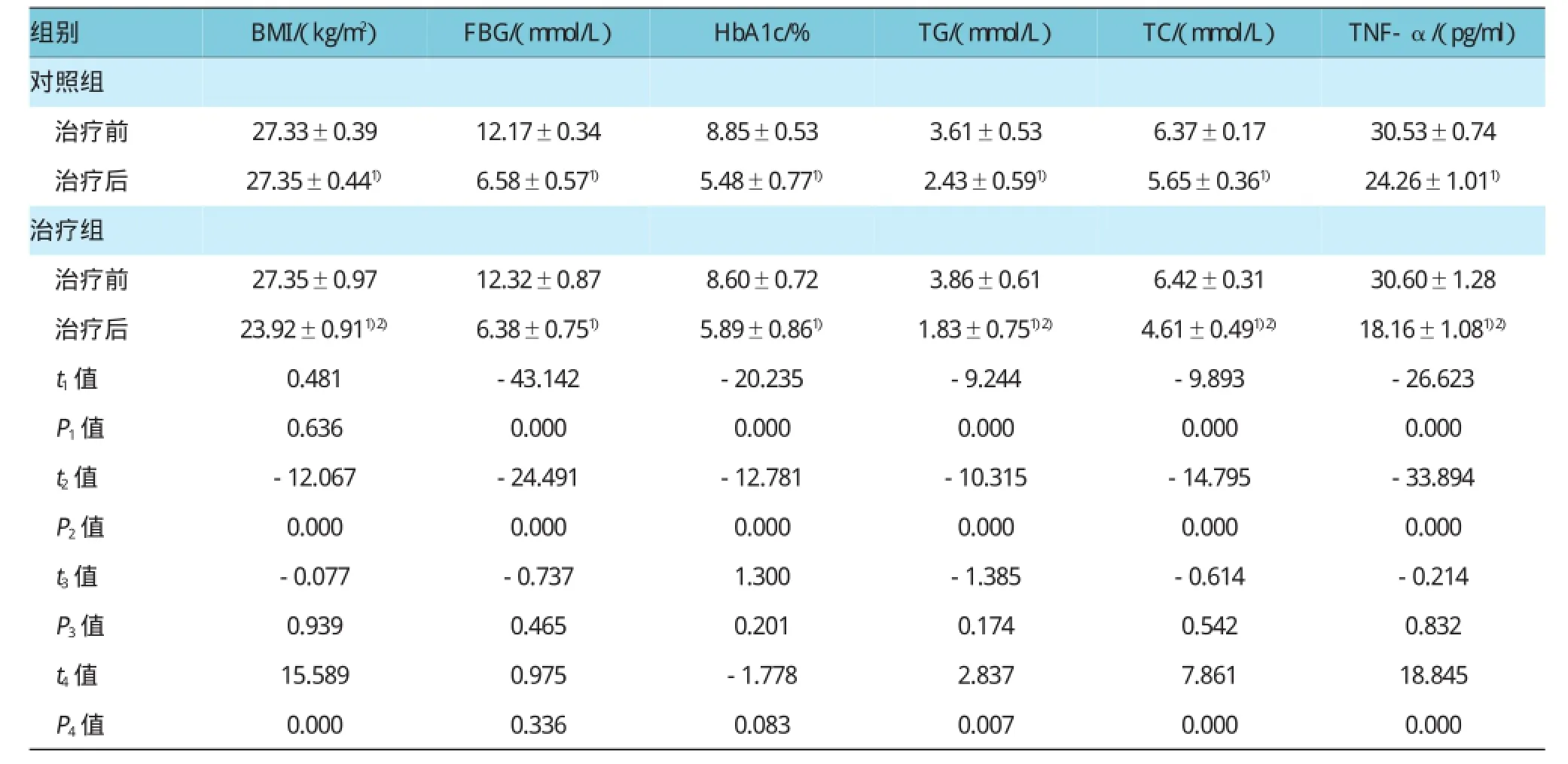
表1 两组临床指标治疗前后比较 (n=21±s)
注:1)与治疗前比较,P<0.05;2)与对照组比较,P<0.05;t1值、P1值:对照组治疗前后比较;t2值、P2值:治疗组治疗前后比较;t3值、P3值:治疗前治疗组与对照组比较;t4值、P4值:治疗后治疗组与对照组比较
组别BMI/(kg/m2)FBG/(mmol/L)HbA1c/% TG/(mmol/L)TC/(mmol/L)TNF-α/(pg/ml)对照组治疗前27.33±0.39 12.17±0.34 8.85±0.53 3.61±0.53 6.37±0.17 30.53±0.74治疗后 27.35±0.441) 6.58±0.571) 5.48±0.771) 2.43±0.591) 5.65±0.361) 24.26±1.011)治疗组治疗前27.35±0.97 12.32±0.87 8.60±0.72 3.86±0.61 6.42±0.31 30.60±1.28治疗后 23.92±0.911)2) 6.38±0.751) 5.89±0.861) 1.83±0.751)2) 4.61±0.491)2) 18.16±1.081)2)t1值 0.481 -43.142 -20.235 -9.244 -9.893 -26.623 P1值 0.636 0.000 0.000 0.000 0.000 0.000 t2值 -12.067 -24.491 -12.781 -10.315 -14.795 -33.894 P2值 0.000 0.000 0.000 0.000 0.000 0.000 t3值 -0.077 -0.737 1.300 -1.385 -0.614 -0.214 P3值 0.939 0.465 0.201 0.174 0.542 0.832 t4值 15.589 0.975 -1.778 2.837 7.861 18.845 P4值 0.000 0.336 0.083 0.007 0.000 0.000
2.2肝脂肪变程度比较
治疗12周后,对照组总有效率为57.14%,低于治疗组的85.71%(P<0.05)。见表2。
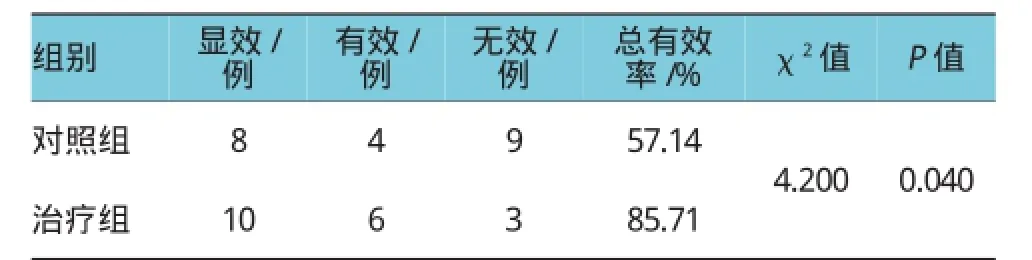
表2 两组肝脂肪变程度比较 (n=21)
2.3两组不良反应发生率比较
治疗过程中,对照组不良反应发生率为9.52%,低于治疗组的28.57%(P<0.05)。见表3。
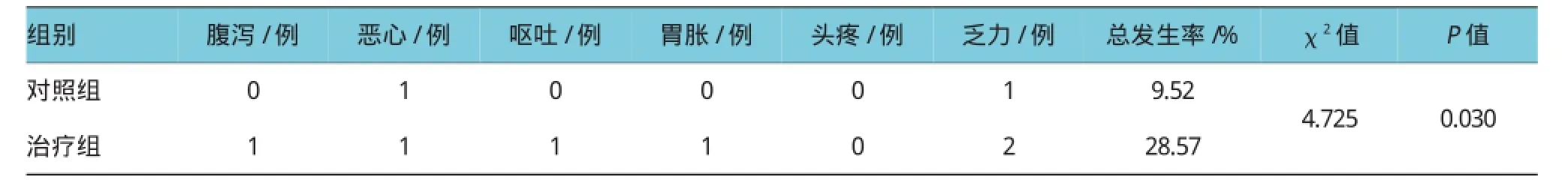
表3 两组不良反应发生率比较 (n=21)
2.4相关性分析
Spearman等级相关分析显示,治疗组肝脂肪变的程度与BMI、TG、TC、TNF-α呈正相关(P<0.05),与其他指标无关。见表4。
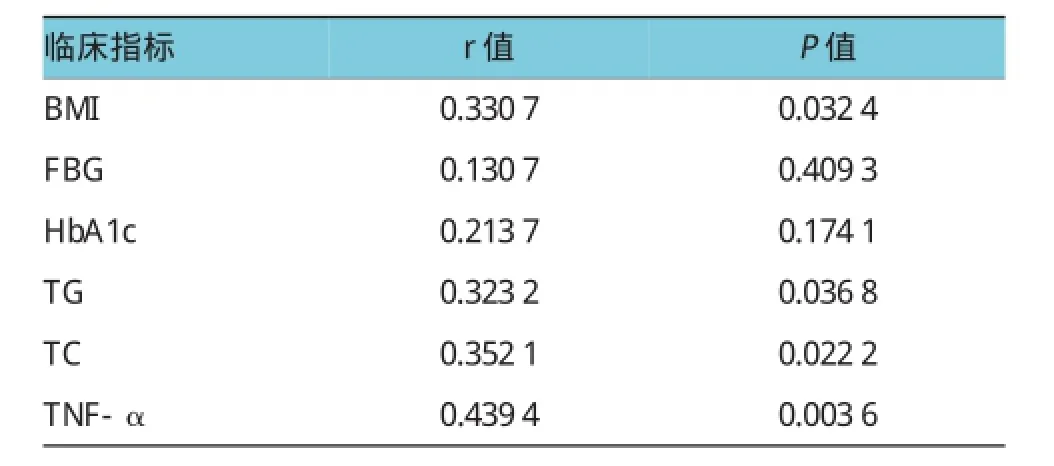
表4 临床指标与肝脂肪变程度的相关性分析
3 讨论
众所周知,国内外指南推荐的T2DM治疗一线用药是二甲双胍,其可以改善外周和肝脏胰岛素敏感性,减少肝脏脂肪累积,减轻脂肪对肝细胞的损伤,降低炎症因子TNF-α水平,改善胰岛素抵抗(insulin resistance,IR)[3],所以也用于NAFLD的治疗[2]。尽管二甲双胍在T2DM治疗中作为一线选择,但仍有大量患者不能通过单一治疗达到目标血糖。美国糖尿病研究协会和欧洲糖尿病研究协会推荐,HbA1c>8.5%的患者应早期使用联合降糖方案,而美国内分泌医师协会则推荐,HbA1c 7.6%~9.0%时,即开始采用联合疗法[4]。胰岛素作为降糖最有效的联用药物之一,具有水钠潴留、增加体重、易出现低血糖的风险,加重IR,所以亟需能够克服这些不足的药物出现,联合二甲双胍治疗T2DM合并NAFLD。
利拉鲁肽是胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)类似物,与天然GLP-1有97%的同源性,2011年正式在中国上市。研究表明,利拉鲁肽通过葡萄糖浓度依赖性促胰岛素分泌、抑制胰高血糖素的生成、增加饱腹感、延迟胃排空、抑制食欲等方式降血糖,同时还可刺激胰岛β细胞新生并抑制其凋亡,对β细胞具有明显的保护作用。与传统降糖药相比,具有低血糖风险小、减轻体质量、保护胰岛β细胞功能等优点[5]。最近研究表明,GLP-1可通过增加脂肪酸氧化,改善肝脏的胰岛素敏感性及肝脂肪病变,降低体质量和低血糖发生率,对非酒精性脂肪肝起到明显的改善作用[6]。本研究中,治疗12周后,治疗组BMI、TG、TC、TNF-α均较对照组明显下降,总有效率较对照组明显升高,提示利拉鲁肽联合二甲双胍治疗,能更有效地调节糖脂代谢紊乱,减轻肝脂肪变程度及肝脏炎症损伤,并且更有效地减轻体重,与国内外多个相关研究结果一致[7-8]。
大量研究表明,细胞免疫和细胞内环境改变导致的代谢慢性炎症反应与T2DM关系密切,T2DM是以炎性标志物升高为特征的一种慢性低度炎症状态[9]。炎症反应同样与NAFLD关系密切,脂质代谢紊乱及IR导致肝细胞内脂肪酸和TG沉积,在此基础上发生氧化应激和脂质过氧化反应,造成肝细胞脂肪变性和炎症反应,最终导致肝细胞的变性、坏死和纤维化,相较而言,脂肪变性危害较小,而炎症反应却可导致不可逆的肝脏损伤[10]。T2DM合并NAFLD患者在内脏脂肪沉积初期,因内脏脂肪周围较皮下脂肪存在更密集的血管,有更高的代谢活性,易产生更多的TNF-α等炎症因子[11]。所以T2DM合并NAFLD患者TNF-α水平明显高于正常人群。升高的TNF-α可促进IR形成,诱导细胞炎症因子生成,聚集炎症细胞破坏肝细胞,诱导肝脂肪变及炎症反应加重,最终导致肝纤维化。大量研究显示,内脏脂肪含量与TNF-α等炎症因子呈正相关[12],与本研究结果一致。本研究中,利拉鲁肽联合二甲双胍治疗组肝脂肪变的程度与TNF-α呈正相关,提示炎症因子TNF-α与T2DM合并NAFLD患者肝脂肪变的发生、发展可能密切相关,减少TNF-α的分泌或抑制其活性,可改善T2DM合并NAFLD患者肝脂肪变状况,有望成为T2DM合并NAFLD治疗的新靶点。
综上所述,利拉鲁肽联合二甲双胍治疗T2DM合并NAFLD,两药联合从不同的病理生理环节改善糖脂代谢及肝脏IR,降低炎症因子TNF-α的水平,与甘精胰岛素联合二甲双胍比较,可以更有效调节糖脂代谢紊乱、减少肝脂肪变程度及肝脏炎症损伤。利拉鲁肽联合二甲双胍治疗T2DM合并NAFLD疗效明确,优于甘精胰岛素联合二甲双胍,低血糖风险低。利拉鲁肽与胰岛素治疗比较,在血糖控制方面差异无统计学意义,可以作为T2DM合并NAFLD治疗的一线用药。美中不足的是,本研究中,利拉鲁肽联合二甲双胍治疗组不良反应发生率略高于对照组,不良反应主要发生在治疗起始时,少数患者出现恶心、呕吐等胃肠道症状,2~4周症状自行缓解,不需要特殊处理。但本研究样本较小,未设利拉鲁肽单药对照组,且观察时间较短,利拉鲁肽联合二甲双胍治疗T2DM合并NAFLD的远期疗效尚需要进一步观察。
参考文献:
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版)[J].中国糖尿病杂志,2012,20(1):S1-S37.
[2]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病的诊疗指南(2010年修订版)[J].中华肝脏病杂志, 2010,18(3):163-166.
[3]张森,郭毅飞,时立新,等.二甲双胍和吡格列酮对初诊糖代谢异常伴腹型肥胖患者血清ghrelin水平的影响[J].中华糖尿病杂志, 2012,4(5):282-285.
[4]DEROSA G,GIUSEPPE D,PAMELA M.Patient considerations and clinical utility of a fixed dose combination of saxagliptin/ metformin in the treatment of type 2 diabetes[J].Diabetes Metab Syndr Obes 2011,4(30):263-271.
[5]DHARMALINGAM M,SRIRAM U,BARUAH MP.Liraglutide:a review of its therapeutic use as a once daily GLP-1 analog for the management of type 2 diabetes mellitus[J].IndianJ Endocrinol Metab,2011,15(1):9-17.
[6]MONJI A,MITSUI T,BANDO Y K,et al.Glucagon-like peptide-1 receptor activation reverses cardiac remodeling via normalizing cardiac steatosis and oxidative stress in type 2 diabetes[J]. Am J Physiol Heart Circ Physio1,2013,305(3):H295-H304.
[7]金惠琳,赵红燕,李媛红,等.利拉鲁肽在2型糖尿病合并脂肪肝治疗中的临床观察[J].哈尔滨医药,2014,34(4):279-281.
[8]NAUCK M,FRID A,HERMANSEN K,et al.Long-term efficacy and safety comparison of liraglutide,glimepiride and placebo,all in combination with metformin in type 2 diabetes:2-year results from the LEAD-2 study[J].Diabetes Obes Metab,2013,15(3): 204-212.
[9]沈寒蕾,赖战峰,谭晓丹,等.2型糖尿病患者血浆内脂素与炎症因子的相关性研究[J].中国现代医学杂志,2012,22(7):44-47.
[10]BIEGHS V,WOUTERS K,PATRIEK J,et al.Role of scavengerreceptorAandCD36indiet-inducednonalcoholic steatohepatitis in hyperlipidemic mice[J].Gastroenterology,2010, 138(7):2477-2486.
[11]WANG B,WOOD I S,TRAYHURN P.Hypoxia induces leptin gene expression and secretion in human preadipocytes:differen tial effects of hypoxia on adipokine expression by preadipocytes[J]. Journal of Endocrinology,2008,198(1):127-134.
[12]BAHCECI M,GOKALP D,BAHCECI S,et al.The correlation between adiposity and adiponectin,tumor necrosis factor alpha, interleukin-6 and high sensitivity C-reactive protein levels.Is adipocyte size associated with inflammation in adults[J].Journal of Endocrinological Investigation,2007,30(3):210-214.
(童颖丹编辑)
中图分类号:R 575.5;R 587.1
文献标识码:B
DOI:10.3969/j.issn.1005-8982.2016.13.021
文章编号:1005-8982(2016)13-0107-05
收稿日期:2015-12-28
Effects of Liraglutide combined with Metformin in type 2 diabetic patients with nonalcoholic fatty liver disease
Wei Guo,Ming-song Gao,Cong Peng,Wei Li,Yang Zhou
(Department of Endocrinology,the First Hospital of Wuhan,Wuhan,Hubei 430022,China)
Abstract:Objective To investigate the effects of Liraglutide combined with Metformin on the serum TNF-α and liver steatosis in type 2 diabetic patients with nonalcoholic fatty liver disease.Methods Forty type 2 diabetic patients with nonalcoholic fatty liver disease were randomly divided into two groups:control group(n =21),received insulin glargine combined with Metformin for 12 weeks;the treatment group(n=21),received Liraglutide combined with Metformin for 12 weeks.Hepatic CT was performed for all the patients,and TNF-α and biochemical parameters were measured before treatment and 12 weeks after treatment. Results BMI,TG,TC and TNF-α in the treatment group were significantly decreased after treatment compared to the original values(P <0.05).The total effective rate of the treatment group was higher than that of the control group(P <0.05).Correlation analysis showed that the degree of liver steatosis was positively correlated with BMI,TG,TC and TNF-α(P <0.05).Conclusions Liraglutide combined with Metformin is effective in the treatment of type 2 diabetes with nonalcoholic fatty liver disease.
Keywords:Metformin;Liraglutide;type 2 diabetes;nonalcoholic fatty liver disease;liver steatosis

