水肥耦合效应对楸树苗期叶片净光合速率和SPAD值的影响
邱 权,李吉跃,*,王军辉,何 茜,苏 艳,马建伟,董菊兰
1 华南农业大学林学与风景园林学院, 广州 510642 2 中国林业科学研究院林业研究所, 国家林业局林木培育重点实验室, 北京 100091 3 甘肃省小陇山林业科学研究所,天水 741022
水肥耦合效应对楸树苗期叶片净光合速率和SPAD值的影响
邱权1,李吉跃1,*,王军辉2,何茜1,苏艳1,马建伟3,董菊兰3
1 华南农业大学林学与风景园林学院, 广州510642 2 中国林业科学研究院林业研究所, 国家林业局林木培育重点实验室, 北京100091 3 甘肃省小陇山林业科学研究所,天水741022
摘要:以楸树无性系004- 1苗木为研究对象,采用三因素五水平二次回归通用旋转组合设计,通过盆栽试验测定不同处理下楸树苗木叶片净光合速率(Pn)和SPAD值,并建立其与土壤水分(W)、施氮量(N)和施磷量(P)回归模型,分析土壤水分、施氮量和施磷量的主因子、单因素及耦合效应对楸树苗木叶片Pn和SPAD值的影响。研究结果表明:(1)W和N对楸树苗木叶片Pn和SPAD均有显著正效应,并且N主效应大于W,而施磷量主效应不显著;(2)单因素效应分析结果表明,楸树苗木叶片Pn和SPAD值随着N的增加均呈现出先增大后减小的变化趋势,与N类似,叶片Pn和SPAD值对W的响应曲线也呈现出类似的“抛物线式”变化趋势;(3)W×N对楸树苗木Pn和SPAD值均存在显著耦合正效应,但Pn和SPAD值与W×N的响应曲面关系图有所不同:随着土壤水分和施氮量的同时增加,叶片Pn逐渐增加,而叶片SPAD值呈现出先增加后减小的变化趋势;(4)楸树苗木叶片Pn与SPAD值呈现出极显著正相关关系(P<0.0001)。总体而言,与土壤水分和施磷量相比,楸树生长更容易受土壤施氮量限制,此外,通过合理水肥配施措施,能一定程度提高楸树苗木的光合生产力和叶片SPAD值。
关键词:水肥耦合;叶片;净光合速率;SPAD;楸树
叶片是植物进行光合作用的主要器官,其叶绿素含量和光合速率的高低可以反映出植物光合生产潜力和实际光合产量水平[1]。由于植物叶片SPAD值与叶绿素含量具有显著相关性[1-4],因而叶片SPAD值常被用来表征植物体叶片叶绿素含量,因此,近年来,SPAD- 502叶绿素计被广泛应用于叶绿素含量的测定[4-6]。土壤水肥条件通常会直接影响植物叶片水分和养分含量以及其它光合功能性状,进而对植物体的光合生产力和叶绿素含量产生显著影响。已有大量研究证实土壤水分和养分会显著影响植物体叶片光合生理[7-10]和SPAD值[10-15],合适的灌溉和施肥管理能大幅提高植物光合生产力。楸树(Catalpa bungei)是紫葳科、梓树属(Catalpa)植物,是中国的珍贵速生树种之一,由于国家重视其推广和应用,近年来受到关注较多。当前已有关于其叶片光合生理指标与土壤环境因子的关系研究报道,但主要研究的内容是水分[16-17]和施肥[18]单因素效应对其叶绿素含量和光合特性的影响。一般而言,水分是植物根系吸收和运输养分的溶剂,而土壤养分也会影响根系对水分的吸收和利用,因此,两者通常存在交互效应。然而,当前鲜见关于楸树叶片光合速率和SPAD值水肥耦合效应研究的相关报道。
本研究以楸树无性系004- 1苗木为研究对象,采用三因素五水平二次回归通用旋转组合设计,通过盆栽试验测定不同水肥处理下楸树苗木生长期叶片净光合速率(Pn)和SPAD值,建立其与土壤水分(W)、施氮量(N)和施磷量(P)回归模型,分析土壤水分、施氮量和施磷量的主因子、单因素及耦合效应对楸树苗木叶片Pn和SPAD值的影响。本研究试图从叶片器官Pn和SPAD值两方面认识楸树叶片光合生产力对土壤环境因子响应规律,以期为楸树育苗过程中的水肥管理提供理论参考和有效建议。
1材料与方法
1.1研究地区概况
试验设在甘肃省小陇山林业科学研究所苗圃,该地位于105° 54 ′E,34 ° 28 ′N,海拔1160m。属温带半湿润季风气候,年降水量600—800mm,年蒸发量1290mm,年平均气温11.0 ℃,极端最高气温 39. 0 ℃,极端最低气温-19.2 ℃。4—9月晴天日平均光照时数11—14h,夏季最高光照强度2500μmolm-2s-1,无霜期约 180d。
1.2研究材料
试验材料为楸树无性系004- 1,苗木由“国家林木种质资源平台——楸树种质资源保存库”提供,在小陇山林科所进行培育。肥料选用氮肥(尿素H2NCONH2含N46%)、磷肥(过磷酸钙CaSO4Ca(H2PO4)2含P2O512%)、钾肥(硫酸钾K2SO4含K2O50%)。2013年3月选择生长一致的健康二年生组培苗进行移苗,采用30cm×30cm×45cm(底径×上口径×高)的花盆,每盆栽植1株。每处理5株,20个处理共计100株。基质组成为黄土和森林土,体积比为6∶4,盆土质量统一为15kg。基质土壤容重(1.15±0.03)g/cm3,田间持水量(FC)(29.96±2.18)%,pH(7.47±0.14),有机质,全N、全P、全K、碱解N、有效P和速效K含量分别为(29.62±2.24)g/kg、(1.55±0.04)g/kg、(0.81±0.01)g/kg、(18.68±0.67)g/kg、(152.36±3.89)mg/kg、(48.34±0.31)mg/kg和(103.06±0.99)mg/kg。待苗木生长至5月初进行试验,试验处理前苗木高度和地径分别为31.2cm和5.9mm。
1.3研究方法1.3.1试验设计
采用三因素五水平二次回归通用旋转设计(CCD),共20个处理,各试验因素和水平编码值见表1,试验结构矩阵见表2。

表1 试验因素和水平编码值

表2 试验结构矩阵
1.3.2施肥
采用穴施法,即在楸树苗木根系分布范围内挖穴5cm,将肥料平均施入。氮肥于5月15日、6月15日、7月15日共分3次施入,每次1/3,磷肥、钾肥(硫酸钾3g)均在5月15日一次性施入。
1.3.3水分控制
采用FOM/mts便携式土壤湿度、温度和盐度计进行土壤水分测量。每隔1d对土壤含水量进行测定。每次测定前,先用小铲铲开表层10cm左右土层,再将传感器的探针插入进行测定,得到体积含水量,根据土壤容重,经换算得到质量含水量。土壤水分(占田间持水量的比例)上限设为田间持水量,下限如表2,如果测得的土壤含水量低于下限则灌水。灌水量计算公式如下:灌水量(mL)=[(田间持水量-土壤含水量)/容重]×盆土质量/水的密度,采用容积1000mL(精确度10mL)的量筒测定。
1.3.4测定指标
(1)叶片瞬时净光合速率(Pn)
于2013年6月、7月和8月中旬,用Li- 6400便携式光合作用分析系统(美国)于9:00—11:00进行测定,每处理5株。测定时,每株选择3片功能叶,取平均值。测定过程中使用LI- 6400- 2B红蓝光源,光强设置为1200μmolm-2s-1,叶温设定为35 ℃,相对湿度为(44.7±5.0)%,大气CO2浓度为(396.3±6.0)μmol/mol。
(2)叶片SPAD值
与叶片净光合速率测定同步,用SPAD- 502叶绿素测定仪分别测定楸树苗木叶片SPAD值。
1.4数据处理与分析
采用Excel2007进行作图,用SAS9.0建立模型,并进行回归分析和回归系数显著性检验。其中,叶片净光合速率和SPAD值回归模型采用一般线性模型。叶片净光合速率和SPAD值与土壤水分、施氮量和施磷量的回归分析采用如下模型:
式中,y表示响应变量,x1、x2和x3分别表示土壤水分、施氮量和施磷量的水平编码值,b表示回归系数。
2结果与分析
2.1楸树苗木叶片净光合速率Pn分析
由图1可知,楸树苗木叶片净光合速率总体呈现出7月>6月>8月的动态变化规律,可见不同处理楸树苗木叶片净光合速率呈现出了相对一致的月动态变化规律。比较各处理6月、7月和8月叶片净光合速率平均值(表3)时发现,处理间叶片净光合速率存在极显著差异(P<0.01),其中,净光合速率较高的楸树苗木主要来自高氮高水(T7、T8)和高氮(T12)处理,而低水(T9)和低氮(T11)处理楸树苗木则数值较低。高氮高水处理会促进楸树苗木叶片光合产力的提高,而水、氮供应不足则会限制叶片光合生产力。
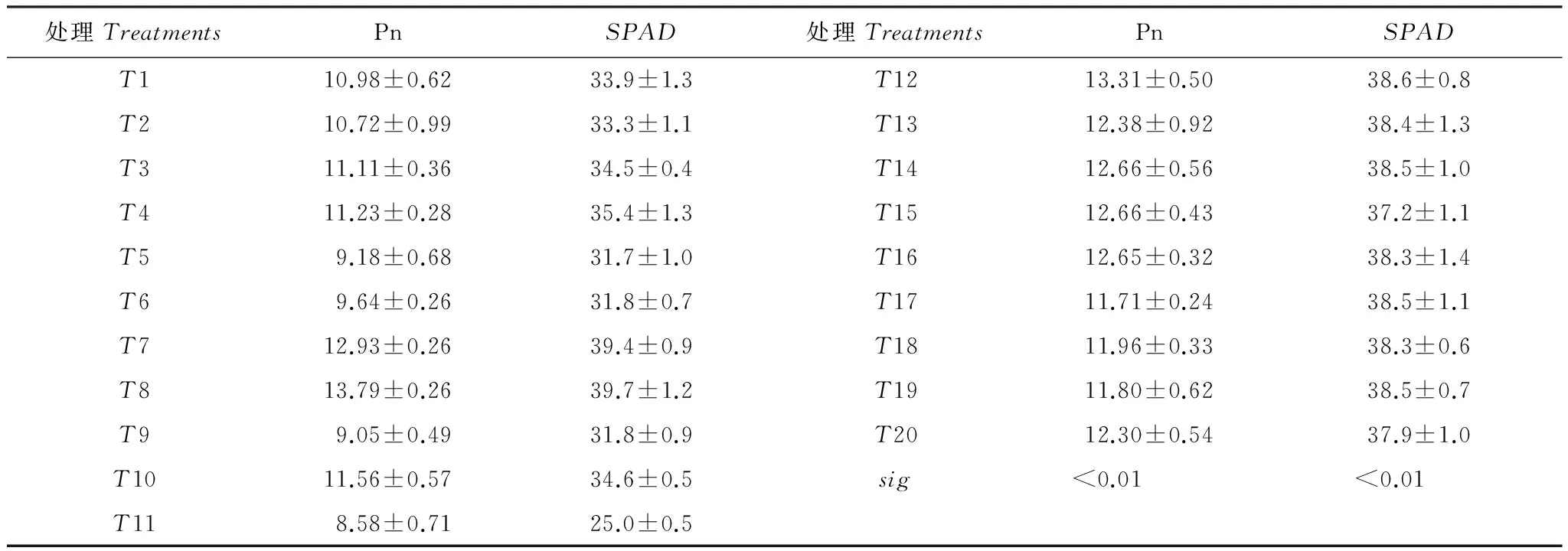
表3 楸树苗木叶片净光合速率和SPAD平均值*
*平均值是指6月、7月和8月3次测定值的平均值

图1 楸树苗木叶片净光合速率月动态变化Fig.1 Monthly dynamic of leaf net photosynthetic rate (Pn) of Catalpa bungei seedlings
2.2楸树苗木叶片SPAD值分析
由图2可知,楸树叶片SPAD值总体呈现出8月>7月>6月的动态变化规律,而T9和T11则呈现出6月>7月>8月的动态变化规律。就各处理6月、7月和8月叶片SPAD平均值而言,由表3可知,处理间叶片SPAD值存在极显著差异(P<0.01),其中,T7、T8和T12处理楸树苗木具有相对较高的SPAD值,而SPAD数值较低的楸树苗木来自T9和T11处理。由此可见,与叶片净光合速率一样,高氮高水处理能一定程度提高楸树苗木叶片SPAD值,相反,水氮亏缺则会导致楸树苗木叶片SPAD值大幅下降。
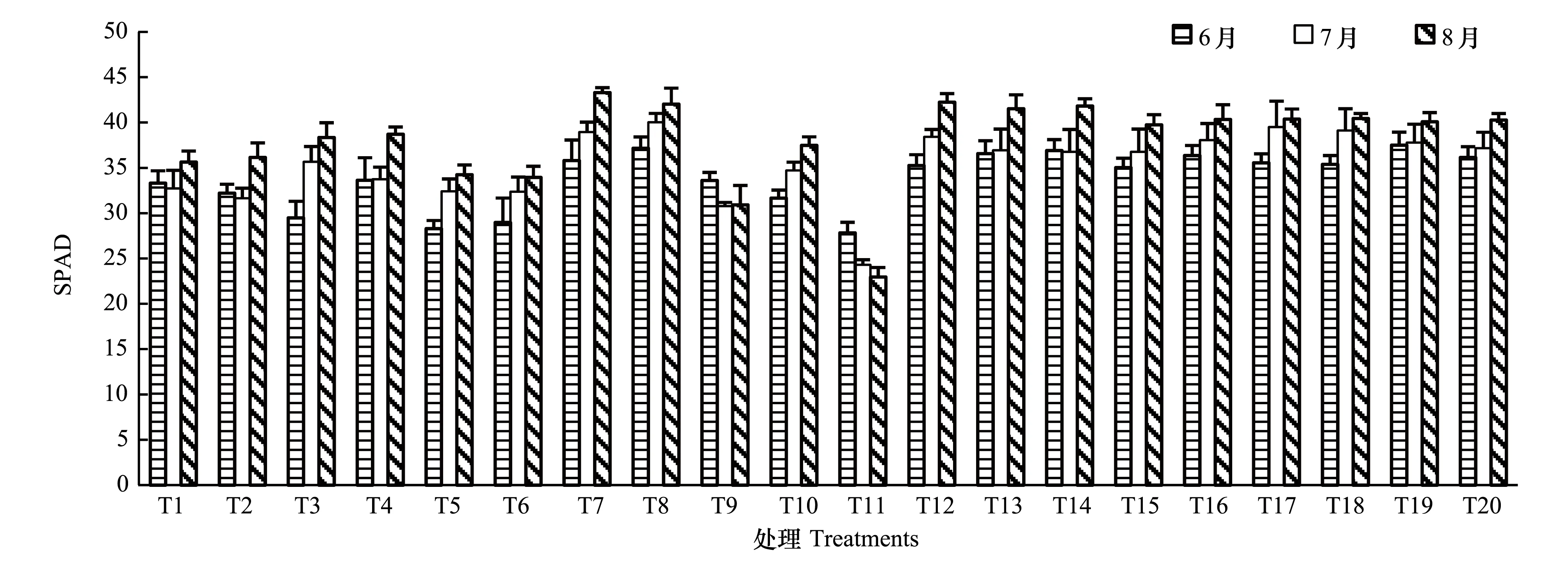
图2 楸树苗木叶片SPAD值月动态变化Fig.2 Monthly dynamic of leaf SPAD of Catalpa bungei seedlings
2.3回归分析
分别建立以楸树苗期叶片净光合速率和SAPD值(取6月、7月和8月测定值平均值)为响应变量,土壤水分(x1),施氮量(x2)和施磷量(x3)为自变量的回归模型。由表4可知,ANOVA分析结果显示2个回归模型均达到了极显著性水平(P<0.01),并且R2分别到了0.944和0.950,说明模型拟合效果较好,各响应变量与土壤水肥因子均有较强的相关性。根据模型回归系数检验结果(表4),剔除掉不显著因素,各响应变量与土壤水肥因子的回归模型如下:
(1)
(2)
式中,yPN和ySP分别表示响应变量楸树苗木叶片净光合速率和SPAD值(取6月、7月和8月测定值平均值);x1、x2和 x3分别表示土壤水分、施氮量和施磷量。
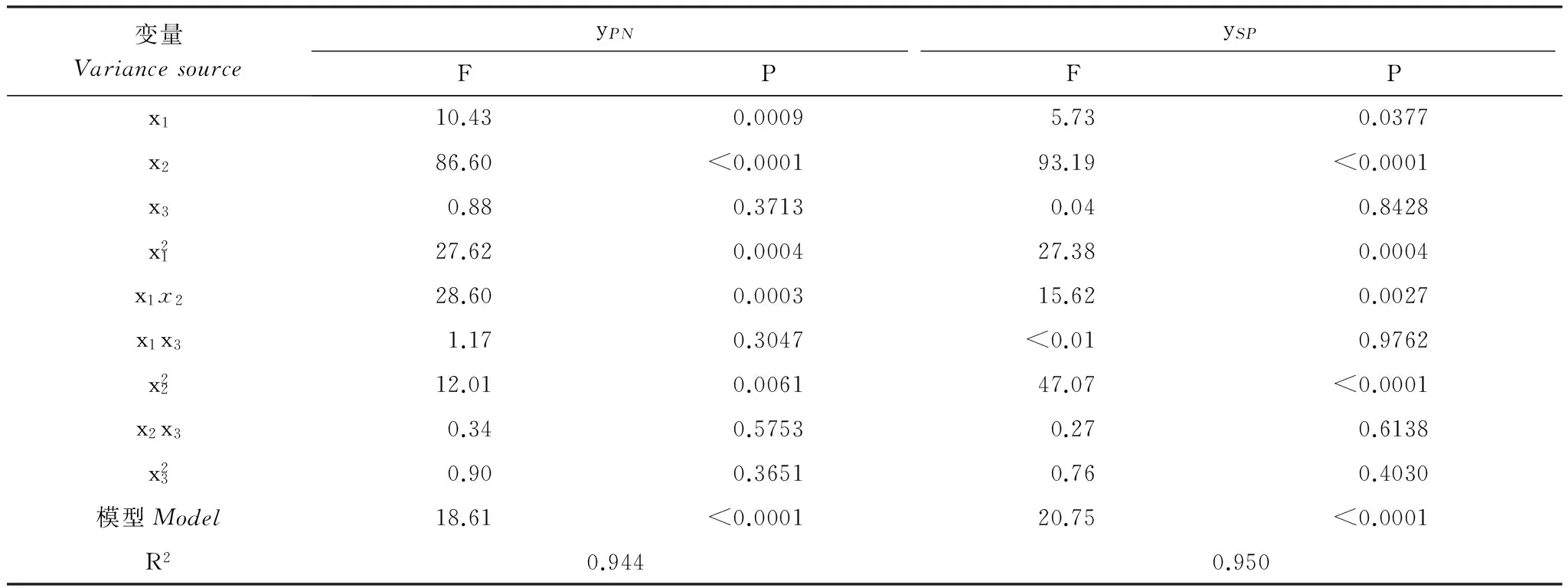
表4 回归模型和系数检验
yPN和ySP分别表示响应变量叶片净光合速率和SPAD值(取6月、7月和8月测定值的平均值)
2.3.1主效应分析
由于试验中各因素水平已经过无量纲线性编码代换,偏回归系数已经标准化,故直接比较其系数绝对值的大小,可以判断各因素对叶片净光合速率和SPAD值的影响效应,正负号表示各因素对响应变量的影响方向[19]。从回归方程(1)和(2)可以看出,施氮量和土壤水分对楸树苗木叶片净光合速率和SPAD值均有显著正效应,并且综合比较2个回归方程中2个因子回归系数发现,其主效应总体大小顺序为:施氮量>土壤水分,而施磷量对楸树苗木叶片净光合速率和SPAD值主效应不显著。此外,发现土壤水分×施氮量对楸树苗木叶片净光合速率和SPAD值均有显著正效应均有显著耦合正效应,而土壤水分×施氮量、施氮量×施磷量对楸树苗木叶片净光合速率和SPAD值无显著耦合效应。
2.3.2单因素分析
由于施磷量对楸树苗木净光合速率和SPAD值主效应不显著,因此,将重点分析土壤水分和施氮量对楸树苗木净光合速率和SPAD值的单因素效应。具体来讲,令x2=0,得到响应变量yPN和ySP与土壤水分(x1)的单因素回归方程,对应回归方程详见图3。如图3所示,楸树苗木叶片净光合速率和SPAD值均随土壤水分增加呈现出“抛物线式”变化趋势,即随着土壤水分量的增加,2个响应变量均呈现出先增加后减小的变化趋势,由此说明,当水分灌溉过量时,楸树苗木叶片净光合速率和SPAD值均会受到抑制。类似地,令x1=0,得到响应变量yPN和ySP与施氮量(x2)的单因素回归方程,对应回归方程详见图3。由图3可知,楸树苗木叶片净光合速率和SPAD值均随施氮量增加也呈现出“抛物线式”变化趋势(图3),由此可见,当氮肥施入过量时,楸树叶片净光合速率和SPAD值也会受到抑制。
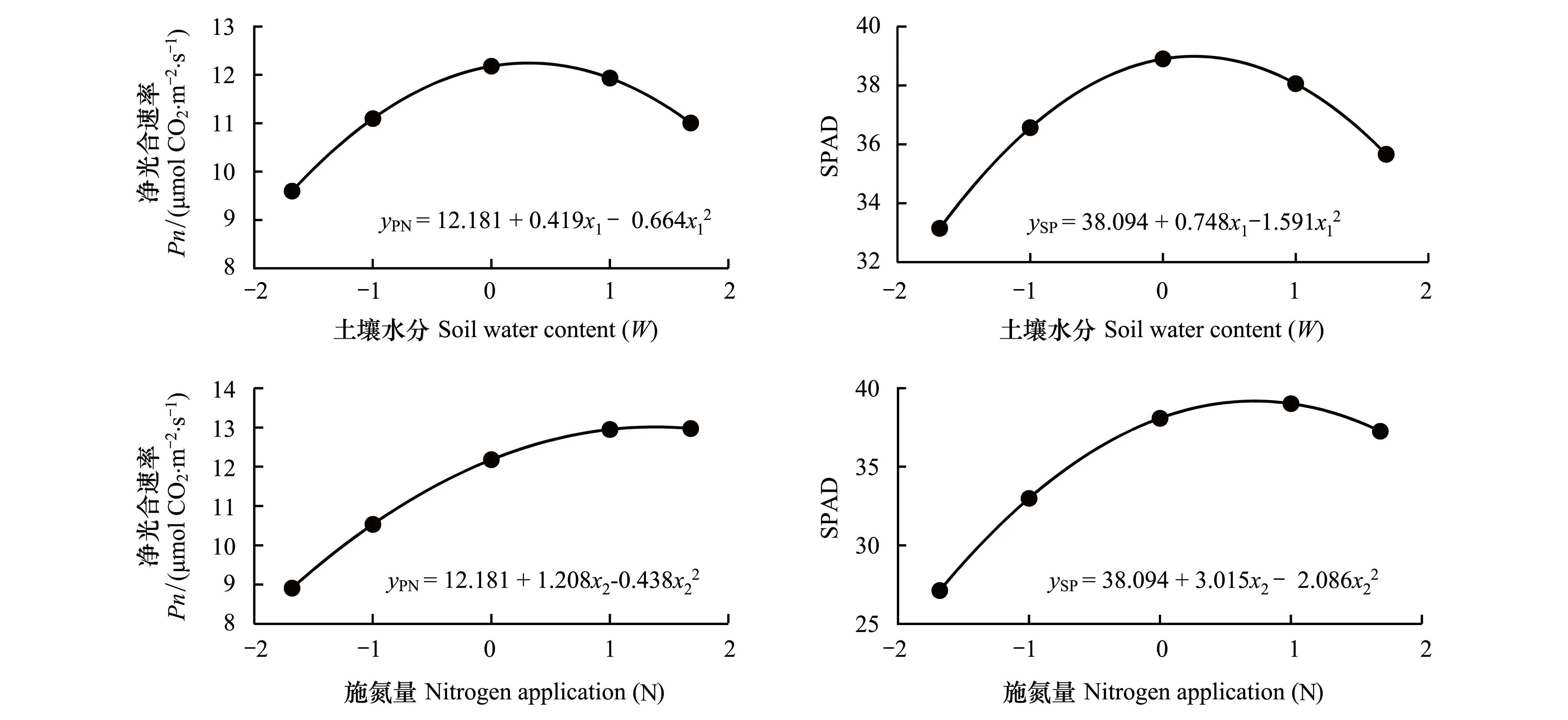
图3 土壤水分、施氮量和施磷量单因素效应对楸树苗木叶片净光合速率和SPAD值的影响Fig.3 Monofactor effects of W, N and P on leaf Pn and SPAD of C. bungei seedlings

图4 土壤水氮耦合效应对楸树苗木叶片净光合速率和SPAD值的影响Fig.4 Interactions between W and N on leaf Pn and SPAD of C. bungei seedlings
2.3.3水肥耦合效应分析
由于仅发现土壤水分和施氮量对楸树苗木叶片净光合速率和SPAD值有显著耦合效应,因此,本研究仅分析土壤水分和施氮量耦合效应对楸树苗木叶片净光合速率和SPAD值的影响。根据回归方程(1)和(2),分别得到yPN和ySP与土壤水分×施氮量耦合效应响应面图(图4)。由图4可知,随着土壤水分和施氮量的增加,楸树苗木叶片净光合速率呈现出逐渐增加的变化趋势,当土壤水分和施氮量因子水平同时达到1.682时,其叶片净光合速率达到峰值。叶片SPAD值方面,如图4所示,随着土壤水分和施氮量的增加,楸树苗木叶片SAPD值呈现出先增加后减小的变化趋势。具体来讲,随着土壤水分和施氮量逐渐增加,叶片SPAD值随之增加,当土壤水分和施氮量因子水平同时达到0.841时,叶片SPAD值达到峰值,而当土壤水分和施氮量继续增加时,叶片SPAD值便出现缓慢下降的变化趋势。
总体而言,在一定范围内,随着土壤水分和施氮量的增加,叶片净光合速率和SPAD值均随之增加,但当土壤水分和施氮量过量时,叶片SPAD反而下降,表现出了一定的抑制作用。
2.4叶片净光合速率与SPAD值的关系
为了研究楸树苗木叶片净光合速率与SPAD值的相关关系,对楸树叶片净光合速率与SPAD值(取6月、7月和8月测定值的平均值)进行回归分析,结果见图5。由图5可知,楸树苗木叶片净光合速率与SPAD值呈现出极显著正相关关系(P<0.0001),并且回归模型R2达到了0.750,说明两者相关性程度较高。
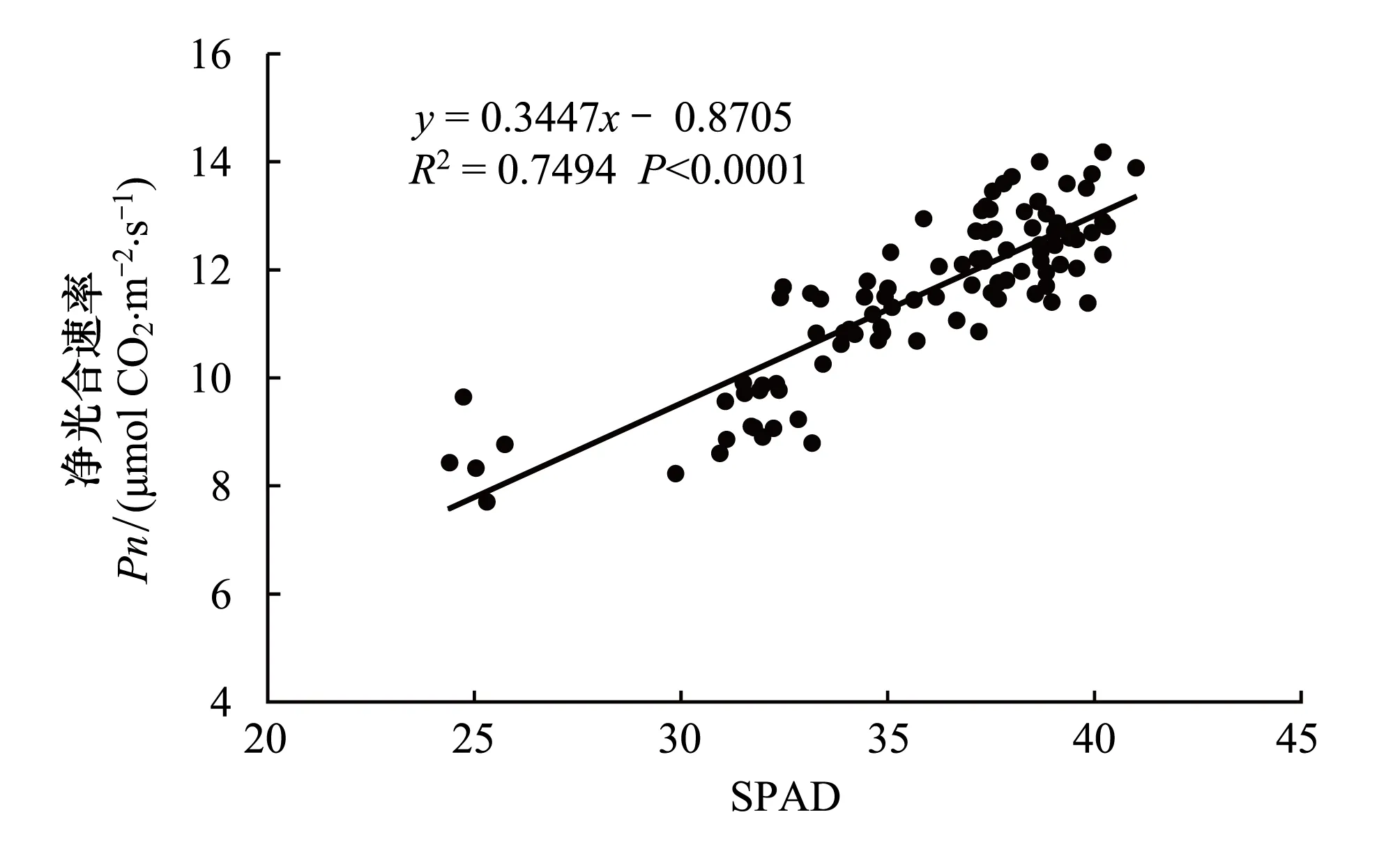
图5 楸树叶片净光合速率与SPAD值的关系 Fig.5 The relationship between leaf Pn and SPAD values of C. bungei seedlings
3讨论
3.1植物叶片光合作用容易受叶片自身生理特征(营养元素含量、叶绿素含量等)和外界环境因子(光照、温度、湿度和CO2浓度等)影响[20-22],其中,叶片中氮元素对植物体叶片光合作用过程具有重要影响。大部分植物叶氮组成直接影响碳同化过程相关联Rubisco、叶绿素及其他生物化学结构,其浓度与光合作用中碳的固定密切相关,因此,叶氮浓度的高低会显著影响叶片光合速率。另一方面,大量研究证实叶氮会直接影响植物体叶绿素合成,并且与植物体叶片SPAD值呈显著正相关关系[23-26]。普遍认为叶氮浓度与叶片净光合速率和SPAD值均呈密切的正相关关系。就叶片净光合速率和SPAD值而言,由于叶绿素是与植物光合作用相关的最重要光合色素,而且叶片SPAD值常用来表征叶绿素含量,因此,叶片净光合速率与SPAD值通常关系密切,本文研究结果(图5)显示两者存在极显著的正相关关系(P<0.0001),进一步证实了此结论。但需要指出的是,影响叶片光合作用的因素较多,树种之间光合作用主要限制因子可能存在差异,也有针对其它树种的研究认为SPAD值与净光合速率并不存在显著的相关关系[1],由此可见,研究结论不一定适用于其它树种,甚至其它楸树无性系是否能得到相同结论尚缺乏数据支持,当然,在今后的研究中,如果能证实其它楸树无性系叶片净光合速率与SPAD同样密切相关,那么叶片SPAD值便能用于指示楸树无性系的光合生长能力,也为比较楸树无性系之间生长性能差异提供了便利条件。一般而言,土壤环境因子主要通过直接影响叶片光合作用相关生理特征,例如,叶氮浓度、含水量等,进而间接对叶片净光合速率和SPAD值产生影响。因此,要解释叶片净光合速率和SPAD值对土壤水肥因子响应规律,需从叶片光合生理特征的角度进行关联分析。
3.2主效应分析结果显示土壤水分显著正向作用于楸树叶片净光合速率和SPAD值。主要原因是:土壤水分充足时,既促进植物体吸收和运输水分和养分效率的提高[27],又可以增加叶片气孔开度,因此,适量增加水分灌溉能正向提升植物光合生产力;此外,水分是保证植物叶绿素合成的重要因子,已有大量研究表明,良好的土壤水分条件能促进叶绿素的合成,而水分严重亏缺时,会导致叶片严重失水,叶绿素合成则会受阻[28-29]。施氮量方面,研究结果表明,施氮量也是正向作用于叶片净光合速率和SPAD值。原因是:随着氮肥施入量的增多,土壤中可利用氮随之增多,因而植物可以大量吸收土壤中有效氮素,促使叶氮浓度不断增加。施磷量方面,研究结果显示施磷量对叶片净光合速率和SPAD值无显著影响,可能与楸树苗期的需肥特性有关,具体原因有待进一步研究。当前,已有大量关于速生树种水肥耦合效应的相关研究报道,其中,Dong等[30]针对毛白杨Populus tomentosa和林国祚等[31]针对尾巨桉Eucalyptus urophylla × E. grandi的研究结果表明土壤水分和施氮量均显著正向作用于植物体生物量干物质积累,说明本文的研究树种楸树与前人研究速生树种毛白杨和尾巨桉可能具有相似的水肥需求特征,但树种之间也存在差异,具体来讲,研究结果显示施氮量主效应程度高于土壤水分,而前人的研究认为,对于毛白杨和尾巨桉的生物量积累而言,土壤水分主效应程度高于施氮量。这两种不同结论可能与树种之间需水需肥特征差异性有关,但还有待进一步研究。
3.3大量研究结果表明土壤水肥因子交互效应对植物体叶片SPAD值[6]、光合速率[9-10,30]、及其它生理特性[7-8]有显著影响,其中Dong等[30]研究显示水氮耦合效应显著正向作用毛白杨苗木生长时期叶片净光合速率,与前人研究结果相似,本研究也发现土壤水分×施氮量对叶片净光合速率和SPAD值存在显著耦合正效应。原因可以解释为:随着水分灌溉量和氮肥施入量的不断增加,土壤中氮有效性随之增加,并且当土壤水分充足时,苗木养分运输效率也会得到显著提高[27],因此,在两者交互作用下,随着土壤水氮供应量的同时增加,苗木可以吸收更多的氮元素,然后快速有效地被运输至茎和叶片器官,叶片氮浓度也会显著升高,另一方面,养分充足时也会促进植物对水分的吸收和利用[32],以便促进植物合成叶绿素合成和光合生产。
3.4近年来,速生树种的水肥消耗问题一直是社会关注的热点问题。在速生树种人工林经营时,经常被指责存在过度消耗水肥资源问题,破坏区域水资源平衡和耗竭土壤肥力资源。最近的研究中,已有大量报道开始关注树木栽培的大量水肥消耗问题和水肥管理技术[33-35]。国内外专家学者普遍认为,在树木培育和田间种植过程中,选择合适的灌溉和施肥策略,既能节约水肥又能实现增产效果[30-31, 36]。从(图3)以及叶片SPAD值的水氮耦合效应响应图(图4)来看,过量的水分灌溉和施氮,反而会抑制楸树苗木光合生产力和叶绿素合成,并且会导致大量水肥资源浪费。在楸树适生区进行大面积推广种植时,特别是在一些干旱地区,同样会面临水肥管理问题,因此,科学的水肥调控技术在楸树育苗和人工林经营过程中意义重大。本文仅从楸树苗期需水需肥规律角度,认识了楸树育苗过程应注意的水肥管理问题,主要关注了如何通过灌溉量和施肥量精准控制和水肥配施措施等手段实现增产和节约水肥双重功效。但研究结果存在局限性,只能为楸树育苗提供有效建议,无法回答在楸树人工林种植过程中的水肥管理问题,在今后的研究中,将重点关注该项研究内容。
4结论
(1)从楸树苗期叶片净光合速率和SPAD对土壤水肥因子响应特征来看,土壤水分和施氮量是引起楸树苗木叶片净光合光合速率和SPAD值变化的主要影响因子,其中,施氮量主效应程度更高,说明楸树苗期光合生长更容易受土壤中氮有效性限制。因此,在楸树育苗过程中,应当重视适量精准施氮,适量的水分灌溉对于楸树苗木的光合生长也具有明显的促进作用。
(2)单一地过量灌溉和施氮反而抑制楸树苗木的光合生长,并会引起水肥资源浪费。水氮耦合效应对楸树苗木叶片净光合速率和SPAD值有显著正向作用,因此,通过合理水肥配施措施,既能大幅提高楸树苗木的光合生产力,又能节约水肥。
参考文献(References):
[1]钟全林, 程栋梁, 胡松竹, 贺利中, 唐承财, 文雅香, 邱剑飞, 李秀花. 刨花楠和华东润楠叶绿素含量分异特征及与净光合速率的关系. 应用生态学报, 2009, 20(2): 271- 276.

[3]UddlingJ,Gelang-AlfredssonJ,PiikkiK,PleijelH.EvaluatingtherelationshipbetweenleafchlorophyllconcentrationandSPAD- 502chlorophyllmeterreadings.PhotosynthesisResearch, 2007, 91(1): 37- 46.
[4]YamamotoA,NakamuraT,Adu-GyamfiJJ,SaigusaM.Relationshipbetweenchlorophyllcontentinleavesofsorghumandpigeonpeadeterminedbyextractionmethodandbychlorophyllmeter(SPAD- 502).JournalofPlantNutrition, 2002, 25(10): 2295- 2301.
[5]AbdelhamidM,HoriuchiT,ObaS.EvaluationoftheSPADvalueinfababean(Vicia fabaL.)leavesinrelationtodifferentfertilizerapplications.PlantProductionScience, 2003, 6(3): 185- 189.
[6]鲍雅静, 覃名茗, 李政海, 孙丽, 高伟, 洪光宇. 羊草叶片SPAD值对水分梯度和氮素添加梯度的响应. 中国草地学报, 2012, 34(4): 26- 30.
[7]杨浩, 罗亚晨. 糙隐子草功能性状对氮添加和干旱的响应. 植物生态学报, 2015, 39(1): 32- 42.
[8]丁红, 张智猛, 戴良香, 慈敦伟, 秦斐斐, 宋文武, 刘孟娟, 付晓. 水分胁迫和氮肥对花生根系形态发育及叶片生理活性的影响. 应用生态学报, 2015, 26(2): 450- 456.
[9]李建明, 潘铜华, 王玲慧, 杜清洁, 常毅博, 张大龙, 刘媛. 水肥耦合对番茄光合、产量及水分利用效率的影响. 农业工程学报, 2014, 30(10): 82- 90.
[10]沈玉芳, 李世清, 邵明安. 水肥空间组合对冬小麦光合特性及产量的影响. 应用生态学报, 2007, 18(10): 2256- 2262.
[11]王飞, 宋希云, 刘树堂, 宋祥云. 水肥耦合下夏玉米不同生育时期的高光谱特性与反演模型研究. 植物生理学报, 2014, 50(3): 358- 363.
[12]SwiaderJM,MooreA.SPAD-chlorophyllresponsetonitrogenfertilizationandevaluationofnitrogenstatusindrylandandirrigatedpumpkins.JournalofPlantNutrition, 2002, 25(5): 1089- 1100.
[13]NatywaM,PociejowskaM,MajchrzakL,PudekoK.Influenceofirrigationandnitrogenfertilizationonyieldandleafgreennessindex(SPAD)ofMaize.ActaScientarumPolonorum,Agricultura, 2014, 13(1): 39- 50.
[14]AzizianA,SepaskhahAR.Maizeresponsetowater,salinityandnitrogenlevels:physiologicalgrowthparametersandgasexchange.InternationalJournalofPlantProduction, 2014, 8(1): 131- 162.
[15]SchlichtingAF,KoetzM,Bonfim-SilvaEM,daSilvaTJA.Maizedevelopmentunderdifferentnitrogenlevelsandsoilwatertensions.IRRIGA, 2014, 19(4): 598- 611.
[16]王新建, 何威, 杨淑红, 丁鑫, 朱延林. 干旱胁迫下4种楸树嫁接苗叶绿素含量的变化. 经济林研究, 2008, 26(1): 20- 24.
[17]王改萍, 岑显超, 何力, 彭方仁. 水分胁迫对楸树苗木光合特性的影响. 南京林业大学学报: 自然科学版, 2007, 31(6): 57- 60.
[18]王力朋, 晏紫伊, 李吉跃, 王军辉, 何茜, 苏艳, 董菊兰. 氮素指数施肥对3个楸树无性系光合特性的影响. 林业科学研究, 2013, 26(1): 46- 51.
[19]ZhouXL,WangH,ChenQG,RenJZ.Couplingeffectsofdepthoffilm-bottomedtillageandamountofirrigationandnitrogenfertilizeronspringwheatyield.Soil&TillageResearch, 2007, 94(1): 251- 261.
[20]HeeremaRJ,VanLeeuwenD,StHilaireR,GutschickVP,CookB.Leafphotosynthesisinnitrogen-starved‘Western’pecanisloweronfruitingshootsthannon-fruitingshootsduringkernelfill.JournaloftheAmericanSocietyforHorticulturalScience, 2014, 139(3): 267- 274.
[21]SunJD,FengZZ,LeakeyADB,ZhuXG,BernacchiCJ,OrtDR.InconsistencyofmesophyllconductanceestimatecausestheinconsistencyfortheestimatesofmaximumrateofRubiscocarboxylationamongthelinear,rectangularandnon-rectangularhyperbolabiochemicalmodelsofleafphotosynthesis-AcasestudyofCO2enrichmentandleafagingeffectsinsoybean.PlantScience, 2014, 226: 49- 60.
[22]ReynaudS,LeclercqN,Romaine-LioudS,Ferrier-PagésC,JaubertJ,GattusoJP.InteractingeffectsofCO2partialpressureandtemperatureonphotosynthesisandcalcificationinascleractiniancoral.GlobalChangeBiology, 2003, 9(11): 1660- 1668.
[23]WangQB,ChenJJ,LiYC.Nondestructiveandrapidestimationofleafchlorophyllandnitrogenstatusofpeacelilyusingachlorophyllmeter.JournalofPlantNutrition, 2004, 27(3): 557- 569.
[24]Lopez-BellidoRJ,ShepherdCE,BarracloughPB.Predictingpost-anthesisNrequirementsofbreadwheatwithaMinoltaSPADmeter.EuropeanJournalofAgronomy, 2004, 20(3): 313- 320.
[25]FritschiFB,RayJD.Soybeanleafnitrogen,chlorophyllcontent,andchlorophylla/bratio.Photosynthetica, 2007, 45(1): 92- 98.
[27]HuTT,KangSZ,LiFS,ZhangJH.Effectsofpartialroot-zoneirrigationonthenitrogenabsorptionandutilizationofmaize.AgriculturalWaterManagement, 2009, 96(2): 208- 214.
[28]NikolaevaMK,MaevskayaSN,ShugaevAG,BukhovNG.Effectofdroughtonchlorophyllcontentandantioxidantenzymeactivitiesinleavesofthreewheatcultivarsvaryinginproductivity.RussianJournalofPlantPhysiology, 2010, 57(1): 87- 95.
[29]SaraniM,NamrudiM,HashemiSM,RaoofiMM.Theeffectofdroughtstressonchlorophyllcontent,rootgrowth,glucosinolateandprolineincropplants.InternationalJournalofFarmingandAlliedSciences, 2014, 3(9): 994- 997.
[30]DongWY,QinJ,LiJY,ZhaoY,NieLS,ZhangZY.InteractionsbetweensoilwatercontentandfertilizerongrowthcharacteristicsandbiomassyieldofChinesewhitepoplar(Populus tomentosaCarr.)seedlings.SoilScienceandPlantNutrition, 2011, 57(2): 303- 312.
[31]林国祚, 谢耀坚, 彭彦. 水肥耦合对尾巨桉苗木生物量的影响. 桉树科技, 2013, 30(2): 1- 8.
[32]Al-KaisiMM,YinXH.Effectsofnitrogenrate,irrigationrate,andplantpopulationoncornyieldandwateruseefficiency.AgronomyJournal, 2003, 95(6): 1475- 1482.
[33]PiresAL,XavierR.InfluenceofvegetationmanagementandfertilizationonPinus pinastergrowthandonunderstorybiomassandcomposition.ForestSystems, 2010, 19(3): 404- 409.
[34]RahbariA,SinakiJM,ZareiM.Phosphatefertilizeranddroughteffectsongrowthcomponentsandelementsofforagemilletvarieties.InternationalJournalofAgronomyandPlantProduction, 2013, 4(2): 292- 299.
[35]deAndradePortoR,KoetzM,Bonfim-SilvaEM,PolizelAC,daSilvaTJA.Effectsofwaterreplacementlevelsandnitrogenfertilizationongrowthandproductionofgladiolusinagreenhouse.AgriculturalWaterManagement, 2014, 131: 50- 56.
[36]HaghjooM,NezhadFP,AmiriE,VazanS,ManeshMMK.Maizeresponsetonitrogenandirrigationregimes.American-EurasianJournalofAgricultural&EnvironmentalSciences, 2013, 13(5): 639- 646.
基金项目:国家“十二五”科技支撑计划项目(2012BAD21B03, 2012BAD21B0304); 教育部博士点基金资助项目(20124404120008)
收稿日期:2015- 04- 10;
修订日期:2015- 11- 30
*通讯作者
Corresponding author.E-mail: ljyymy@vip.sina.com
DOI:10.5846/stxb201504100733
InteractiveeffectsofsoilwaterandfertilizerapplicationonleafnetphotosyntheticrateandSPADreadingsofCatalpa bungeiseedlings
QIUQuan1,LIJiyue1,*,WANGJunhui2,HEQian1,SUYan1,MAJianwei3,DONGJulan3
1 College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, China 2 Research Institute of Forestry, Chinese Academy of Forestry, Key Laboratory of Tree Breeding and Cultivation, State Forestry Administration, Beijing 100091, China
3 Xiaolongshan Forestry Science and Technology Research Institute, Tianshui 741022, China
Abstract:Recent studies have examined problems related to water and fertilizer consumption, including the excessive application of these resources and their use in forest management. Many forest researchers maintain that the choice of suitable irrigation and fertilization strategies for seedling culture and field planting could save water and improve production. Catalpa bungei is a common, high-quality timber tree. The Chinese government plans to promote large-scale planting of C. bungei in appropriate areas; thus, information about irrigation and fertilization of this species is important. Response surface methodology (RSM) can be used to design experiments, establish models, assess significance, and determine optimal conditions. In addition, RSM can be used to analyze how process variables affect responses and to generate three-dimensional plots. Rotatable central composite design (RCCD) is a common experimental method for studying the relationship between plant growth and soil water or fertilizer. Here, we used RCCD for a pot experiment with three factors, five levels, and 20 runs to examine leaf net photosynthetic rate (Pn) and SPAD values of C. bungei seedlings (clone 004- 1). Mathematical models were established to examine the effects of main factors, monofactors, and the combination of soil water (W), nitrogen (N), and phosphorus (P) application on Pn and SPAD. Both W and N had significant positive effects on leaf Pn and SPAD values (the sequence of main factor effects was N > W); P did not affect these variables significantly. Analysis of monofactor effects showed that the values of leaf Pn and SPAD increased initially and then decreased with increasing N or W, indicating that leaf Pn and SPAD would be limited in seedlings subjected to excessive irrigation and fertilizer application. RSM based on RCCD showed that the interaction W × N had a significant positive effect on leaf Pn and SPAD: Pn values increased gradually with increasing W and N, while SPAD first increased and then decreased. The W × P and N × P interactions had no significant effects on leaf Pn or SPAD. In addition, leaf Pn and SPAD were positively correlated (P < 0.0001). Our results showed that N, rather than W or P, was the most important limiting factor in the growth of C. bungei seedlings, and we conclude that leaf Pn and SPAD in C. bungei can be promoted by rational irrigation and fertilization practices. Our findings provide fundamental information for seedling culture and afforestation of C. bungei.
Key Words:combined effects of soil water and fertilizer; leaf; net photosynthetic rate; SPAD; Catalpa bungei
邱权,李吉跃,王军辉,何茜,苏艳,马建伟,董菊兰.水肥耦合效应对楸树苗期叶片净光合速率和SPAD值的影响.生态学报,2016,36(11):3459- 3468.
QiuQ,LiJY,WangJH,HeQ,SuY,MaJW,DongJL.InteractiveeffectsofsoilwaterandfertilizerapplicationonleafnetphotosyntheticrateandSPADreadingsofCatalpa bungeiseedlings.ActaEcologicaSinica,2016,36(11):3459- 3468.
——致秋天的花楸树

