高寒草甸高原早熟禾个体性状对放牧与围封的响应
石红霄,侯向阳,*,师尚礼,吴新宏,杨婷婷,李 鹏
1 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 兰州 730070 2 中国农业科学院草原所, 呼和浩特 010010
高寒草甸高原早熟禾个体性状对放牧与围封的响应
石红霄1,2,侯向阳1,2,*,师尚礼1,吴新宏2,杨婷婷2,李鹏2
1 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 中-美草地畜牧业可持续发展研究中心, 兰州730070 2 中国农业科学院草原所, 呼和浩特010010
摘要:植物对放牧的响应是植物在响应过程中为生存和繁殖所形成的适应策略,研究植物表型反应对揭示草原生态系统的放牧响应机制具有重要意义。以青藏高原高寒草甸主要植物高原早熟禾(Poa alpigena)为研究对象,通过放牧和围封试验,研究其个体性状对放牧与围封的响应,旨在为草原生态系统放牧机制提供理论依据。结果表明:1)在长期放牧干扰下,除叶片数和根重外,其他性状株高、分枝数、叶长、叶宽、叶面积、茎粗、茎长、根长、根粗、穗长、总叶质量、单叶质量、茎重、穗重、全株重均出现显著变小的特征(P<0.05);而短期围封对于高原早熟禾叶长、叶宽、总叶质量、单叶质量、茎重、穗重、根重等功能性状的恢复效果并不显著(P>0.05),表明放牧退化草原植物性状具有保守性;2)通过构建高原早熟禾性状可塑性变化谱,发现穗重、茎重、全株重、分蘖数、茎长、株高等可塑性幅度较大,为放牧响应的敏感指标,叶片数、叶宽、茎粗、根粗的可塑性变化幅度较小,为惰性性状。
关键词:高寒草甸;高原早熟禾;表型可塑性;个体性状
放牧作为人类对草地生态系统最主要的干扰方式,对生态系统过程产生重要的影响。家畜可以通过其选择性采食行为直接影响某些植物种群动态,并间接地改变了植物个体功能性状[1]。从功能性状变化探索草原植物的放牧响应机制,是一备受科学家青睐的思路[2]。适度放牧可以增加群落的物种多样性,进而影响草地的生产力和稳定性;过度放牧将会导致植物个体物种、组成、群落等产生相应的变化,其中植物个体以多种方式对放牧采食造成的影响做出反应[3],植物在放牧影响下表型特征变化也是研究放牧影响的重要内容。植物在生长发育过程中,通过优化生长、维持和繁殖等方面的资源分配以适应环境变化和维持生存[4-5]。
前期研究发现:三江源高山嵩草草甸群落牧草的个体形态特征在长期放牧条件发生变化,优良牧草个体大小、个体生物量等明显变小[6]。迄今,关于放牧对高寒草甸植物个体主要性状的变化特征,长期放牧下草原植物性状可塑性变化的报道仍显不足[7],特别是关于不同性状的敏感度差异尚属未知,成为限制解析放牧下草原植物生物学过程的重要瓶颈。针对这一问题,本文以青藏高原高寒草甸主要优势植物高原早熟禾(Poa alpigena)为对象,通过围封与放牧试验的比较,试图揭示:1)高原早熟禾茎叶性状对放牧与围封的差异化响应特征;2)不同性状在放牧下可塑性响应的敏感性分异。
1材料与方法
1.1研究地概况
试验样区设于农业部“玉树高寒草原资源与生态环境重点野外科学观测站”(33°24′30″N,97°18′00″E),海拔高度为4250m。 年均温为-6.4—4.3℃, 7月份平均最高温度为11.7—21.0℃, 1月份平均最低气温为-27.9—14.3℃。全年可照时数在4425h左右,日照时数为2488—2619h。年降水量多年平均为374.2—721.2mm,分配很不均匀,降水日数在 130—160d,多年一日最大降水量36.5mm。蒸发量在1430—1615mm之间。属于青藏高原气候系统。草地类型为高山嵩草杂草类草甸,草场主要优势牧草是高山嵩草(Kobresia pygmaea),次重要者有矮嵩草(Kobresia humilis)、异针茅(Stipa aliena)、高原早熟禾(Poa alpigena)、垂穗披碱草(Elymus nutans)、丛生钉柱萎陵菜(Potehtilla saundersiana)、乳白香青(Anaphalis lactea)、高山唐松草(Thalictrum alpinum)等[6]。
1.2样地设置
调查研究样地位于农业部玉树高寒草原资源与生态环境重点野外科学观测试验站佳塘草原,该样地为一块平坦开阔的放牧地,面积约2000hm2,自20世纪80年代草场承包政策实施以来,长期的放牧方式下形成了不同利用方式的放牧草场,即,冬春季草场、夏秋季草场和全年放牧草场。试验选取6个具有代表性的样地作为实验样地,分别为全年放牧样地(YG)、夏季放牧样地(SG)、冬季放牧(WG)、围栏3a(UG3)、5a(UG5)、12a(UG12)等样地(表1)。
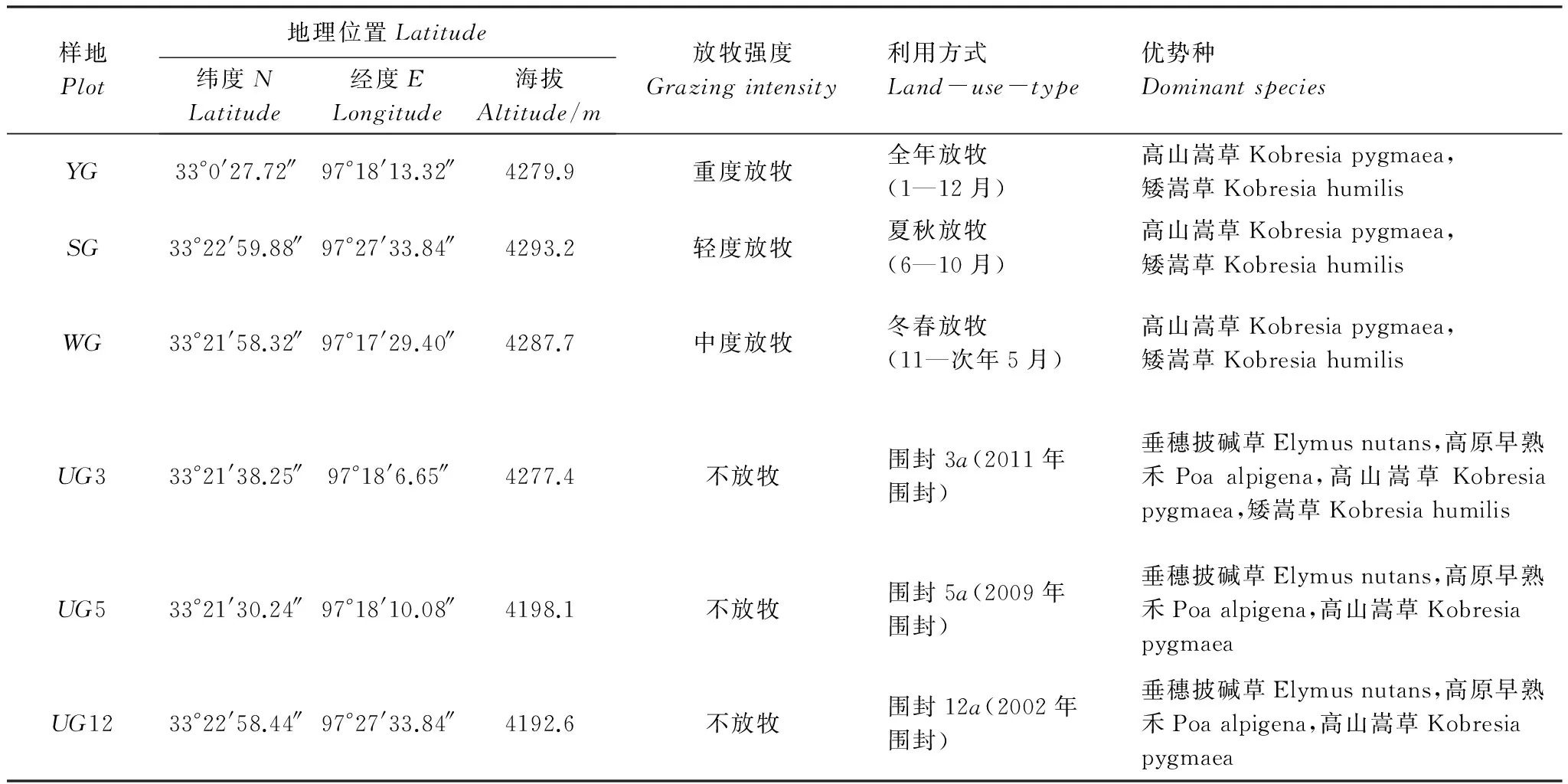
表1 试验样地基本特征
1.3数据获取
本研究选取的样地及试验处理位于连续的同一地段,地势平坦,环境条件相对均质,有效地避免了空间异质性的干扰。试验数据获取于2014年8月初在SG、WG、UG3、UG5、UG12等6个样地内进行取样工作,每个样地分别随机选取6个1.0m×1.0m的样方。每个样方随机选取9株器官完好的高原早熟禾成年植株,每个样地共计54个重复。利用电子游标卡尺等仪器分别对株高、叶片数、叶长、叶宽、茎粗、茎长、根长、根粗、穗长等表型性状指标进行测定。其中,测定高原早熟禾植株所有叶片的叶长、叶宽,计算平均叶长、平均叶宽。用数字扫描仪和图像分析软件AdobePhotoshop测定样株所有叶片的叶面积,并计算平均单叶面积。测定完表型性状指标后,将高原早熟禾植株茎、叶、穗、根等器官分离,分装于不同的信封,并在烘箱中65℃下烘干48h至恒重,用电子天平称取每个植株的茎、叶、穗、根干质量。
1.4数据处理
本研究分析的高原早熟禾功能性状含叶片性状、茎秆性状、根性状、穗性状、全株性状5类,叶片性状包括叶片数(LN)、叶长(LL)、叶宽(LW)、单叶面积(LA)、总叶质量(TLW)、单叶质量(LWE);茎秆性状包括茎长(SL)、茎粗(SD)、茎杆重(SW);根性状包括根长(RL)、根粗(RD)、根重(RW);穗性状包括穗长(FL)、穗重(FW);全株性状包括株高(PH)、分枝数(NB)、全株重(WW)。利用单因素方差分析法分析YG、SG、WG、UG3、UG5、UG10等样地高原早熟禾茎叶等性状的差异显著性,进行Duncun多重比较,数据以平均值±标准误差表示,利用Pearson相关法分析各茎叶性状之间的相关性,以回归分析方法拟合高原早熟禾个体地上生物量和茎叶表型性状之间的关系,在0.05和0.01水平进行显著性检验。茎叶性状对放牧的响应程度用可塑性指数表示,参考李西良等[8]的方法计算求得,SG、WG、UG3、UG5、UG12等样地中某一性状的可塑性指数(PI)为:YG样地高原早熟禾个体性状平均数值减去SG、WG、UG3、UG5、UG12等样地个体性状平均数值,除以YG样地个体性状平均数值。
采用统计分析软件SPSS17.0进行方差分析、相关性分析,并进行0.05和0.01水平显著性检验,数据通过SigmaPlot12.0作图。
2结果与分析
2.1叶性状对放牧与围封的差异化响应
叶片是植物重要的功能器官。由图1可见,不同利用方式下高原早熟禾叶片各性状存在显著性差异(P<0.05),放牧利用下叶长、叶宽、单叶面积、单叶质量、总叶质量均为SG>WG>YG,随着放牧强度的增加而减小(P<0.05);围栏禁牧下叶长为UG3>UG5>UG12,叶长在围封3a和围封5a时出现峰值(P<0.05),叶宽、单叶面积、单叶质量、总叶质量均为UG5>UG3>UG12,在围封5a时出现峰值(P<0.05)。但叶片数的变化规律与上述叶性状不同,随着放牧轻度的减小而增加,在全年放牧时达到最大值(P<0.05)。
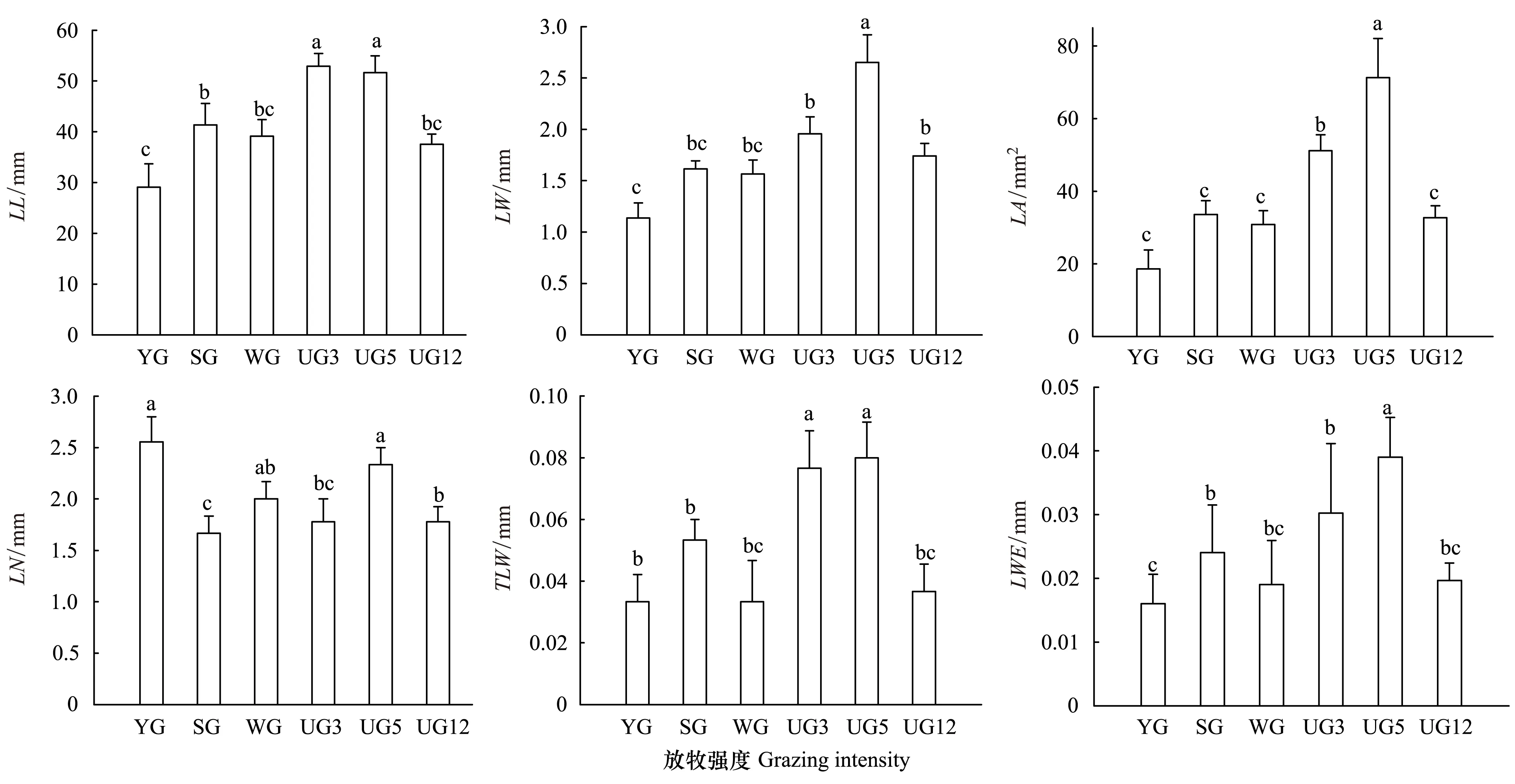
图1 放牧与围封对高原早熟禾叶性状的影响Fig.1 Effects of Grazing and enclosure to leaf phenotypic trait of Poa alpigena LL: 叶长;LW: 叶宽;LA: 叶面积;LN: 叶片数;LWE: 叶质量;TLW: 总叶质量; 不同小写字母表示差异显著(P<0.05); 图中数据为平均值±标准误差
2.2茎、穗、根性状对放牧与围封的差异化响应
由图2可见, 不同利用方式下高原早熟禾茎、穗、根等性状存在显著性差异(P<0.05)。放牧利用下茎粗、茎重、穗长、穗重、根长、根粗、根重均为SG>WG>YG,随着放牧强度的增加而减小,其中茎粗、穗长、根粗差异显著(P<0.05);茎重、穗重、根长、根重无显著性差异(P>0.05),而茎长为WG>SG>YG,且差异显著(P<0.05)。围栏禁牧下茎粗、茎重、穗重均为UG5>UG3>UG12,围封5a时值最大(P<0.05);茎长、根粗为UG3>UG12>UG5,根粗差异显著(P<0.05);穗长、根长为UG3>UG5>UG12,随着围封年限的增加而减小,根长存在显著性差异;根重则为UG12>UG5>UG3,随着围栏年限的增加而减小(P>0.05)。
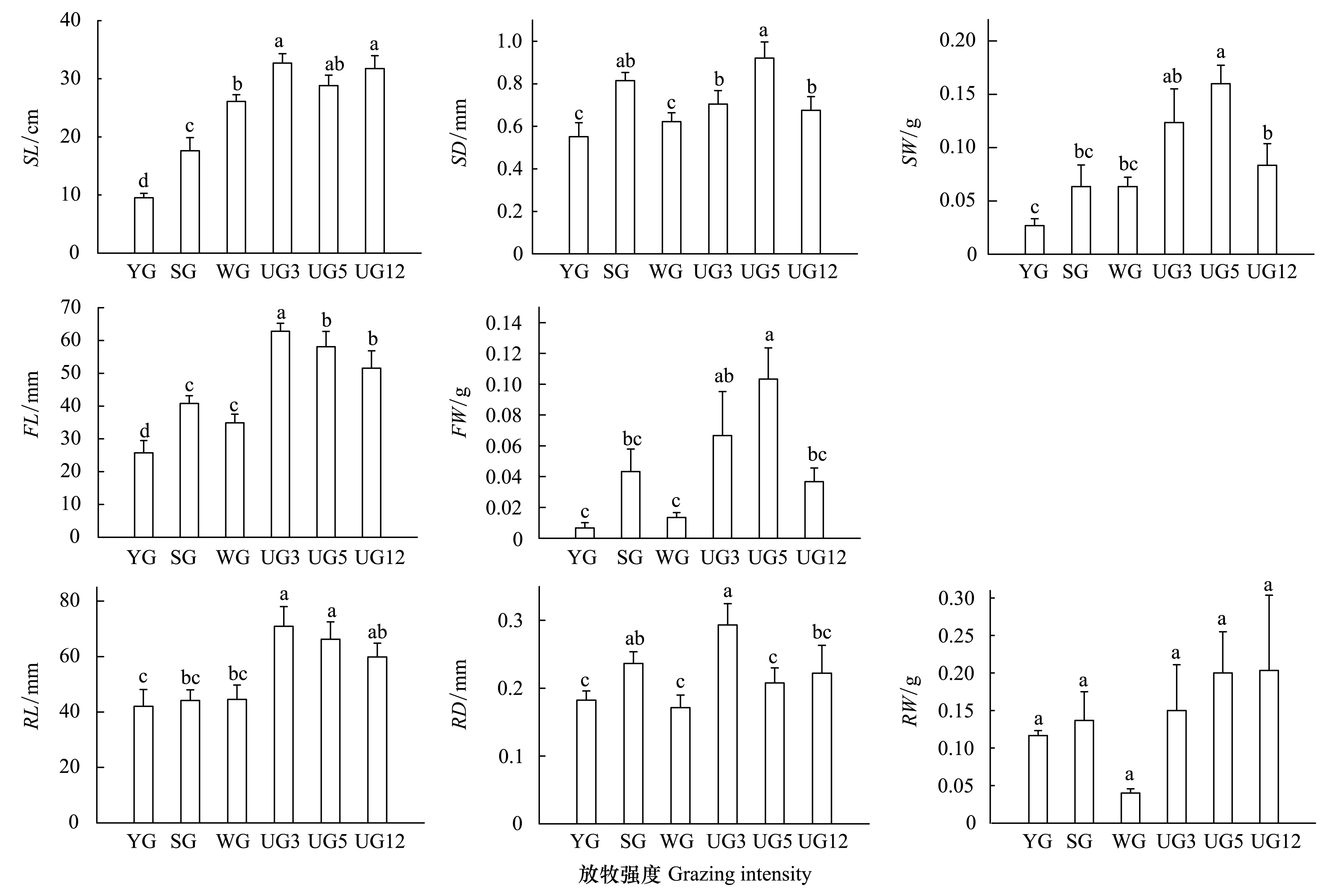
图2 放牧与围封对高原早熟禾茎、穗、根性状的影响Fig.2 Effects of Grazing and enclosure to stem,fringe,and root trait of Poa alpigenaSL: 茎长;SD: 茎粗;SW: 茎重;FL: 穗长;FW: 穗重;RL: 根长;RD: 根粗;RW: 根重;不同小写字母表示差异显著(P<0.05); 图中数据为平均值±标准误差
2.3全株性状对放牧与围封的差异化响应
由图3可见,不同利用方式下株高、分枝数、全株重存在显著性差异(P<0.05)。放牧利用下分枝数、全株重均为SG>WG>YG,随着放牧强度的增加而减小(P<0.05);株高为WG>SG>YG,随着放牧强度的增加而减小(P<0.05)。围栏禁牧下分枝数、全株重均为UG5>UG3>UG12,围封5a时值最大(P<0.05);株高为UG3>UG12>UG5,围封3a时值最大(P>0.05)。

图3 放牧与围封对高原早熟禾全株性状的影响Fig.3 Effects of Grazing and enclosure to functional trait of Poa alpigenaWW: 全株重;NB: 分枝数;PH: 株高;不同小写字母表示差异显著(P<0.05); 图中数据为平均值±标准误差
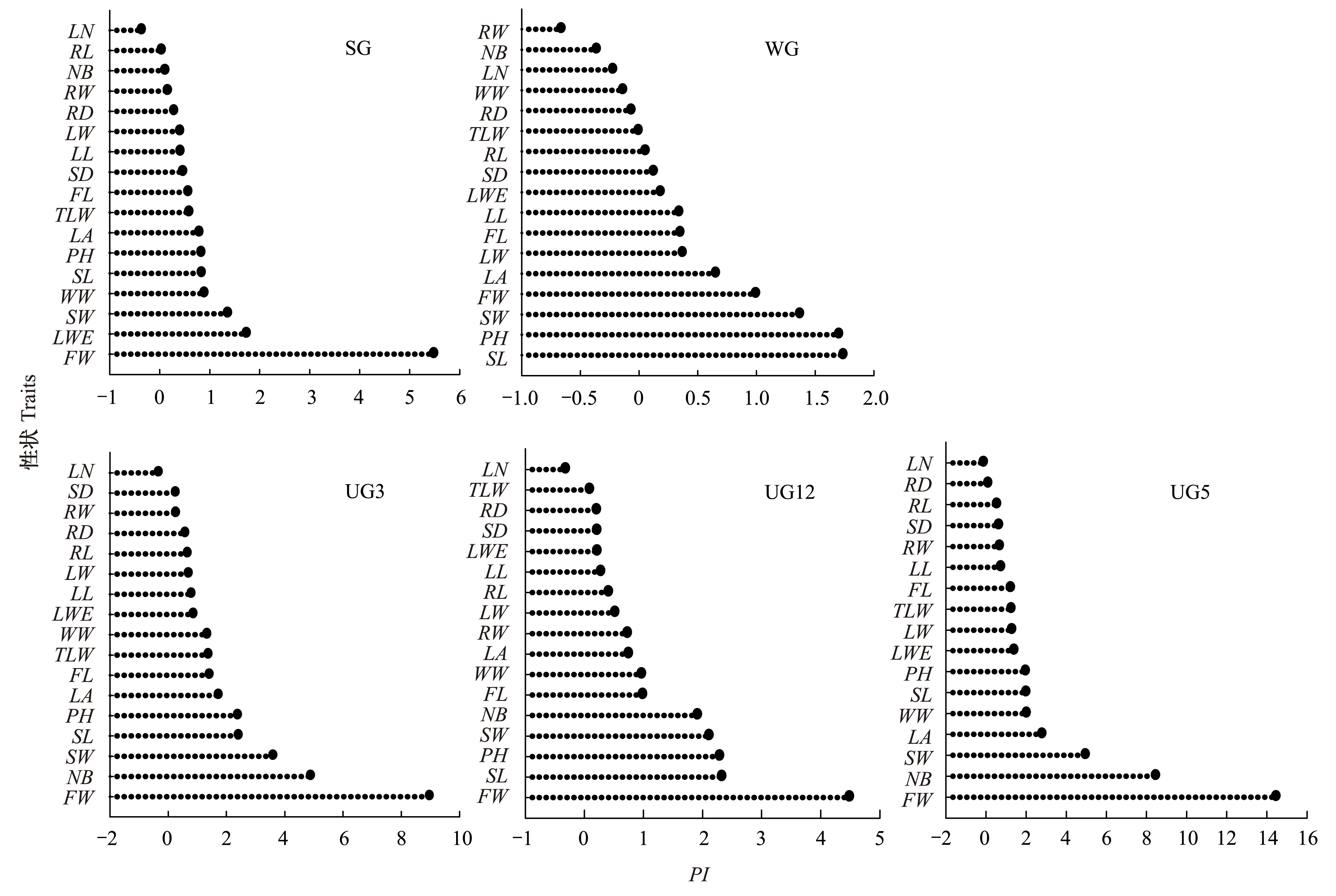
2.4各性状指标可塑性变化的敏感度
以全年放牧(YG)为参照系,对高原早熟禾17个性状指标进行可塑性指数排序(图4),整体看来,各性状可塑性指数UG5>UG3>UG12>SG>WG,叶、茎、根、穗等功能性状明显受放牧的影响。5个样地中, 各性状可塑性指数大小排序规律基本一致,穗重、茎重、全株重、分枝数、茎长、株高等的可塑性幅度较大(-0.13 图4 高原早熟禾表型性状可塑性指数变化程度排序Fig.4 Sorting of Poa alpigena phenotypic trait plasticity index(PI)LL: 叶长;LW: 叶宽;LA: 叶面积;LN: 叶片数;LWE: 叶质量;TLW: 总叶质量;SL: 茎长;SD: 茎粗;SW: 茎重;FL: 穗长;FW: 穗重;RL: 根长;RD: 根粗;RW: 根重;WW: 全株重;NB: 分枝数;PH: 株高 3结论与讨论 3.1放牧与围封对植物个体性状的影响 过度放牧下植物性状功能发生变化,是植物对过度放牧的适应性形成的避牧机制[9]。植物在长期放牧过程中,已经进化出多种适应机制,在形态、生长、繁殖和资源分配等方面表现出相应变化[10-11]。随着放牧强度的增加,牧草的再生能力降低,其叶量,株高和个体生物量均呈降低趋势[12]。本研究表明,与围封5a相比,在长期放牧干扰下,高原早熟禾株高、分枝数、叶片数、叶长、叶宽、叶面积、茎粗、茎长、根长、 根粗、穗长、总叶质量、单叶质量、茎重、穗重、根重、全株重等性状中,除叶片数和根重外,其他性状均出现显著的变小特征(P<0.05);而短期围封(3a)和长期围封(12a)对于高原早熟禾叶长、叶宽、总叶质量、单叶质量、茎重、穗重、根重等功能性状的恢复效果并不显著(P>0.05),短期围封对功能性状恢复不显著,表明放牧退化草原植物性状具有保守性,这与王炜等[13]报道的结论是一致的,而长期围封对功能性状不显著,可能是由于围封年限过长,草地发生了次生退化导致的。这与刘忠宽等[14]和吴建波等[15]研究表明,长期围封造成植物个体形态指标、繁殖分配、生物量和密度等降低,草原植被灌丛化趋势明显,可食化程度、均匀性降低,草原发生二次逆行演替的研究结论相一致。这些性状的变化将产生怎样的生态学效应?有研究证实,退化样地植株个体生物量较未退化样地植株下降30%—80%,植物随着放牧胁迫增强,往往先采取高度和生物量降低的适应策略[10],此外,家畜喜食牧草生态位收缩, 杂毒草生态位趁机扩张,使优良牧草分布范围缩减[13]。因此,植物的个体变小是草原生态系统结构与功能变化的重要触发机制。 3.2表型性状敏感性与适应性 植物通过表型可塑性对环境的异质性产生反应。表型可塑性是指植物的形态和生理特点随环境变化而改变的特性[16]。通过对自然界协同进化过程中植物的适应特征与表型可塑性的分析,可以解释植物在不同生存环境中的生态适应对策[17]。 生存在不同生境中的同种植物,为了适应不同的生境,表型特征呈现不同程度差异,不同性状的差异大小可以反映其对生境条件变化的敏感程度。本研究以全年为参照系,计算了各处理可塑性指数排序为,UG5>UG3>UG12>SG>WG,性状指标穗重、茎重、全株重、分蘖数、茎长、株高等可塑性幅度较大,为放牧响应的敏感指标,叶片数、叶宽、茎粗、根粗的可塑性变化幅度较小,为惰性性状。植物的表型可塑性是植物体与环境相互作用的结果。同一植物体在不同的生境中可能会出现不同的表现型,它在进化上的意义受到了广泛重视。因为植物体是相对静止的,而周围资源的丰富度,质量和干扰却是异质的,在时间,空间上的分布也是不均匀的。植物体只能通过表型上的可塑性来完成对这种环境中干扰异质性的反应。一般认为在特定生境中,植物体可以通过性状的可塑性表达,形成与环境相适应的有利特征。可以假设,不同强度的放牧干扰生境中的植株表现型最终应使所有的构件处于最有利的位置,以保证最高的适合度,因此不同干扰生境中的高原早熟禾表现型的比较在一定程度上反映了植物体不同适应对策。 3.3放牧对植物表型可塑性的可能机制 前文已阐述,放牧导致了高原早熟表型性状具有可塑性,且性状可塑性具有敏感性,哪么高原早熟禾性状可塑性和敏感性的生物学响应机制是什么?表型可塑性是否具有遗传性?表型可塑性变异在各类生物中普遍存在[18],但围绕可塑性变异的发生机制及其进化意义存在很多争论。目前,有证据表明很多可塑性变异与发育调控基因在不同环境条件下的“可塑性”表达密切相关,并能通过表观遗传途径传递给子代,有些可塑性变异还可能通过遗传同化过程得以固定,从而对个体发育式样、种群遗传组成和结构,以及物种的进化潜力都产生显著影响[19-23]。那么高原早熟禾及其它高寒草甸优势植物,在放牧干扰下都具有表型可塑性?以及这种表型可塑性是否具有遗传性?然而,探讨放牧下植物型变的机制,可能将是一个长久的命题。在未来研究中,解析放牧干扰下植物型变机理,不仅应考虑种群、群落、生态系统、景观等宏观尺度过程,而且应更侧重于分子生态学机理。分子生物学理论与技术近年来得到迅猛发展,它以巨大的解释能力,为探究放牧下草原植物矮化型变这一生态现象背后的机理提供了新的方法,展现了诱人前景。但目前草原植物分子生态学研究才刚刚起步[24],未来需利用基因组学、转录组学、蛋白组学、代谢组学,以及表型组学的高通量分析技术,发现从放牧等诱导信号到植物代谢调控的过程,解析环境应答基因,从而构建起草原植物表型可塑性形变的信号调控途径与代谢网络。 参考文献(References): [1]DíazS,LavorelS,McIntyreS,FalczukV,CasanovesF,MilchunasDG,SkarpeC,RuschG,SternbergM,Noy-MeirI,LandsbergJ,ZhangW,ClarkH,CampbellBD.Planttraitresponsestograzing—aglobalsynthesis.GlobalChangeBiology, 2007, 13(2): 313- 341. [2]LouaultF,PillarVD,AufrèreJ,GarnierE,SoussanaJF.Planttraitsandfunctionaltypesinresponsetoreduceddisturbanceinasemi-naturalgrassland.JournalofVegetationScience, 2005, 16(2): 151- 160. [3]SchmidB.Someecologicalandevolutionaryconsequencesofmodularorganizationandclonalgrowthinplants.EvolutionaryTrendsinPlants, 1990, 4(1): 25- 34. [4]张大勇. 理论生态学研究. 北京: 高等教育出版社, 2000: 35- 38. [5]姚红, 谭敦炎. 胡卢巴属4种短命植物个体大小依赖的繁殖输出与生活史对策. 植物生态学报, 2005, 29(6): 954- 960. [6]石红霄, 范月君, 侯向阳, 杨玉平, 吴新宏, 杨婷婷, 李鹏. 三江源区围栏与放牧高山嵩草草甸植物群落特征分析. 中国草地学报, 2014, 36(3): 67- 72. [7]StahlheberKA,D′AntonioCM.Usinglivestocktomanageplantcomposition:Ameta-analysisofgrazinginCaliforniaMediterraneangrasslands.BiologicalConservation, 2013, 157(2): 300- 308. [8]李西良, 侯向阳, 吴新宏, 萨茹拉, 纪磊, 陈海军, 刘志英, 丁勇. 草甸草原羊草茎叶功能性状对长期过度放牧的可塑性响应. 植物生态学报, 2014, 38(5): 440- 451. [9]SuzukiRO,SuzukiSN.Facilitativeandcompetitiveeffectsofalargespecieswithdefensivetraitsonagrazing-adapted,smallspeciesinalong-termdeergrazinghabitat.PlantEcology, 2011, 212(3): 343- 351. [10]汪诗平, 王艳芬, 陈佐忠. 放牧生态系统管理. 北京: 科学出版社, 2003: 113- 132. [11]SmithSE.VariationinresponsetodefoliationbetweenpopulationsofBouteloua curtipendulavar.caespitosa(Poaceae)withdifferentlivestockgrazinghistories.AmericanJournalofBotany, 1998, 85(9): 1266- 1272. [12]ChristiansenS,SvejcarT.Grazingeffectsonshootandrootdynamicsandabove-andbelow-groundnon-structuralcarbohydrateinCaucasianbluestem.GrassandForageScience, 1988, 43(2): 111- 119. [13]王炜, 梁存柱, 刘钟龄, 郝敦元. 草原群落退化与恢复演替中的植物个体行为分析. 植物生态学报, 2000, 24(3): 268- 274. [14]刘忠宽, 汪诗平, 陈佐忠, 王艳芬, 韩建国. 不同放牧强度草原休牧后土壤养分和植物群落变化特征. 生态学报, 2006, 26(6): 2048- 2056. [15]吴建波, 包晓影, 李洁, 赵念席, 高玉葆. 不同围封年限对典型草原群落及大针茅种群特征的影响. 草地学报, 2010, 18(4): 490- 495. [16]SladeAJ,HutchingsMJ.TheeffectsofnutrientavailabilityonforagingintheclonalherbGlechomahederacea.JournalofEcology, 1987, 75(1): 95- 112. [17]BrownJH,WhithamTG,ErnestSKM,GehringCA.Complexspeciesinteractionsandthedynamicsofecologicalsystems:long-termexperiments.Science, 2001, 293(5530): 643- 650. [18]SultanSE.Evolutionaryimplicationofphenotypicplasticityinplants.EvolutionaryBiology, 1995, 21(1): 127- 178. [19]PigliucciM.PhenotypicPlasticity:BeyondNatureandNurture.Baltimore:JohnsHopkinsUniversityPress, 2001. [20]SultanSE.Phenotypicplasticityforplantdevelopment,functionandlifehistory.TrendsinPlantScience, 2000, 5(12): 537- 542. [21]SchlichtingCD,SmithH.Phenotypicplasticity:linkingmolecularmechanismswithevolutionaryoutcomes.EvolutionaryEcology, 2002, 16(3): 189- 211. [22]PigliucciM,MurrenCJ,SchlichtingCD.Phenotypicplasticityandevolutionbygeneticassimilation.JournalofExperimentalBiology, 2006, 209(12): 2362- 2367. [23]RichardsEJ.Inheritedepigeneticvariation-revisitingsoftinheritance.NatureReviewsGenetics, 2006, 7(5): 395- 401. [24]韩冰, 赵萌莉, 珊丹. 针茅属植物分子生态学. 北京: 科学出版社, 2011: 1- 32. 基金项目:国家重点基础研究发展计划(973计划)(2014CB138802); 国家科技支撑计划课题(2012BAD13B07); 中央级公益科研院所基本科研业务专项项目资助(1610332015011) 收稿日期:2015- 06- 15; 修订日期:2015- 11- 13 *通讯作者 Corresponding author.E-mail: houxy16@126.com DOI:10.5846/stxb201506151200 Poa alpigenaresponsetraitsaffectedbygrazingandenclosuersinanalpinemeadowontheQinghai-TibetPlateau SHIHongxiao1, 2,HOUXiangyang1,2,*,SHIShangli1,WUXinhong2,YANGTingting2,LIPeng2 1 College of Pratacultural Science, Gansu Agricultural University; Key Laboratory of Grassland Ecosystem, Ministry of Education; Sino-U.S. Centers for Grazingland Ecosystem Sustainability, Lanzhou 730070, China 2 Grassland Research Institute of the Chinese Academy of Agricultural Science, Hohhot 010010, China Abstract:Plant responses to grazing form part of an adaptation strategy that enables them to survive and reproduce. Plant phenotypic responses are important to characterize grazing-induced plant mechanisms in grassland ecosystems. In the present study, we investigated how grazing and enclosures affect individual traits of Poa alpigena, the primary plant species in alpine meadows of the Qinghai-Tibet Plateau. The objectives of our research were to (1) reveal the different P. alpigena stem and leaf response traits affected by grazing and enclosures, and (2) determine the sensitivity of the phenotypic plasticity of different traits during grazing.The present study was conducted using field experiments involving various grazing and enclosure conditions on the Qinghai-Tibet Plateau. We compared the effects of annual grazing (YG), summer grazing (SG), winter grazing (WG), 3-year enclosure (UG3), 5-year enclosure (UG5), and 12-year enclosure (UG12) on P. alpigena functional traits. The experimental data for YG, SG, WG, UG3, UG5, and UG12 were randomly collected from sample areas in early August 2014. Plants with intact organs were collected from six plots (1.0 m × 1.0 m), with nine collections from each plot for a total of 54 plant samples. Plant height, number of leaves, leaf length, leaf width, stem diameter, stem length, root length, root thickness, ear length, and other phenotypic traits were determined. Averages for leaf length and width were calculated using these data. Leaf area was measured using a digital scanner and image analysis software, and the average individual leaf area was calculated. After phenotypic traits were assessed and recorded, the stems, leaves, spikes, and roots were separated and dried. The dry weight of the stems, leaves, spikes, and roots of each plant was determined.The results showed that under long-term grazing conditions, there was a significant decrease (P<0.05) in root weight, number of leaves, plant height, number of branches, leaf length, leaf width, leaf area, stem diameter, stem length, root length, root thickness, spike length, total leaf quality, stem weight, spike weight, and whole-plant weight. Under short-term enclosure conditions, the recovery of functional properties such as leaf width, leaf quality, simple leaf quality, stem weight, spike weight, and root weight was not significant (P>0.05). The results suggest that the recovery of P. alpigena traits on degraded grassland due to short-term grazing were associated with conservation. We also determined the spectrum of P. alpigena trait plasticity and observed that phenotypic variations in spike weight, stem weight, total plant weight, number of tillers, stem length, and plant height were high, indicating that these characteristics are sensitive to grazing. Phenotypic variations in leaf width, number of leaves, stem diameter, and root diameter were low, suggesting that these are inert characteristics. Generally, phenotypic changes are significant in the adaptive strategy used by P. alpigena to manage the effects of long-term grazing. Key Words:plateau alpine meadow;Poa alpigena; phenotypic plasticity; individual traits 石红霄,侯向阳,师尚礼,吴新宏,杨婷婷,李鹏.高寒草甸高原早熟禾个体性状对放牧与围封的响应.生态学报,2016,36(12):3601- 3608. ShiHX,HouXY,ShiSL,WuXH,YangTT,LiP.Poa alpigenaresponsetraitsaffectedbygrazingandenclosuresinanalpinemeadowontheQinghai-TibetPlateau.ActaEcologicaSinica,2016,36(12):3601- 3608.