大黄虫丸对Lewis肺癌小鼠免疫状态的影响
赵瑞宝,曹慧慧,张瑞卿,郭晓峰,李俊莲(山西中医学院,山西太原030024)
赵瑞宝,曹慧慧,张瑞卿,郭晓峰,李俊莲
(山西中医学院,山西太原030024)
目的:研究大黄虫丸对Lewis肺癌小鼠免疫状态的影响。方法:取SPF级昆明种小鼠64只,雌雄各半,随机分为空白组、模型组、中药组、西药组。空白组不做任何处理,其余3组分别于每只小鼠右腋窝下注射0.2 mL Lewis肺癌细胞悬液,并于造模后3d进行药物干预。第29天称重、取材,称瘤重,计算抑瘤率;胸腺、脾脏称重,计算胸腺指数和脾指数;酶联免疫吸附法(ELISA法)检测血清白介素2(IL-2),流式细胞仪检测脾脏中CD4+CD25+Foxp3+占CD4+的比例。结果:①抑瘤率:中药组小鼠抑瘤率为44.73%,西药组为48.82%;②对脏器指数的影响:与模型组比较,中药组可提高胸腺指数(P<0.05);中药组、西药组均表现为降低脾指数(P<0.05),且中药组降低程度显著缓慢于西药组(P<0.05);③对脾脏CD4+CD25+Foxp3+占CD4+比例及血清中IL-2水平的影响:与空白组比较,模型组脾脏中CD4+CD25+Foxp3+T-reg占CD4+T-reg的比例明显升高(P<0.01);与模型组比较,中药组和西药组小鼠脾脏中CD4+CD25+Foxp3+T-reg占CD4+T-reg的比例明显下降(P<0.05)。血清内IL-2水平:与空白组比较,模型组小鼠血清中IL-2的分泌水平明显下降(P<0.01);与模型组比较,中药组小鼠血清中IL-2的分泌水平明显升高(P<0.05),西药组小鼠血清中IL-2的分泌水平明显下降(P<0.05)。结论:大黄虫丸能够影响Lewis肺癌小鼠免疫状态,其抑瘤机制可能与降低CD4+CD25+Foxp3+的表达以及提高血清内IL-2水平有关。大黄虫丸在抑瘤的同时能够保护Lewis肺癌荷瘤小鼠免疫器官,提高小鼠机体的免疫机能。
大黄虫丸;Lewis肺癌;免疫
●“实验”虽然是现代科学研究常用的方法,然在我国却自古有之。古代学者王冲说“等类众多,行事比肩,略举较著,以定实验也”,颜之推说“昔在江南,不信有千人帐,及来河北,不信有二万斛船,皆实验也”,大凡此义均与现代科学意义上的experiment相通。照此,传统中医药学并非只是经验之学,而更充满实验的思想和方法。实验中医药学,将现代实验科学的方法和传统中医药学的实验方法融合起来,开拓现代实验生物学、医学和药物科学的新领域。
1 材料与方法
1.1实验材料
1.1.1实验动物SPF级昆明种小鼠,64只,5~6 w龄,体质量(18±0.2)g,雌雄各半,由山西医科大学动物实验中心购入。
1.1.2细胞小鼠Lewis肺癌细胞株(LLC),购自中国科学院上海生命科学研究院细胞资源中心。
1.1.3药物与试剂小鼠白介素-2(IL-2)ELISA试剂盒(批号:201407061);500 μg FITC anti-mouse CD4(批号:100510);100 μg PE anti-mouse CD25(批号:101904);无支原体胎牛血清(未经灭活)(浙江天杭生物科技有限公司,批号:130825);DULBECCO′S PHOSPHATE BUFFERED SALINE (PBS)(批号:20131015);DMEM/HIGH GLUGOSE (1×)(批号:NYJ0960);胰蛋白酶-EDTA消化液(批号:20131118);大黄虫丸(北京同仁堂,批号:9013138);冻干型顺铂粉剂(批号:311030208)。
1.1.4 实验仪器酶标仪:型号DENLEY DRAGON Wellscan MK 3(芬兰Thermo公司);ENCO21246二氧化碳培养箱;FACSCalibur流式细胞仪(美国BD公司);0.1~50 mL分液器;连续分液器(Tomos Life Science Group)。
1.2实验方法
1.2.1实验分组昆明种小鼠64只,雌雄各半,体质量(18±0.2)g,自然光照,自由饮食饮水,相同条件下适应性饲养3d(饲料由山西医科大学购入,为普通鼠饲料),随机分为空白组、模型组、中药组、西药组,每组16只,雌雄各半。
1.2.2Lewis肺癌模型的建立小鼠Lewis肺癌细胞株置于含有10%胎牛血清、100 U/mL青霉素及100 mg/L链霉素的培养液中,放入5%CO2,37℃饱和湿度的培养箱中培养,每1~2d换1次培养液,每3~4d进行1次传代。收集处于对数期的Lewis肺癌细胞,调整浓度为1×107/mL制成单细胞悬液,于模型组、中药组和西药组的每只小鼠右腋窝皮下注射0.2 mL,空白组小鼠在相同部位注射等量的生理盐水[3-4]。
1.2.3给药剂量及方法造模第4天进行药物干预。中药组予以大黄虫丸混悬液灌胃给药。将3g大黄虫丸(1粒)溶于55.5 mL生理盐水中,在磁力搅拌机作用下制成混悬液,根据“人和动物体表面积折算的等效剂量比率表”[5]计算小鼠用药量,即大黄虫丸的给药剂量为1.17g/kg,每天灌胃1次。西药组予化疗药顺铂(DDP)作阳性对照,每只小鼠按1 mg/kg腹腔注射[1],第4、11、18、25天各给药1次。空白组和模型组予以等容积蒸馏水灌胃,每天1次,连续25d。
y=a×0.018,其中y为小鼠用药量,a为人日用剂量。
1.3观察指标
1.3.1小鼠血清IL-2的含量测定第29天摘眼球取血处死小鼠,收集的全血用离心机以3 000 r/min的转速离心10min,收集并分装血清,按照(IL-2)ELISA试剂盒说明书采用ELISA法检测小鼠血清IL-2的含量。
1.3.2胸腺及脾脏指数的测定小鼠处死后,无菌剖开胸和腹腔,迅速取出胸腺、脾脏,放入PBS缓冲液中反复冲洗,洗去组织表面血污后,用滤纸吸干,称重记录,并通过以下公式计算其胸腺指数(TI)和脾指数(SI)[7]。
1.3.3肿瘤抑瘤率的测定在无菌环境完整地剥离小鼠右腋窝皮下的肿瘤,剔除瘤块上附着的脂肪等非肿瘤组织,称取瘤体重量,记录、并计算抑瘤率。
1.3.4脾脏中CD4+CD25+Foxp3+T-reg占CD4+T-reg比例的测定各组小鼠处死后,在无菌环境取出小鼠脾脏称重后研磨,提取出淋巴细胞,加入少量PBS缓冲液(少于4 mL)冲洗1遍,1 500 r/min离心5min,弃上清液。用PBS缓冲液调整细胞浓度为1×107/mL,加入FITC-anti-CD4+和APC-anti-CD25+抗体各5 μL,行表面染色,避光孵育20min,加Buffer 2 mL冲洗,1 000 r/min离心4min,弃上清液。轻轻摇起细胞后,加1 mL破膜固定液,混匀,避光孵育13min,加Buffer 2 mL终止破膜,1 000 r/min离心4min,弃上清液。加Foxp3抗体,避光孵育30min,加Buffer 2 mL,离心,弃上清,悬起细胞,加250 μL PBS缓冲液,悬起摇匀,用流式细胞仪进行检测。
1.4统计学方法
2结果
2.1各组小鼠抑瘤率比较
与模型组比较,中药组、西药组的瘤重明显减轻(P<0.05),说明两种药物均对Lewis肺癌小鼠肿瘤有抑制作用;中药组与西药组抑瘤率比较差异无统计学意义(P>0.05)。结果见表1。
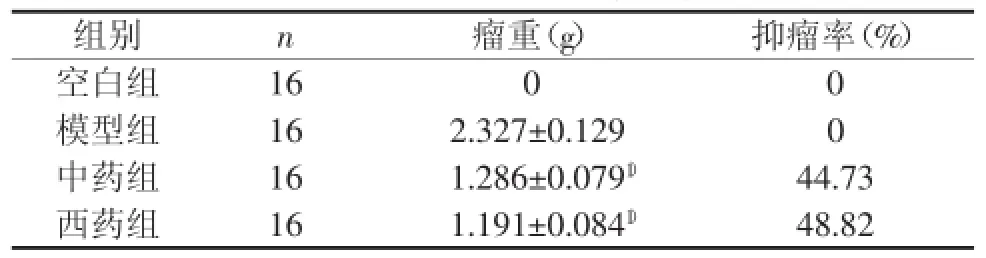
表1 各组小鼠抑瘤率比较
2.2各组小鼠胸腺指数、脾指数变化比较
与空白组比较,模型组的胸腺指数明显降低(P<0.05),说明小鼠注射Lewis肺癌细胞后,导致胸腺指数降低,免疫功能降低;与模型组比较,中药组胸腺指数明显升高(P<0.05),西药组的胸腺指数明显降低(P<0.05),说明造模小鼠进行中药干预后,提升了胸腺指数;脾指数中,模型组小鼠脾重指数明显比空白组小鼠脾指数高(P<0.05),中、西药物组与模型组小鼠相比脾指数明显降低(P<0.05);中药组小鼠脾指数高于西药组(P<0.05)。结果见表2。
表2 各组小鼠胸腺指数、脾重指数变化比较 (±s)

表2 各组小鼠胸腺指数、脾重指数变化比较 (±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与西药组比较,3)P<0.05
组别 n TI SI空白组 16 4.53±0.48 7.14±1.13模型组 16 2.13±0.301) 9.27±1.081)西药组 16 1.65±0.762) 4.28±1.192)中药组 16 3.74±0.402)3) 8.18±1.572)3)
2.3脾脏内CD4+CD25+Foxp3+T-reg占CD4+的比例和血清IL-2的含量比较
与空白组比较,模型组、中药组、西药组的脾脏中CD4+CD25+Foxp3+T-reg占CD4+T-reg的比例明显升高(P<0.01)。与模型组比较,中药组和西药组小鼠中脾脏的CD4+CD25+Foxp3+T-reg占CD4+T-reg的比例明显下降(P<0.05),说明小鼠注射Lewis肺癌细胞后,导致小鼠脾脏中CD4+CD25+Foxp3+T-reg占CD4+T-reg的比例升高,中药大黄虫丸和西药顺铂均可降低脾脏中的CD4+CD25+Foxp3+T-reg比例。与空白组比较,模型组、中药组、西药组小鼠血清中IL-2水平明显下降(P<0.01)。与模型组比较,中药组小鼠血清中IL-2水平明显升高(P<0.05),西药组小鼠血清中IL-2水平明显下降(P<0.05),说明造模小鼠进行药物干预后,中药大黄虫丸可改善机体免疫状态,提升细胞因子血清IL-2的分泌水平;而西药顺铂则会降低血清IL-2的分泌水平,影响免疫效应。结果见表3和图1。
表3 脾脏内CD4+CD25+Foxp3+T-reg/CD4+比例和血清IL-2的含量(±s)

表3 脾脏内CD4+CD25+Foxp3+T-reg/CD4+比例和血清IL-2的含量(±s)
注:与空白组比较,1)P<0.01;与模型组比较,2)P<0.05
组别 n CD4+CD25+Foxp3+/CD4+(%) IL-2(pg/mL)空白组 16 2.36±0.12 20.076±0.406模型组 16 8.29±0.341) 5.859±0.2301)中药组 16 3.97±0.631)2) 15.229±0.3671)2)西药组 16 4.15±0.651)2) 4.151±0.4861)2)
3讨论
CD4+CD25+Foxp3+T-reg与肿瘤免疫耐受机制的关系一直是众多学者的研究热点[8-9]。其中CD4+CD25+调节性T细胞是一类具有免疫调节作用的T细胞亚群,在维持机体免疫自稳、调控免疫应答方面起重要作用。研究发现在肺癌的发生发展中CD4+CD25+调节性T细胞比例增高,说明肺癌患者机体的免疫系统抑制其产生有效的抗肿瘤免疫应答,导致肿瘤细胞逃避免疫监视,发生免疫逃逸[10]。而Foxp3来源于胸腺,是公认的CD4+CD25+T-reg细胞的特异性标志,已经成为调节性T细胞研究中的热点,且很有希望发展成为肿瘤患者免疫干预治疗的新的特异性靶点[11],常与CD4+CD25+细胞合用。IL-2即白细胞介素2(Interleukin-2,IL-2),又名T细胞生长因子(T cell growth factor,TCRF),是免疫应答调控过程中的重要因子。现代肿瘤免疫学通过实验证实IL-2可通过刺激T淋巴细胞增殖,尤其通过杀伤T细胞(Tc)的增殖与分化,达到杀伤肿瘤细胞的目的[12]。因此提高IL-2在机体血清中的含量,增强机体免疫功能是现代治疗肿瘤的一个思路。
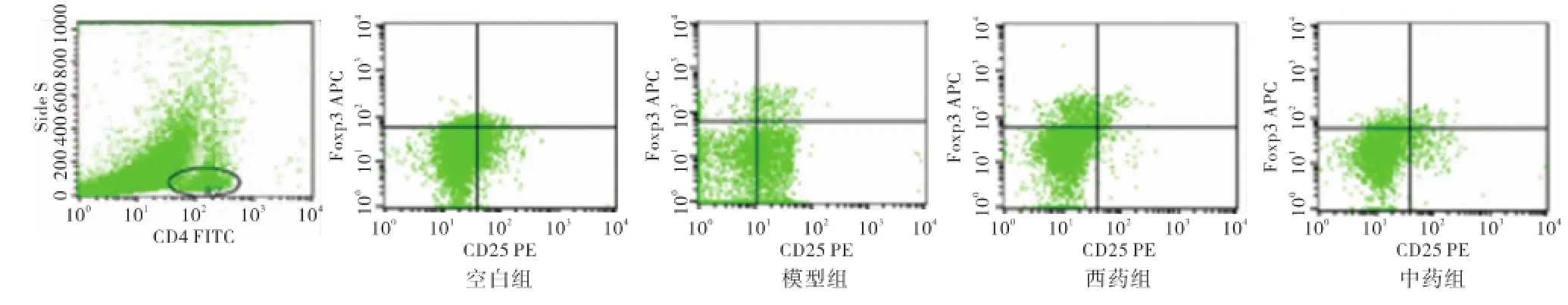
图1 Lewis肺癌小鼠脾脏CD4+CD25+Foxp3+T-reg占CD4 T-reg的比例
[1]李俊莲,吴晋英,陈筱云.大黄虫丸的抗肿瘤作用机理浅析[J].世界中西医结合杂志2010,6(5):453-455.
[2]宁耀瑜,杨志平,张明安.绿茶AFB致大鼠肝癌作用中对免疫功能的影响[J].广西医学院学报,1990,7(1):27-29.
[3]刘馨,伍治平,佐曙光,等.小鼠Lewis肺癌原位模型的构建[J].中国肺癌杂志,2010,13(1):42-47.
[4]李春燕,王颖,刘浩,等.C57BL/6近交系小鼠Lewis肺癌动物模型:建设性描述肺癌损害程度的指标[J].中国临床康复,2003,7(26):3 582-3 583.
[5]徐淑云,卞如濂,陈修.药理实验学方法[M].3版.北京:人民卫生出版社,2002:202-205.
[6]薛松,钟美佐,刘巍,等.黄芪扶正汤抗小鼠Lewis肺癌机制的实验研究[J].肿瘤药学.2011,1(1):37-39.
[7]吴益平,戴关海.消瘤冲剂对Lewis肺癌小鼠免疫功能影响的实验研究[J].浙江中西医结合杂志.2010,20(10):595-596.
[8]Pausl S,Cantor H.Regullatory T cells and autoimmune disease[J].Immunol Rev,2005,204(2):195-207.
[9]Takahashi T,Sakaguchi S.The role of regulatory T cells in controlling immunologic self-tolerance[J].Int Rev Cytol,2003,225(3):1-32.
[10]方乐,潘凌霄,黎雅婷,等.复方小柴胡汤对荷EAC鼠IL-2水平和CD4+/CD8+比值的影响[J].中国病理生理杂志,2007,23(9):1 720-1 723.
[11]段巧虹,王刚,罗庆礼,等.食管癌患者化疗前后CD4+CD25 high调节性T细胞及Foxp3 mRNA的表达及其临床意义[J].临床肿瘤学杂志,2009,14(3):196.
[12]汤钊猷.现代肿瘤学[M].上海:上海医科大学出版社,1993:381-384.
(编辑:翟春涛)
The Influence of Dahuang Zhechong Bolus on Lewis Lung Cancer Mice
Zhao Ruibao,Cao Huihui,Zhang Ruiqing,Guo Xiaofeng,Li Junlian
(Shanxi College of TCM,Taiyuan Shanxi 030024)
Objective:To study the influence of Dahuang Zhechong pills on Lewis lung cancer mice.Method:64 SPF Kunming mice,half male and half female,were randomly divided into 4 groups:blank group,model group,TCM group and western medicine group.Blank group receives no medicine,as for other 3 groups,every mouse was injected 0.2 ml Lewis lung cancer cell suspension at the right maxillary,and began the medical interference 3 days after the modeling.On the 29thday,the mice were weighed;the tumors and spleens were cut and weighed,tumor inhibition rate,thymus index and spleen index were calculated.Serum interleukin2(IL-2)was tested with ELISA.The rate of CD4+CD25+Foxp3+in CD4+was tested with flow cytometer.Result:①Tumor inhibition of TCM group was 44.73%,and that of the western medicine group was 48.82%.②The effect on organ index:compared with the model group,the thymus index of the TCM group was increased(P<0.05);the spleen indice of the TCM group and the western medicine group were decreased(P<0.05),and the TCM group decreased obviously slower than that of the western medicine group(P<0.05).③the effect on the proportion of CD4+CD25+Foxp3+in CD4+and IL-2 level in serum:compared with the blank group,the proportion of CD4+CD25+Foxp3+T-reg in CD4+T-reg was increased obviously in model group(P<0.01).Compared with the model group,the proportion of CD4+CD25+Foxp3+T-reg in CD4+T-reg in the spleen of the TCM group and the western medicine group were decreased (P<0.05).The IL-2level serum:compared with the blank group,the IL-2 level in the serum of the model group,the TCM group and the western medicine group decreased obviously(P<0.05).Compared with the modeling group,the IL-2 level in serum of the TCM group was increased obviously(P<0.05),while for the western medicine group,the IL-2 level in serum was decreased(P<0.05).Conclusion:Dahuang Zhechong pills can affect the immune statue of Lewis lung cancer mice.Its tumor inhibition mechanism may relate to the expression lowering of CD4+CD25+Foxp3+and the serum IL-2 level. DahuangZhechong Bolus has the function of tumor inhibition,at the same time it can protect the immune organ of Lewis lung cancer mice and promote the immune function of the mice.
Dahuang Zhechong pills;Lewis lung cancer;immune
R285.5
A
1671-0258(2016)03-0013-04
国家自然基金项目(81173155);山西省自然基金项目(2013011046-9);山西省国际合作项目(2014081049-6)
赵瑞宝,讲师,E-mail:zhaoruibao@126.com
李俊莲,教授,硕士研究生导师,E-mail:shanxidali@126.com

