常压下甲醇-聚甲氧基二甲醚二元体系汽液平衡
王丰阳,梁欢欢,周彩荣
常压下甲醇-聚甲氧基二甲醚二元体系汽液平衡
王丰阳,梁欢欢,周彩荣
(郑州大学化工与能源学院,河南 郑州 450001)
摘要:在101.3 kPa恒定压力下,采用改进的Rose汽液平衡釜测定了甲醇-DMM3(聚甲氧基二甲醚,聚合度为n,即 DMMn)二元体系汽液平衡数据,并对汽液平衡数据进行热力学一致性检验,结果表明所测定数据符合Gibbs-Duhenm的热力学一致性。用Aspen Plus v7.1计算机软件,分别对Wilson、NRTL、UNIQUAC活度系数模型进行关联,由最大似然法对目标函数进行优化,回归出相应的二元交互作用参数。将关联结果与实验结果相比较,得到关联值与实验值的温度和汽相组成的平均绝对偏差,分别小于0.65 K和0.0065。为化工数据库增添了内容,也为含甲醇、DMM3体系的工程设计和进一步深入研究奠定了基础。
关键词:汽液平衡;甲醇;DMM3;热力学模型
引 言
聚甲氧基二甲醚(聚合度为n,即DMMn)可用作新型柴油添加剂和无芳烃绿色环保型溶剂[1-2]。其作为柴油添加剂的有效成分主要是聚合度为 3~ 8的组分,即DMM3~8。DMM3~8具有高的闪点和高的十六烷值以及能够改善柴油在柴油机中的燃烧性能,其优越表现受到广泛关注。2014年我国柴油表观消费量约为1.67亿吨,若向柴油中加入15%的 DMM3~8,我国每年对 DMM3~8的潜在需求量为2500万吨。这在一定程度上能够缓解甲醇产能过剩,且将廉价的甲醇转变为高附加值产品[3]。工业生产过程中为获得较高纯度的目标产物(DMM3~8),需采用精馏分离技术对合成 DMMn过程中产生的产物、副产物及未反应原料(如甲醇,甲缩醛等)进行分离[4-8]。实现上述分离设计需要相应组分的汽液平衡数据。目前国内外只有数篇文献报道了有关甲醇、甲缩醛、DMM2等轻组分不同体系的汽液平衡数据[9-11],而有关DMM3及更高聚合度组分的汽液平衡数据尚未见报道。本文通过实验测定了常压下甲醇-DMM3二元体系的汽液平衡数据,并分别用Wilson、NRTL和UNIQUAC模型进行关联,回归出二元交互作用参数,为分离设计与优化提供必要的汽液平衡数据,并为多元体系热力学性质的预测提供数据依据。
1 实验部分
1.1 实验试剂
甲醇:色谱纯,质量分数≥99.9%,天津市科密欧化学试剂有限公司。DMM3:由实验室制备,经无水碳酸钾除水后多次蒸馏得到,气相色谱分析质量分数>99.6%,常压下测得沸点为428.71 K,与文献值[12]429.05 K基本相吻合。异丙醇:分析纯,质量分数≥99.7%,天津市风船化学试剂科技有限公司。正己烷:分析纯,质量分数≥99.5%,天津市科密欧化学试剂有限公司(内标物)。
1.2 实验装置及分析仪器
改进的Rose汽液平衡釜,容量50~70 ml;自制恒压装置,精度±100 Pa,汽液平衡釜准确性已经过检验[9];50~100℃,100~150℃,150~200℃精密温度计,精度0.1℃。实验中均对精密温度计进行了刻度校正及露颈校正。分析天平(FA1004型,上海精科天平)。GC/FID-900A气相色谱(上海科创色谱仪器有限公司)。
1.3 实验方法
向 Rose汽液平衡釜中加入适量的甲醇,连接恒压装置等。用加热棒加热,通过调节电源电压使汽相冷凝液以20~30滴·min-1的速率进行循环。每隔30 min记录一次温度,平衡时间3 h以上,并且精密温度计示数已经恒定,认为此时达到汽液平衡。记录平衡时的温度,之后同时对汽相冷凝液及液相取样并分别置于称重过的5 ml容量瓶中,再次对容量瓶称重、记录。向容量瓶中加入0.2 ml正己烷并称重、记录,用异丙醇定容后待测。在进行下一个平衡点测定时,先从Rose釜液相取样口移出适量的液相组分,再向Rose釜中加入与移出总量等量的DMM3,重复上述实验步骤。当液相中甲醇质量分数降至约30%,可从 DMM3纯组分做起。如果Rose釜温度比甲醇沸点高很多,加入甲醇时应使甲醇逐滴缓慢加入,以防止因局部甲醇浓度较高而出现瞬间爆沸。
1.4 分析方法
使用GC/FID-900A气相色谱,采用中科院兰州化物所生产的SE-54毛细管柱(30 m × 0.53 mm × 1 μm),固定相组成为1%乙烯基5%苯基甲基聚硅烷氧烷。分析条件为:柱箱60℃,汽化240℃,检测器280℃。程序升温设置为柱箱温度停留2 min,之后以20℃·min-1升温至150℃。载气为氮气,柱前压0.04 MPa,气速为40 ml·min-1。
在上述色谱条件做甲醇内标标准曲线,其标准曲线的相关系数为R2=0.99947。
实验中对达到平衡的汽相和液相样品分析至少4次,选取相近的3组数据求平均值。
2 实验结果与讨论
在101.3 kPa恒定压力下测定了甲醇-DMM3二元体系的汽液平衡数据,其结果见表1。
在常压条件下,汽液相平衡关系可以通过修订拉乌尔定律来表示[13]。汽相可视为理想气体,液相的非理想性由活度系数表示。汽液相平衡关系可表述为

式中,p为系统的总压,yi为组分i在汽相中的摩尔组成,psi为纯组分i的饱和蒸气压,xi为组分i在液相中的摩尔组成,γi为液相中组分i的活度系数。组分i的饱和蒸气压可以通过Antoine方程得到。甲醇[10]、DMM3[12]的Antoine方程参数列于表2。
2.1 热力学一致性检验
检验汽液平衡数据可使用Gibbs-Duhenm方程活度系数形式。二元体系在恒压条件下的Gibbs-Duhenm方程积分形式如式(2)所示。

由于式(2)右侧积分结果难以确定,常采用Herington半经验式[14-16],相应的方程如式(3)~式(6)。


表1 常压下甲醇(1)+DMM3(2)汽液平衡数据及用Wilson、NRTL和UNIQUAC模型关联结果Table 1 VLE data and fitting results of methanol+DMM3by Wilson, NRTL and UNIQUAC models at a normal atmospheric pressure

表3 甲醇和DMM3的Antoine方程参数Table 2 Antoine parameters of methanol and DMM3

式中,Tmin为体系的最低温度,Tmax为体系的最高温度。150为Herington分析典型有机溶液混合热所确定的经验常数。δ是ln(γ1/γ2)-x1曲线下面积的代数和;φ是 ln(γ1/γ2)-x1曲线下的总面积。经验证明,如果实测数据是符合热力学一致性的,则D < J;否则,就不符合热力学一致性[9,17]。
根据汽液平衡数据得到的液相活度系数见表1,做ln(γ1/γ2)-x1曲线,如图1所示。

图1 ln(γ1/γ2)-x1图Fig.1 Diagram of ln (γ1/γ2)-x1
计算结果表明D=19.13,J=40.44。亦即D < J,由此表明实验结果是符合热力学一致性检验的。
2.2 实验数据关联
2.2.1 理论模型 Wilson、NRTL、UNIQUAC方程均能用二元参数直接预测多元体系汽液平衡[18]。对于不同体系,各活度系数模型与实验数据关联效果不尽相同。如Wilson方程对烃、醇物系的回归效果较好,而用其他模型回归效果不佳。因而选择合适的模型对获取更多数据及提高预测结果准确性十分重要。Wilson方程能准确地描述烃、醇、醚、酮、腈、酯及含水、硫、卤素互溶体系的活度系数。与Wilson方程相比,NRTL方程中引入了一个能反应体系特征的参数αij,即非随机参数。αij值一般在0.2~0.47之间,对于非极性和不缔合极性组分混合物,普遍将αij=0.3作为固定值处理[19]。NRTL方程最突出的优点是能用于部分互溶体系。UNIQUAC方程中分别反映了分子大小、形状及分子间相互作用对活度系数的影响,仅用两个可调参数便可用于描述部分互溶体系(NRTL方程需要3个)。此外,该方程也适用于分子大小悬殊的体系,如聚合物溶液。采用上述3个模型,使用Aspen Plus软件对实验数据进行关联时,为提高关联结果的准确性,Aspen Plus中设置了多个参数(aij,aji,bij,bji)。除NRTL模型中的cij外,其他缺少的参数(如dij、dji、eij、eji)均作为0[20]。
Wilson模型


式中,aij≠aji,bij≠bji,cij≠cji,dij≠dji。
NRTL模型
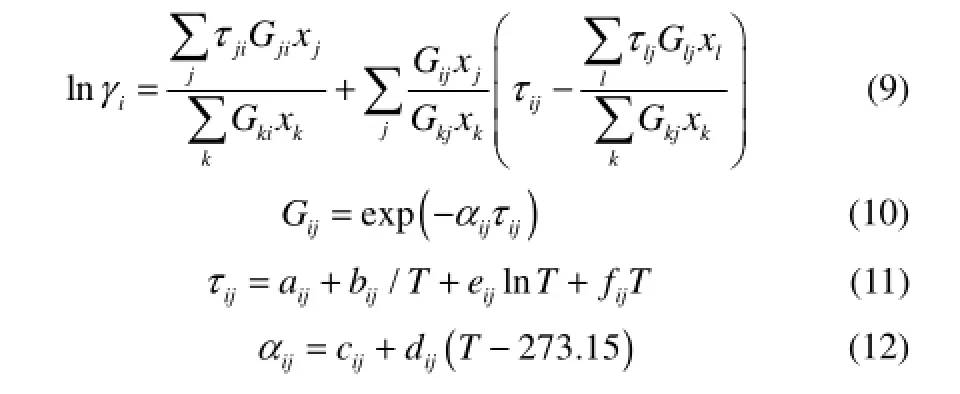
式中,αij=0.3;τii=0;Gii=1;aij≠aji,bij≠bji,cij≠cji,dij≠dji。
UNIQUAC模型

式中,Z=10;aij≠aji,bij≠bji,cij≠cji,dij≠dji。
2.2.2 模型关联结果 借助Aspen Plus v7.1软件,采用最大似然法,分别用Wilson、NRTL、UNIQUAC活度系数模型对实验结果进行关联。NRTL模型非随机参数α12(cij)=0.3作为固定值进行回归运算。回归出相应的模型参数见表3。

表3 Wilson、NRTL和UNIQUAC模型参数Table 3 Parameters of Wilson, NRTL and UNIQUAC models
Wilson、NRTL、UNIQUAC模型参数可以通过式(18)~式(20)来确定。

通过对汽液平衡数据关联分别得到了平衡时温度和汽相组成的计算值,将计算值与实验值进行比较,得到计算值与实验值的绝对偏差见表 1。选取目标函数为温度平均绝对偏差 σT和汽相组分的平均绝对偏差σy,分别见式(21)和式(22)。

用Wilson、NRTL、UNIQUAC模型关联结果为温度平均绝对偏差σT分别为0.61,0.61,0.61。汽相组成的平均绝对偏差σy分别为0.0060、0.0061、0.0061。三者关联的结果相差不大,都能够用于关联常压下甲醇-DMM3二元体系的汽液平衡数据。实验值与计算值的T-x1-y1图见图2~图4,汽液平衡相图见图5。
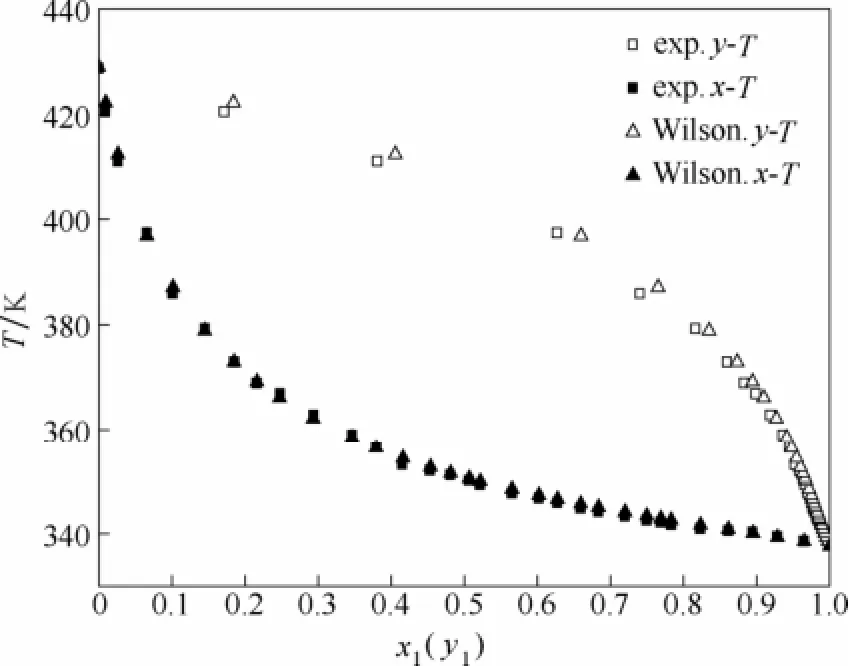
图2 甲醇(1)-DMM3(2) T-x1-y1图(Wilson模型)Fig.2 T-x1-y1diagram of methanol(1)-DMM3(2)system(Wilson model)

图3 甲醇(1)-DMM3(2) T-x1-y1图(NRTL模型)Fig.3 T-x1-y1diagram of methanol(1)-DMM3(2)system(NRTL model)

图4 甲醇(1)-DMM3(2) T-x1-y1图(UNIQUAC模型)Fig.4 T-x1-y1diagram of methanol(1)-DMM3(2)system(UNIQUAC model)

图5 甲醇(1)-DMM3(2) x1-y1图Fig. 5 x1-y1diagram of methanol(1)-DMM3(2) system
3 结 论
实验测定了甲醇-DMM3在101.3 kPa恒定压力下的汽液平衡数据。用 Herington半经验式对汽液平衡数据进行热力学一致性检验,结果符合热力学一致性。
使用Wilson、NRTL、UNIQUAC活度系数模型分别对汽液平衡数据进行关联。关联结果与实验结果相比,温度平均绝对偏差σT均小于0.65 K,汽相组分平均绝对偏差σy均小于0.0065,三者关联结果相近。回归出的二元交互作用参数能够用于含甲醇-DMM3多元体系分离的设计与优化。
符 号 说 明
A~F——Antoine常数
aij——二元交互作用参数
bij——二元交互作用参数
HE——混合热
p ——系统的总压,

qi——纯物质参数
ri——纯物质参数
Tmax——体系的最高温度,K
Tmin——体系的最低温度,K
ΔT ——温度实验值与关联值的差,K
xi——组分i在液相中的摩尔组成
yi——组分i在汽相中的摩尔组成
Δy ——汽相组成实验值与关联值的差
Z ——晶格配位数
α12——NRTL模型非随机参数
γ ——活度系数
δ ——ln(γ1/γ2)-x1曲线下面积的代数和
θi——纯物质i的平均面积分数
Λij——Wilson 方程参数
σT——温度平均绝对偏差
σy——汽相组分的平均绝对偏差
τij——NRTL、UNIQUAC模型二元可调参数
ϕi——纯物质i的体积分数
φ ——ln(γ1/γ2)-x1曲线下的总面积
上角标
E ——超额性质
s ——饱和状态
下角标
cal ——计算值
exp ——实验值
1,2,i,j ——组分
References
[1] 杨丰科, 王俊伟. 柴油添加剂聚甲氧基二甲醚的合成研究进展[J].应用化工, 2012, 41(10): 1803-1806.
YANG F K, WANG J W. Progress on the synthesis of polyoxymethylene dimethyl ethers as component of tailored diesel fuel[J]. Applied Chemical Industry, 2012, 41(10): 1803-1806.
[2] ECHHARD S, HANS H, SERGEJ B. Method for producing polyoxymethylene dimethyl ethers from methanol and formaldehyde: US7671240[P]. 2010-03-02.
[3] 史高峰, 陈英赞, 陈学福, 等. 聚甲氧基二甲醚研究进展[J]. 天然气化工(C1化学与化工), 2012, 37(2): 74-78.
SHI G F, CHEN Y Z, CHEN X F, et al. Research progress in polyoxymethylene[J]. Natural Gas Chemical Industry, 2012, 37(2): 74-78.
[4] 苗剑, 史高峰, 王国英, 等. 基于Aspen Plus的聚甲氧基二甲醚精馏过程模拟分析[J]. 计算机与应用化学, 2015, 32(1): 119-123. DOI: 10.11719/com.app.chem20150126.
MIAO J, SHI G F, WANG G Y, et al. Process for polyoxymethylene dimethyl ethers by Aspen Plus [J]. Computers and Applied Chemistry, 2015, 32(1):119-123. DOI: 10.11719/com.app.chem20150126.
[5] HAGEN G P, SPANGLER M J. Preparation of polyoxymethylene dimethyl ethers by catalytic conversion formaldehyde formed by oxidation of dimethyl ethers: US6392102[P]. 2002-05-21.
[6] HAGEN G P, SPANGLER M J. Preparation of polyoxymethylene dimethyl ethers by acid-catalytic conversion of methanol with formaldehyde formed by dehydrogenation of methanol: US6437195 [P]. 2002-08-20.
[7] HAGEN G P, SPANGLER M J. Preparation of polyoxymethylene dimethyl ethers by acid-activated catalytic conversion of methanol with formaldehyde formed by oxy-dehydrogenation of dimethyl ether: US6265528[P]. 2001-07-24.
[8] MANNHEIM E S, KAISERSLAUTERN H H, STUTTGART S B. Process for preparing polyoxymethylene dimethyl ethers from methanol and formaldehyde: US7700809[P]. 2010-08-20.
[9] 周彩荣, 张丽, 梁欢欢, 等. 甲缩醛-甲醇二元系汽液平衡数据的测定与关联[J]. 高校化学工程学报, 2015, 29(5): 1032-1037. DOI: 10.3969/j.issn.1003-9015.2015.00.021.
ZHOU C R, ZHANG L, LIANG H H, et al. Measurement and correlation for the vapor-liquid equilibrium of methylal + methanol binary system[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(5): 1032-1037. DOI: 10.3969/j.issn.1003-9015. 2015.00.021.
[10] 宋玉鹤, 李青松, 丁建飞, 等. 甲醇-甲缩醛-聚甲醛二甲基醚体系汽液平衡[J]. 化学工程, 2015, 43(2): 30-34. DOI: 10.3969/j.issn. 1005-9954.2015.02.007.
SONG Y H, LI Q S, DING J F, et al. Vapor-liquid equilibrium for methanol-methylal-polymethoxy methylal (n=2) system[J]. Chemical Engineering, 2015, 43(2): 30-34. DOI: 10.3969 /j.issn.1005-9954. 2015.02.007.
[11] ALBERT M, HAHNENSTEIN I, HASSE H, et al. Vapor-liquid and liquid-liquid equillibria in binary and ternary mixtures of water, methanol, and methylal[J]. Journal of Chemical & Engineering Data, 2001, 46 (4): 897-903. DOI: 10.1021/je000352l.
[12] BOYD R H. Some physical properties of polyoxymethylene dimethyl ethers[J]. Journal of Polymer Science, 1961, 50(153): 133-141. DOI: 10.1002/pol.1961.1205015316.
[13] LORENZO D, SANTOS A, ROMERO A. Vapor-liquid equilibria of cyclohexanone + 2-cyclohexen-1-one and cyclohexanol + 2-cyclohexen-1-one, validated in a packed column distillation[J]. Journal of Chemical & Engineering data, 2015, 60(10): 2818-2826. DOI: 10.1021/je501135p.
[14] 马沛生, 李永红. 化工热力学[M]. 2版. 北京: 化学工业出版社, 2009: 148-151.
MA P S, LI Y H. Chemical Engineering Thermodynamics[M]. 2nd ed. Beijing: Chemical Industry Press, 2009: 148-151.
[15] 王训遒, 闫炳利, 付丽. 常压下环己烷-环氧环己烷二元体系汽液平衡研究[J]. 高校化学工程学报, 2012, 26(4): 547-551.
WANG X Q, YAN B L, FU Li. Study on the vapor-liquid equilibrium for cyclohexane – 1,2-epoxycyclohexane binary system under normal atmospheric pressure[J]. Journal of Chemical Engineering of Chinese Universities, 2012, 26(4): 547-551.
[16] MARTINS V D, GRANATO M A, RODRIGUES A E. Isobaric vapor-liquid equilibrium for binary systems of 2,2,4-trimethylpentane with o-xylene, m-xylene, p-xylene, and ethylbenzene at 250 kPa[J]. Journal of Chemical & Engineering Data, 2014, 59 (5): 1499-1506. DOI: 10.1021/je401057z.
[17] 曾庆荣, 王桂英, 王广铨. 环己烷-乙烯基降冰片烯体系汽液平衡数据测定及关联[J]. 化工学报, 2004, 55(10): 1621-1625.
ZENG Q R, WANG G Y, WANG G Q. Measurement and correlation of cyclohexane-5-ethenyl-2-bicyclo [2.2.1] hept-2-ene binary system vapor-liquid equilibrium data[J]. Journal of Chemical Industry and Engineering (China), 2004, 55(10): 1621-1625.
[18] 陈钟秀, 顾飞燕, 胡望明. 化工热力学[M]. 2版. 北京: 化学工业出版社, 2001: 94-97.
CHEN Z X, GU F Y, HU W M. Chemical Engineering Thermodynamics[M]. 2nd ed. Beijing: Chemical Industry Press, 2001: 94-97.
[19] 西德尔, 亨利. 分离过程原理[M]. 朱开宏, 吴俊生, 译. 上海: 华东理工大学出版社, 2007: 78.
SEADER J D, HENLEY E J. Separation Process Principles [M]. ZHU K H, WU J S, trans. Shanghai: East China University of Science and Technology Press, 2007: 78.
[20] 孙兰义. 化工流程模拟实训——Aspen Plus教程[M]. 北京: 化学工业出版社, 2012: 35-38.
SUN L Y. Chemical Engineering Process Simulation Using Aspen Plus[M]. Beijing :Chemical Industry Press, 2012: 35-38.
2015-12-29收到初稿,2016-04-11收到修改稿。
联系人:周彩荣。第一作者:王丰阳(1991—),男,硕士研究生。
Received date: 2015-12-29.
中图分类号:O 642.42
文献标志码:A
文章编号:0438—1157(2016)07—2685—07
DOI:10.11949/j.issn.0438-1157.20151985
基金项目:河南省教育厅重点科技攻关项目(13A530712)。
Corresponding author:ZHOU Cairong, zhoucairong@zzu.edu.cn supported by the Key Scientific Research Foundation of Zhengzhou Education Bureau, Henan Province (13A530712).
Vapor-liquid equilibrium for methanol + polyoxymethylene dimethyl ethers binary system under normal atmospheric pressure
WANG Fengyang, LIANG Huanhuan, ZHOU Cairong
(School of Chemical and Energy Engineering, Zhengzhou University, Zhengzhou 450001, Henan, China)
Abstract:At 101.3 kPa constant pressure, the VLE data of methanol-DMM3(polyoxymethylene dimethyl ethers with degree of polymerization of n, i.e., DMMn) system were determined by using an improved Rose still. Thermodynamic consistency of the obtained vapor liquid equilibrium data were examined. The results were satisfied with Gibbs-Duhenm’s thermodynamic consistency. The VLE data were correlated by Wilson, NRTL and UNIQUAC activity coefficient model by Aspen Plus v7.1. The objective function was optimized by the maximum likelihood method and the corresponding model parameters were returned. Compared with the experimental results, the average absolute deviations for temperature and the composition in the vapor phase were less than 0.65 K and 0.0065, respectively. This work provides the important engineering data for an engineering design and further study in the multicomponent system containing methanol and DMM3.
Key words:vapor-liquid equilibrium; methanol; DMM3; thermodynamic model

