红肉火龙果酒天然酵母发酵期间品质变化研究
袁星星,余元善,吴继军,肖更生,徐玉娟,李 俊
(1.江西农业大学食品科学与工程学院,江西 南昌 330045;2.广东省农科院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州 510610)
红肉火龙果酒天然酵母发酵期间品质变化研究
袁星星1,2,余元善2,吴继军2,肖更生2,徐玉娟2,李 俊2
(1.江西农业大学食品科学与工程学院,江西 南昌 330045;2.广东省农科院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广东 广州 510610)
分析了红肉火龙果酒天然酵母发酵期间其糖组分、酒精度、pH、可滴定酸、总酚、抗氧化活性、甜菜苷含量、色泽、甲醇、高级醇和挥发性风味成分等的变化规律。结果表明,20℃发酵6 d后,可转化糖全部耗尽,酒精度达到10%(V/V)以上,该天然酵母菌株的起酵速度和转化糖利用率明显优于目前常用的商业葡萄酒酵母。发酵期间,火龙果酒中高级醇(异丁醇、3-甲基丁醇、2-甲基丁醇)和甲醇的含量均处于正常果酒含量范围内,并且也没有观察到明显的色泽变化。随着酵母发酵的进行,新鲜火龙果中正己醇(及其衍生物)和正十三烷两种主体风味成分的相对含量逐步下降。同时,生成了很多新的挥发性风味成分,主要是醇和酯类,其中乙醇、苯乙醇、乙酸苯乙酯、异戊醇、2-甲基-1-丁醇和异丁醇构成了火龙果酒的主体风味。
红肉火龙果;天然酵母;发酵;品质;果酒
袁星星,余元善,吴继军,等.红肉火龙果酒天然酵母发酵期间品质变化研究[J].广东农业科学,2016,43(4):124-130.
火龙果(pitaya)俗称红龙果、仙人果等,是仙人掌科(Caetaceae)三角柱属(Hylocereus)的果用栽培种,为典型的热带植物[1],其营养成分主要有蛋白质及氨基酸、维生素、糖类物质、脂肪酸和矿质元素,功能性物质有黄酮类、植物甾醇类化合物、植物多糖和膳食纤维等[2]。火龙果按其果皮果肉的颜色可分为红皮白肉、红皮红肉、黄皮白肉3个品种,其中红肉火龙果营养丰富、功能独特[1]。Wu等[3]的研究表明,火龙果果肉和果皮富含多酚,是抗氧化剂的良好来源,火龙果果皮对黑素瘤细胞的生长有抑制作用。
近年来,火龙果已陆续引种到广西、广东、海南、福建、云南、贵州等省区,随着火龙果在我国种植面积不断扩大,火龙果病虫害问题日益严重,加上火龙果本身对温度的敏感性,常温下不耐储藏,经常出现严重的滞销现象。果酒是以野生或人工种植植物的果实为原料发酵而成的低酒精度饮料,保留了水果原有的糖类、氨基酸、有机酸和矿物质等成分。目前,国内提倡逐步以低度酒代替高度酒,尤其在华南地区,饮用果酒已是一种趋势。
目前,火龙果酒大多数是以商业的葡萄酒酵母进行酿造[2]。由于品种的差异,商业葡萄酒酵母在发酵火龙果时往往出现发酵迟缓、发酵不彻底等问题。很多科研工作者正在筛选适合火龙果酒发酵的专用酵母,本课题组经过前期的研究工作,筛选到了一株适合火龙果酒发酵的天然酿酒酵母。本试验主要探讨该天然酵母发酵过程中红肉火龙果的理化性质、营养品质等方面的变化规律,以期为高品质火龙果酒的研发提供理论依据。
1 材料与方法
1.1 试验材料
红肉火龙果,购于广东河源(原果浆pH为4.60,可溶性固形物含量为16.3°Brix);天然酵母(Saccharomyces cerevisiae),本实验室保藏;安琪葡萄酒高活性干酵母,购自安琪酵母股份公司;法国葡萄酒酿酒酵母(LAFFORT FX10),购自法国LAFFORT公司;食品级蔗糖,购自广西来宾东糖迁江有限公司;环己酮,色谱纯;其它试剂均为国产分析纯。
LLJ-206J 型多功能料理机,江门市贝尔斯顿电器有限公司;UV1800 型紫外可见分光光度计,日本岛津公司;PB-10型pH计,Sartorius公司;UltraScan VIS 型全自动色差仪,美国HunterLab公司;Infinite M200PRO型酶标仪,瑞士TECAN公司;Agilent 1200 series 型高效液相色谱仪,美国安捷伦科技有限公司;Agilent 6890N/5975B 型气相色谱-质谱连用仪,美国安捷伦科技有限公司。
1.2 试验方法
1.2.1 酵母活化 安琪葡萄酒高活性干酵母和法国葡萄酒酿酒酵母LAFFORT FX10按产品说明书要求活化后再次转接麦芽汁液体培养基中振荡培养(28℃)24 h后接种火龙果浆用于后续果酒发酵。同样,天然酵母从斜面培养基中转接到麦芽汁液体培养基中振荡培养24 h后接种火龙果浆。
1.2.2 火龙果酒发酵 火龙果去皮后直接打浆,用食品级蔗糖和柠檬酸分别调节其可溶性固形物含量和pH值至22.0oBrix和4.0,经热巴士杀菌(85℃,30 s)冷却后分别接种3种不同酵母菌(采用血球计数板法将接种量控制在5.5 Lg CFU/mL左右),并于20℃恒温培养箱中静置发酵,每隔2 d取样用于后续品质参数指标的分析。
1.3 测定项目及方法
1.3.1 糖组分 糖的测定采用HPLC法。样品采用Shodex Asahipak液相色谱柱(NH2 P-504E,250× 4.6 mm)分离,流动相为75%乙腈的水溶液,流速为1.0 mL/min,柱温为35℃,并采用蒸发光检测器(ELSD)检测。进样量为10 μL,并采用外标法定量。
1.3.2 pH和可滴定酸测定 pH值用pH计直接测定。可滴定酸按照GB/T 15038-2006《葡萄酒、果酒通用分析方法》[4],采用滴定法测定,总酸度以柠檬酸计。
1.3.3 酒精度 酒精度的测定采用酒精计法,具体参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》执行[4]。
1.3.4 甲醇含量 甲醇含量的测定参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》(化学法)执行[4]。
1.3.5 高级醇含量 果酒样品中的高级醇经蒸馏、二氯甲烷萃取后采用气相色谱法分析,具体的操作步骤参照文献[5]。
1.3.6 甜菜苷含量 火龙果酒样品中的甜菜苷经20% 乙醇溶液萃取后,采用比色法测定其含量[6]。
1.3.7 总酚含量 采用福林酚法测定[7],结果以没食子酸当量表示。
1.3.8 抗氧化能力 抗氧化能力的测定采用氧自由基吸收能力(Oxygen Radical Absorbance Capacity,ORAC)法测定[7],结果以Trolox当量表示。
1.3.9 色差 采用全自动色差仪测定[8],色差值以L*、a*、b*和△E表示。
1.3.10 挥发性风味的测定 准确量取100 μL火龙果酒样品于15 mL顶空瓶中,加入100 μL环己酮做内标(最终质量浓度为10 mg/L),加入4.8 mL纯净水,1.5 g NaCl。50℃条件下平衡20 min,用50/30 μm DVB/CAR/PDMS萃取头萃取酒样,萃取头吸附时间为50 min,于气相色谱仪解析5 min。
GC-MS的色谱条件为采用DB-5MS弹性毛细管柱(30 m×0.25 mm×0.25 μm),氦气为载气,其流速为20 mL/min,分流比为10∶1;进样口温度为270℃;程序升温方式为初始温度35℃,保持6 min,以5℃/min的速率升至150℃并保持2 min;以10℃/min的速率升至250℃并保持3 min。GC-MS的质谱条件为EI离子源(70 eV),离子源温度230℃,接口温度为280℃,质量扫描范围m/z10~450。
将通过GC-MS检测到的未知化合物的图谱与谱库(NIST08、NIST08s、FFNSC1.3)进行比对,相似度最大者(一般为90%以上)可以作为暂定结果,然后应用相同气相条件的正构烷烃(C5-C20)混合标准品的保留时间计算LRI值确定挥发性成分,所得到的LRI与 LRI libraries比对后确认。挥发性物质的定量采用内标法,结合内标物的含量计算出各组分的含量。
试验数据采用统计软件SPSS 12.0进行Duncan's 方差分析,用Origin8.5.1软件制图。
2 结果与讨论
2.1 天然酵母发酵期间火龙果酒中可转化糖和酒精度的变化
由图1可知,天然酵母的起酵速度非常快,发酵前6 d,可转化糖的含量呈现直线下降,同时酒精含量也出现直线上升。发酵6 d后,可转化糖消耗完毕,没有残留的可转化糖被检测出,此时酒精浓度达到最大值(10.06%,V/V)。发酵后期,由于没有可利用的转化糖,酒精含量不再升高,并且由于自身蒸发和酵母有氧代谢等原因[5],酒精含量出现轻微下降。
由图2可知,与商业上常用的葡萄酒酵母相比,该天然菌株在火龙果酒的发酵上优势非常明显。常用的葡萄酒酵母在火龙果发酵期间,起酵速度非常缓慢,特别是安琪葡萄酒高活性酵母,发酵8~10 d后可转化糖才出现明显下降,并且火龙果中可转化糖难以被常用的商业酵母完全利用,发酵后期残糖含量仍高达3%以上,酒精度也只有6%~7% (V/V)左右。这进一步说明该天然菌株非常适合火龙果酒的发酵生产,可以优先考虑成为火龙果酒发酵专用酵母菌株。

图2 两种商业葡萄酒酵母发酵期间红肉火龙果酒中可转化糖含量的变化
2.2 天然酵母发酵期间火龙果酒中pH值和可滴定酸的变化
由图3可知,火龙果酒发酵期间其pH值呈缓慢的上升趋势,说明整个发酵过程中乳酸菌等杂菌的生长代谢较弱,可转化糖几乎全部被酵母代谢用于维持生长和转化生成酒精。火龙果酒发酵期间pH值的缓慢升高可能跟火龙果浆中的一些生理碱性盐被酵母菌利用相关[9]。对应的,发酵2 d后可滴定酸含量也呈缓慢的上升趋势,而发酵前2 d可滴定酸的突然下降可能跟火龙果中的柠檬酸被酵母菌的有氧代谢有关。有研究表明[9],在有氧条件下,一些酵母菌能很好的利用柠檬酸进行代谢生长(直接参与三羧酸循环途径)。在发酵前期,火龙果中残留的氧气可能促进了火龙果浆中柠檬酸的有氧代谢,导致少量的柠檬酸被转化利用。另外,也有研究认为[5],水果中果胶的羧酸甲酯部的分解也会导致水果可滴定酸含量的升高。此外,火龙果浆具有一定的缓冲能力,因此,发酵前期少量的柠檬酸代谢消耗不会导致火龙果酒的pH出现明显下降。

图3 天然酵母发酵期间红肉火龙果酒中pH和可滴定酸含量的变化
2.3 天然酵母发酵期间火龙果酒中总酚和抗氧化活性的变化
由图4可知,发酵前期总酚含量快速下降,而发酵后期则基本趋于稳定。发酵前期总酚的快速下降可能跟总酚被火龙果浆中残留的氧气氧化有关[7-8],酵母的生长代谢也能导致一些酚类物质的氧化或降解,使总酚含量下降。此外,虽然福林酚试剂是目前测定植物总酚含量最常用的方法,但福林酚试剂也存在专一性问题,一些非酚类的还原物质也能与其发生反应[10]。已有研究报道酵母生长代谢期间产生的一些还原性物质能导致福林酚测定结果偏高[7-8,10]。
发酵期间,火龙果酒中抗氧化活性则呈现先上升后快速下降的趋势(图4),与多酚的变化趋势没有明显的相关性。很多研究发现[11],多酚类物质是水果的主要抗氧化物质,多酚含量与其抗氧化活性具有较好的正相关性,而在本研究中,发酵期间,多酚和抗氧化活性的变化没有明显的相关性,说明酵母的生长代谢活动对火龙果酒的抗氧化活性具有较显著的影响。发酵前期,酵母生长代谢活跃,能产生大量强还原能力的具有抗氧化活性的代谢产物,可能是导致火龙果酒中抗氧化活性呈现快速上升的主要原因。发酵后期,随着糖的消耗,酵母生长代谢减弱,产生的具有抗氧化活性的代谢产物量将快速下降,那将导致火龙果酒中抗氧化活性呈现快速下降[10]。

图4 天然酵母发酵期间红肉火龙果酒中总酚和抗氧化活性的变化
2.4 天然酵母发酵期间火龙果酒中甜菜苷色素和色差值的变化
甜菜苷是红肉火龙果果肉的主要色素,在酸性介质中呈现紫红色,属于吡啶类衍生物,其基本发色团是1,7-二偶氮庚甲碱,自然条件下以糖苷形式存在,因此其水溶性较好[6]。由图5可知,发酵期间,随着发酵时间的延长,甜菜苷的含量逐渐下降,发酵10 d后火龙果酒中甜菜苷含量下降了27.01%左右。研究发现,甜菜苷的色素稳定性强烈受pH、温度、光及氧的影响,发酵期间火龙果酒中甜菜苷含量的下降可能跟其氧化分解和光分解有关[6]。
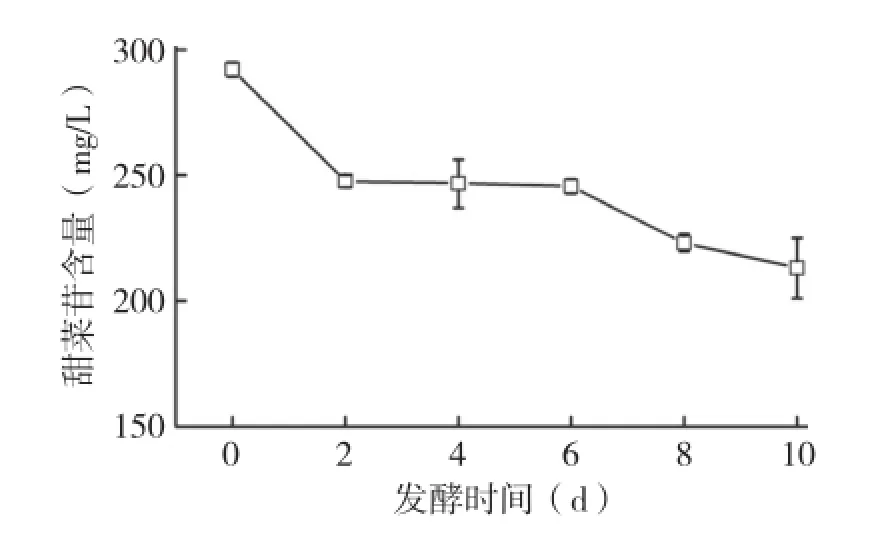
图5 天然酵母发酵期间红肉火龙果酒中甜菜苷色素的变化
虽然发酵期间火龙果酒中甜菜苷含量呈现缓慢的下降趋势,但甜菜苷具有较强的着色和呈色能力,整个发酵期间火龙果酒均呈现亮丽的紫红色,肉眼没有观察到明显的颜色变化。同样,从色差计的数据看,整个发酵期间,火龙果酒的L*、a*、b*仅有轻微的变化,△E*值的波动均在6.0以下(表1)。一般认为,仪器色差值△E*值小于3.0~6.0时肉眼将无法观察到其颜色变化,或仅轻微的颜色变化[8],因此,色差数据进一步说明发酵期间火龙果酒的颜色相对较稳定。

表1 天然酵母发酵期间红肉火龙果酒中色差值的变化
2.5 天然酵母发酵期间火龙果酒中甲醇和高级醇含量的变化
甲醇和高级醇是果酒发酵过程中产生的代谢产物。高级醇虽然是果酒香气的主要构成成分,但过高的高级醇还容易导致饮用者口干和头疼。甲醇在人体能逐渐积累,不易排出体外,对眼睛视力有损害作用。因此,甲醇和高级醇是果酒发酵中必须监控的重要参数。由图6可知,发酵前2d,果酒中的甲醇含量出现一个高峰,随后随着发酵时间的延长,甲醇的含量快速下降并趋于稳定,发酵10 d后,甲醇的含量仅为64.58 mg/L,符合果酒中的甲醇限量标准(400 mg/L,GB 15037-2006 葡萄酒)。同样,在火龙果酒中检测出异丁醇、3-甲基丁醇和2-甲基丁醇三种高级醇,发酵期间它们的含量也呈现先升高然后逐步稳定的趋势,总高级醇的含量也处于正常果酒含量范围内[5]。果酒中的甲醇主要是发酵期间水果中的果胶分解产生的,一般果酒中甲醇含量的变化跟水果中果胶的结构、果胶甲酯酶的活性以及甲醇的氧化或挥发相关[4,12]。而高级醇则是酵母氨基酸合成和分解代谢产生的副产物,其含量跟原料的营养成分和酵母菌株的生理特性有关[12]。
2.6 天然酵母发酵期间火龙果酒中挥发性风味的变化

图6 天然酵母发酵期间红肉火龙果酒中甲醇和高级醇含量的变化
由天然酵母发酵期间红肉火龙果酒中主要香气成分的变化(表2)可知,新鲜的火龙果浆中主要挥发性风味物质是乙醇、正己醇(及其乙酸酯)、正十三烷、正己醛、反式-2-己烯醛、长叶烯和正己酸乙酯等,其中乙醇和正己醇(及其衍生物)和正十三烷占火龙果总挥发性风味成分的90%。根据文献报道,正己醇或其羧酸酯微量存在于柑桔类、浆果等中[13]。茶叶以及香叶油各种薰衣草油、香蕉、苹果、草莓、紫罗兰叶油等的多种精油也都含有[13]。
随着酵母发酵的进行,新鲜火龙果中正己醇(及其衍生物)和正十三烷两种主体风味的相对含量呈现逐步下降的趋势(表2)。同时,生成了很多新的挥发性风味成分,主要是醇和酯类,其中乙醇、苯乙醇、乙酸苯乙酯、异戊醇、2-甲基-1-丁醇和异丁醇构成了火龙果酒的主体风味。苯乙醇具有清甜的玫瑰样花香,在苹果、杏仁、香蕉、桃子、梨子、草莓、可可、蜂蜜等天然植物中发现。苯乙醇、异戊醇是酒中重要的醇类,在酒中有协调平衡作用,以构成酒的不同风格。其它高级脂肪酸酯如月桂酸乙酯和十四酸乙酯等的形成可能跟火龙果籽油中的物质转化有关。另外,发酵过程中乙酸含量也缓慢增加,乙酸在酒中不仅能生成酯,而且还可以起调味作用,是形成酒的“后味”的重要物质[14]。
3 结论

表2 天然酵母发酵期间红肉火龙果酒中主要挥发性成分与相对含量变化
本试验结果表明,与商业上常用的葡萄酒酵母相比,该天然酵母菌株特别适合火龙果酒的发酵,特别是其起酵速度和转化糖利用率,可以优先考虑成为火龙果酒发酵专用酵母菌株。该酵母菌株在火龙果发酵期间,没有大量的有机酸生成,果酒的pH值呈缓慢上升趋势。虽然发酵前期总酚含量呈现快速下降,但发酵后期则基本趋于稳定;发酵期间,火龙果酒中抗氧化活性则呈现先上升后快速下降的趋势,与多酚的变化趋势没有明显的相关性。虽然发酵期间火龙果酒中甜菜苷含量呈现缓慢的下降趋势,但甜菜苷具有较强的着色和呈色能力,整个发酵期间火龙果酒均呈现亮丽的紫红色,肉眼没有观察到明显的颜色变化。
火龙果酒发酵期间,高级醇(异丁醇、3-甲基丁醇和2-甲基丁醇)和甲醇的含量均呈现先升高然后逐步稳定的趋势,它们的含量均处于正常果酒含量范围内。
新鲜的火龙果浆中主要挥发性风味物质是乙醇、正己醇(及其乙酸酯)、正十三烷、正己醛、反式-2-己烯醛、长叶烯和正己酸乙酯等。随着酵母发酵的进行,新鲜火龙果中正己醇(及其衍生物)和正十三烷两种主体风味的相对含量呈现逐步下降。同时,生成了很多新的挥发性风味成分,主要是醇和酯类,其中乙醇、苯乙醇、乙酸苯乙酯、异戊醇、2-甲基-1-丁醇和异丁醇构成了火龙果酒的主体风味。
[1]高国丽,张冰雪,乔光,等.火龙果种质资源的耐寒性综合评价[J].华中农业大学学报,2014,33 (3):26-32.
[2]申世辉,马玉华,蔡永强.火龙果研究进展[J].中国热带农业,2015(1):48-52.
[3]Wu L C,Hsu H W,Chen Y C,et al.Antioxidant and antiproliferative activities of red pitaya[J].Food Chemistry,2006,95(2):319-327.
[4]中国国家标准化管理委员会.GB/T 15038-2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2008.
[5]杜昌陈,余元善,徐玉娟,等.沙田柚果肉处理方式对柚子果酒发酵的影响[J].酿酒科技,2015(2):81-84.
[6]赵珍珍.红肉火龙果色素提取工艺优化及其化学成分分析[D].福州:福建农林大学,2012.
[7]Yu Y,Xu Y,Wu J,et al.Effect of ultra-high pressure homogenisation processing on phenolic compounds,antioxidant capacity and anti-glucosidase of mulberry juice[J].Food Chemistry,2014,153:114-120.
[8]龚小洁,余元善,徐玉娟,等.乳酸菌发酵对荔枝果渣理化性质的影响[J].现代食品科技,2015,31 (10):257-262.
[9]Lee T J.Changes in yeast cell number,total acid and organic acid during production and distribution processes of Makgeolli,Traditional Alcohol of Korea [J].The Korean Journal of Microbiology,2009,45 (4):391-396.
[10]Pérez-Gregorio M R.Influence of alcoholic fermentation process on antioxidant activity and phenolic levels from mulberries(Morus nigra L.)[J].LWT-Food Science and Technology,2011,44:1793-1801.
[11]Fu L.Antioxidant capacities and total phenolic contents of 62 fruits[J].Food Chemistry,2011,129:345-350.
[12]Matsuda F.Engineering strategy of yeast metabolism for higher alcohol production[J].Microbial Cell Factories 2011,10:1-10.
[13]Baldwin E.A.Fruit Quality and its Biological Basis [M].CRC Press,2002.
[14]Ariffi A A.Essential fatty acids of pitaya(dragon fruit)seed oil[J].Food Chemistry,2009,114:561-564.
(责任编辑 邹移光)
Study on quality change of red pitaya wine during fermentation with autochthonous yeast
YUAN Xing-xing1,2,YU Yuan-shan2,WU Ji-jun2,XIAO Geng-sheng2,XU Yu-juan2,LI Jun2
(1.College of Food Science & Engineering,Jiangxi Agricultural University,Nanchang 330045,China;2.Sericultural & Agri-Food Research Institute,Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods,Ministry of Agriculture/Guangdong Key Laboratory of Agricultural Products Processing,Guangzhou 510610,China)
In this paper,changes in the sugar,alcohol,pH,titratable acid,total phenolics,antioxidant capacity,betanin,color,methanol,higher alcohol and volatile flavor were investigated during fermentation of red pitaya with autochthonous yeast.Results showed that the invert sugar was depleted,and more than 10%(V/V)of alcohol was produced after 6 d of fermentation at 20℃.And the autochthonous yeast showed a better ability in the fermentation rate and sugar conversion rate compared with other commercial grape wine yeast.Higher alcohol(isobutanol,3-methyl butanol and 2-methyl butanol)and methanol contents were less than normal level of wine,and no significant color change was observed during fermentation.The relative content of hexanol(and its derivatives)and tridecane,as two main flavor of red pitaya,decreased with the increase of fermentation time,and also some new flavor(alcohols and esters)produced,including ethanol,benzene ethanol,benzene ethyl acetate,isoamyl alcohol,2-methyl-1-butanol and isobutanol,that constituted the subject flavor of red pitaya wine.
red pitaya;autochthonous yeast;fermentation;quality;wine
S667.9;TS261.4
A
1004-874X(2016)04-0124-07
10.16768/j.issn.1004-874X.2016.04.024
2015-12-02
广东省自然科学基金研究团队项目(2015A030312001)
袁星星(1992-),女,在读硕士生,E-mail:1300640634@qq.com
徐玉娟(1974-),女,博士,研究员,E-mail:xyj6510@126.com

