水稻广谱抗性负调控基因OsSSI2的克隆及原核表达
陈亚红,刘早利,王春台,刘新琼
(中南民族大学生命科学学院/武陵山区特色资源植物种质保护与利用湖北省重点实验室/生物技术国家民委重点实验室,湖北 武汉 430074)
水稻广谱抗性负调控基因OsSSI2的克隆及原核表达
陈亚红,刘早利,王春台,刘新琼
(中南民族大学生命科学学院/武陵山区特色资源植物种质保护与利用湖北省重点实验室/生物技术国家民委重点实验室,湖北 武汉 430074)
水稻OsSSI2基因负调控水稻的抗病反应,为了研究该基因的抗性机理,构建pGEX-6P1-OsSSI2原核表达载体,转化大肠杆菌BL21细胞后利用IPTG诱导外源蛋白表达并优化表达条件,使用SDS-PAGE和Western Blot检测分析表达产物。结果表明:成功构建了pGEX-6P1-OsSSI2原核表达载体后进行原核表达,在IPTG浓度为0.3 mmol/L,温度为25℃,诱导表达7 h,通过SDS-PAGE和Western Blot检测发现OsSSI2蛋白的可溶性表达量最多,为进一步研究水稻OsSSI2蛋白的抗性机理奠定了基础。
水稻;OsSSI2基因;原核表达载体;诱导表达
陈亚红,刘早利,王春台,等.水稻广谱抗性负调控基因OsSSI2的克隆及原核表达[J].广东农业科学,2016,43(4):33-37.
稻瘟病是由真菌Magnaporthe oryzae 引起的水稻病害,是全球最具影响力和破坏力的水稻病害之一[1]。目前,稻瘟病的防治主要采用化学防治和抗病新品种培育两种途径。化学防治通常成本高、效果差而且污染环境。因此发掘水稻自身的广谱抗性基因资源,培育持久高抗品种,是最经济有效的病害控制措施[2-3],但对于水稻的广谱抗性机理不甚清楚。
植物在抗病过程中通过激活不同的防御通路来对抗病原体感染,其中水杨酸(SA)、茉莉酸(JA)和乙烯(ET)等植物激素是诱导植物抗病反应的重要的信号分子[4-5]。每种激素调节不同的防御通路但相互配合。除了植物激素,一些研究也表明脂肪酸(FA)及其衍生物在植物抗病反应中也起着重要作用,扮演了一个重要信号分子的作用。已经有报道证明,抑制硬脂酰-ACP去饱和酶基因(SACPD)的表达提高了拟南芥(SSI2)和大豆对多种病原体的抗性[6-8]。
OsSSI2基因是脂肪酸去饱和基因SSI2在水稻中的同源基因,OsSSI2的RNAi转基因水 稻表现对稻瘟病及白叶枯的广谱抗病性,说明OsSSI2基因参与并且负调控水稻的抗病反应[9-13]。因此该基因是研究广谱抗性机理的一个很好材料。本研究以前期得到的水稻OsSSI2基因为对象,构建pGEX-6P1-OsSSI2原核表达载体并尝试不同的表达条件,得到可溶性GST-OsSSI2融合蛋白,以期为下一步获取与OsSSI2蛋白相互作用的蛋白及研究该蛋白的抗性机理奠定基础。
1 材料与方法
1.1 试验材料
原核表达载体pGEX-6P-1,大肠杆菌菌株BL21和DH5α由中南民族大学国家民委生物技术重点实验室提供。
限制性内切酶BamH I、EcolR I,DNA分子量Marker,购自宝生物工程有限公司(大连);PCR扩增酶KOD,连接酶Ligation high都购自TOYOBO公司(日本);Pageruler®Prestained 预染蛋白分子量Marker购自FERMENTAS公司(美国);凝胶回收试剂盒、凝胶清洁试剂盒与反转试剂盒均购自Axygen公司(美国);Anti-GST Antibody 抗体和二抗购自天根生化科技有限公司(北京)和Abbkine公司(美国);超敏ECL化学发光即用型底物购自博士德生物公司(武汉);引物合成及测序都在金斯瑞生物有限公司(南京)进行。
1.2 pGEX-6P1-OsSSI2原核表达载体的构建
以OsSSI2质粒DNA为PCR扩增模板,限制性内切酶BamH I、EcoR I为酶切位点设计引物,利用PCR反应扩增出目的片段,引物为:
OsSSI26P-1-BamH IF:5'-GATAggatccGCGTC GAGGATGGCGCTCC-3'
OsSSI26P-1-EcoR IR:5'-GCGAgaattcGAGTTG AACTTCCCTACC-3'
(1)大学生企业家精神和创业价值观培育情况普遍一般。在对10所省属公办本科高校大学生创业教育调研中发现只有1所高校大学生企业家精神和创业价值观培育情况较好,另外9所高校情况一般;在对10所湖北省属民办本科高校大学生创业教育调研中发现只有2所高校情况较好,另外8所高校情况一般;而其他3种类型的高校在该指标上都表现一般。
采用20 μL体系,共3管进行PCR反应,各反应物用来如下:ddH2O 4.2 μL、2×KOD buffer 1.0 μL、OsSSI26P-1-BamH IF(10 μmol/L)0.6 μL、OsSSI26P-1-EcoR IR(10 μmol/L)0.6 μL、dNTP(2.5 mmol/L)3.2 μL、模板DNA 1.0 μL、KOD 0.4 μL、总体积 20.0 μL。
PCR反应程序:94℃预变性2 min;94℃变性15 s,60℃退火30 s,68℃延伸2.0 min,重复34个循环,68℃延伸10 min。扩增反应完成后进行1.0%琼脂糖凝胶电泳检测。使用清洁回收试剂盒对目的片段进行清洁回收,然后用限制性内切酶BamH I和EcoR I同时双酶切目的片段和pGEX-6P1空载体,37℃酶切2 h。使用凝胶回收试剂盒对酶切的目的片段及载体片段进行切胶回收,16℃用Ligation high连接酶连接OsSSI2目的片段和pGEX-6P1载体片段2 h后转化DH5α感受态细胞,涂Amp+平板后于37℃恒温培养箱倒置过夜培养。从平板上随机挑取单克隆,提取质粒并且进行PCR及双酶切鉴定,鉴定结果为阳性的单克隆送公司测序。
1.3 重组蛋白的原核表达
1.3.1 重组蛋白的诱导表达 将构建好的pGEX-6P1-OsSSI2的重组质粒和pGEX-6P1载体转化BL21表达菌株,涂Amp+平板后于37℃恒温培养箱倒置过夜,随机挑取6个单克隆菌落接种于3 mL含Amp+的液体 LB培养基中,于37 ℃摇床中180 r/min振荡培养12 h作为种子液,按1∶1000的接种量接种至5 mL含Amp+的液体 LB培养基中,37 ℃摇床中180 r/min振荡培养至OD600约为0.6,保存菌液后加入IPTG至终浓度为1 mmol/L,于37℃振荡培养3 h诱导蛋白的表达。同时诱导不加IPTG的pGEX-6P1-OsSSI2和pGEX-6P1空载体的BL21菌株作为阴性对照。
1.3.2 重组蛋白的诱导表达条件的优化 选取上一步中表达量较好的一个克隆,用保存的菌液按1∶1000的接种量接种至5 mL含Amp+的液体 LB培养基中,37℃摇床中180 r/min振荡培养至OD600约为0.6后,分别加入IPTG至终浓度为0、0.1、0.2、0.3、0.5、0.7、1.0 mmol/L诱导表达确定IPTG浓度后,分别于10、15、25、37℃条件下诱导蛋白表达,分别于1、3、5、7 h诱导时间取样5 mL,利用SDS-PAGE电泳检测比较诱导温度和时间对可溶性蛋白表达的影响。
1.3.3 重组蛋白的SDS-PAGE检测 将诱导表达完成的菌液转入离心管中,4 000 r/min离心10 min,弃上清收集菌体,加入3 mL PBS(pH7.4)缓冲液重新悬浮菌体,在冰浴中超声波破碎细胞,破碎5 s,间隔5 s,每管破碎10 min,4 000 r/min离心15 min收集蛋白上清,在沉淀中加入1 mL bufferB,室温静置1 h,间隔震荡几次,12 000 r/min离心15 min,取上清为蛋白沉淀。各取上清100 μL加入适量Loading buffer于100℃沸水中煮10 min,瞬时离心后进行10% SDS-PAGE检测。恒压100 V电泳,用考马斯亮蓝染色液染色3 h后用脱色液进行脱色。
2 结果与分析
2.1 pGEX-6P1-OsSSI2原核表达载体的克隆
将重组质粒pGEX-6P1-OsSSI2通过PCR鉴定,OsSSI2大小为1 197 bp(图1A);通过双酶切鉴定显示,重组质粒经过BamH I和EcoR I双酶切,得到两段大小分别为5 000、1 200 bp左右大小的条带,与预期估计条带大小相同(图1B)。将构建好的载体送公司测序,其测序结果100%匹配,说明pGEX-6P1-OsSSI2原核表达载体构建成功。
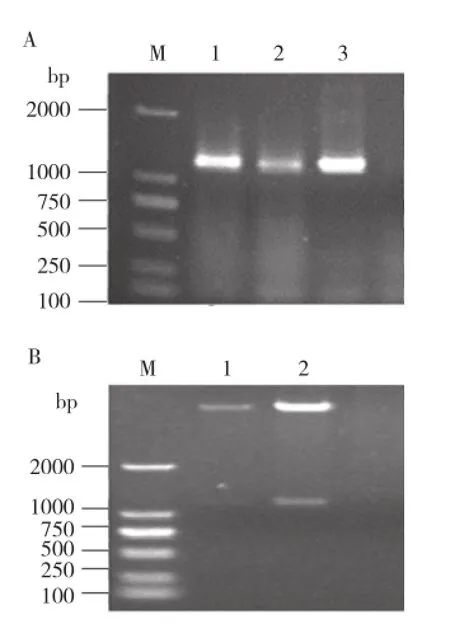
图1 重组表达载体阳性克隆鉴定
2.2 重组蛋白的SDS-PAGE检测
将构建好的pGEX-6P1-OsSSI2的重组质粒和pGEX-6P1载体转化BL21表达菌株,随机挑取6个单克隆菌落进行诱导表达,用SDS-PAGE检测表达产物,经染色和脱色后观察,目的蛋白大小约为44.4 ku,GST标签大小约为26 ku,所以表达目的蛋白大小约为70.4 ku,从图2可见,在70 ku左右,诱导处理后的样品与空载蛋白存在明显差异,表明OsSSI2蛋白可能高效表达,其中2、3、7号克隆蛋白表达量较高,可用于下一步蛋白表达条件摸索。
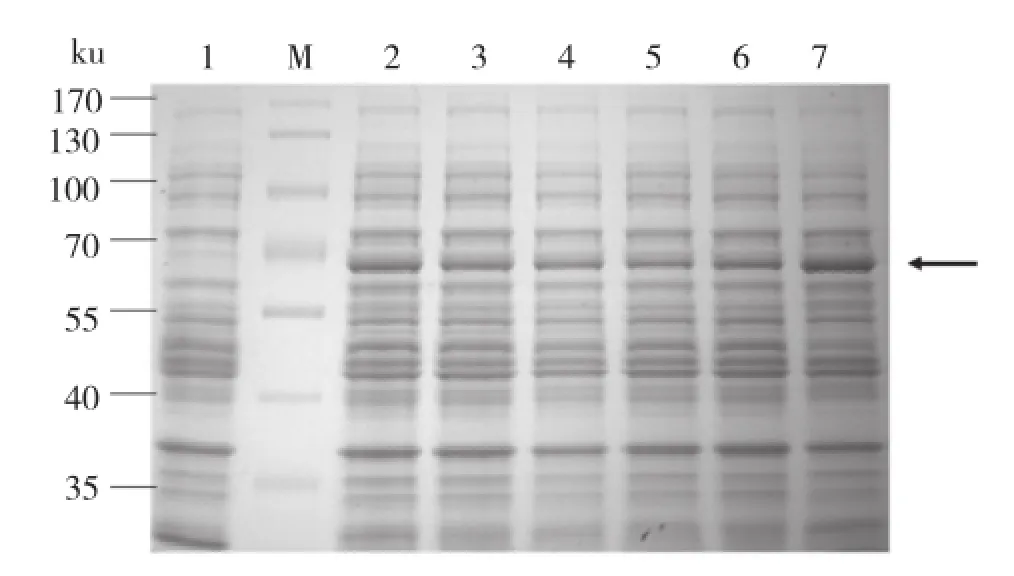
图2 含GST标签的OsSSI2融合蛋白的诱导表达SDS-PAGE检测
利用表达量较高的克隆进行蛋白表达IPTG浓度的摸索,发现该蛋白同时在上清和沉淀都有表达,当IPTG浓度为0.3 mmol/L时,上清中可溶性蛋白表达量最高,因此我们确定IPTG终浓度为0.3 mmol/L(图3)。
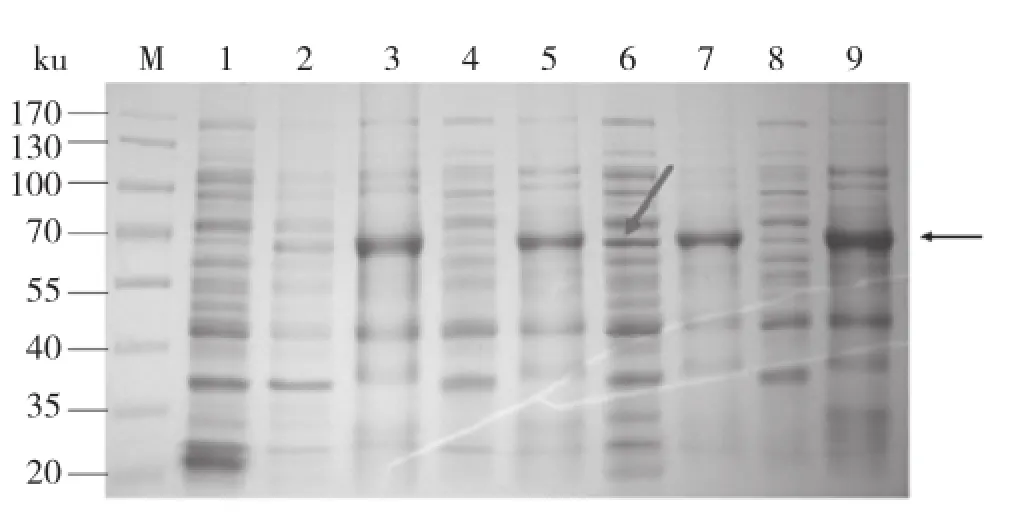
图3 不同浓度 IPTG诱导pGEX-6P1-OsSSI2蛋白表达SDS-PAGE检测
在蛋白表达IPTG终浓度为0.3 mmol/L时,进行表达温度和时间的优化,经过10、15、25、37℃不同温度,1、3、5、7 h不同时间的摸索,确定25℃、7 h为最佳表达条件(图4)。
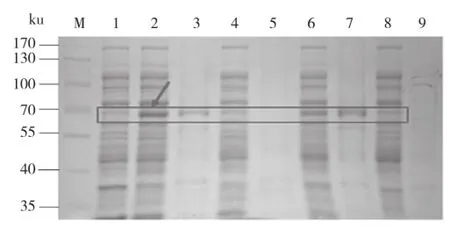
图4 不同温度时间诱导pGEX-6P1-OsSSI2蛋白表达SDS-PAGE检测
综上所述,确定目的蛋白较适宜的诱导表达条件为:IPTG终浓度为0.3 mmol/L、诱导温度和时间为25℃、7 h。
2.3 重组蛋白的Western Blot检测
用GST单抗对诱导表达的蛋白孵育进行检测,可以观察到在20 ku和35 ku之间空载体及诱导后重组蛋白均有,分析该条带为GST条带。在70 ku附近,诱导处理后的pGEX-6P1-OsSSI2上清、沉淀中均出现单一的信号条带,而未加IPTG诱导的pGEX-6P1-OsSSI2和空载体的蛋白样品中未见信号表达(图5)。此结果进一步表明载体构建成功,水稻OsSSI2蛋白成功并高效的表达,并且该外源蛋白有可溶性和包涵体两种表达形式。
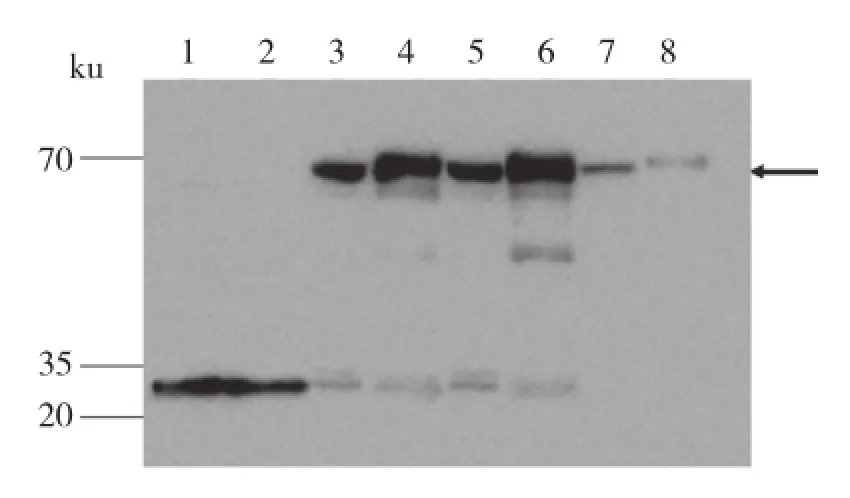
图5 OsSSI2蛋白Western Blot检测
3 结论与讨论
本试验采用pGEX-6P1原核表达载体,在目标蛋白的N端加上一个约26 ku的GST标签蛋白,在原核表达时优化诱导表达条件,从不同的IPTG浓度、诱导温度、诱导时间去摸索,结果在表达条件为IPTG终浓度为0.3 mmol/L、诱导温度为25℃、诱导时间为7 h时提高了目的蛋白的可溶性表达,为进一步去研究OsSSI2蛋白在水稻中的相关功能奠定了基础。
在原核细胞表达外源基因过程中,尤其是以大肠杆菌为宿主菌高效表达外源基因时,表达蛋白常常在细胞质内聚集,形成包涵体。以包涵体形式存在的蛋白质分子不具有正确的天然三维结构,表达蛋白不具有生物活性,需要通过复性操作以得到具有预期生物活性的蛋白质。而通常的包涵体复性过程中,复性条件难以控制,成本高,在复性过程中也很难保证包涵体蛋白形成正确的折叠结构,为后续的研究提供了诸多的不便[18-19]。外源表达OsSSI2蛋白时发现目的蛋白仍然以部分包涵体形式存在,而如果能从上清中表达出大量可溶性的OsSSI2蛋白则会避免这个问题,于是在原核表达时优化诱导表达条件,最终提高了目的蛋白的可溶性表达。
本研究室在前期研究中,通过酵母双杂交技术初步筛选到与OsSSI2蛋白互作的潜在的互作蛋白,为了进一步研究其互作关系,本研究克隆该目的基因并利用原核表达成功表达出可溶性目的蛋白,下一步将进行两个互作蛋白体外Pull-down的验证,这对其抗病机理的研究具有重要意义。
[1]Kush G S,Jena K K.Current status and future prospects for research on blast resistance in rice(Oryza sativa L.)[M].Advances in Genetics,Genomics and Control of Rice Blast Disease.Springer Netherlands,2009(2):1-10.
[2]McDowell J M,Woffenden B J.Plant disease resistance genes:recent insights and potential applications[J].Trends in Biotechnology,2003,21(4):178-183.
[3]Baker B,Zambryski P,Staskawicz B,et a1.Signaling in plantmicrobe interactions[J].Science,1997,276:726-733.
[4]Kachroo A,Kachroo P.Salicylic acid,jasmonic acidand ethylene mediated regulation of plant defense signaling[J].Genet Eng(N.Y.),2007(2):55-83.
[5]Durrant W,Dong X.Systemic acquired resistance[J].Phytopathol,2004,42:185-209.
[6]Dong X.NPR1,all things considered[J].Plant Biology,2004(7):547-552.
[7]Bostock R M.Signal crosstalk and induced resistance:straddling the line between cost and benefit[J].Annu Rev Phytopathol,2005,43:545-580.
[8]Chang J,Masaki S,Satoru M,et al.Suppression of the rice fatty-acid desaturase gene OsSSI2 enhances resistance to blast and leaf blight diseases in rice[J].Molecular Plant-Microbe Interactions,2009(22):820-829.
[9]Vergne E,Ballini E,Marques S,et al.Early and specific gene expression triggered by rice resistance gene Pi33 in response to infection by ACE1 avirulent blast fungus[J].New Phytol,2007,174:159-171.
[10]Shimono M,Sugano S,Nakayama A,et al.Rice WRKY45 plays a crucial role in benzothiadiazoleinducible blast resistance[J].Plant Cell,2007(19):2064-2076.
[11]Kachroo P,Kachroo A,Lapchyk L,et al.Restoration of defective cross talk in ssi2 mutants:role of salicylic acid,jasmonic acid,and fatty acids in SSI2-mediated signaling[J].Plant-Microbe Interact,2003(16):1022-1029.
[12]Chandra S,Venugopal S,BarmanS,et al.Plastidial fatty acid levels regulate resistance gene-dependent defense signaling in Arabidopsis[J].Proceedings of the National Academy of Sciences,2007,104:7277-7282.
[13]Shah J,Kachroo P,Nandi A,et al.A recessive mutation in the Arabidopsis SSI2 gene confers SA and NPR1-independent expression of PR genes and resistance against bacterial and oomycete pathogens [J].Plant Journal,2001(25):563-574.
[14]Zhen L,Xing Z L,Peng Y,et al.Orthogonal optimization of prokaryotic expression of a natural snake venom phospholipase A2 inhibitor from Sinonatrix annularis[J].Toxicon,2015,108:264-271.
[15]Kou J X,Zhao G H,Wei Q K,et al.Cloning,prokaryotic expression and immunological identification of Toxoplasma surface antigen IMP1[J].Chinese Journal of Schistosomiasis Control,2015,27(3):285-289.
[16]刘洋,王春台,刘学群,等.水稻VDAC3蛋白的可溶性外源表达及纯化[J].安徽农业科学,2014,42 (13):3815-3818.
[17]刘新琼,徐玮玉,刘早利,等.水稻OsAAA1蛋白的原核表达载体构建及其可溶性表达研究[J].中南民族大学学报,2015,34(2):18-21.
[18]包义风,应蓬芳,蒋琳.包涵体蛋白复性技术研究进展[J].微生物学免疫学进展,2012(2):84-88.
[19]赵喜红,何小维,李文美,等.大肠杆菌表达包涵体蛋白体外复性研究进展[J].食品工业科技,2010(6):379-383.
(责任编辑 杨贤智)
Cloning and prokaryotic expression of broad-spectrum resistance negative control gene OsSSI2 from rice
CHEN Ya-hong,LIU Zao-li,WANG Chun-tai,LIU Xin-qiong
(Hubei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China/Key Lab for Biotechnology of State Ethnic Affairs Commission /College of Life Science,South-Central University for Nationalities,Wuhan 430074,China)
The rice OsSSI2 gene regulates negatively rice disease resistance.In order to dissect the resistance mechanism of OsSSI2,the recombinant prokaryotic expression vector pGEX-6P1-OsSSI2 was constructed and transformed into E.coli strain BL21.The OsSSI2 protein was induced with IPTG,and confirmed by SDS-PAGE and Western Blot analysis.The results revealed that the prokaryotic expression vector pGEX-6P1-OsSSI2 was constructed and expressed successfully.In the condition that IPTG concentration was 0.3 mmol/L,the temperature was 25℃,and the time induced expression was 7 h,maximum expression of OsSSI2 soluble protein was detected by SDS-PAGE and Western Blot,which laid the foundation for further research of resistance mechanism of OsSSI2 protein from rice.
rice;OsSSI2;prokaryotic expression vector;induced expression
S511.01
A
1004-874X(2016)04-0033-05
10.16768/j.issn.1004-874X.2016.04.008
2015-11-02
国家自然科学基金(31370306);湖北省自然科学基金重点项目(2013CFA098)
陈亚红(1989-),女,在读硕士生,E-mail:896826843@qq.com
刘新琼(1972-),女,博士,教授,E-mail:liuxinqiong@mail.scuec.edu.cn

