HIF-1α和AMPK在前列腺癌中的表达及临床意义
江绍钦,李梦强,王玉兵,王辉丽,许恩赐
(1.福建医科大学附属协和医院泌尿外科,2.福建医科大学免疫学系,福建福州 350001)
·临床研究·
HIF-1α和AMPK在前列腺癌中的表达及临床意义
江绍钦,李梦强1,王玉兵1,王辉丽2,许恩赐1
(1.福建医科大学附属协和医院泌尿外科,2.福建医科大学免疫学系,福建福州350001)
摘要:目的探讨缺氧诱导因子1α(HIF-1α)及腺苷酸活化蛋白激酶(AMPK)在前列腺癌中的表达及临床意义。 方法收集我院2011年3月至2013年5月手术切除的前列腺癌标本34例,采用免疫组化SABC法染色观察癌组织中HIF-1α、AMPK的表达情况。结果前列腺癌组织免疫组化显示:年龄分组中,HIF-1α在高龄组阳性表达率为77.27%,显著高于低年龄组的41.67%(P<0.05)。Gleason评分中,高分组HIF-1α的阳性表达率为74.07%,显著高于低分组的28.57%(P<0.05);高分组AMPK的阳性表达率为22.22%,显著低于低分组的71.43%(P<0.05)。在TNM分组中,HIF-1α在高危组阳性表达率为84.21%,显著高于低危组的40.00%(P<0.05)。HIF-1α在前列腺癌组织的高表达与AMPK的低表达呈负相关,具有统计学(P<0.05)。AMPK的阳性表达率在不同年龄、血清PSA、TNM分组比较中均无显著差异(P>0.05);HIF-1α在血清PSA分组比较无显著差异(P>0.05)。结论HIF-1α和AMPK表达均同前列腺癌的病理及临床预后相关。前列腺癌组织HIF-1α的高表达同AMPK低表达呈负相关,而AMPK有可能是前列腺癌细胞中HIF-1α活化调控的关键组分。
关键词:缺氧诱导因子1α;腺苷酸活化蛋白激酶;前列腺肿瘤
前列腺癌是发达国家中死亡率排在第三位的恶性肿瘤,是男性中比较常见的癌症[1],国内前列腺癌患病人数也在逐年增加。恶性肿瘤的过快生长造成瘤体严重缺氧及供能与耗能之间的不平衡。缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)是调节肿瘤细胞耐受缺氧能力的核转录因子,能影响能量代谢相关的下游基因的转录表达,且相关实验表明HIF-1α在多种瘤体缺氧环境下表达异常[2]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是广泛存在于真核细胞内的能量变化感受器,主要调节细胞内的能量和代谢平衡[3]。AMPK同HIF-1α在前列腺癌组织的表达及调控关联鲜有报道。本研究通过观察前列腺癌组织中HIF-1α、AMPK表达情况,探究HIF-1α、AMPK在前列腺癌表达的关联性及临床意义。
1资料与方法
1.1研究对象收集福建医科大学附属协和医院泌尿外科2011年3月至2013年5月手术切除的前列腺癌标本34例,年龄57~78岁,平均67岁。选取的患者均未行放疗、化疗及内分泌治疗且病理检查均证实为前列腺癌。根据年龄、血清PSA、Gleason评分和TNM分期分组,将年龄>65岁者设为高年龄组(n=22), ≤65岁者设为低年龄组(n=12);将PSA(ng/mL)>20者设为高PSA组(n=9), ≤20者设为低PSA组(n=24),1例患者PSA缺失,被剔除;将Gleason评分>6分者设为高Gleason评分组(n=27),≤6分者设为低Gleason评分组(n=7);将TNM分期>T2b者设为高危组,≤T2b者设为低危组。
1.2主要试剂与仪器兔抗人HIF-1α单克隆抗体(美国epitmics公司,货号#2015-1);兔抗人p-AMPKα单克隆抗体(美国Cell Siganling公司,货号#2535);兔IgG-SABC即用型免疫组化试剂盒(武汉博士德生物科技有限公司,货号09F27C);DAB显色试剂盒(北京中杉金桥生物科技有限公司,货号ZLI-9018);CX40光学显微镜(日本Olympus公司);电热恒温鼓风干燥箱(上海跃进医疗器械厂)。
1.3免疫组化染色手术切除的肿瘤组织于甲醛固定后,常规石蜡包埋,组织切片。采用链霉亲和素-生物素复合物法(strept avidin-biotin complex,SABC)进行染色,检测前列腺癌组织中HIF-1α、AMPK的表达情况。染色操作过程严格按照SABC免疫组化试剂盒的说明书进行,阴性对照以PBS代替一抗。
1.4结果判定胞核和(或)胞质染棕黄色为阳性。HIF-1α、AMPK染色结果的判断方法:在光学显微镜(×400)下随机选取5个视野,计数1 000个细胞。根据阳性细胞所占的百分比打分:阳性细胞>75%为4分,75%~51%为3分,50%~11%为2分,≤10%为1分,阴性为0分;再以染色强度打分:棕褐色为3分,棕黄色为2分,淡黄色为1分,无色为0分。两者评分乘积大于3分则判定为免疫反应阳性。
1.5统计学分析应用SPSS19.0统计软件进行统计学分析。计数资料比较采用χ2检验,相关性采用Spearman相关分析。以P<0.05表示差异有统计学意义。
2结果
2.1HIF-1α、AMPK在不同年龄组的前列腺癌组织的表达HIF-1α在高龄组前列腺癌组织的阳性表达率为77.27%,显著高于低年龄组的41.67%(P<0.05,表1)。AMPK在高龄组前列腺癌组织的阳性表达率为22.72%,低龄组为50.00%,差异没有统计学意义(P>0.05,表2、图1、图2)。
表1HIF-1α蛋白在前列腺癌的表达与临床病理的关系
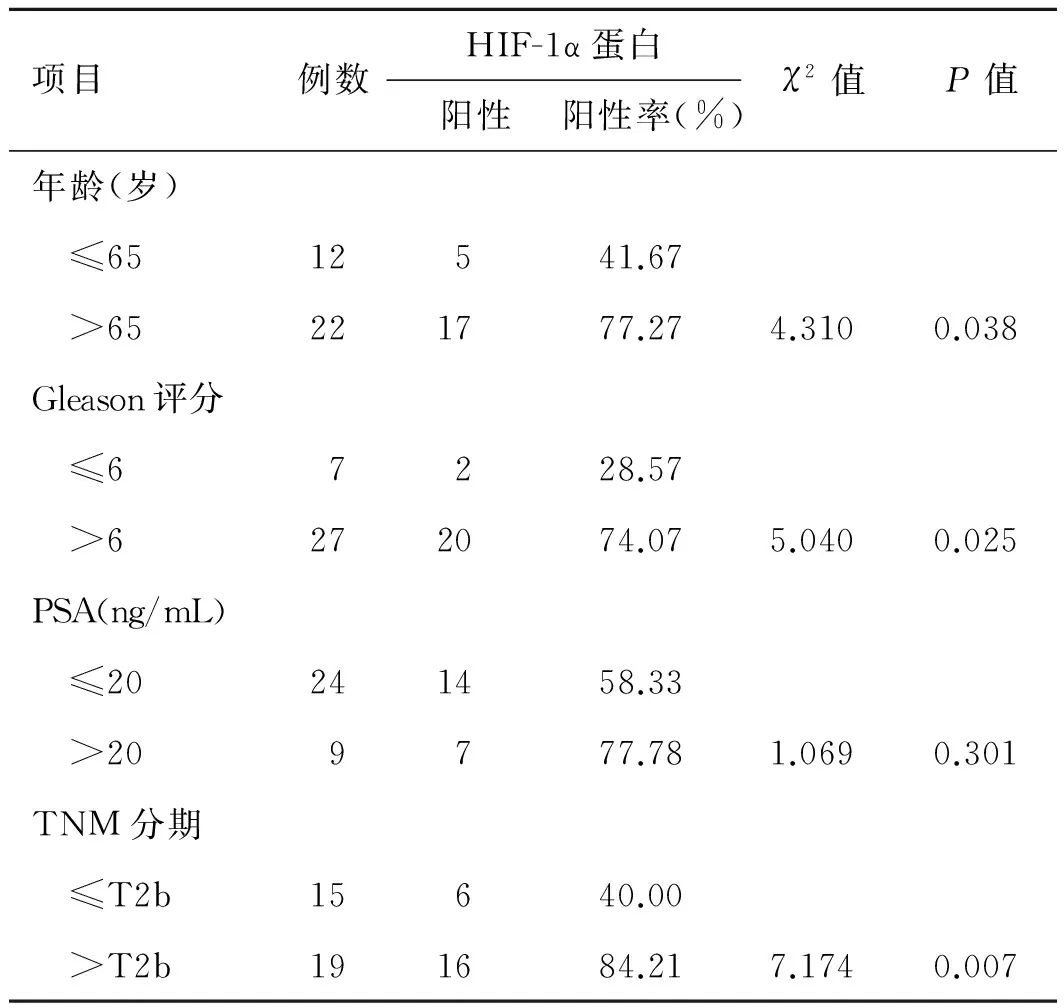
项目例数HIF-1α蛋白阳性阳性率(%)χ2值P值年龄(岁) ≤6512541.67 >65221777.274.3100.038Gleason评分 ≤67228.57 >6272074.075.0400.025PSA(ng/mL) ≤20241458.33 >209777.781.0690.301TNM分期 ≤T2b15640.00 >T2b191684.217.1740.007
表2AMPK蛋白在前列腺癌的表达与临床病理的关系
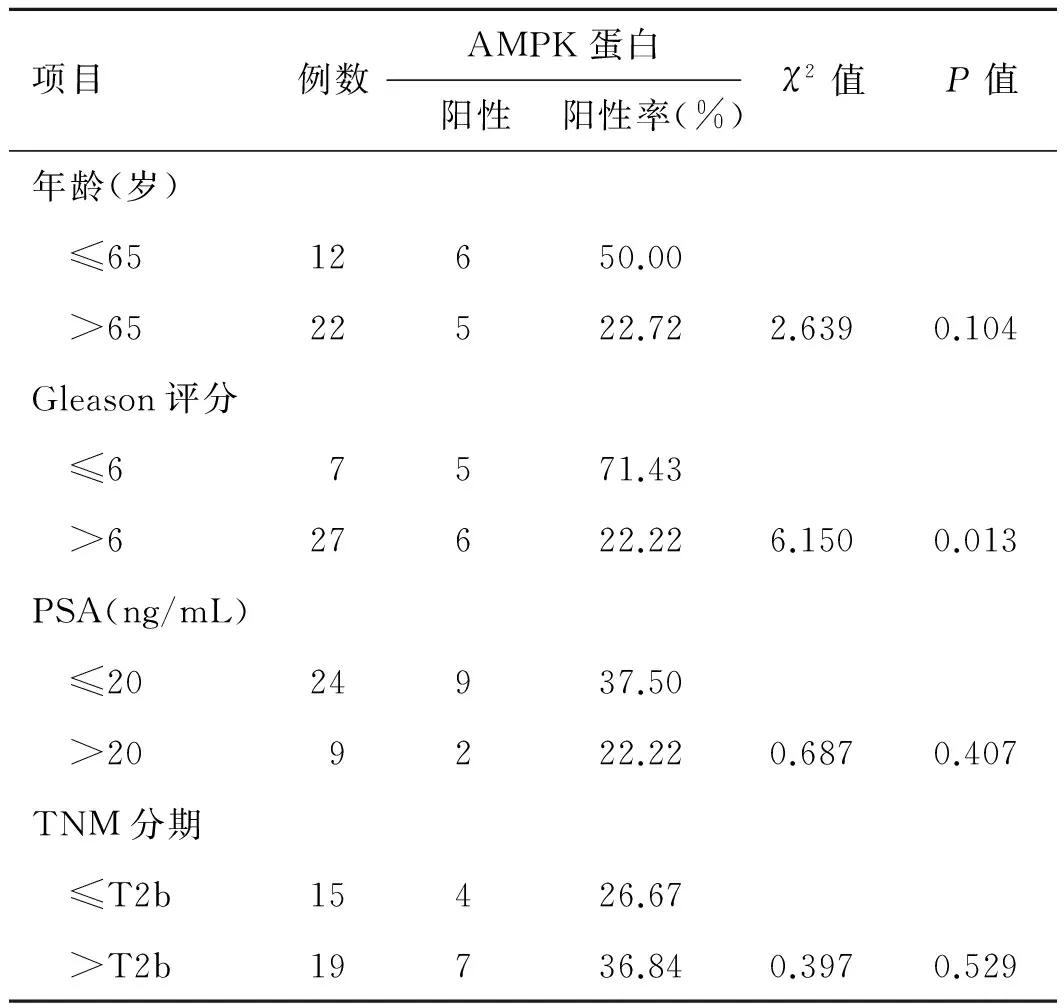
项目例数AMPK蛋白阳性阳性率(%)χ2值P值年龄(岁) ≤6512650.00 >6522522.722.6390.104Gleason评分 ≤67571.43 >627622.226.1500.013PSA(ng/mL) ≤2024937.50 >209222.220.6870.407TNM分期 ≤T2b15426.67 >T2b19736.840.3970.529
2.2HIF-1α、AMPK表达与前列腺癌不同血清PSA水平组的关系HIF-1α、AMPK在血清PSA高水平组的前列腺癌组织的阳性表达率分别为77.78%、22.22%;低PSA水平组为58.33%、37.50%。两指标PSA组间比较均不具有统计学意义(P>0.05)。
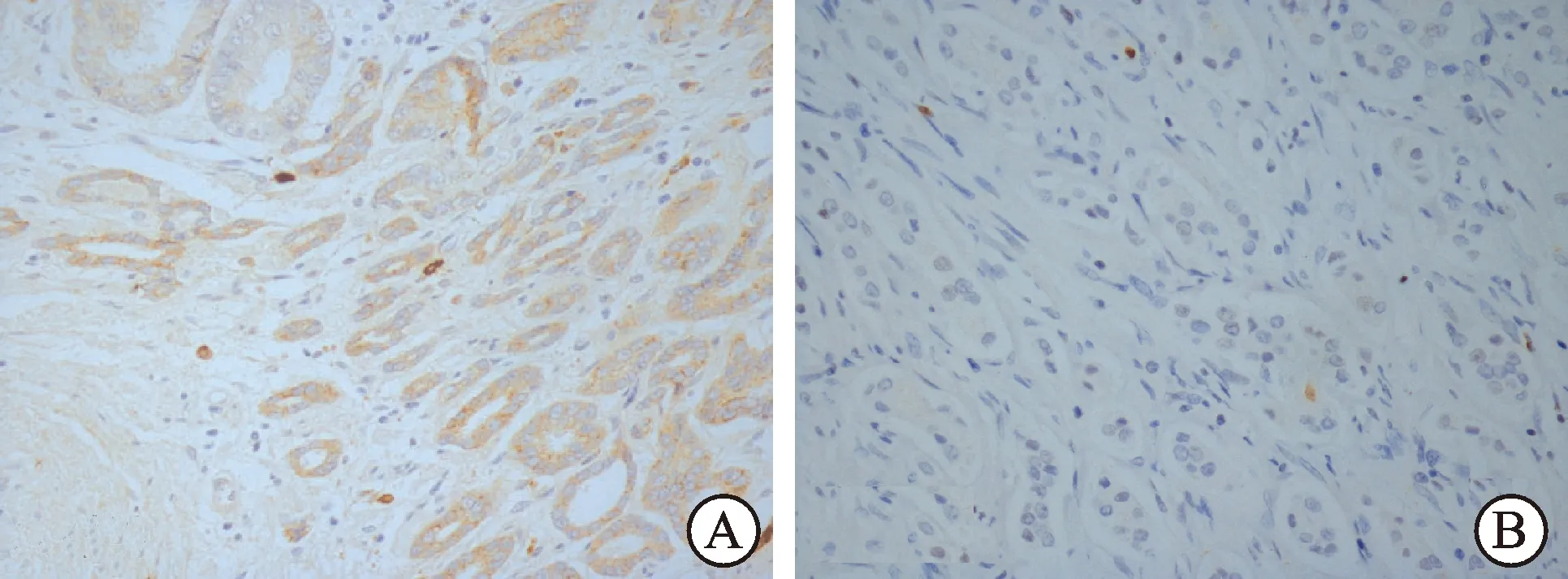
图1 HIF-1α蛋白在前列腺癌组织表达情况(×400)

图2 AMPK蛋白在前列腺癌组织表达情况(×400)
2.3HIF-1α、AMPK表达与前列腺癌不同Gleason评分组的关系HIF-1α在高Gleason评分组前列腺癌组织的阳性表达率为74.07%,低Gleason评分组阳性表达率为28.57%;高评分组的HIF-1α阳性表达率显著高于低评分组(P<0.05)。高评分组前列腺癌组织AMPK的阳性表达率为22.22%,而低评分组阳性表达率为71.43%,两者差异显著具有统计学意义(P<0.05)。
2.4HIF-1α、AMPK表达与前列腺癌不同TNM分期组的关系高危组(T分期>T2b)HIF-1α阳性表达率为84.21%,显著高于低危组(T分期≤T2b)的40.00%,差异具有统计学意义(P<0.05);AMPK的表达在TNM分组中未显现统计学差异(P>0.05)。
2.5前列腺癌中HIF-1α表达和AMPK表达的相关性对前列腺癌的HIF-1α和AMPK表达结果进行卡方检验,χ2值为5.720(P=0.017),说明两个指标具有相关性。进一步运用Spearman的相关分析得出前列腺癌中HIF-1α的高表达与AMPK的低表达呈负相关(γs=-0.410,P=0.016),结果具有统计学意义(表3)。
表3HIF-1α蛋白和AMPK蛋白在前列腺癌组织中的表达
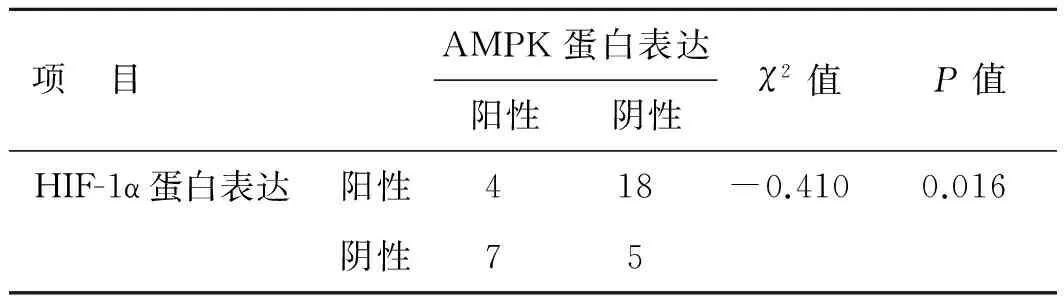
项 目AMPK蛋白表达阳性阴性χ2值P值HIF-1α蛋白表达阳性418-0.4100.016阴性75
3讨论
适应缺氧环境和改变糖能量代谢是肿瘤细胞生存的基本条件及生物学特征。有实验表明处于缺氧环境中的13种实体肿瘤存在HIF-1α蛋白异常过量表达的情况,包括肺癌、乳腺癌、结肠癌、前列腺癌等[4-5]。HIF-1α是异源性二聚体HIF-1的亚单位,本质是适应组织供氧环境变化的核转录调控因子。正常供氧条件下,组织细胞虽然可以不断的合成HIF-1α蛋白,但是泛素-蛋白酶系统的特异性的分解作用下,其转录调节作用较弱。当组织内环境缺氧和(或)基因改变例如致瘤基因ERBB2、抑瘤基因VHL等突变都有可能造成HIF-1α的过量表达[6]。HIF-1α能诱导葡萄糖转运蛋白、血管内皮生长因子(vascular endothelial growth factor,VEGF)、丙酮酸脱氢酶激酶-1等相关基因的转录,促进缺氧瘤体内新生血管的形成并舒张血管提高血氧供应,为肿瘤细胞的生存提供条件甚至刺激肿瘤转移[7]。本实验结果显示,HIF-1α蛋白在前列腺癌组织中存在明显高表达,与前期相关报道相符。Gleason评分及TNM分期是预测前列腺癌临床转归、预后以及选择治疗方案的重要参数,而高龄是前列腺癌较为明确的危险因素。本研究发现Gleason高评分组和TNM分期高危组的HIF-1α的表达量均明显高于Gleason低评分组和TNM分期低危组,高龄组的HIF-1α的表达量较低龄组高,均提示HIF-1α对指示前列腺癌生物学行为及预后具有重要作用。
本次研究还探讨AMPK表达在前列腺癌发生、发展过程的作用及HIF-1α和AMPK两者之间的关联。AMPK的本质是高保守性的异源三聚体的丝/苏氨酸激酶,由具有催化活性的α亚单位、具有调控作用的β亚单位以及γ亚单位构成[8]。它的主要生理功能是细胞能量感受器。当细胞面对例如缺氧或葡萄糖供给不足等各种不同的生存压力时会导致细胞内ATP/AMP的比率下降,继而激活AMPK能量感受器并通过促进分解代谢通路(例如糖酵解、脂肪酸氧化),抑制合成代谢通路(例如蛋白质、糖原、脂质的合成)来恢复细胞内部的能量平衡。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)对促进细胞生长、增殖起到重要的作用[9]。有研究表明,AMPK是mTOR的上游调控分子之一,其激活可抑制mTOR过表达的肿瘤细胞的生长。在多种肿瘤AMPK相关的研究发现,在癌细胞内存在AMPK表达过低、mTOR高表达现象,继而促进细胞生长,这同肿瘤细胞增殖旺盛的特性相符。进一步的研究发现[10]:AMPK能负向调节肿瘤细胞内的有氧糖酵解,抑制肿瘤的生长。HADAD等[11]在乳腺癌中发现AMPK低表达跟组织学分级和淋巴结转移有着密切的关联。本实验结果显示,AMPK蛋白在前列腺癌组织内也呈低表达且与Gleason评分关系密切。Gleason高评分组的前列腺癌组织内AMPK蛋白的表达更低,说明AMPK对于评价前列腺癌的预后风险有一定的意义。
研究发现在人肝细胞癌HepG2细胞内发现AMPK与HIF-1α蛋白的合成存在反向作用关系,并且AMPK是通过TSC1/TSC2复合物来调节mTOR信号通路影响HIF-1α蛋白的表达[12]。本次实验结果显示前列腺癌组织中AMPK呈低表达状态,低水平AMPK会减少TSC2的磷酸化及TSC复合物的产生继而提高mTOR的信号传导。前列腺癌细胞可能通过调节AMPK-mTOR信号增加HIF-1α蛋白表达,后者能激发血管内皮生长因子等表达,促进缺氧瘤体内新生血管形成,提高血氧供应以利于肿瘤细胞的生长扩散。TREINS等[13]研究也发现AMPK高表达能抑制mTOR信号通路,继而降低胰岛素和胰岛素样生长因子1诱导的HIF-1α蛋白表达。
综上所述, HIF-1α、AMPK作为临床检测指标有助于对前列腺癌的病理诊断及鉴别诊断,同时有利于评估前列腺癌的生物学行为,对临床判断预后、疾病治疗具有一定的指导意义。前列腺癌组织中AMPK同HIF-1α存在的调控关联也可能成为今后抗癌治疗研究的一个新突破点。
参考文献:
[1] JEMAL A, BRAY F,CENTER MM, et al.Global cancer statistics[J].CA Cancer J Clin, 2011, 61(2):69-90.
[2] PALAZON A, GOLDRATH AW, NIZET V, et al.HIF transcription factors, inflammation, and immunity[J].Immunity, 2014, 41(4):518-528.
[3] FAUBERT B, BOILY G, IZREIG S, et al.AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo[J].Cell Metab, 2013, 17(1):113-124.
[4] KIMBRO KS, SIMONS JW.Hypoxia-inducible factor-1 in human breast and prostate cancer[J].Endocr Relat Cancer, 2006, 13(3):739-749.
[5] ZHONG H, DE MARZO AM, LAUGHNER E, et al.Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases[J].Cancer Res, 1999, 59(22):5830-5835.
[6] SEMENZA GL.Targeting HIF-1 for cancer therapy[J].Nat Rev Cancer, 2003, 3(10):721-732.
[7] IURLARO R, LEON-ANNICCHIARICO CL, MUNOZ-PINEDO C.Regulation of cancer metabolism by oncogenes and tumor suppressors[J].Methods Enzymol, 2014, 542:59-80.
[8] FAUBERT B, VINCENT EE, POFFENBERGER MC, et al.The AMP-activated protein kinase(AMPK) and cancer: many faces of a metabolic regulator[J].Cancer Lett, 2015, 356(2 Pt A):165-170.
[9] XU K, LIU P, WEI W.mTOR signaling in tumorigenesis[J].Biochim Biophys Acta, 2014, 1846(2):638-654.
[10] FAUBERT B, BOILY G, IZREIG S, et al.AMPK is a negative regulator of the Warburg effect and suppresses tumor growth in vivo[J].Cell Metab, 2013, 17(1):113-124.
[11] HADAD SM, BAKER L, QUINLAN PR, et al.Histological evaluation of AMPK signalling in primary breast cancer[J].BMC Cancer, 2009, 9:307.
[12] HSU CC, WANG CH, WU LC, et al.Mitochondrial dysfunction represses HIF-1alpha protein synthesis through AMPK activation in human hepatoma HepG2 cells[J].Biochim Biophys Acta, 2013, 1830(10):4743-4751.
[13] TREINS C, MURDACA J, VAN OBBERGHEN E, et al.AMPK activation inhibits the expression of HIF-1alpha induced by insulin and IGF-1[J].Biochem Biophys Res Commun, 2006, 342(4):1197-1202.
(编辑王玮)
收稿日期:2015-06-28修回日期:2015-07-22
通讯作者:许恩赐,主任医师,教授.E-mail:xuenci0531@163.com
作者简介:江绍钦(1989-),男(汉族),硕士研究生.研究方向:泌尿系肿瘤.E-mail:jiang81555767@126.com
中图分类号:R737.25
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.02.008
Expression and clinical significance of HIF-1α and AMPK in prostate cancer
JIANG Shao-qin1, LI Meng-qiang1, WANG Yu-bing1, WANG Hui-li2, XU En-ci1
(1.Department of Urology, Union Hospital of Fujian Medical University,2.Department of Immunology, Fujian Medical University, Fuzhou 350001, China)
ABSTRACT:ObjectiveTo detect the protein expression of hypoxia inducible factor-1α(HIF-1α) and adenosine monophosphate activated protein kinase(AMPK) in prostate cancer and to explore their clinical significance.MethodsA total 34 cases of prostate cancer tissues collected in our hospital during Mar.2011 and May 2013 were enrolled in this study.The HIF-1α and AMPK protein expression was detected with immunohistochemistry SABC method.ResultsThe positive expression rate of HIF-1α protein in old-age group was 77.27%, which was significantly higher than that in young-age group(41.67%)(P<0.05).HIF-1α protein expression rate in high Gleason score group was 74.07%, which was significantly higher than that in low Gleason score group(28.57%)(P<0.05).On the contrary, the positive expression rate of AMPK protein in high Gleason score group was 22.22%, which was significantly lower than that in low Gleason score group(71.43%)(P<0.05).According to TNM standard, the positive expression rate of HIF-1α protein in high-risk group was 84.21%, which was significantly higher than that in low-risk group(40.00%)(P<0.05).HIF-1α and AMPK expression in prostate cancer tissues was significantly negatively correlated(P<0.05).There was no difference in the level of AMPK protein between patients of different age, prostate specific antigen(PSA), and TNM stage(P>0.05).The HIF-1α protein expression in different PSA groups had no statistically significance(P>0.05).ConclusionThe expression of HIF-1α and AMPK protein in prostate cancer was related with pathology and clinical prognosis.The high expression of HIF-1α in prostate cancer tissues was negatively correlated with the low expression of AMPK, which may be the key component to control activation of HIF-1α in prostate cancer.
KEY WORDS:hypoxia inducible factor-1α; AMP-activated protein kinase; prostate carcinoma
网络出版时间:2015-07-28
网络出版地址:http://www.cnki.net/kcms/detail/61.1374.R.20150728.1019.002.html

