磁性纳米微粒介导的尿前列腺癌抗原3检测诊断前列腺癌的价值
王 伟,彭瑞鲜,何林富,乐 飚,渠香云,施国伟,何家扬
(1.复旦大学附属上海市第五人民医院泌尿外科、复旦大学泌尿外科研究所、复旦大学循证医学中心,上海 200240;2. 上海度微医学技术有限公司,上海 201507)
·临床研究·
磁性纳米微粒介导的尿前列腺癌抗原3检测诊断前列腺癌的价值
王伟1,彭瑞鲜1,何林富2,乐飚2,渠香云2,施国伟1,何家扬1
(1.复旦大学附属上海市第五人民医院泌尿外科、复旦大学泌尿外科研究所、复旦大学循证医学中心,上海200240;2. 上海度微医学技术有限公司,上海201507)
摘要:目的探讨磁性纳米微粒介导的尿前列腺癌抗原3(PCA3)检测诊断前列腺癌的价值。方法对2014年9月至2015年5月在我院行前列腺穿刺活检的90例患者行诊断试验研究。诊断试验为尿PCA3检测,分别采用磁性纳米微粒介导法和传统尿沉淀法。诊断的金标准为前列腺穿刺活检病理。绘制尿PCA3诊断前列腺癌的受试者工作特征曲线,计算曲线下面积(AUC),比较两种不同检测方法诊断前列腺癌的价值,计算灵敏度和特异度等。结果90例患者中活检诊断前列腺癌25例,磁性纳米微粒介导法的AUC为0.934(95%CI=0.881~0.986,P<0.001),高于传统尿沉淀法的0.792(95%CI=0.668~0.915,P<0.001)。磁性纳米微粒介导法测得的尿PCA3分值,当临界点为25时,诊断前列腺癌的敏感度为77.3%,特异度为91.2%。结论磁性纳米微粒介导的尿PCA3检测,能提高检测的敏感性,诊断价值优于传统尿沉淀法。
关键词:前列腺癌;诊断试验;前列腺癌抗原3;磁性纳米微粒;尿沉淀
前列腺癌是一种常见的泌尿生殖系肿瘤。在美国,前列腺癌在危害男性健康的肿瘤中已经位列首位[1],其在中国近年来的发病率也逐年上升[2]。但前列腺癌的早期诊断目前仍缺乏理想的肿瘤标记物,血清前列腺特异性抗原(prostatespecificantigen,PSA)、尿前列腺癌抗原3(prostatecancerantigen3,PCA3)虽已广泛用于前列腺癌的筛查,但其敏感性和特异性并不理想[3-6]。磁性纳米微粒是近年来快速发展且极具应用价值的新型材料[7-8]。利用偶联特定探针的功能化磁性纳米微粒,能快速高效富集尿液中的靶RNA片段,无需使用尿沉淀物,能减少检测过程中的损失,可能会提高靶RNA例如PCA3检测的敏感性。因此,本研究通过前瞻性的诊断试验研究,探讨磁性纳米微粒介导的尿PCA3检测诊断前列腺癌的价值。
1材料与方法
1.1研究对象将2014年9月至2015年5月在我院泌尿外科行前列腺穿刺活检的患者纳入本项前瞻性的诊断试验研究。纳入研究的患者均有前列腺穿刺活检的指征,包括以下几项中的至少一项:直肠指检阳性,PSA>10ng/mL,PSA4~10ng/mL且游离PSA/总PSA<0.16。入组方式采取连续性入组。因各种原因不愿纳入研究的患者排除出研究。最终共有90例患者纳入本研究。采集研究对象的病例信息包括年龄、血清PSA、病理诊断、Gleason评分、肿瘤分期等。
1.2诊断试验
1.2.1磁性纳米微粒介导的尿PCA3检测在前列腺穿刺活检前,采集前列腺按摩(左右叶各3次)之后的初次排尿,量20~30mL,放入含有RNA稳定剂的样本收集管中混匀,-20 ℃保存。采用全程回流法制备磁性纳米微粒[7]。从四氧化三铁出发,通过共聚自组装技术将聚苯乙烯微、二氧化硅顺次包被在超顺磁性纳米微粒表面,形成多层核壳结构的纳米磁性聚合物微球,最后经3-氨丙基三乙氧基硅烷表面改性后赋予其表面富含伯氨基的高分子层。该高分子层与oligoDT偶联,然后再与含polyA尾并与靶序列互补的捕获探针结合,形成靶序列特异性的磁性纳米微粒核酸提取体系。调节优化磁珠表面的伯氨基含量,以达到最佳的核酸分离效果。检测时先加入细胞裂解液,再加入偶联了PCA3和PSA特定捕获探针的磁性纳米微粒,使PCA3和PSAmRNA结合到磁性纳米微粒,外加磁场,吸弃上清液,漂洗液洗脱,完成PCA3和PSAmRNA富集。再采用iScriptcDNASynthesisKit(美国Bio-Rad公司)合成cDNA。最后进行实时荧光定量PCR,仪器采用ABI7500实时定量PCR仪(美国ABI公司),反应体系采用300nmol/L引物,200nmol/LTaqManMGB探针,2μLcDNA,10μLUniversalMasterMix(美国ABI公司),扩增40个循环。分别测定PCA3和PSAmRNA,采用2-△△CT法求RNA的相对表达程度,最后用PCA3/PSAmRNA×1 000得到尿PCA3分值。
1.2.2传统尿沉淀法PCA3检测获得尿液标本后,4 ℃离心尿液10min,转速2 500r/min,得到尿沉淀物。用pH值为7.0的冰磷酸盐溶液冲洗尿沉淀物2遍,-80 ℃保存。尿液标本留取、逆转录cDNA合成和实时荧光定量PCR的方法同上。
1.3金标准和质量控制前列腺癌诊断的金标准定义为前列腺穿刺活检的病理结果。所有前列腺穿刺活检采取B超引导下经直肠途径,针数至少12针,并对可疑的前列腺结节加行穿刺。病理切片由两位病理科医师分别阅片,结果不一致时请第3位高年资医师核片。尿PCA3测定和病理切片读片分别由不同人员进行,互不知晓检查结果。尿标本的获取先于前列腺穿刺活检,且间隔时间不超过1周。PCR测定采取三孔重复。
1.4统计分析采用SPSS16.0统计软件。对年龄、PCA3分值、PSA等计量资料采用中位数和全距为统计量,采用非参数检验Mann-Whitney U检验,比较前列腺癌和非前列腺癌患者的PCA3分值。描绘尿PCA3诊断前列腺癌的受试者工作特征(receiveroperatingcharacteristic,ROC)曲线,计算曲线下面积(areaundercurve,AUC)并比较两种不同PCA3检测方法诊断前列腺癌的价值。选取合适的临界值,计算磁性纳米微粒介导的尿PCA3检测诊断前列腺癌的灵敏度、特异度、阳性预测值、阴性预测值和似然比。P<0.05认为差异有统计学意义。
2结果
2.1临床情况纳入本研究的90例患者中,中位年龄74 (58~91) 岁,活检前血清PSA的中位值13.9(3.1~521.2)ng/mL。活检病理证实前列腺癌25例(27.8%),其余为良性前列腺增生64例(71.1%),高级别上皮内瘤1例(1.1%)。25例前列腺癌患者中,Gleason评分≤6分者8例(32.0%),7分者10例(40.0%),≥8分者7例(28.0%)。局限性前列腺癌10例(40.0%),局部进展性前列腺癌3例(12.0%),转移性前列腺癌12例(48.0%)。
2.2前列腺癌和非前列腺癌患者PCA3分值的比较90例患者中,传统尿沉淀法检测有11例PCA3或/和PSA无扩增,磁性纳米微粒介导法有2例无扩增。磁性纳米微粒介导法测得的PCA3分值中位数为19.7(0.2~568.9):其中前列腺癌25例,PCA3分值中位数为60.4(0.3~568.9);非前列腺癌63例,PCA3分值中位数为9.3(0.2~179.9)。经Mann-Whitney U检验,两组差异有统计学意义(P<0.001,图1)。传统尿沉淀法检测出的患者中,前列腺癌22例,非前列腺癌57例,两组差异亦有统计学意义(P<0.01)。
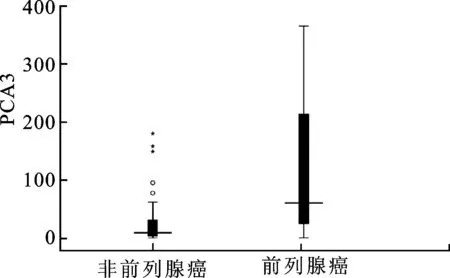
图1 前列腺癌和非前列腺癌患者尿PCA3分值的比较
2.3两种尿PCA3检测方法的比较图2显示了两种尿PCA3检测方法诊断前列腺癌的ROC曲线。磁性纳米微粒介导法的AUC为0.934 (95%CI=0.881~0.986,P<0.001),传统尿沉淀法的AUC为0.792(95%CI=0.668~0.915,P<0.001),前者的AUC较后者更高,说明磁性纳米微粒介导的尿PCA3检测诊断准确性更高。而PSA诊断前列腺癌的AUC仅为0.613(95%CI=0.350~0.876),较两种尿PCA3检测方法均低,诊断价值不及尿PCA3检测。通过亚组分析,对其中PSA4~10ng/mL的患者而言,磁性纳米微粒介导法的AUC为0.832 (95%CI=0.736~0.928),传统尿沉淀法的AUC为0.720(95%CI=0.602~0.838),两者均有诊断前列腺癌的价值,但前者的准确性更高。
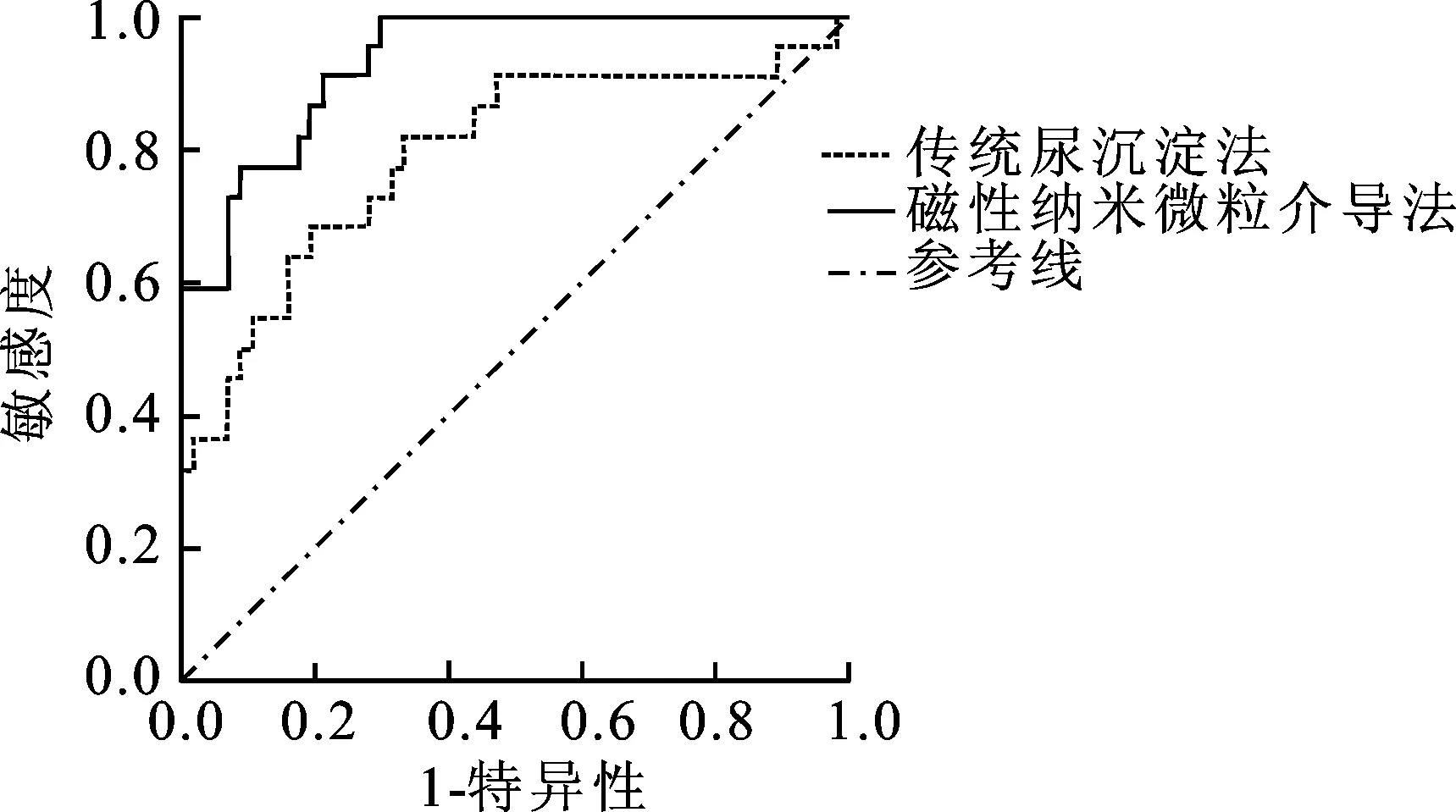
图2 两种尿PCA3检测方法诊断前列腺癌的ROC曲线
2.4磁性纳米微粒介导尿PCA3检测的敏感度和特异度当PCA3分值的临界点选择为25时,其诊断前列腺癌的敏感度和特异度总体上较高,因此选为截点值。此时敏感度为77.3%,特异度为91.2%,阳性预测值为77.3%,阴性预测值为91.2%,似然比为34.0。此外,当临界点为35时,敏感度和特异度分别为63.6%和93.0%,当临界点为20时,敏感度和特异度分别为81.8%和82.5%。
2.5不同分级、分期前列腺癌患者尿PCA3分值的比较将25例前列腺癌患者按Gleason评分≤6分、7分和≥8分分为3组,分别比较磁性纳米微粒介导法和传统尿沉淀法测得的尿PCA3分值,经Kruskal-Wallis H检验,发现不论采取何种方法检测,3组差异均无统计学意义。再按疾病进展程度分为局限性、局部进展性和转移性前列腺癌3组,同法行比较,3组差异亦无统计学意义。
3讨论
前列腺癌近年来在我国的发病率呈逐年上升的趋势,早期诊治前列腺癌显得日益重要。目前血清PSA检测被普遍用于前列腺癌的筛查,但其敏感性和特异性仍不理想,需要引进新的前列腺癌肿瘤标记物。随着研究的深入,已经发现一些新的前列腺癌肿瘤标记物,如TMPRSS2:ERG融合基因[9]、[-2]proPSA[10]、长链非编码RNA[11]和miRNA标记物[12]等,但大部分仍处于研究阶段。
PCA3由于在前列腺癌组织中呈特异性高表达,因此适宜作为前列腺癌的特异性标记物。它是一种非编码RNA,基因位于9号染色体短臂(9q21-22),包含4个外显子,其中第4个外显子有3个不同的节段可进行选择性聚腺苷酸化。由于前列腺癌细胞脱落至尿液中会导致尿PCA3含量增高,因此可通过检测尿PCA3含量来辅助诊断前列腺癌。通常采集前列腺按摩后的初次排尿,离心后通过RT-PCR检测尿沉淀物中的PCA3。研究发现尿PCA3诊断前列腺癌的价值要优于PSA,尤其是其特异性较高[4-6]。而且,对血清PSA在2.5~10ng/mL范围且既往前列腺穿刺活检阴性的患者,尿PCA3能预测再次前列腺活检的结果[13]。但研究同时也发现,尿PCA3检测的敏感性较低,原因可能为PCA3容易降解,检测前的离心沉淀也会损失一部分RNA,使得尿液中原本就微量的PCA3难以检出。因此,需要通过其他方法提高尿液中PCA3的获取率,比如磁性纳米微粒。
磁性纳米微粒是近年来得到快速发展的一种新型功能材料。微粒的结构一般由磁性内核及包裹在内核外的高分子壳构成,因此在施加外磁场的情况下,微粒在磁场中做定向运动,辅以微控制和检测手段可以实现微粒的定位和介质的分离。同时,磁性纳米微粒外壳高分子材料可以与核酸等物质结合,因此可以通过磁性纳米微粒实现在反应介质中对特定核酸的识别检测[7-8]。磁性纳米微粒是性质优良的载体,同时又具有分离功能,能够大大简化传统复杂的生化实验操作,提高检测效率,因而在生物医学领域得到应用。本研究采用的磁性纳米微粒使用全程回流法制备,克服了制备过程的瓶颈即团聚现象,磁性纳米微粒与oligoDT偶联,然后再与含polyA尾并与靶序列互补的捕获探针结合,形成靶序列特异性的磁性纳米微粒核酸提取体系,以此富集靶向核酸片段,能降低信噪比,提高检测的敏感性。
本研究发现,与传统尿沉淀法相比,磁性纳米微粒介导的尿PCA3检测诊断准确性更高。磁性纳米微粒介导法的AUC为0.934,传统尿沉淀法的AUC为0.792,前者的AUC更高,提示诊断前列腺癌的准确性更高。通过使用基因特异性捕获探针,能更高效富集尿中的PCA3和PSAmRNA,提取的RNA量更高,提高了尿PCA3检测的灵敏度。研究报道,传统尿沉淀法测得的PCA3,最佳临界点时诊断前列腺癌的敏感度为62.9%,特异度为90.6%[14]。而本研究中最佳临界点时的敏感度和特异度分别为77.3%和91.2%,特异度相近,但敏感度提高了近15%,提示功能化磁性纳米微粒介导法的诊断准确性更高,关键在于提高了检测的敏感度。但本研究为初步研究,研究病例数有限、病例来源于单中心是本研究的不足之处,有待临床进一步验证。
综上所述,功能化磁性纳米微粒介导的尿PCA3检测,能提高检测的敏感性,进一步增加了尿PCA3诊断前列腺癌的准确性,可用于前列腺癌的早期诊断和筛查,从而减少前列腺癌的漏诊和不必要的前列腺穿刺活检。
参考文献:
[1]WACHTELMS,NELIUST,HAYNESAL,etal.PSAscreeninganddeathsfromprostatecancerafterdiagnosis-apopulationbasedanalysis[J].Prostate,2013,73(12): 1365-1369.
[2] 上海市疾病预防控制中心. 2009年上海市恶性肿瘤发病率[J]. 上海预防医学,2013,25(1):54-55.
[3]BHINDIB,MAMDANIM,KULKARNIGS,etal.ImpactoftheU.S.preventiveservicestaskforcerecommendationsagainstprostatespecificantigenscreeningonprostatebiopsyandcancerdetectionrates[J].JUrol,2015,193(5):1519-1524.
[4]LEYTENGH,HESSELSD,JANNINKSA,etal.ProspectivemulticentreevaluationofPCA3andTMPRSS2-ERGgenefusionsasdiagnosticandprognosticurinarybiomarkersforprostatecancer[J].EurUrol,2014,65(3):534-542.
[5] 王伟, 何家扬, 施国伟. 前列腺癌抗原3研究进展[J].中华泌尿外科杂志,2011,32(11):789-791.
[6] 朱国栋,杨志尚,吴大鹏,等. 前列腺癌标志物PCA3的研究进展[J]. 现代泌尿外科杂志,2014,19(10):698-702.
[7]KARIMIZ,KARIMIL,SHOKROLLAHIH.Nano-magneticparticlesusedinbiomedicine:coreandcoatingmaterials[J].MaterSciEngCMaterBiolAppl,2013,33(5): 2465-2475.
[8]BORLIDOL,AZEVEDOAM,ROQUEAC,etal.Magneticseparationsinbiotechnology[J].BiotechnolAdv,2013,31(8):1374-1385.
[9]TOMLINSSA.UrinePCA3andTMPRSS2:ERGusingcancer-specificmarkerstodetectcancer[J].EurUrol,2014,65(3):543-545.
[10] 吴义启,刘修恒. 前列腺特异性抗原前体2型及其百分比、前列腺健康指数对前列腺癌的诊断价值[J].现代泌尿外科杂志,2015,20(7):525-527.
[11]ZHANGW,RENSC,SHIXL,etal.Anovelurinarylongnon-codingRNAtranscriptimprovesdiagnosticaccuracyinpatientsundergoingprostatebiopsy[J].Prostate,2015,75(6):653-661.
[12]KELLYBD,MILLERN,HEALYNA,etal.AreviewofexpressionprofilingofcirculatingmicroRNAsinmenwithprostatecancer[J].BJUInt,2013,111(1):17-21.
[13]GITTELMANMC,HERTZMANB,BAILENJ,etal.PCA3molecularurinetestasapredictorofrepeatprostatebiopsyoutcomeinmenwithpreviousnegativebiopsies:aprospectivemulticenterclinicalstudy[J].JUrol,2013,190(1):64-69.
[14]SHENM,CHENW,YUK,etal.ThediagnosticvalueofPCA3gene-basedanalysisofurinesedimentsafterdigitalrectalexaminationforprostatecancerinaChinesepopulation[J].ExpMolPathol,2011,90(1):97-100.
(编辑何宏灵)
收稿日期:2015-11-18修回日期:2015-12-26
基金项目:上海市医学重点专科基金(No.ZK2012A22);上海市科委自然科学基金(No.14ZR1432900);上海市卫生和计划生育委员会青年科研项目(No.20124y197);闵行区自然科学研究课题(No.2011MHZ36)
通讯作者:施国伟,主任医师.E-mail:dr.sgw@189.cn
作者简介:王伟(1979-),男(汉族),硕士,副主任医师.研究方向:泌尿系肿瘤与结石.E-mail:ericwang79@126.com
中图分类号:R737.25
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.04.006
Diagnostic accuracy of urinary PCA3 test by magnetic nanoparticle mediated approach for prostate cancer
WANG Wei1, PENG Rui-xian1, HE Lin-fu2, LE Biao2, QU Xiang-yun2, SHI Guo-wei1, HE Jia-yang1
(1.DepartmentofUrology,FifthPeople’sHospitalofShanghai,FudanInstituteofUrology,CenterforEvidence-basedMedicine,FudanUniversity,Shanghai200240; 2.ShanghaiDowellMedicalTechnologyCo.Ltd,Shanghai201507,China)
ABSTRACT:Objective To investigate the diagnostic accuracy of urinary prostate cancer antigen 3 (PCA3) test by magnetic nanoparticle mediated approach for prostate cancer. MethodsAltogether 90 patients who received prostate biopsy in our department during Sept. 2014 and May 2015 were enrolled in this prospective study. All patients had indications of prostate biopsy due to elevated prostate specific antigen or abnormal results of digital rectal examination. The index tests were urinary PCA3 tests, either by magnetic nanoparticle mediated approach or urinary sediment approach. The gold standard of diagnosis for prostate cancer was prostate biopsy. The receiver operating characteristic curves of PCA3 were drawn and area under curve (AUC) was calculated to compare the diagnostic accuracy of the two different approaches. Sensitivity, specificity, positive predictive value, negative predictive value and likelihood ratio were calculated. ResultsAmong the 90 cases, 25 were diagnosed as prostate cancer. The AUC obtained by the magnetic nanoparticle mediated approach was 0.934 (95%CI, 0.881~0.986, P<0.001), higher than that by the traditional sediment approach, which was 0.792 (95%CI, 0.668~0.915,P<0.001). For nanoparticle mediated approach, when the cutoff value of PCA3 score was 25, the sensitivity was 77.3%, and the specificity was 91.2% for the diagnosis of prostate cancer. ConclusionThe diagnostic accuracy of urinary PCA3 test by magnetic nanoparticle mediated approach is superior to that by urinary sediment approach.
KEY WORDS:prostate neoplasm; diagnostic accuracy test; prostate cancer antigen 3; magnetic nanoparticle; urinary sediment

