更昔洛韦治疗111例婴儿巨细胞病毒感染不良反应分析
郝世莉 许红梅
·论著·
更昔洛韦治疗111例婴儿巨细胞病毒感染不良反应分析
郝世莉 许红梅
目的 了解更昔洛韦(GCV)治疗巨细胞病毒(CMV)感染婴儿时的安全性。方法 收集2011年1月至2014年2月重庆医科大学附属儿童医院出院诊断CMV感染、住院期间有GCV治疗指征且规范使用GCV治疗3个疗程的患儿,界定GCV的不良反应,回顾性采集病史,分析不良反应的发生情况。结果 符合本文纳入和剔除标准的111份病历进入本文分析,男70例,女41例,平均年龄2个月29 d。在完成GCV规范治疗后均临床好转。60例诊断CMV肝炎,38例诊断CMV肝炎伴听力损害,10例诊断CMV感染并发听力损害,2例诊断CMV脑炎,1例诊断CMV感染并发间质性肺炎、听力损害。GCV用药前血常规(1例)、肝功能(2例)、DB(4例)和肾功能(14例)数据缺失者,用药后除2例(1例用药后ALT 270 U·L-1、1例用药后直接胆红素 35.3 μmol·L-1)外均在正常范围; GCV用药前2例PLT减少症和5例肾功能异常者用药后均在正常范围。111例婴儿用药后发生21例ANC减少症,完成当次疗程后1周随访,其中15例患儿ANC恢复正常,其余6例患儿ANC减少症发生在第3疗程未获得后续随访数据;15例贫血,完成当次疗程后1周随访,其中13例Hb上升,1例Hb降低,1例贫血发生在第3疗程未获得后续随访数据;27例GCV所致肝功能损害的患儿中,除3例ALT、AST上升发生在第3疗程无法获得后续随访数据外,其余患儿ALT和AST值均有所下降。用药后部分患儿ALT[49.6%(54/109)]、AST[37.6%(41/109)]和直接胆红素[18.7%(20/107)]一过性升高;18例出现以皮疹为表现的过敏反应;未发现WBC减少和PLT减少等不良反应,用药过程中肾功能均在正常范围,未记载神经系统和胃肠道不良反应。用药前以ANC 2.00×109·L-1为界值,用药后ANC减少症发生率(11/30 vs 10/80,χ2=10.17,R=0.291,P=0.001)差异有统计学意义; 以Hb 100 g·L-1为界值,用药后贫血发生率(11/52 vs 4/58,χ2=4.73,R=0.207,P=0.030)差异有统计学意义。结论 GCV在治疗婴儿CMV感染时可引起骨髓抑制、肝功能损害和皮疹等不良反应,多发生在诱导治疗期间,程度较轻且可逆。
更昔洛韦; 不良反应; 婴儿; 巨细胞病毒感染
巨细胞病毒(CMV)感染在我国极其广泛,一项国内的流行病学调查[1]显示,1岁婴儿CMV抗体累积阳性率高达83.3%。基于国外CMV感染的Meta分析[2]发现,活产婴儿中先天性CMV感染的患病率约为0.64%,其中约11%的婴儿出现临床症状。CMV感染可导致婴儿神经、消化、呼吸和血液等多系统的损害,其中以神经系统及肝脏损害最为多见[3]。在有症状的先天性CMV感染患儿中,25%~35%可出现神经系统后遗症,如听力障碍、视力损害、智力低下、运动障碍和认知障碍等[4]。
更昔洛韦(GCV)是抗CMV感染的一线药物, 2项CMV患儿使用GCV治疗的RCT[5,6]显示,分别使用脑干诱发电位(BSER)及丹佛(Denver II)筛查量表随访评价神经系统损害,GCV可改善CMV患儿神经系统的预后。GCV是一种2’-脱氧鸟嘌呤核苷类似物,以其三磷酸盐为活性形式抑制病毒DNA的合成,可竞争性地抑制病毒 DNA聚合酶,掺入病毒及宿主细胞的 DNA内导致病毒DNA延长的终止[7]。在作用于CMV的同时,GCV 对宿主细胞也产生一定的影响,造成一系列的不良反应[8],主要包括:骨髓抑制、肝功能损害、神经系统损害、过敏反应和消化道反应等。其不良反应在器官移植术后及免疫缺陷患者中报道较多,本研究对婴儿GCV用药前及用药各疗程中的临床资料及实验室检查结果进行回顾性总结,了解治疗过程中的不良反应发生情况和发生不良反应的影响因素。
1 方法
1.1 CMV感染的诊断标准[3]黄疸[直接胆红素(DB)升高]和(或)肝功能损害,CMV-IgM检测阳性,尿CMV-DNA PCR检测阳性。CMV脑炎:抽搐,且血CMV-IgM阳性和IgG阳性,尿CMV-DNA PCR阳性,脑脊液病毒学检测CMV-IgM阳性。
1.2 GCV的用药指征 重庆医科大学附属儿童医院(我院)GCV的用药指征:①符合CMV感染诊断标准并有较严重或易致残的CMV感染性疾病,包括间质性肺炎、黄疸型或淤胆型肝炎、脑炎和视网膜脉络膜炎(可累及黄斑而致盲),尤其是对于免疫抑制者如艾滋病患儿;②移植后预防性应用GCV;③有中枢神经系统损伤(包括感音神经性耳聋)的先天感染者[3]。
1.3 我院CMV感染的治疗常规 ①对症治疗,在GCV治疗过程中对存在黄疸、肝功能损害、神经系统症状体征者同时行退黄、保肝、营养神经和降颅压等对症处理。②治疗前与患儿家属沟通,告知其可能出现的不良反应并签署知情同意书。GCV(注射剂,浙江亚太药业股份有限公司生产)静脉滴注,第1疗程(诱导治疗)15 mg·kg-1,每日2次,2周;第2~3疗程(维持治疗)5 mg·kg-1,每日1次,各1周,各疗程间隔1周。完成1个疗程后办理出院并预约下个疗程住院。③每次住院先行血常规、肝肾功能等相关指标监测,无GCV用药禁忌则开始新疗程治疗,治疗过程中对怀疑发生不良反应者随时复测相关指标。
1.4 GCV不良反应指标及其判断标准 参照WHO药物毒性反应分度标准[9]及《实用儿科学》[10],提取以下指标并根据判断界值作为本文统计的不良反应,①骨髓抑制:WBC<2.00×109·L-1, ANC<1.00×109·L-1界定为ANC减少症,PLT<80×109·L-1界定为血小板减少症, Hb<90 g·L-1界定为贫血,存在上述指标中任何1项异常即认为发生骨髓抑制。②肝功能损害:治疗过程中任一次监测ALT、AST和直接胆红素(DB)较用药前升高50 U·L-1以上,且>正常值上限的5倍(ALT、AST>250 U·L-1,DB>34 μmol·L-1),3项指标中1项达到判定标准即为肝功能损害。③肾功能损害:治疗过程中任意一次血清BUN或Cr升高(>正常值)。④过敏反应:治疗过程中出现与用药明确相关的皮疹和瘙痒等临床表现。⑤神经系统损害:治疗过程中出现与用药明确相关的震颤、惊厥或烦躁等临床表现。⑥胃肠道反应:治疗过程中出现与用药明确相关的呕吐、腹泻和便血等临床表现。
1.5 病历纳入标准 2011年1月至2014年2月在我院出院诊断为CMV感染并符合GCV用药指征且达到规范疗程的婴儿。
1.6 病历剔除标准 ①出院诊断中不仅包括CMV感染,还包括可能影响血常规、肝肾功能结果的严重并发症及合并症(如胆道畸形行外科手术、多脏器功能损伤、使用血液制品等)的病历;②GCV不良反应指标数据缺失影响不良反应判定的病历。
1.7 截取资料的原则 截取病历中使用GCV前,使用GCV后第1疗程(第1周和第2周)、第2疗程和第3疗程
不同时段的不良反应指标,取其用药前及用药后每时段监测得到的最大异常值。
1.8 统计学分析 使用SPSS 19.0统计分析软件,采用重复测量数据的方差分析方法比较用药前后各项指标的变化趋势,并计算不同用药时段各不良反应在研究总体中的发生频数。采用均值±标准差(x±s)描述各个时段测量指标的平均水平及离散程度,P<0.05为差异有统计学意义;采用发生率描述研究对象中不良反应的发生频率。
2 结果
2.1 一般情况 符合本文纳入和剔除标准的111份病历进入本文分析,男70例,女41例,年龄14 d至10个月27 d,平均2个月29 d。在完成3个疗程的GCV规范治疗后均临床好转(黄疸逐渐消退,肝功能逐渐好转,随访纯音听阈测听及脑干听觉诱发电位较用药前改善)。60例患儿诊断CMV肝炎,38例诊断CMV肝炎伴听力损害(纯音听阈测听及脑干听觉诱发电位异常),10例诊断CMV感染并发听力损害,2例诊断CMV脑炎,1例诊断CMV感染并发间质性肺炎、听力损害。
GCV用药前血常规数据缺失的1例,用药后血常规在正常范围;GCV用药前肝功能数据缺失的2例中,1例用药后ALT 270 U·L-1,1例用药后肝功能在正常范围;GCV用药前DB数据缺失的4例中,1例用药后DB 35.3 μmol·L-1,3例用药后DB在正常范围;GCV用药前肾功能数据缺失的14例用药后肾功能均未见异常。GCV用药前2例PLT减少和5例肾功能异常者用药后均在正常范围。
2.2 GCV用药前后血常规、肝肾功能比较 表1显示,用药3个疗程4次血常规监测WBC、ANC均值与用药前比较均降低,差异有统计学意义,诱导治疗第2周最低,WBC第2和3疗程、ANC第2疗程与诱导治疗第2周相比较,差异有统计学意义。Hb均值呈上升趋势,第2、3疗程Hb均值分别与用药前和第1疗程第1、2周比较,差异有统计学意义。PLT在诱导治疗第2周及第2疗程较用药前差异有统计学意义,在诱导治疗第2周最高。ALT、AST和DS均值呈下降趋势,与用药前比较差异均有统计学意义(P<0.05)。BUN及Cr在用药前及用药后4次监测差异均无统计学意义(P>0.05)。
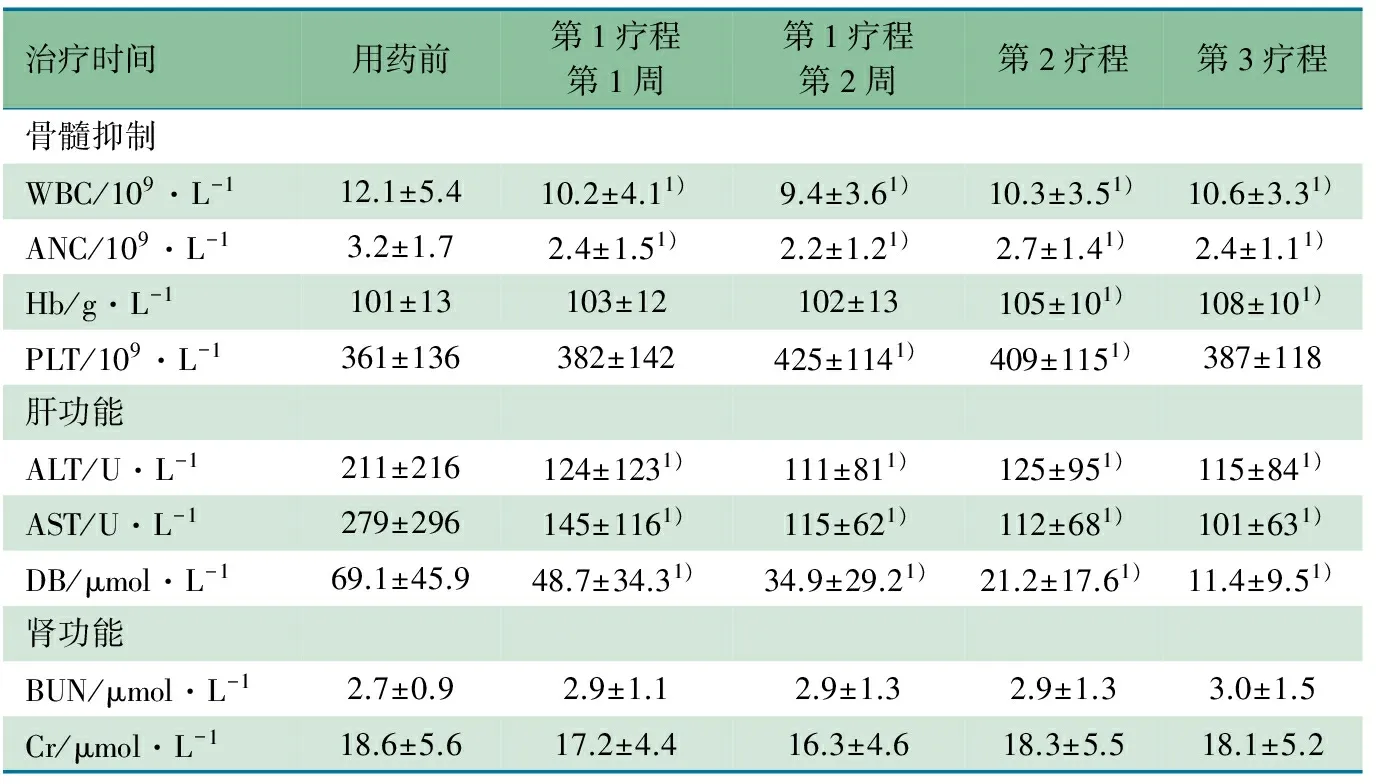
表1 GCV用药前后血常规和肝肾功能比较(x ±s)
注 1)与GCV用药前均值相比较差异有统计学意义(P<0.05)
2.3 GCV用药后不同疗程的不良反应 表2显示,111例婴儿用药后未发现以WBC减少和PLT减少症为表现的不良反应;用药前ANC≤2.00×109·L-130例,用药后11例发生ANC减少症,用药前ANC>2.00×109·L-180例,用药后10例发生ANC减少症,ANC减少症的发生率差异有统计学意义(χ2=10.17,P=0.001,r=0.291)。用药前Hb≤100 g·L-152例,用药后11例发生贫血或原有贫血加重,用药前Hb﹥100 g·L-158例,用药后4例发生贫血,贫血发生率差异有统计学意义(χ2=4.73,P=0.030,rR=0.207)。包括GCV用药前5例肾功能异常的111例婴儿用药过程中肾功能均在正常范围。111例均未记载神经系统和胃肠道不良反应。3例婴儿治疗过程中出现吐奶情况,不能明确为使用GCV所致。用药后过敏反应18例,均以皮疹为表现:颜面部18例,累及躯干5例;红色丘疹3例、斑丘疹2例、水疱1例,未描述具体性质的皮疹12例;3例出现2次皮疹;未发现皮疹进行性增多、喉头水肿、过敏性休克等严重的过敏反应。
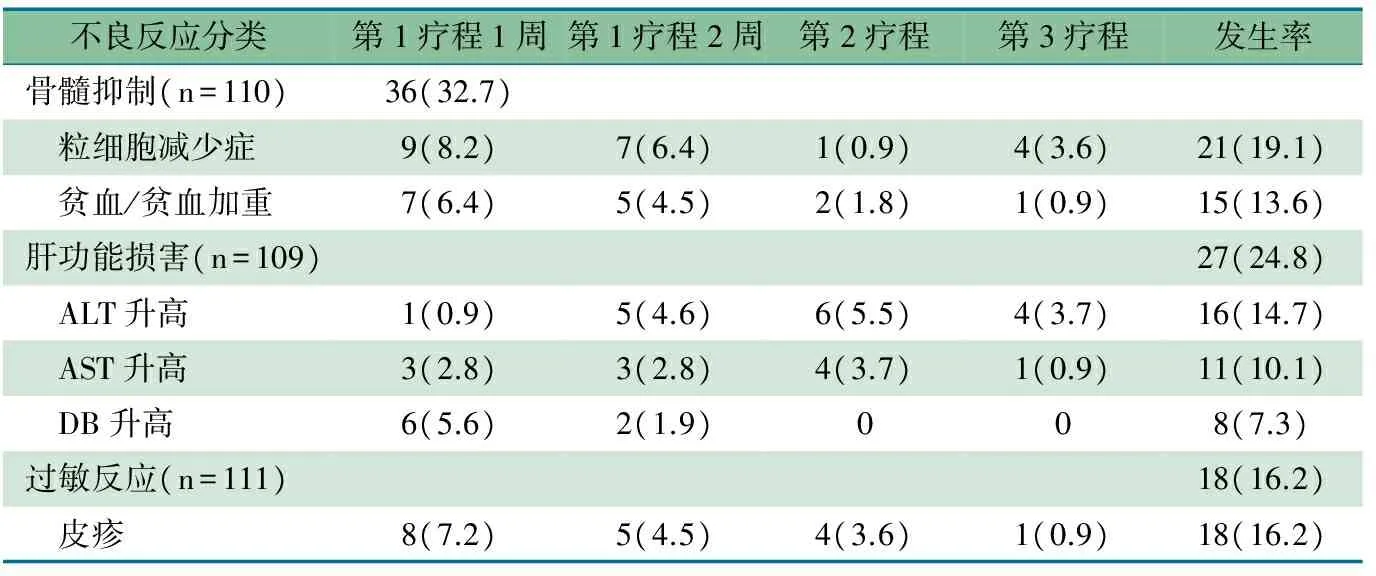
表2 GCV用药后各期不良反应监测统计结果 [n(%)]
21例ANC减少症婴儿中, 1例ANC 0.34×109·L-1,余ANC(0.5~1.0)×109·L-1,完成当疗程治疗后1周左右,15例患儿ANC恢复正常,6例患儿ANC减少症发生在第3疗程未获得后续随访数据。15例贫血(60~90)g·L-1,在完成当疗程治疗后1~2周,13例患儿Hb上升,1例患儿Hb降低,1例患儿贫血发生在第3疗程,缺少后续随访数据。
27例肝功能损害的患儿中,除3例ALT和AST上升发生在第3疗程无法获得后续随访数据外,其余患儿ALT和AST值均有所下降。用药后有ALT[49.6%(54/109)]、AST[37.6%(41/109)]和DB[18.7%(20/107)]一过性升高,但未发现其伴有黄疸进行性加重和肝脾进行性肿大等器质性肝功能损害表现。用药过程中ALT和AST监测最高值较用药前升高1~100 U·L-1者分别为37.6%(41/109)和27.5%(30/109),DB监测最高值较用药前升高0.1~6.7 μmol·L-1者占12.5%(13/107)。ALT升高>150 U·L-1占7.3%(8/109),AST升高>150 U·L-1占5.5%(6/109);ALT在100~150 U·L-1占4.6%(5/109),AST 100~150 U·L-1占4.6%(5/109);DB 6.8~20 μmol·L-1占3.7%(4/107),20~33.5 μmol·L-1的占2.8%(3/107),未见DB>33.6 μmol·L-1者。
3 讨论
GCV治疗可以改善CMV感染患儿的预后[5,6]。但在抗CMV的同时也可能对宿主细胞造成影响。目前已有研究报道GCV可造成离体细胞细胞周期延长,增殖率降低,凋亡细胞增多[11]。临床上也有报道显示GCV存在不可忽视的不良反应[12]。
应用GCV后发生骨髓抑制的报道相对较多。本研究ANC减少症发生率19.1%(21/110),贫血13.6%(15/110),未见到PLT减少症。国内熊小丽[13]报道100例患儿中,ANC减少者占3%、贫血者占9%、PLT减少者占2%。于四景[14]的研究中观察到ANC减少者占17.8%、PLT减少者占4.3%,未见贫血。本研究GCV用药方案与熊小丽[13]和于四景[14]相同,而ANC减少症及贫血的发生率较上述2个研究结果高。不同研究间的差距可能与不良反应判定标准和患儿基线情况不尽相同有关,也可能与纳入研究病例不多有关。国外Whitley等[15]的Ⅱ期临床随机对照试验纳入47例使用GCV的CMV感染患儿,其中16例按 8 mg·kg-1·d-1用药6周,其余按照12 mg·kg-1·d-1用药6周;ANC减少、贫血的发生率分别为34%和2%,未见PLT减少;每组各有3例因ANC<0.5×109·L-1而停药。本研究ANC减少症的发生率较其低,而贫血的发生率较其高,可能与用药方法不同、患儿基础疾病及人种差异有关。
本研究发现患儿用药后各疗程WBC、ANC均值较用药前降低,且以第2周降低尤著,各骨髓抑制相关不良反应的发生率也以诱导治疗第2周为高,均提示GCV诱导治疗期导致的骨髓抑制较重。这与国内相关研究[13,14]相一致。可能与诱导治疗期GCV 的用量(5 mg·kg-1,q12 d)为维持治疗期(5 mg·kg-1,qd)的 2 倍有关。贺晓日[16]等研究提示,常规剂量GCV治疗的骨髓抑制不良反应较大剂量小。因此,骨髓抑制及其严重程度与GCV剂量之间可能有关。
本研究进一步发现,用药前ANC及Hb水平低的患儿用药后ANC减少症和贫血的发病率明显升高。所以在临床使用GCV过程中对WBC、ANC、Hb和PLT等降低的患儿尤其应注意密切随访。
本研究中明显的肝功能损害发生率为24.8%,以ALT和AST升高为主,部分有DB升高。经保肝及抗病毒等治疗,在完成3疗程GCV治疗后,肝功能均有好转。本研究中肝功能损害发生率高于熊小丽[13](ALT升高者9%)及于四景[14](ALT升高者9.7%)的报道,也明显高于Whitley等[15]的报道(肝功能损害2%)。这可能与肝功能损害判定标准不同或CMV肝炎病程中ALT升高的干扰有关。另外本研究还发现治疗过程中分别有49.6%(54/109)、37.6%(41/109)和18.7%(20/107)患儿存在ALT、AST和DB一过性升高,其中ALT升高1~100 U·L-1占 37.6%(41/109)、AST升高1~100 U·L-1占27.5%(30/109)、DB升高0.1~6.7 μmol·L-1占12.5%(13/107)。Whitley等[15]观察的47例患儿中,分别有28例(60%)和23例(49%)ALT、AST升高1 ~100 U·L-1,13例(27%)DB升高0.1~3.9 μmol·L-1,被认为是实验室指标异常。在GCV治疗过程中出现的肝功能指标异常多预后较好,这种现象可能与肝脏对GCV肝毒性的适应性有关,但也需警惕GCV所致的严重肝脏损害。Whitley等[15]的研究中,有1例(2%)因严重肝功能损害停止治疗。
多个研究[5,13-15]均未报道GCV引起肾脏损害,本研究也未发现用药后出现肾功能损害的患儿,但也有儿童使用GCV后肾功能异常的报道[8],所以用药过程中也应引起重视,定期监测肾功能变化。
本研究中患儿使用GCV后18例出现皮肤的过敏反应,18例均有颜面皮疹,5例皮疹累及躯干,1例伴瘙痒,未发现皮疹进行性增多、喉头水肿和过敏性休克等严重过敏反应。本研究中过敏性反应发生率比国内外相关研究[13-15]高。此外,国内温鸿飞[17]曾报道婴儿静脉滴注GCV后出现过敏性休克的个案病例。
本研究仅发现3例患儿出现吐奶情况,且不能确定其为GCV所致;未发现用药过程中震颤、抽搐、烦躁和哭吵等神经系统异常表现者。但有研究[13-15,18]显示GCV用药后可能出现神经系统表现(如震颤、烦吵等)和消化系统表现(呕吐、腹泻、食欲下降等)。
本研究为回顾性研究,与对GCV不良反应前瞻性系统观测的结果存在差距;纳入的样本量不大,可能使得发生率不高的GCV不良反应难以被发现;回顾性收集病历记载的主观性指标,如皮疹、消化道症状和神经系统表现(震颤、烦吵)等,不同医生的理解认识不同,存在测量偏倚。
综上所述,GCV在治疗婴儿CMV感染过程中的不良反应多发生在诱导治疗期间。用药前ANC、Hb水平较低的患儿更易发生骨髓抑制不良反应。GCV相关的不良反应程度多较轻,预后较好。婴儿使用GCV抗CMV治疗前应进行血常规、肝肾功能等实验室筛查,识别发生不良反应的高危患儿,治疗过程中需严格监测,及时发现并处理相关不良反应。
[1] 吴美玲,陈洁,钟天鹰, 等. 南京市0~8岁儿童CMV感染流行病学调查. 中华实用儿科临床杂志, 2013, 28(4): 298-300
[2] Kenneson A, Cannon MJ. Review and meta-analysis of the epidemiology of congenital cytomegalovirus (CMV) infection. Rev Med Virol, 2007, 17(4): 253-276
[3] 中华医学会儿科学分会感染学组, 全国儿科临床病毒感染协作组, 《中华儿科杂志》编辑委员会. 儿童巨细胞病毒性疾病诊断和防治的建议. 中华儿科杂志,2012, 50(4): 290-292
[4] Oriol Coll, Guillaume Benoist, Yves Ville, et al. Guidelines on CMV congenital infection. J Perinat Med, 2009, 37(5): 433-445
[5] Kimberlin DW, Lin CY, Sánchez PJ, et al. Effect of ganciclovir therapy on hearing in symptomatic congenital cytomegalovirus disease involving the cen-tral nervous system: a randomized, controlled trial. J Pediatr, 2003, 143 (1): 16-25
[6] Oliver SE, Cloud GA, Sánchez PJ, et al. Neurodevelopmental outcomes following Ganciclovir therapy in symptomatic congenital cytomegalovirus infections involving the central nervous system. J Clin Virol, 2009, 46(Suppl 4): 22-26
[7] Thomas Matthews, Richard Boehme. Antiviral Activity and Mechanism of Action of Ganciclovir. The American Journal of Hospice and Palliative Care, 1988, 10(3): S490-S494
[8] Ganciclovir Side Effects. http://www.drugs.com/sfx/ganciclovir-side-effects.html. [2016-11-01][9] Miller AB, Hoogstraten B, Staquet M, et al. Reporting results of cancer treatment. Cancer, 1981, 47(1): 207-214
[10] 胡亚美, 江载芳. 实用儿科学, 第8版. 北京: 人民卫生出版社, 2015: 1807
[11] Choi WS, Koh JW, Chung TY, et al. Cytotoxicity of ganciclovir on culture-d human corneal endothelial cells. Antivir Ther, 2013, 18(6): 813-820
[12] Bueno J, Ramil C, Green M. Current management strategies for the prevention and treatment of cytomegalovirus infection in pediatric transplant recipients. Paediatric Drugs, 2002, 4(5): 279-290
[13]熊小丽, 陈鹏, 鄢素琪, 等. 更昔洛韦治疗婴儿巨细胞病毒性肝炎(淤胆型)的疗效及不良反应观察. 中国医院药学杂志, 2013, 33(7), 563-566
[14] 于四景, 李双杰, 刘朝宙, 等. 更昔洛韦治疗婴儿巨细胞病毒肝炎的不良反应观察. 中国感染控制杂志, 2010, 9(6): 400-404
[15] Whitley RJ, Cloud G, Gruber W, et al. Ganciclovir treatment of symptomat-ic congenital cytomegalovirus infection: results of a phaseⅡ study. J Infect Dis, 1997, 175(5): 1080-1086
[16]贺晓日, 陈平洋, 王涛, 等. 不同剂量更昔洛韦治疗新生儿先天性巨细胞病毒感染的临床观察. 中国当代儿科杂志, 2009, 11(8): 641-644
[17] 温鸿飞, 徐渲, 彭越. 婴儿静脉滴注更昔洛韦致过敏性休克. 药物不良反应杂志, 2007, 9(2): 140
[18] 孙文英, 孙新, 肖华, 等. 更昔洛韦治疗婴幼儿巨细胞病毒感染安全性和不良反应的临床研究. 中国儿童保健杂志, 2002, 10(4): 230-232
(本文编辑:张崇凡,孙晋枫)
Astudyonadverseeffectsofganciclovirin111infantswithcytomegalovirusinfection
HAOShi-li,XUHong-mei
(Children'sHospitalofChongqingMedicalUniversity,Chongqing400014,China)
Corresponding Author:XU Hong-mei, E-mail: xuhongm0095@sina.com
ObjectiveTo evaluate the safety of ganciclovir (GCV) in infants with CMV infection. MethodsOne hundred and eleven infants were collected who were diagnosed as symptomatic CMV infection that had indications to use GCV, and they were treated for 3 courses of GCV in Children's Hospital of Chongqing Medical University from Jan. 2011 to Feb. 2014. Clinic data of adverse effects were collected and analyzed retrospectively. ResultsAmong 111 cases, 70 were boys and 41 were girls. The mean age was 2 m and 29 d (14 d to10 m and 27 d). There were 60 cases with CMV hepatitis, 38 with CMV hepatitis and hearing impairment, 10 with hearing impairment caused by CMV, 2 with CMV encephalitis, 1 was with interstitial pneumonia and hearing impairment caused by CMV. All of them got better after treated with GCV for 3 courses. Before the treatment with GCV, the data of blood routine examination missed in 1 case, liver function examination missed in 2 cases, DB missed in 4 cases and renal function examination missed in 14 cases. The examination of blood routine , liver function and renal function after the GCV treatment of above cases were normal except 2 cases (ALT was 270 U·L-1in 1 child, DB was 35.3 μmol·L-1in 1 child). In 2 cases with thrombocytopenia and in 5 cases with renal impairment before using GCV, PLT or renal function was normal after GCV medication. There were 21 cases with granulocytopenia during the GCV treatment. And ANC number was normal one week follow-up later in 15/21 cases after granulocytopenia occurred and other 6/21 cases with granulocytopenia occurred at the end of the third course were not followed-up because patients missed. There were 15 cases with anemia. HB were increased in 13/15 cases and decreased in 1/15 case 1 week later. Anemia in 1/15 case occurred at the end of the third course was not followed-up because patient missed. Liver damage caused by GCV was found in 27 cases. The level of ALT and AST in 24/27 cases decreased after the GCV treatment. The other 3/27 cases with anemia occurred in the third course were not followed-up because patients missed. Transient increase of ALT, AST and/or DB that did not get the criterion of liver damage were found in 54/109(49.6%), 41/109(37.6%)and 20/107 (18.7%) respectively. Rash was found in 18 cases. WBC reducing, thrombocytopenia and renal damage were not found. And describes about adverse effects of nervous system and gastrointestinal tract were not recorded. Incidence of granulocytopenia in cases whose ANC≤2.00×109·L-1was higher than those whose ANC>2.00×109·L-1(11/30vs10/80,χ2=10.17,P=0.001,R=0.291). Incidence of anemia in cases whose Hb≤100 g·L-1was higher than those whose Hb>100 g·L-1(11/52vs4/58,χ2=4.73,P=0.030,R=0.207).ConclusionGCV can cause bone marrow suppression, liver function damage and rash in infants with CMV infection. The adverse effects often occur in the induction period of GCV treatment, and are usually mild and reversible.
Ganciclovir; Adverse effect; Infant; Cytomegalovirus infection
重庆医科大学附属儿童医院 重庆,400014
许红梅,E-mail: xuhongm0095@sina.com
10.3969/j.issn.1673-5501.2016.06.006
2016-11-17
2016-12-08)

