爱必妥联合FOLFOX化疗治疗晚期结肠癌的疗效分析
赵微 于佩瑶 金霞
爱必妥联合FOLFOX化疗治疗晚期结肠癌的疗效分析
赵微 于佩瑶 金霞
目的探讨晚期结肠癌治疗中爱必妥联合FOLFOX化疗的临床疗效和不良反应。方法选取KRAS野生型晚期转移性结肠癌患者90例,根据患者情况均分为3组,分别为无爱必妥的对照组(FOLFOX化疗)、单周方案组(爱必妥单周给药联合FOLFOX化疗)、双周方案组(爱必妥双周给药联合FOLFOX化疗),观察3组患者临床效果及毒副反应。结果对照组、单周方案组、双周方案组客观缓解率分别为16.67%、40.00%、33.33%,疾病控制率分别为66.67%、83.33%、80.00%;对照组、单周方案组、双周方案组痤疮样皮疹发生率为0、86.67%、80.00%,爱必妥联合化疗组痤疮样皮疹发生率与对照组差异有统计学意义(P<0.05),且爱必妥单周及双周给药联合化疗组痤疮样皮疹发生率差异无统计学意义(P>0.05);其余各项毒副反应与对照组差异无统计学意义(P>0.05)。结论爱必妥联合FOLFOX方案治疗晚期结肠癌的近期疗效显著,毒副反应可耐受。
爱必妥;FOLFOX化疗;晚期结肠癌
目前,在晚期结肠癌的临床治疗中,化疗仍是主要的治疗手段,其中FOLFOX方案是晚期结肠癌的一线化疗方案,但因肿瘤耐药性,常导致治疗失败[1]。爱必妥又称为“西妥昔单抗”,是一种人鼠嵌合性IgG1型单克隆抗体,靶点为表皮生长因子受体(EGFR),有研究报道显示,爱必妥可对EGFR高表达进行有效抑制,进而实现对肿瘤的抑制。经过临床实践证实,在化疗中联合应用靶向药物,可有效延长患者的生存时间[2]。鉴于此,本研究通过随机对照试验,观察爱必妥联合FOLFOX化疗的临床疗效和不良反应,并将有关情况报告如下。
1 资料与方法
1.1 一般资料选取大连医科大学附属第一医院2013-01—2014-12晚期转移性结肠癌患者90例,所有患者均经病理组织学检测确诊。其中女34例,男56例;患者年龄为35~75岁,平均年龄为(58.54±2.64)岁;其中53例为中分化腺癌,28例为高分化腺癌,2例为黏液腺癌,7例为低分化腺癌。所有患者均经过K-ras基因检测,为野生型。并通过CT对肿瘤病灶进行客观的评估;另对患者肝肾功能、血尿常规等进行检测,均未发现异常现象;所有患者KPS评分≥60分,且预计生存期时间在3个月及以上。根据患者实际情况,将其分为3组,分别为无爱必妥的对照组、单周方案组、双周方案组。
1.2 治疗方法对照组:仅用FOLFOX方案化疗:奥沙利铂100 mg/m2静滴>2 h,d1;亚叶酸钙400 mg/m2静滴,d1;氟尿嘧啶2 400 mg/m2持续静脉泵入46~48 h。14 d为1个周期,化疗不超过12个周期。化疗前均给予托烷司琼5 mg静滴。
治疗组:各组FOLFOX方案用药与对照组相同。爱必妥先于化疗药物前使用,两者相隔1 h以上。在给予爱必妥前,首先需肌注苯海拉明20 mg、静脉推注地塞米松5 mg。
单周方案组:爱必妥首次400 mg/m2,第2周始250 mg/m2持续静滴120 min,1次/周,使用16~22次,平均使用20次。
双周方案组:爱必妥500 mg/m2,每2周1次,使用6~12次,平均使用10次。
1.3 观察指标3组患者均需要接受4周期以上的化疗,若在化疗期间病情进展,经证实为PD的患者即停止治疗。在患者治疗的过程中,每周均行血常规检查,每个周期都需要对患者的肝肾功能、心电图等进行检查。在4个周期中接受腹部B超、盆腔B超等常规检查项目,必要情况下,可安排患者接受MRI、CT以及全身骨扫描等检查。在复查入组之后,再根据患者肿瘤变化情况进行疗效判定。
1.4 判断标准
1.4.1 疗效标准根据实体瘤的疗效评价标准(RECIST)所拟定的关于抗肿瘤药物临床近期疗效评价标准[3]作为本研究判断标准。完全缓解(CR):观测患者肿瘤变化情况,已经完全消失,且临床症状已基本上得到了有效缓解;部分缓解(PR):患者的肿瘤肿块已经有了非常显著的缩小,缩小面积超过了一半以上,并未出现其他新病灶;稳定(SD):患者的肿瘤肿块已经有了明显缩小,缩小面积不足一半,或者增大面积未超过1/4,且无其他新病灶;进展(PD):患者的肿瘤肿块面积出现了显著增加,并且病灶增大超过了1/4,或者有新病灶出现。客观缓解率=(PR+CR)/总例数×100%;疾病控制率=(SD+PR+CR)/总例数×100%。
1.4.2 毒副反应包括患者胃肠道反应、骨髓抑制、痤疮样皮疹、肝功能损害、神经毒性等。
1.5 统计学处理运用SPSS 20.0统计学软件分析,计数资料采用χ2检验。若P<0.05,即表示差异有统计学意义。
2 结果
2.1 一般资料比较3组患者一般资料比较,差异均无统计学意义(P=0.068 1),具有可比性。
2.2 3组患者临床治疗效果比较(表1)无爱必妥的对照组客观缓解率为16.67%,疾病控制率为66.67%;单周方案组客观缓解率为40.00%,疾病控制率为83.33%;双周方案组客观缓解率为33.33%,疾病控制率为80.00%。根据比较结果来看,爱必妥联合化疗的两组患者,客观缓解率与疾病控制率均高于对照组(P=0.021 6);单周方案组与双周方案组两项指标对比差异无统计学意义(P=0.092 4)。

表1 3组患者临床治疗效果比较(n=30)
2.3 3组患者临床毒副反应比较(表2)两组爱必妥联合化疗组均有痤疮样皮疹病例发生,与对照组比较差异有统计学意义(P=0.030 8),且两组爱必妥联合化疗组痤疮样皮疹发生率对比差异无统计学意义(χ2=3.502 9,P=0.071 3),两组皮疹多为1~2级,级皮疹发病率较低(均<10%),经治疗后均得到了有效改善,未影响后续治疗。其余各项毒副反应与对照组比较,差异无统计学意义(χ2=5.618 7,P=0.066 9)。
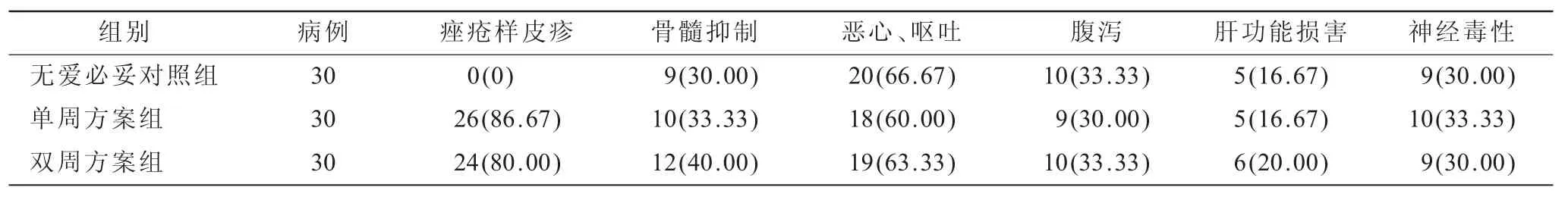
表2 3组患者临床毒副反应比较[n(%)]
3 讨论
近年来伴随着人们膳食结构和经济发展的影响,结肠癌发病率逐年增加。因结肠癌早期具有非常强的隐蔽性,大部分的患者不能早期发现、及时就诊[4]。约25%的结肠癌患者在初诊时已有潜在转移,约有50%患者会在病程中出现转移[5]。而目前晚期结肠癌的治疗仍是以化疗为主的综合治疗,但化疗的有效率无法达到预期。现在分子靶向药物治疗为肿瘤患者提供了新的治疗途径,以EGFR为靶点的治疗药物是目前癌症研究领域中的一个热点问题[6]。EGFR在相当一部分肿瘤中都有不同程度的表达,90%以上结肠癌患者的EGFR为阳性[7]。爱必妥(Cetuximab,C225)作为IgG1单克隆抗体,可以特异性地与EGFR结合,阻断其与内源性配体的结合,从而阻断整个下游信号途径的传导而发挥抗肿瘤作用,在晚期结肠癌等的临床治疗中取得了令人鼓舞的疗效[8]。K-ras基因是一个编码EGFR信号转导通路Ras蛋白的基因[9]。在K-ras野生型结肠癌中,该蛋白受到严格调控,仅在特定的刺激下(如EGFR信号)发生活化。因此,EGFR靶向药物爱必妥能有效阻断肿瘤下游信号的传导[10]。研究显示,K-ras基因野生型的患者能从爱必妥联合化疗中获得更好的疗效,而突变型的患者无法获益。
为进一步指导临床治疗,本研究采用随机对照研究,共入组经组织病理学证实的结肠癌患者90例,且均经K-ras基因检测为野生型,其中60例患者采用两种不同的爱必妥用法联合FOLFOX方案进行化疗,另外选取30例患者为对照组,单用FOLFOX方案进行化疗,观察比较3组患者接受治疗后的近期疗效和不良反应,并对研究结果进行了统计分析。结果显示,爱必妥单周及双周给药联合化疗的治疗方案较单纯化疗组取得的效果显著(P<0.05)。爱必妥副作用主要为痤疮样皮疹,本研究中,爱必妥联合用药组均出现了较大范围的痤疮样皮疹,但多为1~2级,3~4级严重皮疹发病率较低,经有效治疗后未影响临床用药,在临床试验中显示了可以接受的毒性。且两组爱必妥联合用药组痤疮样皮疹的发生率对比差异无统计学意义(P>0.05),这表明改变爱必妥用药方案,并不会致使痤疮样皮疹发生率变化。同时,研究显示痤疮样皮疹可能与疗效有关。本临床研究中其他用药后毒副反应:骨髓抑制、腹泻、恶心呕吐、肝功能损害以及神经毒性等,大多比较轻微,3组患者都以Ⅰ~Ⅱ度为主,Ⅲ~Ⅳ度较少见。
由此可知,在K-ras基因表达状态为野生型的晚期结肠癌患者的临床治疗中,通过爱必妥靶向药物联合FOLFOX方案化疗,无论是单周方案还是双周方案,均可较好的实现对病情的控制,且疗效安全,故值得推广。
[1]刘汉山,吴国岭.爱必妥联合放疗治疗中晚期食管癌临床观察及生活质量分析[J].武警医学院学报,2010,19(5):367-370.
[2]曾进龙,王志超,张海良,等.FOLFIRI化疗方案及其与西妥昔单抗联用治疗晚期结肠癌分析[J].临床医学工程,2012,19(11):1929-1930.
[3]王晓红,黄颖.比较单用FOLFIRI化疗方案及其与西妥昔单抗联用治疗晚期结肠癌的疗效[J].中国临床药理学杂志,2011,27(12):972-975.
[4]郭桂芳,夏良平,徐瑞华,等.西妥昔单抗联合化疗治疗晚期结直肠癌的生存分析及KRAS对疗效的影响[J].中山大学学报:医学科学版,2011,31(5):637-643.
[6]周陈西,刘孟娟,王增,等.西妥昔单抗联合化疗方案治疗晚期结直肠癌的临床疗效[J].中国临床药学杂志,2012,16(2):99-102.
[7]吕瑶,石燕,王治宽,等.贝伐珠单抗联合FOLFOX方案优化治疗晚期结肠癌的疗效观察[J].癌症进展,2014,11(6):593-596.
[8]茅慧,石燕,戴广海.西妥昔单抗联合FOLFOX4方案一线治疗转移性结直肠癌的临床观察[J].临床肿瘤学杂志,2012,17(4):356-359.
[9]王华,蔡苏玲.西妥昔单抗联合化疗治疗转移性结直肠癌的临床观察[J].医药前沿,2014,3(24):128-129.
[10]王秀丽,刘春玲,李晓琴.西妥昔单抗联合化疗治疗转移性结直肠癌的临床观察[J].肿瘤预防与治疗,2010,23(4):286-290.
Objective To explore the clinical effects and adverse effects of Erbitux w ith FOLFOX chemotherapy to treat advanced colon cancer.Methods 90 sufferers w ith KRAS w ild type advanced colon cancer were selected and divided into three groups:control group w ithout Erbitux(FOLFOX chemotherapy),one-week schema group(one-week Erbitux w ith FOLFOX chemotherapy),and two-week schema group(two-week Erbitux with FOLFOX chemotherapy).The clinical effects and adverse effects of the three groups were observed.Results The objective rem ission rate of the control group,the one-week schema group and the two-week schema group was respectively 16.67%,40.00%,and 33.33%,the disease control rate 66.67%,83.33%,and 80.00%,the acneiform rash incidence rate 0,86.67%,and 80.00%.The acneiform rash incidence rate between the Erbitux w ith FOLFOX chemotherapy groups and the control group had differences of statistical significance(P<0.05),but the acneiform rash incidence rate between the one-week schema group and two-week schema group had no difference of statistical significance(P>0.05),while the toxic and side effects had no difference of statistical significance(P>0.05).Conclusion Erbitux w ith FOLFOX chemotherapy has obvious short-term curative effects to treat advanced colon cancer,w ith tolerated toxic and side effects.
Erbitux;FOLFOX chemotherapy;Advanced colon cancer
2015-04-21)
1005-619X(2016)01-0008-03
10.13517/j.cnki.ccm.2016.01.004
116011大连机车医院(赵微,金霞);116011大连医科大学附属第一医院(于佩瑶)
金霞

