成都市不同园林植物土壤呼吸特征及其影响因子分析
王中煜++王刚


摘要:以四川省道路4种园林绿化植物龙柏、青冈、合欢、榆树为试验材料,通过测定根区的土壤养分含量和酶活性,比较土壤的呼吸特征及其影响因子。结果表明,日变化尺度上,4种园林植物的土壤呼吸均表现为单峰型,且峰值出现的时间基本一致,14:00左右达到最大,最低值出现在早上06:00,同一时间,土壤呼吸速率基本表现为合欢>榆树>龙柏>青冈;4种园林植物土壤呼吸与土壤温度、土壤湿度之间的拟合均以线性方程为最好,土壤温度可以解释土壤呼吸强度的80.49%,土壤湿度可以解释土壤呼吸强度的98.10%;4种园林植物土壤养分含量和土壤酶活性的变化趋势一致,基本表现为合欢>龙柏>榆树>青冈;4种园林植物根区土壤的全磷含量差异不显著(P>0.05);不同园林植物土壤呼吸与土壤养分、土壤酶活性呈现出一定的相关性,土壤有机碳、全氮、蔗糖酶是土壤呼吸的主要影响因子。
关键词:园林植物;土壤呼吸;土壤养分;土壤酶活性
中图分类号: S154.36;S181文献标志码: A文章编号:1002-1302(2016)06-0296-05
收稿日期:2016-02-19
基金项目:国家自然科学基金(编号:20140356);四川省科技厅创新课题(编号:BC0147)。
作者简介:王中煜(1995—),男,四川成都人,硕士研究生,从事风景园林研究。E-mail:Zhongyu_wang95@163.com。
通信作者:王刚,博士,教授,硕士生导师,主要从事风景园林及生态环境效益研究。园林植物是城市自然景观复合生态系统的一部分,在减少阳光辐射、吸尘、增大空气湿度、净化空气、调节气候和景观、改善城市生态环境等方面有着重要的作用[1-2],研究城市特别是大型的发展型城市不同园林植物土壤的呼吸特征及其影子因子显得尤为重要。土壤作为生态系统中的重要组成部分,在生态系统物质循环和能量流动方面有着重要的作用[3],土壤作为大气CO2重要的源或者汇,土壤CO2的细微改变会显著改变大气中CO2的浓度和碳的累积速率[4-5]。土壤呼吸释放的CO2是全球碳循环中活跃的组成部分,包括土壤微生物呼吸、根系呼吸、土壤动物呼吸的生物学过程,经不完全统计,每年土壤呼吸向大气释放的碳达80~100 Pg,是化石燃料燃烧释放CO2量的10倍之多[6]。在陆地生态系统中,土壤碳库是大气碳贮量的2~3倍,通过土壤呼吸作用向大气释放的CO2约占全球CO2交换量的25%左右[4]。土壤呼吸受多种因素的共同交互影响,包括土壤温度、湿度、养分、酶活性和人类干扰等[7],国内外学者对陆地土壤呼吸进行了大量研究[4-7],但由于城市园林植物土壤呼吸速率存在巨大差异,使土壤呼吸量化及其影响因子分析十分困难。
在对成都市绿地现状分布全面调查的基础上,选取龙柏、青冈、合欢、榆树4种主要的园林植物为材料,采用美国Li-6400便携式气体分析系统、Li-6400土壤呼吸室测量园林植物土壤的呼吸速率及土壤影响因子,试验测定园林植物根区土壤的养分和酶活性,分析探讨不同园林植物土壤的呼吸特征以及土壤温度、湿度、养分、酶活性对土壤呼吸的影响,通过相关性及主成分分析探讨园林植物土壤呼吸的主要影响因子,以期深入了解城市园林植物土壤呼吸作用的变化过程及变化机理,为城市生态系统碳循环提供基础数据和理论支持。
1材料与方法
1.1研究区概况
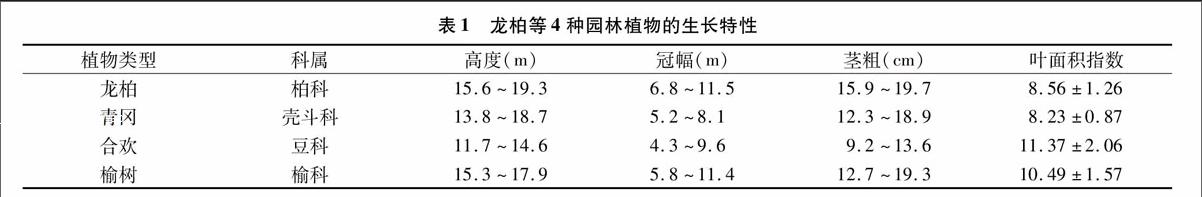
研究区为成都市,位于四川盆地西部崛江中游,总面积为12 390 km2。成都地貌类型多样,平原、丘陵、山地均有,以平原为主;土壤为冲积土,以紫色土为主,土质肥沃,富含微量元素,土质风化程度低,土壤发育浅,肥力高,适宜植物生长;具明显的亚热带湿润季风气候特征,受特有的地形条件及大气环流影响,冬无严寒,夏无酷暑,四季分明,秋短夏长,日照少,气压低,湿度大,年平均气温16.2~16.7 ℃,极端高温和低温分别为37、6.2 ℃,全年无霜期300 d左右,年平均日照时数 1 025~1 372 h,平均风速13 m/s,平均降水量945.6 mm,平均相对湿度52%。优越的自然环境使成都拥有丰富的园林植物,成都市园林局最新数据显示,成都市园林绿化常用乔木树种共有77种,计87 630株,常用的种类有女贞、含笑、香樟、法国梧桐、银杏、四季杨、水杉、柳树、龙柏、红叶李、青冈、雪松、桉树、广玉兰、桂花、榆树、罗汉松、合欢等,成都市于2006年荣获“国家园林城市”称号,2007年分别荣获“中国最佳旅游城市”“国家森林城市”称号。成都市城区绿地率为35.06%,绿化覆盖率为38.03%,人均公园绿地面积为 10.64 m2。龙柏等4种主要园林植物在成都的生长特性见表1。
1.2土壤呼吸的测定
2015年8—9月,在成都市3条主要街道选取龙柏、青冈、合欢、榆树共4种园林植物各2株,分别在根区布设监测点并标记。第1次测定土壤呼吸前,提前1 d将仪器测定基座嵌入土壤中,每个基座存留的地表植被自土壤表层彻底剪除,聚氯乙烯圆柱体经过24 h平衡,土壤呼吸速率会恢复到基座放置前的水平,从而避免因安置气室对土壤扰动而造成的短期内呼吸速率波动。采用动态密闭气室红外CO2分析仪(IRGA)法,利用美国产Li-6400便携式气体分析系统和Li-6400土壤呼吸室测定土壤呼吸日变化,06:00—18:00点之间每隔1 h测定1次,每个监测点1次,取其平均值。在观测土壤呼吸的同时,使用日本产SK-250 WP手持长杆电子温度探针测定0~10 cm深处的土壤温度,使用美国产TDR 300型时域反射仪测定每个监测点附近0~10 cm范围内土壤湿度,以分析土壤呼吸速率和水热因子的关系。
1.3土壤指标的测定
取监测园林植物根区0~10 cm混合土样2份带回实验室,1份15~20 d自然风干,去除碎片和部分根,过0.5 mm筛,用于测定土壤养分含量;1份冰箱4 ℃保存,用于测定土壤酶活性。土壤养分参照鲍士旦的方法[8]测定,土壤有机碳、全氮、全磷、全钾分别采用重铬酸钾氧化外加热法、凯氏定氮法、NaOH熔融-钼锑抗比色法、火焰分光光度法测定,单位均为g/kg。根区土壤酶活采用分光光度计比色法测定,纤维素酶活性用1 g土样30 min内分解产生1 mg葡萄糖所需的酶量表示,转化酶活性用1 g土样24 h内分解产生1 mg葡萄糖所需的酶量表示,脲酶活性用1 g土样24 h内分解产生1 mg氨基氮所需的酶量表示[9]。
1.4统计分析
采用Excel 2007软件对数据进行统计和整理,采用SPSS 21.0对数据进行方差分析和统计学检验,单因素方差分析比较其差异显著性。
2结果与分析
2.1园林植物土壤呼吸的日变化
由图1可知,4种园林植物土壤呼吸具有明显的日变化规律,均呈单峰型,且峰值出现的时间基本一致,土壤呼吸速率在14:00左右达到最大,最低值出现在06:00;06:00—11:00,4种园林植物土壤呼吸升高缓慢,11:00后急剧上升,达到最大值后急剧降低,17:00以后,基本达到平稳的趋势;龙柏、青冈、合欢、榆树土壤呼吸日变化范围分别为0.42~152、0.35~1.26、0.68~1.78、0.53~1.63 μmol/(m2·s),同一时间土壤的呼吸速率基本表现为合欢>榆树>龙柏>青冈。
2.2土壤温度、湿度对土壤呼吸的影响
为进一步探讨园林植物土壤呼吸与其影响因子土壤温度、湿度的关系,国内外学者一般采用线性模型、二次方程、指数模型等多种方法进行拟合。由图2可知,4种园林植物土壤呼吸与土壤温度的线性关系为y=0.362 7x-5.432 9(r=0.897 2,P<0.001),达到极显著水平,线性模型拟合效果较好,从线性模型看,土壤温度可以解释土壤呼吸强度的 89.72%;4种园林植物土壤呼吸与土壤湿度之间的线性关系为y=-0.062 12x+3.396 7(r=-0.990 4,P<0.001),线性模型的决定系数相对较大,线性拟合效果较好,从线性模型看,土壤湿度可以解释土壤呼吸强度的99.04%。
2.3园林植物根区的土壤养分
由图3可知,4种园林植物根区土壤有机碳含量变化范围为9.2~17.3 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,其中,合欢根区土壤有机碳含量显著高于其他植物(P<0.05),青冈根区土壤有机碳含量最低,显著低于其他植物(P<0.05),龙柏和榆树根区土壤有机碳含量差异不显著(P>0.05);4种园林植物根区土壤全氮含量变化范围为123~3.51 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,其中,合欢根区土壤全氮含量显著高于其他植物(P<005),青冈根区土壤全氮含量最低,显著低于其他植物(P<0.05),而龙柏和榆树根区土壤全氮含量差异不显著(P>005);4种园林植物根区土壤全磷含量变化范围为0.98~123 g/kg,从高到低依次为青冈>合欢>榆树>龙柏,但相互间差异不显著(P>005);4种园林植物根区土壤全钾含量
变化范围为163~27.1 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,且相互间差异显著(P<0.05)。
2.4园林植物根区土壤的酶活性
由图4可知,4种园林植物根区土壤纤维素酶活性变化范围为1.23~2.38 mg/(g·min),从高到低依次为合欢>榆树>龙柏>青冈,其中,合欢、榆树根区的土壤纤维素酶活性差异不显著(P>0.05),二者显著高于龙柏和青冈;4种园林植物根区土壤脲酶活性变化范围为3.14~6.85 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,其中,合欢与榆树根区的土壤脲酶活性差异显著(P<0.05),二者显著高于龙柏和青冈,龙柏和青冈根区的土壤脲酶活性差异不显著(P>0.05);4种园林植物根区土壤转化酶活性变化范围为1.23~4.98 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,合欢和榆树、榆树和龙柏根区土壤的转化酶活性差异不显著(P>0.05),青冈根区土壤转化酶活性显著低于其他植物(P<0.05);4种园林植物根区土壤蔗糖酶活性变化范围为1.23~2.78 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,合欢和榆树、龙柏和青冈根区土壤蔗糖酶活性差异不显著(P>0.05),合欢和榆树根区土壤的蔗糖酶活性显著高于龙柏和青冈。
2.5园林植物土壤呼吸的主要影响因素
土壤呼吸主要是植物根及土壤微生物的呼吸,植物生长、微生物氧化分解等活动都受周围环境如土壤温度、水分、空气湿度等的影响,这也是影响土壤呼吸强度的重要因素。统计表明,4种园林植物土壤呼吸强度与各环境因子的Pearson相关关系均显著,但有时某一共同变量的干扰会导致2个变量间呈假相关,为排除其他因素的干扰,对各因子分别作偏相关分析,通过控制其他几个变量以分析土壤呼吸与另一个变量
的净相关关系。由表2可知,龙柏土壤呼吸与有机碳、全氮、纤维素酶、转化酶活性呈极显著的相关关系(P<0.01),与全钾、脲酶、蔗糖酶活性呈显著的相关关系(P<0.05);青冈土壤呼吸与有机碳、全氮、纤维素酶、脲酶、转化酶活性呈极显著的相关关系(P<0.01),与全钾呈显著的相关关系(P<0.05);合欢土壤呼吸与有机碳、全氮、纤维素酶、脲酶活性呈极显著的相关关系(P<0.01),与全钾、蔗糖酶活性呈显著的相关关系(P<0.05);榆树土壤呼吸与有机碳、全氮、纤维素酶、脲酶活性呈极显著的相关关系(P<0.01),与全钾呈显著的相关关系(P<0.05)。
2.6园林植物土壤各影响因子主成分分析
主成分分析是处理数据降维的一种方法,能够将多个变量通过线性变换以选出较少个数的重要变量。以4种园林植物土壤养分和酶活性作为原变量,通过计算变量方差和协方差矩阵的特征量,将多个变量通过降维对土壤养分和酶活性信息进行集中、提取,识别出起主导作用的土壤环境因子。表3是各土壤环境因子的总方差分解表,由此可见,第一、第二主成分特征值占总方差的百分比为89.401%,即前2个主成分对8个指标所涵盖的大部分信息进行了概括,其中第一主成分携带的信息最多,达到64%以上,而主成分3、主成分4对总方差的贡献很小,特征值分别为8.156%、2.443%,因此,选取前2个因子作为主成分。表4是土壤环境因子对应于2个主成分的荷载值,反映主成分与变量的相关系数,载荷值大的即可认为是重要因子。由表4可见,第一主成分负荷值相对较高的指标为有机碳、全氮、蔗糖酶,荷载值分别为 0.865、0.732、0.623,第二主成分分负荷值相对较高的指标为全氮、全钾、纤维素酶,荷载值分别为0.856、0.756、0.665,这说明有机碳、全氮、蔗糖酶是园林植物土壤呼吸的主要影响因子。
3结论与讨论
本研究中,4种园林植物所在的大气温度存在显著的日变化规律,早、晚温差可达10 ℃以上,白天较高的温度有利于植物进行光合作用,下午较低的温度使植物呼吸作用渐弱,有利于植物进行有机物质的积累,1 d之中,14:00左右的温度达到最高,土壤呼吸速率对地表温度的响应较快,土壤呼吸速率在这一时段达到峰值。成都市4种园林植物土壤呼吸日变化呈明显的单峰曲线,日变化峰值出现在14:00,最小值出现在早上06:00左右,这与Schlesinger等的研究结论[4-5,10]较为吻合。土壤呼吸速率主要由温度、湿度、环境因子等共同作用,并随生态系统类型和气候类型不同而不同[3-4,10]。因此,土壤温度、湿度和养分含量相互作用影响着园林植物土壤呼吸。另外,城市环境污染也影响着园林植物土壤的呼吸。
大量研究表明,园林植物土壤呼吸主要受温度和水分的影响,具有明显的日动态,土壤湿度在一定程度上降低了土壤呼吸速率对土壤温度的响应,土壤湿度的限制作用可能导致土壤呼吸速率的敏感性降低[10]。通常情况下,土壤湿度会促进土壤呼吸,当土壤湿度较低时,土壤呼吸强度随土壤水分的增加而增加,而土壤水分的增加会导致土壤的通透性变差[3,11-12];O2是植物根系和土壤微生物进行有氧呼吸的必要条件,过高的土壤湿度会限制土壤中O2的扩散,此时土壤处于嫌气状态,植物根系和好氧微生物的活动受到抑制,土壤有机碳的分解速率降低,土壤中产生的CO2减少,因此会出现当土壤湿度超过阈值,土壤呼吸有所下降的现象[3,11-12]。本研究中,园林植物土壤呼吸作用受土壤湿度的影响较为明显,土壤呼吸速率与0~10 cm土壤湿度呈负线性相关关系,并没有出现影响土壤呼吸的湿度阈值。
通过相关性分析可知,不同园林植物土壤呼吸与土壤养分和土壤酶活性有一定的相关性,而主成分分析结果显示,不同园林植物土壤有机碳、全氮、蔗糖酶是土壤呼吸的主要影响因子。土壤养分主要来自于地表枯枝落叶层的分解补充与积累,主要取决于有机物质和腐殖质的淋溶、迁移和淀积过程[13]。本研究中,4种园林植物土壤养分含量不尽一致,主要受土壤母质及地上植物有效吸收的影响,土壤养分基本表现为合欢>龙柏>榆树>青冈,因此,在园林绿化中,可以根据植物对养分的需求量来选择合适的园林植物。4种园林植物土壤全磷含量差异并不显著,主要是由于磷素作为一种沉积性元素,其分解作用缓慢[14-15]。土壤酶活性是土壤养分循环和土壤微生物代谢活性的重要指标,通过分泌酶的方式参与土壤生态系统营养循环等,能够反映土壤养分累积、分解转化规律和各种生化过程的强度及方向[16-17]。本研究中,不同园林植物对环境的敏感度不一样,从而导致根区土壤酶活性出现差异,土壤纤维素酶、脲酶、转化酶、蔗糖酶活性与土壤养分的变化趋势相一致,基本表现为合欢>龙柏>榆树>青冈,造成这种分布的主要原因可能是不同园林植物根系释放的化学物质不一致及植物根尖细胞敏感性和生长过程中离子积累的不一致。在代谢过程中,园林植物各种酶系的活力对环境的变化都很敏感,微弱的环境也会对根细胞中酶系的活力产生影响,因而园林植物对环境的胁迫适应性反应仍是复杂的生理生态学问题。此外,植物根系分泌物的化感作用以及外界环境的变化也改变土壤酶活性及土壤养分的变化。
参考文献:
[1]Guo Y L. Gene family evolution in green plants with emphasis on the origination and evolution of Arabidopsis thaliana genes[J]. Plant Journal,2013,73(6):941-951.
[2]Kusaba M,Tanaka Ayumi,Tanaka R. Stay-green plants:what do they tell us about the molecular mechanism of leaf senescence[J]. Photosynthesis Research,2013,117(1/2/3):221-234.
[3]Davidson E A,Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature,2006,440(781):165-173.
[4]Schlesinger W H,Andrews J A. Soil respiration and the global carbon cycle[J]. Biogeochemistry,2000,48(1):7-20.
[5]Hogberg P,Nordgren A,Buchmann N,et al. Large-scale forest girdling shows that current photosynthesis drives soil respiration[J]. Nature,2001,411(6839):789-792.
[6]Monson R K,Lipson D L,Burns S P,et al. Winter forest soil respiration controlled by climate and microbial community composition[J]. Nature,2006,439(777):711-714.
[7]Hanson P J,Edwards N T,Garten C T,et al. Separating root and soil microbial contributions to soil respiration:a review of methods and observations[J]. Biogeochemistry,2000,48(1):115-146.
[8]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[9]周礼恺,张志明. 土壤酶活性的测定方法[J]. 土壤通报,1980,5(1):37-38.
[10]Raich J W,Potter C S,Bhagawati D. Interannual variability in global soil respiration,1980—1994[J]. Global Change Biology,2002(8):800-812.
[11]Tang J W,Baldocchi D D,Xu L. Tree photosynthesis modulates soil respiration on a diurnal time scale[J]. Global Change Biology,2005,11(8):1298-1304.
[12]Davidson E A,Verchot L V,Cattnio J H,et al. Effects of soil water content on soil respiration in forests and cattle pastures of eastern amazonia[J]. Biogeochemistry,2000,48(1):53-69.
[13]Schlesinger W H,Cross A F. On the spatial pattern of soil nutrients in desert eco-systems[J]. Ecology,1996,77(2):364-374.
[14]Jobbagy E G,Jackson R B. The distribution of soil nutrients with depth:global patterns and the imprint of plants[J]. Biogeochemistry,2001,53(1):51-77.
[15]Newman S,Reddy K R,Debusk W F,et al. Spatial distribution of soil nutrients in a northern everglades marsh:water conservation area 1[J]. Soil Science Society of America Journal,1997,61(2):543-552.
[16]Sinsabaugh R L,Lauber C L,Weintraub M N,et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters,2008,11(11):1252-1264.
[17]Sardans J,Peuelas J. Drought decreases soil enzyme activity in a mediterranean Quercus ilex L. forest[J]. Soil Biology and Biochemistry,2005,37(3):455-461.
王中煜 王刚



摘要:以四川省道路4种园林绿化植物龙柏、青冈、合欢、榆树为试验材料,通过测定根区的土壤养分含量和酶活性,比较土壤的呼吸特征及其影响因子。结果表明,日变化尺度上,4种园林植物的土壤呼吸均表现为单峰型,且峰值出现的时间基本一致,14:00左右达到最大,最低值出现在早上06:00,同一时间,土壤呼吸速率基本表现为合欢>榆树>龙柏>青冈;4种园林植物土壤呼吸与土壤温度、土壤湿度之间的拟合均以线性方程为最好,土壤温度可以解释土壤呼吸强度的80.49%,土壤湿度可以解释土壤呼吸强度的98.10%;4种园林植物土壤养分含量和土壤酶活性的变化趋势一致,基本表现为合欢>龙柏>榆树>青冈;4种园林植物根区土壤的全磷含量差异不显著(P>0.05);不同园林植物土壤呼吸与土壤养分、土壤酶活性呈现出一定的相关性,土壤有机碳、全氮、蔗糖酶是土壤呼吸的主要影响因子。
关键词:园林植物;土壤呼吸;土壤养分;土壤酶活性
中图分类号: S154.36;S181文献标志码: A文章编号:1002-1302(2016)06-0296-05
收稿日期:2016-02-19
基金项目:国家自然科学基金(编号:20140356);四川省科技厅创新课题(编号:BC0147)。
作者简介:王中煜(1995—),男,四川成都人,硕士研究生,从事风景园林研究。E-mail:Zhongyu_wang95@163.com。
通信作者:王刚,博士,教授,硕士生导师,主要从事风景园林及生态环境效益研究。园林植物是城市自然景观复合生态系统的一部分,在减少阳光辐射、吸尘、增大空气湿度、净化空气、调节气候和景观、改善城市生态环境等方面有着重要的作用[1-2],研究城市特别是大型的发展型城市不同园林植物土壤的呼吸特征及其影子因子显得尤为重要。土壤作为生态系统中的重要组成部分,在生态系统物质循环和能量流动方面有着重要的作用[3],土壤作为大气CO2重要的源或者汇,土壤CO2的细微改变会显著改变大气中CO2的浓度和碳的累积速率[4-5]。土壤呼吸释放的CO2是全球碳循环中活跃的组成部分,包括土壤微生物呼吸、根系呼吸、土壤动物呼吸的生物学过程,经不完全统计,每年土壤呼吸向大气释放的碳达80~100 Pg,是化石燃料燃烧释放CO2量的10倍之多[6]。在陆地生态系统中,土壤碳库是大气碳贮量的2~3倍,通过土壤呼吸作用向大气释放的CO2约占全球CO2交换量的25%左右[4]。土壤呼吸受多种因素的共同交互影响,包括土壤温度、湿度、养分、酶活性和人类干扰等[7],国内外学者对陆地土壤呼吸进行了大量研究[4-7],但由于城市园林植物土壤呼吸速率存在巨大差异,使土壤呼吸量化及其影响因子分析十分困难。
在对成都市绿地现状分布全面调查的基础上,选取龙柏、青冈、合欢、榆树4种主要的园林植物为材料,采用美国Li-6400便携式气体分析系统、Li-6400土壤呼吸室测量园林植物土壤的呼吸速率及土壤影响因子,试验测定园林植物根区土壤的养分和酶活性,分析探讨不同园林植物土壤的呼吸特征以及土壤温度、湿度、养分、酶活性对土壤呼吸的影响,通过相关性及主成分分析探讨园林植物土壤呼吸的主要影响因子,以期深入了解城市园林植物土壤呼吸作用的变化过程及变化机理,为城市生态系统碳循环提供基础数据和理论支持。
1材料与方法
1.1研究区概况
研究区为成都市,位于四川盆地西部崛江中游,总面积为12 390 km2。成都地貌类型多样,平原、丘陵、山地均有,以平原为主;土壤为冲积土,以紫色土为主,土质肥沃,富含微量元素,土质风化程度低,土壤发育浅,肥力高,适宜植物生长;具明显的亚热带湿润季风气候特征,受特有的地形条件及大气环流影响,冬无严寒,夏无酷暑,四季分明,秋短夏长,日照少,气压低,湿度大,年平均气温16.2~16.7 ℃,极端高温和低温分别为37、6.2 ℃,全年无霜期300 d左右,年平均日照时数 1 025~1 372 h,平均风速13 m/s,平均降水量945.6 mm,平均相对湿度52%。优越的自然环境使成都拥有丰富的园林植物,成都市园林局最新数据显示,成都市园林绿化常用乔木树种共有77种,计87 630株,常用的种类有女贞、含笑、香樟、法国梧桐、银杏、四季杨、水杉、柳树、龙柏、红叶李、青冈、雪松、桉树、广玉兰、桂花、榆树、罗汉松、合欢等,成都市于2006年荣获“国家园林城市”称号,2007年分别荣获“中国最佳旅游城市”“国家森林城市”称号。成都市城区绿地率为35.06%,绿化覆盖率为38.03%,人均公园绿地面积为 10.64 m2。龙柏等4种主要园林植物在成都的生长特性见表1。
1.2土壤呼吸的测定
2015年8—9月,在成都市3条主要街道选取龙柏、青冈、合欢、榆树共4种园林植物各2株,分别在根区布设监测点并标记。第1次测定土壤呼吸前,提前1 d将仪器测定基座嵌入土壤中,每个基座存留的地表植被自土壤表层彻底剪除,聚氯乙烯圆柱体经过24 h平衡,土壤呼吸速率会恢复到基座放置前的水平,从而避免因安置气室对土壤扰动而造成的短期内呼吸速率波动。采用动态密闭气室红外CO2分析仪(IRGA)法,利用美国产Li-6400便携式气体分析系统和Li-6400土壤呼吸室测定土壤呼吸日变化,06:00—18:00点之间每隔1 h测定1次,每个监测点1次,取其平均值。在观测土壤呼吸的同时,使用日本产SK-250 WP手持长杆电子温度探针测定0~10 cm深处的土壤温度,使用美国产TDR 300型时域反射仪测定每个监测点附近0~10 cm范围内土壤湿度,以分析土壤呼吸速率和水热因子的关系。
1.3土壤指标的测定
取监测园林植物根区0~10 cm混合土样2份带回实验室,1份15~20 d自然风干,去除碎片和部分根,过0.5 mm筛,用于测定土壤养分含量;1份冰箱4 ℃保存,用于测定土壤酶活性。土壤养分参照鲍士旦的方法[8]测定,土壤有机碳、全氮、全磷、全钾分别采用重铬酸钾氧化外加热法、凯氏定氮法、NaOH熔融-钼锑抗比色法、火焰分光光度法测定,单位均为g/kg。根区土壤酶活采用分光光度计比色法测定,纤维素酶活性用1 g土样30 min内分解产生1 mg葡萄糖所需的酶量表示,转化酶活性用1 g土样24 h内分解产生1 mg葡萄糖所需的酶量表示,脲酶活性用1 g土样24 h内分解产生1 mg氨基氮所需的酶量表示[9]。
1.4统计分析
采用Excel 2007软件对数据进行统计和整理,采用SPSS 21.0对数据进行方差分析和统计学检验,单因素方差分析比较其差异显著性。
2结果与分析
2.1园林植物土壤呼吸的日变化
由图1可知,4种园林植物土壤呼吸具有明显的日变化规律,均呈单峰型,且峰值出现的时间基本一致,土壤呼吸速率在14:00左右达到最大,最低值出现在06:00;06:00—11:00,4种园林植物土壤呼吸升高缓慢,11:00后急剧上升,达到最大值后急剧降低,17:00以后,基本达到平稳的趋势;龙柏、青冈、合欢、榆树土壤呼吸日变化范围分别为0.42~152、0.35~1.26、0.68~1.78、0.53~1.63 μmol/(m2·s),同一时间土壤的呼吸速率基本表现为合欢>榆树>龙柏>青冈。
2.2土壤温度、湿度对土壤呼吸的影响
为进一步探讨园林植物土壤呼吸与其影响因子土壤温度、湿度的关系,国内外学者一般采用线性模型、二次方程、指数模型等多种方法进行拟合。由图2可知,4种园林植物土壤呼吸与土壤温度的线性关系为y=0.362 7x-5.432 9(r=0.897 2,P<0.001),达到极显著水平,线性模型拟合效果较好,从线性模型看,土壤温度可以解释土壤呼吸强度的 89.72%;4种园林植物土壤呼吸与土壤湿度之间的线性关系为y=-0.062 12x+3.396 7(r=-0.990 4,P<0.001),线性模型的决定系数相对较大,线性拟合效果较好,从线性模型看,土壤湿度可以解释土壤呼吸强度的99.04%。
2.3园林植物根区的土壤养分
由图3可知,4种园林植物根区土壤有机碳含量变化范围为9.2~17.3 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,其中,合欢根区土壤有机碳含量显著高于其他植物(P<0.05),青冈根区土壤有机碳含量最低,显著低于其他植物(P<0.05),龙柏和榆树根区土壤有机碳含量差异不显著(P>0.05);4种园林植物根区土壤全氮含量变化范围为123~3.51 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,其中,合欢根区土壤全氮含量显著高于其他植物(P<005),青冈根区土壤全氮含量最低,显著低于其他植物(P<0.05),而龙柏和榆树根区土壤全氮含量差异不显著(P>005);4种园林植物根区土壤全磷含量变化范围为0.98~123 g/kg,从高到低依次为青冈>合欢>榆树>龙柏,但相互间差异不显著(P>005);4种园林植物根区土壤全钾含量
变化范围为163~27.1 g/kg,从高到低依次为合欢>龙柏>榆树>青冈,且相互间差异显著(P<0.05)。
2.4园林植物根区土壤的酶活性
由图4可知,4种园林植物根区土壤纤维素酶活性变化范围为1.23~2.38 mg/(g·min),从高到低依次为合欢>榆树>龙柏>青冈,其中,合欢、榆树根区的土壤纤维素酶活性差异不显著(P>0.05),二者显著高于龙柏和青冈;4种园林植物根区土壤脲酶活性变化范围为3.14~6.85 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,其中,合欢与榆树根区的土壤脲酶活性差异显著(P<0.05),二者显著高于龙柏和青冈,龙柏和青冈根区的土壤脲酶活性差异不显著(P>0.05);4种园林植物根区土壤转化酶活性变化范围为1.23~4.98 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,合欢和榆树、榆树和龙柏根区土壤的转化酶活性差异不显著(P>0.05),青冈根区土壤转化酶活性显著低于其他植物(P<0.05);4种园林植物根区土壤蔗糖酶活性变化范围为1.23~2.78 mg/(g·d),从高到低依次为合欢>榆树>龙柏>青冈,合欢和榆树、龙柏和青冈根区土壤蔗糖酶活性差异不显著(P>0.05),合欢和榆树根区土壤的蔗糖酶活性显著高于龙柏和青冈。
2.5园林植物土壤呼吸的主要影响因素
土壤呼吸主要是植物根及土壤微生物的呼吸,植物生长、微生物氧化分解等活动都受周围环境如土壤温度、水分、空气湿度等的影响,这也是影响土壤呼吸强度的重要因素。统计表明,4种园林植物土壤呼吸强度与各环境因子的Pearson相关关系均显著,但有时某一共同变量的干扰会导致2个变量间呈假相关,为排除其他因素的干扰,对各因子分别作偏相关分析,通过控制其他几个变量以分析土壤呼吸与另一个变量
的净相关关系。由表2可知,龙柏土壤呼吸与有机碳、全氮、纤维素酶、转化酶活性呈极显著的相关关系(P<0.01),与全钾、脲酶、蔗糖酶活性呈显著的相关关系(P<0.05);青冈土壤呼吸与有机碳、全氮、纤维素酶、脲酶、转化酶活性呈极显著的相关关系(P<0.01),与全钾呈显著的相关关系(P<0.05);合欢土壤呼吸与有机碳、全氮、纤维素酶、脲酶活性呈极显著的相关关系(P<0.01),与全钾、蔗糖酶活性呈显著的相关关系(P<0.05);榆树土壤呼吸与有机碳、全氮、纤维素酶、脲酶活性呈极显著的相关关系(P<0.01),与全钾呈显著的相关关系(P<0.05)。
2.6园林植物土壤各影响因子主成分分析
主成分分析是处理数据降维的一种方法,能够将多个变量通过线性变换以选出较少个数的重要变量。以4种园林植物土壤养分和酶活性作为原变量,通过计算变量方差和协方差矩阵的特征量,将多个变量通过降维对土壤养分和酶活性信息进行集中、提取,识别出起主导作用的土壤环境因子。表3是各土壤环境因子的总方差分解表,由此可见,第一、第二主成分特征值占总方差的百分比为89.401%,即前2个主成分对8个指标所涵盖的大部分信息进行了概括,其中第一主成分携带的信息最多,达到64%以上,而主成分3、主成分4对总方差的贡献很小,特征值分别为8.156%、2.443%,因此,选取前2个因子作为主成分。表4是土壤环境因子对应于2个主成分的荷载值,反映主成分与变量的相关系数,载荷值大的即可认为是重要因子。由表4可见,第一主成分负荷值相对较高的指标为有机碳、全氮、蔗糖酶,荷载值分别为 0.865、0.732、0.623,第二主成分分负荷值相对较高的指标为全氮、全钾、纤维素酶,荷载值分别为0.856、0.756、0.665,这说明有机碳、全氮、蔗糖酶是园林植物土壤呼吸的主要影响因子。
3结论与讨论
本研究中,4种园林植物所在的大气温度存在显著的日变化规律,早、晚温差可达10 ℃以上,白天较高的温度有利于植物进行光合作用,下午较低的温度使植物呼吸作用渐弱,有利于植物进行有机物质的积累,1 d之中,14:00左右的温度达到最高,土壤呼吸速率对地表温度的响应较快,土壤呼吸速率在这一时段达到峰值。成都市4种园林植物土壤呼吸日变化呈明显的单峰曲线,日变化峰值出现在14:00,最小值出现在早上06:00左右,这与Schlesinger等的研究结论[4-5,10]较为吻合。土壤呼吸速率主要由温度、湿度、环境因子等共同作用,并随生态系统类型和气候类型不同而不同[3-4,10]。因此,土壤温度、湿度和养分含量相互作用影响着园林植物土壤呼吸。另外,城市环境污染也影响着园林植物土壤的呼吸。
大量研究表明,园林植物土壤呼吸主要受温度和水分的影响,具有明显的日动态,土壤湿度在一定程度上降低了土壤呼吸速率对土壤温度的响应,土壤湿度的限制作用可能导致土壤呼吸速率的敏感性降低[10]。通常情况下,土壤湿度会促进土壤呼吸,当土壤湿度较低时,土壤呼吸强度随土壤水分的增加而增加,而土壤水分的增加会导致土壤的通透性变差[3,11-12];O2是植物根系和土壤微生物进行有氧呼吸的必要条件,过高的土壤湿度会限制土壤中O2的扩散,此时土壤处于嫌气状态,植物根系和好氧微生物的活动受到抑制,土壤有机碳的分解速率降低,土壤中产生的CO2减少,因此会出现当土壤湿度超过阈值,土壤呼吸有所下降的现象[3,11-12]。本研究中,园林植物土壤呼吸作用受土壤湿度的影响较为明显,土壤呼吸速率与0~10 cm土壤湿度呈负线性相关关系,并没有出现影响土壤呼吸的湿度阈值。
通过相关性分析可知,不同园林植物土壤呼吸与土壤养分和土壤酶活性有一定的相关性,而主成分分析结果显示,不同园林植物土壤有机碳、全氮、蔗糖酶是土壤呼吸的主要影响因子。土壤养分主要来自于地表枯枝落叶层的分解补充与积累,主要取决于有机物质和腐殖质的淋溶、迁移和淀积过程[13]。本研究中,4种园林植物土壤养分含量不尽一致,主要受土壤母质及地上植物有效吸收的影响,土壤养分基本表现为合欢>龙柏>榆树>青冈,因此,在园林绿化中,可以根据植物对养分的需求量来选择合适的园林植物。4种园林植物土壤全磷含量差异并不显著,主要是由于磷素作为一种沉积性元素,其分解作用缓慢[14-15]。土壤酶活性是土壤养分循环和土壤微生物代谢活性的重要指标,通过分泌酶的方式参与土壤生态系统营养循环等,能够反映土壤养分累积、分解转化规律和各种生化过程的强度及方向[16-17]。本研究中,不同园林植物对环境的敏感度不一样,从而导致根区土壤酶活性出现差异,土壤纤维素酶、脲酶、转化酶、蔗糖酶活性与土壤养分的变化趋势相一致,基本表现为合欢>龙柏>榆树>青冈,造成这种分布的主要原因可能是不同园林植物根系释放的化学物质不一致及植物根尖细胞敏感性和生长过程中离子积累的不一致。在代谢过程中,园林植物各种酶系的活力对环境的变化都很敏感,微弱的环境也会对根细胞中酶系的活力产生影响,因而园林植物对环境的胁迫适应性反应仍是复杂的生理生态学问题。此外,植物根系分泌物的化感作用以及外界环境的变化也改变土壤酶活性及土壤养分的变化。
参考文献:
[1]Guo Y L. Gene family evolution in green plants with emphasis on the origination and evolution of Arabidopsis thaliana genes[J]. Plant Journal,2013,73(6):941-951.
[2]Kusaba M,Tanaka Ayumi,Tanaka R. Stay-green plants:what do they tell us about the molecular mechanism of leaf senescence[J]. Photosynthesis Research,2013,117(1/2/3):221-234.
[3]Davidson E A,Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature,2006,440(781):165-173.
[4]Schlesinger W H,Andrews J A. Soil respiration and the global carbon cycle[J]. Biogeochemistry,2000,48(1):7-20.
[5]Hogberg P,Nordgren A,Buchmann N,et al. Large-scale forest girdling shows that current photosynthesis drives soil respiration[J]. Nature,2001,411(6839):789-792.
[6]Monson R K,Lipson D L,Burns S P,et al. Winter forest soil respiration controlled by climate and microbial community composition[J]. Nature,2006,439(777):711-714.
[7]Hanson P J,Edwards N T,Garten C T,et al. Separating root and soil microbial contributions to soil respiration:a review of methods and observations[J]. Biogeochemistry,2000,48(1):115-146.
[8]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[9]周礼恺,张志明. 土壤酶活性的测定方法[J]. 土壤通报,1980,5(1):37-38.
[10]Raich J W,Potter C S,Bhagawati D. Interannual variability in global soil respiration,1980—1994[J]. Global Change Biology,2002(8):800-812.
[11]Tang J W,Baldocchi D D,Xu L. Tree photosynthesis modulates soil respiration on a diurnal time scale[J]. Global Change Biology,2005,11(8):1298-1304.
[12]Davidson E A,Verchot L V,Cattnio J H,et al. Effects of soil water content on soil respiration in forests and cattle pastures of eastern amazonia[J]. Biogeochemistry,2000,48(1):53-69.
[13]Schlesinger W H,Cross A F. On the spatial pattern of soil nutrients in desert eco-systems[J]. Ecology,1996,77(2):364-374.
[14]Jobbagy E G,Jackson R B. The distribution of soil nutrients with depth:global patterns and the imprint of plants[J]. Biogeochemistry,2001,53(1):51-77.
[15]Newman S,Reddy K R,Debusk W F,et al. Spatial distribution of soil nutrients in a northern everglades marsh:water conservation area 1[J]. Soil Science Society of America Journal,1997,61(2):543-552.
[16]Sinsabaugh R L,Lauber C L,Weintraub M N,et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters,2008,11(11):1252-1264.
[17]Sardans J,Peuelas J. Drought decreases soil enzyme activity in a mediterranean Quercus ilex L. forest[J]. Soil Biology and Biochemistry,2005,37(3):455-461.

