猪流行性腹泻病毒实时荧光定量RT-PCR检测方法的建立
劳秀杰,王静静,郑东霞,邵春艳,何海建,王晓洁,王志亮,王晓杜,宋厚辉(.浙江农林大学动物科技学院,浙江杭州 00;.中国动物卫生与流行病学中心,山东青岛 660;.金华职业技术学院农业与生物工程学院,浙江金华 007)
猪流行性腹泻病毒实时荧光定量RT-PCR检测方法的建立
劳秀杰1,王静静2,郑东霞2,邵春艳1,何海建3,王晓洁1,王志亮2,王晓杜1,宋厚辉1
(1.浙江农林大学动物科技学院,浙江杭州 311300;2.中国动物卫生与流行病学中心,山东青岛 266032;3.金华职业技术学院农业与生物工程学院,浙江金华 321007)
摘 要:根据GenBank报道的N基因高度保守核苷酸序列,设计并合成一对引物。上下游引物与GenBank中登录的153株猪流行性腹泻病毒(PEDV)N基因全长序列匹配度分别是100%和97%。以本实验室分离流行毒株为模板,利用SYBR Green I荧光染料法进行RT-PCR扩增,获得扩增产物构建重组质粒作为阳性对照,建立检测猪流行性腹泻病毒核酸的方法。同一样品进行3次重复试验,变异系数<0.9%。通过对临床样品进行检测和测序验证,核酸检测结果中的阳性样品准确率为100%。本研究所建立的荧光定量PCR检测方法具有快速、灵敏、准确等优点,可用于临床PEDV的检测及分子流行病学调查。
关键词:猪流行性腹泻病毒;N基因;实时荧光定量RT-PCR;检测
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(PEDV)引起猪的一种高度接触性肠道传染病,其特征为呕吐、腹泻、脱水[1]。本病主要发生在当年12月至次年2月,夏季也可发生,可以感染各年龄阶段的猪,其中哺乳仔猪最易感,发病率可达100%,平均死亡率可达50%。PED最早报道发生于英国和比利时,随后在中国、加拿大、匈牙利、德国、日本及韩国等国家流行,给全世界养猪业造成巨大的经济损失[2]。PEDV是有囊膜的单股正链RNA病毒,编码4个蛋白,分别为纤突蛋白(Spike,S)、小膜蛋白(Envelope,E)、膜蛋白(Membrane,M)、核衣壳蛋白(Nucleocapsid,N)。由于蛋白在PEDV病毒中数目最多,且高度保守,因此可以用此基因建立PEDV分子生物学诊断方法[3-7]。自2010年以来,PED在国内流行,给养猪业造成巨大经济损失。为了能及时发现该病毒,避免不必要的经济损失,本研究根据PEDV高度保守的N基因核苷酸序列,设计合成了一对特异性荧光定量PCR引物并建立了一种可快速、灵敏、特异地检测PEDV的荧光定量PCR方法。
1 材料与方法
1.1生物材料
猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)和猪圆环病毒2型(PCV2)均由本实验室保存。
1.2主要试剂
2×SYBR.premix、ExTaq GC、Rox reference Dye II、DNA Maker DL2000、反转录试剂盒、质粒小提试剂盒购自Takara公司;DNA凝胶回收试剂盒购自生工公司;Trizol试剂盒购自Invitrogen公司;零背景快速连接试剂盒购自TIANGEN公司。
1.3引物设计
根据GenBank登录的PEDV的N基因核苷酸序列分别在(723-1286 bp)和(1001-1180 bp),用Primer 5.0软件设计了常规PCR引物和荧光定量PCR引物。由生工生物工程(上海)股份有限公司合成。引物序列见表1和表2。

表1 常规PCR引物

表2 荧光定量PCR引物
1.4荧光定量PCR检测体系的建立
1.4.1病毒RNA提取。收集感染了72 h PEDV的Vero细胞沉淀,加入Trizol试剂中,振荡混匀;然后4℃,12 000 r/min离心10 min,吸取上清液转移至空的1.5 mL离心管。加入200 μL氯仿,振荡15 s,室温静置3 min,4℃,1 2000 r/min离心10 min,吸取上清液转移至空的1.5 mL离心管。加入等体积的氯仿,剧烈振荡15 s,室温静置3 min ;4℃,1 2000 r/min离心10 min,吸取上清液转移至空的1.5 mL离心管中。加入等体积的异丙醇,轻轻颠倒混匀后,室温静置10 min,4℃,12 000 r/min离心10 min,弃上清。加入用DEPC水配制的70 %乙醇洗涤沉淀1次,4℃,12000 r/min离心5 min,弃上清,室温干燥后溶于适量的RNase free水中,用紫外分光光度计测定浓度及纯度,-80℃保存备用。
1.4.2cDNA 反转录。根据AMV反转录试剂盒说明书进行反转录,所得cDNA置-20℃保存。
1.4.3常规PCR扩增。反应体系为:25 mmol/ L MgSO42μL,10× buffer 2.5μL,2 mmol/L dNTP 2.5μL,KOD plus 酶1μL,PEDV cDNA 2μL,上下游引物各0.5μL,ddH2O 14μL。反应条件为:94℃3 min,1个循环;98℃ 10 s,60℃ 30 s,68℃ 30 s,30个循环;68℃ 5 min,1个循环。
1.4.4标准模板的制备。按照胶回收试剂盒说明书割胶回收1.4.3扩增的目的片段,并将其与零背景载体连接,随后转化到大肠埃希菌Escherichia coli 感受态细胞DH5α,摇菌提取质粒,经鉴定正确后测定OD260值,将其浓度换算成拷贝/μL,放置-20℃备用。
1.4.5 荧光定量PCR扩增。已优化的荧光定量PCR反应体系20 μL,其中2×SYBR Green I premix 10 μL,辅助染料0.4 μL,上游引物0.4 μL,下游引物0.4 μL,模板1μL,ddH2O 7.8μL。采用三步法扩增反应条件:第一步95℃ 30 s,1个循环;第二步95℃ 10 s,56℃ 30 s,72℃ 30 s,40个循环;第三步95℃ 1 min,60℃ 30 s,95℃ 30 s,1个循环。
1.4.6标准曲线和溶解曲线的建立。以10倍梯度稀释的阳性标准模板,模板浓度为1×109~1×100copy/μL,进行荧光定量PCR扩增,并设置阴性对照。利用荧光定量PCR仪随机附带的软件分析标准曲线和溶解曲线。
1.4.7灵敏度试验。以10倍梯度稀释标准模板,模板浓度为1×109~1×100copy/μL,进行荧光定量PCR扩增,计算出荧光定量PCR检测模板的最低拷贝数,设置阴性对照。
1.4.8重复性试验。对同一阳性标准质粒设三个重复管,用建立的荧光定量PCR方法检测其重复性,计算其组内变异系数。
1.4.9特异性试验。用PEDV荧光定量PCR检测猪传染性胃肠炎病毒、猪繁殖与呼吸综合征病毒、猪瘟病毒和猪圆环病毒2型基因组,确定该方法的特异性。
1.4.10临床样品检测。将采集的多个猪场病猪的肛门棉试子进行处理,提取RNA,用建立的荧光定量PCR方法检测,同时设阳性和阴性对照。
2 结果
2.1标准品的制备
用特异性引物对PEDV进行PCR扩增,所得目的片段564 bp且无非特异性条带(图1),将阳性质粒的测序结果在美国国家生物技术信息中心(NCBI)网站上进行BLAST,同源性达99%。
2.2标准曲线和溶解曲线的建立
用10倍梯度稀释的阳性标准模板进行荧光定量PCR扩增,模板浓度分别为1×109~1×100copy/μL,用荧光定量PCR仪附带的软件分析即得到标准曲线(图2)和溶解曲线(图3)。标准曲线R2=1.000,斜率为-3.200,截距为36.58, Eff=105.4%。溶解曲线峰型锐利,熔解温度一致Tm值为81.7℃,没有引物二聚体和非特异性产物等其它峰值出现。
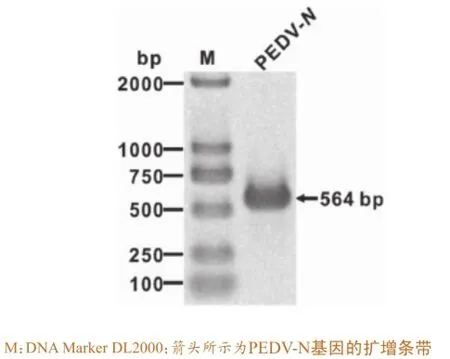
图1 PEDV N基因PCR扩增产物的琼脂糖凝胶电泳分析

图2 荧光定量PCR标准曲线
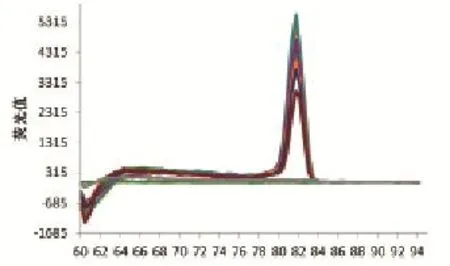
图3 荧光定量PCR扩增产物的溶解曲线
2.3灵敏度试验
将质粒标准模板稀释10个不同浓度,分别是 1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100copy/μL,进行荧光定量PCR扩增,结果显示检测有效值至1×100copy/ μL(图4),比常规PCR (1×102copy/μL)的灵敏度高100倍(图5)。
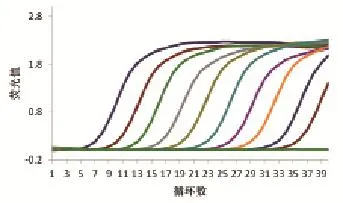
图4 荧光定量PCR灵敏度分析
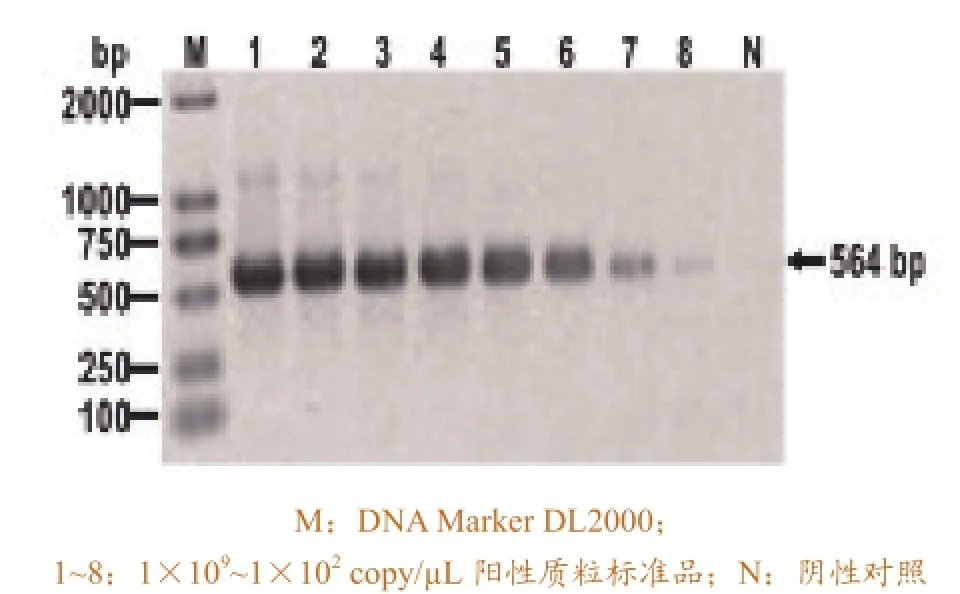
图5 PCR扩增产物的琼脂糖凝胶电泳分析
2.4特异性试验
分别以TGEV、PRRSV、CSFV和PCV2的核酸作为模板,用PEDV荧光定量PCR检测,并设阳性对照和阴性对照,结果显示只有PEDV阳性模板产生荧光信号(图6),表明设计的荧光定量PCR检测引物有良好的特异性。
2.5重复性试验
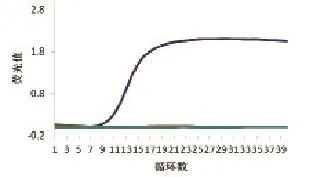
图6 荧光定量PCR的特异性分析
选取1×106,1×105,1×104copy/μL的三个标准模板进行扩增,每个标准模板做三个重复进行组内和组间重复性试验,结果显示组内重复性试验的3个标准品的变异系数低于0.9%(表3);组间重复性试验的3个标准品的变异系数低于0.9%(表4),表明PEDV荧光定量PCR检测方法有较好的重复性。
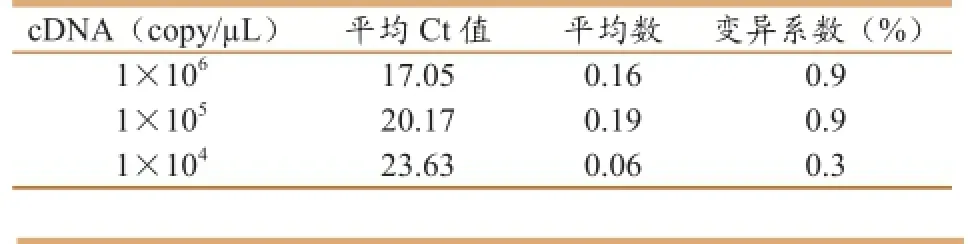
表3 荧光定量PCR组内重复性分析

表4 荧光定量PCR组间重复性分析
2.6临床样品检测
采取3个不同猪场疑似PEDV感染的病猪肛门拭子共计18份,收集细胞毒提取核酸进行检测,结果显示14份样品呈现阳性,扩增曲线、溶解曲线见图7、图8。扩增所获得的序列进行测序验证,结果表明所获得序列全部为PEDV病毒核酸序列。阳性样品准确率为100%,表明该样品存在PEDV核酸。
3 讨论
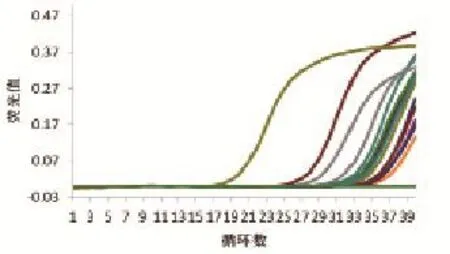
图7 荧光定量PCR检测临床样品扩增曲线
由于PEDV与TGEV在流行病学、临床症状和病理变化等方面很难区分,所以建立快速、准确的实验室检测方法尤为重要[8-9]。目前检测PEDV的方法有,PCR技术[10-11]、以RT为基础的环介导等温扩增(RT-LAMP)技术[12]、ELISA实验[13]、胶体金免疫层析实验[14]、限制性酶切片段长度多态性分析(RFLP)实验[5]等。PCR技术是近年来发展起来的新技术,较其他几种检测方法更简便、快速、准确。SYBR Green I 实时荧光定量PCR技术主要是在常规PCR基础上加入SYBR Green I 荧光物质对核酸进行定性定量检测,与常规PCR比较,具有重复性好、灵敏度高、定量准确、工作效率高、成本低廉等优点,并可避免由扩增产物交叉污染所导致的假阳性,同时适用于高度变异的基因检测。
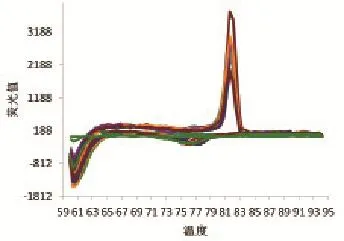
图8 荧光定量PCR检测临床样品溶解曲线
由于实时荧光定量PCR检测技术优于其他分子生物学检测技术,因此被世界动物卫生组织(OIE)认可并推荐应用于畜禽疾病的检测。然而荧光定量PCR检测结果受很多因素的影响,如:样品的来源及处理、提取核酸的方式方法、核酸的质量、实验操作技能、实验操作环境、PCR仪器的选择、反应体系和反应条件等。其中,最重要的影响因素是引物的设计。因此,在引物设计时要考虑到GC含量、退火温度、长度、保守性以及与流行毒株的匹配度等方面的问题,在引物设计过程中考虑到的问题越全面,实验结果越准确、可靠。
本研究根据PEDV N基因设计一对可扩增出564 bp目的片段的引物,构建阳性对照,同时用另外一对扩增180bp的引物进行荧光定量RT-PCR。标准曲线线性关系良好,相关系数为1.0,扩增效率为105.4%。溶解曲线峰型锐利,熔解温度一致,Tm值为81.7℃,没有引物二聚体和非特异性产物。灵敏度高,最低检出线为1×100copy/μL ;特异性强,与其它猪病病毒无交叉反应;耗时短,整个过程只需105 min,且批内批间重复性试验的变异系数低于0.9%。以上结果表明建立的SYBR GreeenⅠ实时荧光定量PCR检测方法特异、敏感、快速、重复性好,不仅可以快速准确诊断PEDV,还可用于PEDV流行病学调查、疫苗效价评估和致病机理等方面的研究,适合临床推广应用。
参考文献:
[1]郎景华.黑龙江省部分地区PED流行特征及病毒生物学特性研究[D].哈尔滨:东北农业大学,2003.
[2]Pensaert M B,de Bouck P. A new coronavirus-like particle associated with diarrhea in swine[J]. Arch Virol,1978,58(3):243-247.
[3]Hou X L,Yu L Y,Liu J. Development and evaluation of enzyme-linked immunosorbent assay based on recombinant nucleocapsid protein for detection of porcine epidemic diarrhea (PEDV)antibodies[J]. Vet Microbiol,2007,123(1-3):86-92.
[4]李思银,杨亮宇,杨玉艾. 猪流行性腹泻的实验室诊断方法[J]. 猪业科学,2010(12):54-57.
[5]Song D S,Yang J S,Oh J S,et al. Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean fi eld strains by restriction fragment length polymorphism analysis of ORF 3[J]. Vaccine,2003,21(17-18):1833-1842.
[6]Brian D A,Baric R S. Coronavirus genome structure and replication[J]. Curr Top Microbiol Immunol,2005,287:1-30.
[7]Wang K,Lu W,Chen J,et al. PEDV ORF3 encodes an ion channel protein and regulates virus production[J]. FEBS Lett,2012,586(4):384-391.
[8]邱永敏,朱瑞良,崔国林. 猪流行性腹泻防控措施与体会[J]. 山东畜牧兽医,2013,34(6):46-47.
[9]尹宝英,吴旭锦,熊忙利.猪流行性腹泻诊断方法研究进展[J].动物医学进展,2013,34(12):156-159.
[10]Ishikawa K,Sekiguchi H,Ogino T,et al. Direct and rapid detection of porcine epidemic diarrhea virus by RT-PCR[J]. J Virol Methods,1997,69(1-2):191-195.
[11]Kubota S,Sasaki O,Amimoto K,et al. Detection of porcine epidemic diarrhea virus using polymerase chain reaction and comparison of the nucleocapsid protein genes among strains of the virus[J]. J Vet Med Sci,1999,61(7):827-830.
[12]Ren X,Li P. Development of reverse transcription loopmediated isothermal amplifi cation for rapid detection of porcine epidemic diarrhea virus[J]. Virus Genes,2011,42(2):229-235.
[13]Knuchel M,Ackermann M,Muller H K,et al. An ELISA for detection of antibodies against porcine epidemic diarrhoea virus (PEDV) based on the specifi c solubility of the viral surface glycoprotein[J]. Vet Microbiol,1992,32(2):117-134.
[14]张利勃,周铁忠,王坤,等.猪流行性腹泻胶体金抗体检测技术的建立及其应用[J]. 中国农学通报,2011,27(3):374-377.
(责任编辑:朱迪国)
中图分类号:S852.65
文献标识码:A
文章编号:1005-944X(2016)01-0062-05
基金项目:浙江省科技厅项目(2014C32061,2014C02003);金华市农业类重点研究项目(2014-2-003)
通讯作者:宋厚辉,王晓杜
Development of Real-time Quantitative RT-PCR Method for Detecting Porcine Epidemic Diarrhea Virus
Lao Xiujie1,Wang Jingjing2,Zheng Dongxia2,Shao Chunyan1,He Haijian3,Wang Xiaojie1,Wang Zhiliang2,Wang Xiaodu1,Song Houhui1
(1.College of Animal Science and Technology,Zhejiang A&F University,Hangzhou,Zhejiang 311300;2. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;3. School of Agricultural and Biological Engineering,JinHua Polytechnic,Jinhua,Zhejiang 321007)
Abstract:A pair of primers was synthesized according to the conservative sequence of PEDV N genes that have been retrieved from GenBank. The forward and reverse primers were aligned with 153 full-length sequences of PEDV N genes,and exhibited identifi es of 100% and 97%,respectively. The fl uorescent dye SYBR Green I was used to develop the real-time RT-PCR method. The N gene of an isolated PEDV was amplifi ed by RT-PCR,subcloned into a plasmid,and then was used as a positive control. The coeffi cient of variation was less than 0.9% in triplicate assays. Based on positive clinical samples,100% agreement was achieved by using this real-time RT-PCR method. This method would be useful in diagnostic analysis against PEDV in epidemiological investigations.
Key words:porcine epidemic diarrhea virus;N gene;real-time fl uorescent quantitative RT-PCR;test

