实时荧光RT-PCR鉴别小反刍兽疫病毒疫苗株和野毒株
李 林,吴晓东,刘春菊,王清华,包静月,王志亮(中国动物卫生与流行病学中心/国家外来动物疫病研究中心,山东青岛 266032)
实时荧光RT-PCR鉴别小反刍兽疫病毒疫苗株和野毒株
李 林,吴晓东,刘春菊,王清华,包静月,王志亮
(中国动物卫生与流行病学中心/国家外来动物疫病研究中心,山东青岛 266032)
摘 要:为快速鉴别小反刍兽疫病毒的疫苗株和野毒株,本研究通过分析GenBank中已发布的小反刍兽疫病毒全基因组序列,设计了1对通用引物以及疫苗株和野毒株特异性探针各1条,建立了小反刍兽疫病毒鉴别实时荧光RT-PCR方法。结果显示,该方法对疫苗株和野毒株的检测灵敏度均可以检测至10拷贝/反应,在108至101拷贝/反应之间具有良好的线性关系,扩增效率均接近1。该方法具有良好的特异性,能够区分不同谱系的野毒株株和疫苗株。使用该方法对136份临床疑似样品检测,检出的阳性数量与普通RT-PCR相同,并且测序后的区分结果也相同。本方法的建立为该病的实验室鉴别检测和流行病学调查提供了技术支持。
关键词:小反刍兽疫病毒;谱系IV;Nigeria 75/1疫苗;实时荧光RT-PCR
小 反 刍 兽 疫(Peste des petits ruminants,PPR)是由副黏病毒科、麻疹病毒属的小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起的一种高度接触性传染病,主要感染绵羊、山羊,野生小反刍动物也可被感染,是危害养羊业最重要的疫病之一。PPR主要在非洲、中东和南亚等地区流行。我国于2007年首先发现该病[1],随后又有几次小规模暴发,但只局限在西藏阿里地区。2013年新疆再次暴发该病,并随后传播到国内22个省(自治区或直辖市),给我国养羊业造成巨大损失。目前该病在国内已得到有效控制,仅出现零星发病。
PPRV为不分节段单股负链RNA病毒,病毒基因组编码6种结构蛋白和2个非结构蛋白。根据PPRV的N基因或F基因的遗传进化分析可以把PPRV分为4个谱系(lineage I~IV)[2-3]。各种谱系的分布呈现不同的地理特征,其中以谱系IV分布最为广泛,主要分布在南亚、中亚和和非洲的部分地区。我国流行的野毒株也属于谱系IV,世界各地广泛使用的弱毒活疫苗Nigeria 75/1株属于谱系II。
由于PPR的发病率和死亡率较高,国内普遍采取了免疫Nigeria 75/1弱毒疫苗的主动预防措施,但是Nigeria 75/1疫苗为活病毒疫苗,动物免疫后在短时间内会出现排病毒现象[4],这给该病的病原学监测造成了干扰。PPRV只有一个血清型,目前血清学还无法区分是野毒感染还是疫苗免疫,这给鉴别诊断也带来了困难。当前已经建立的病毒核酸检测方法,如RT-PCR[5]和荧光RT-PCR(Realtime RT-PCR)[6-8],绝大多数是针对全部PPRV毒株进行检测,缺乏区分疫苗毒株与流行毒株的高通量快速诊断方法。本研究建立的双重鉴别荧光RTPCR检测方法,在主动监测和确诊中能够快速区分PPRV野毒株和疫苗株。
1 材料与方法
1.1 毒株
国内分离株China/XJ/2013和China/Tibet/2007均由本实验室分离和保存。Nigeria 75/1疫苗购自新疆天康畜牧生物技术有限公司。PPRV谱系IV中的其余3个代表毒株、谱系III和谱系I各1个代表毒株(Morocco 2008,Sungri 96,Turkey 2000,Uganda 2012和ICV89)的部分序列片段由上海生物工程公司合成。
1.2 试剂与主要仪器
引物和基因序列由生工生物工程(上海)股份有限公司合成;TaqMan探针由Life Technology公司合成;High Pure viral RNA kit购自Roche公司;TranscriptAid T7 High yield Transcription kit购 自ThermoFisher公司;SacI限制性内切酶购自New England BioLabs公司;SuperScript III Platinum One-Step Quantitative RT-PCR system购自Invitrogen公司;Prime Script One Step RT-PCR试剂盒购自宝生物(大连)有限公司。荧光定量PCR仪为Applied Biosyestems公司产品。Nanodrop 1000分光光度计购自Thermo Fisher公司。
1.3 引物设计
根据GenBank中所公布的不同基因系PPRV毒株全基因组序列,使用MEGA 5.0生物学软件比对分析,然后使用Primer Express 3.0设计出引物和TaqMan探针,序列如表1所示。检测野毒株和疫苗株所用的上、下游引物均相同,只是TaqMan探针序列有所区别。疫苗株所用探针Va 的5’端标记VIC报告荧光基团,野毒株所用探针Vi的5’端分别标记FAM报告荧光基团,两种探针的3’端均标记TAMRA淬灭荧光基团。
表1 鉴别荧光RT-PCR所用引物和探针
1.4 样品处理和RNA的提取、制备
使用PBS(0.01 M,pH 7.4)浸泡羊口鼻腔棉拭子或眼结膜棉拭子,震荡混匀后备用。或取约100 mg组织样品(如淋巴结、脾脏、肺脏、肾脏和肝脏等)与1 mL的PBS混合研磨,然后匀浆液3000 g室温离心5 min后取上清。处理后的样品或病毒培养液均采用Roche公司的High Pure viral RNA kit提取病毒核酸。
使用引物PPRV All F和PPRV All R分别进行RT-PCR扩增China/XJ/2013株和Nigeria 75/1疫苗株的病毒序列,然后再分别连接pGEM-T载体,经测序、单酶切后再使用TranscriptAid T7 High yield Transcription kit以线性化的载体为模板体外转录RNA,测定浓度后计算RNA分子拷贝数,10倍倍比稀释,作为检测灵敏度的两种RNA标准品,-80℃冰箱保存备用。
人工合成的5株病毒核酸序列首先连接到pBluescript II SK(+)克隆载体的SmaI酶切位点,然后使用SacI酶切重组载体使其线性化,再体外转录RNA,测定浓度,-80℃冰箱保存备用。
1.5 荧光RT-PCR
PPRV野毒株和疫苗株鉴别荧光RT-PCR使用SuperScript III Platinum One-Step Quantitative RT-PCR system进行,反应体积为25 μL,其中包括12.5 μL 的2× Reaction Mix、引物PPRV All F(10 μM)和PPRV All R(10 μM)各1 μL、0.5 μL PPRV Va Probe (10 μM)、0.5 μL PPRV Vi Probe(10 μM)、0.5 μL Enzyme Mix、0.5 μL ROX reference dye、3 μL病毒核酸模板、5.5 μL无RNase的水。采用ABI 7500型荧光定量PCR仪按照如下程序进行反应:50℃反转录15 min,95℃ 3 min,然后进行40个循环(95℃5 s,60℃ 1 min),延伸过程中同时收集FAM和VIC两种荧光信号。
1.6 特异性分析
使用鉴别荧光RT-PCR对不同PPRV毒株RNA或体外转录的RNA进行检测,同时使用该方法对口蹄疫病毒(FMDV)、山羊痘病毒(GPV)和羊口疮病毒(ORFV)等病毒分别进行核酸检测,观察其特异性。
1.7 检测灵敏度和线性关系分析
分别计算出体外转录的国内流行野毒株China/ XJYL/2013和疫苗株Nigeria75/1两种RNA片段的拷贝数,再连续10倍倍比稀释。使用浓度范围为108~101拷贝/反应的RNA分别进行荧光RTPCR,分析对两种毒株的检测下限,以及模板拷贝数与Ct值的线性关系。
1.8 对临床样品的检测
使用建立的鉴别实时荧光RT-PCR对2014年国内的送检的136份临床样品进行检测。这些样品已经使用针对N基因的普通RT-PCR进行过检查[5]。对阳性结果样品再进行测序,判断是疫苗株或野毒株。比较两种检测方法的差异。
2 结果
2.1 特异性分析
经对国内PPRV野毒株和Nigeria 75/1疫苗株的基因组序列进行分析,设计了特异性引物和TaqMan探针,建立了鉴别PPRV野毒株和疫苗株的荧光RT-PCR方法。使用该方法对不同病毒RNA或体外转录的RNA片段进行检测的结果表明,野毒株探针对5株谱系IV病毒RNA的反应结果都为阳性,对其他3个谱系的毒株RNA检测结果均为阴性;疫苗株探针对Nigeria 75/1疫苗株病毒RNA检测结果为阳性,对其他PPRV毒株检测结果均为阴性。使用该鉴别荧光RT-PCR方法对FMDV、GPV和ORFV等病毒核酸检测,两种探针的检测结果均为阴性(表2)。
2.2 检测灵敏度和线性关系分析
表2 对不同病毒核酸的检测结果
图1 对两种PPRV毒株的检测灵敏度分析
使用建立的鉴别荧光RT-PCR对10倍连续稀释的体外转录的China/XJYL/2013野毒株和Nigeria 75/1疫苗株RNA模板检测的结果表明,每个反应中对两种毒株均可以检测低至10个拷贝的阳性RNA。在108~101拷贝时具有良好的线性关系(图1)。对野毒株检测,其标准曲线的相关系数(R2)为0.9996,标准曲线为y =-3.2895x + 39.405;对疫苗株检测,标准曲线的R2为0.9978,标准曲线为y =-3.2456x + 39.984(图2)。使用公式E = 10(-1/S)- 1(E为扩增效率,S为斜率)计算反应的扩增效率,其结果对两种毒株检测的扩增效率均接近1。
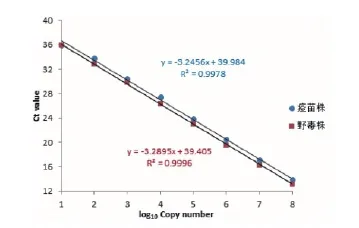
图2 对两种PPRV毒株检测的线性关系分析
2.3 对临床样品检测
使用鉴别荧光RT-PCR对136份已经使用普通RT-PCR检测过的临床样品进行重复检测(普通RTPCR检测出99份阳性样品,37份阴性样品)。经鉴别荧光RT-PCR检测的99份阳性样品与普通RTPCR的阳性检测结果一致,其中90份样品判定为野毒株阳性,9份样品判定为疫苗株阳性。所有普通RT-PCR阳性样品测序后的野毒株和疫苗株区分结果与鉴别荧光RT-PCR区分结果相同。部分样品的鉴别荧光RT-PCR检测结果如图3所示。
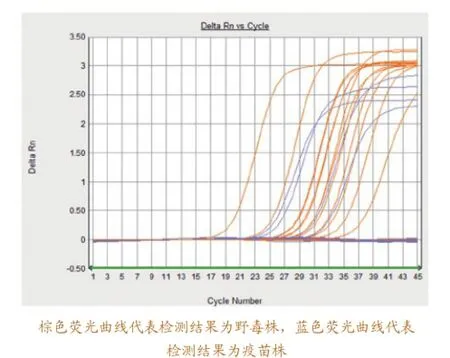
图3 部分临床样品检测结果
3 讨论
PPR自2013年在我国新疆重新出现以来,已经传播到国内许多省份。由于弱毒疫苗免疫效果较好,大规模接种弱毒疫苗是该病的重要防控手段。但目前血清学方法无法区分弱毒疫苗免疫和野毒感染,而常规病原学检测方法也无法区分,分子生物学方法大多也需要经过测序才能区分疫苗株和野毒株,所需时间较长,这给该病的防控工作带来困难。为解决病原学主动监测中无法快速区分PPRV疫苗株和野毒株的问题,本研究采用双重荧光RT-PCR建立了PPRV鉴别检测方法,缩短了试验操作时间。虽然PPRV只有一个血清型,但根据N基因或F基因可以分为4个谱系(I~IV),每个谱系具有相对明显的地域特征。国内流行的野毒株属于谱系IV,而使用的疫苗株却属于谱系II。根据GenBank中已公布的PPRV基因组序列,经对比分析Nigeria 75/1疫苗株与国内流行的野毒株序列,设计了1对引物和2条TaqMan探针。相比之前国内建立的鉴别荧光RT-PCR方法[9-10],本试验的反应体系中只使用1对引物和2条TaqMan探针,简化了操作和结果判定,避免了引物和探针过多产生的干扰,提高了PCR反应效率,对两种毒株检测PCR反应的扩增效率均可以接近于100%。整个检测过程仅需2个小时左右,缩短了检测时间。
试验结果表明,所建立的荧光RT-PCR具有极高的灵敏度、特异性和极佳的反应特性。对两种毒株RNA标准品的检测下限均可以达到约10个拷贝/反应。对PPRV不同毒株的RNA进行检测,野毒株探针能够检测出PPRV谱系IV中的不同野毒株;而疫苗株探针仅能检测出疫苗株,与其他谱系IV中的毒株没有交叉反应。两种探针与其他的羊常见病毒也没有非特异性反应。鉴别荧光RT-PCR中的两种荧光曲线均具有良好的线性关系,相关系数均接近于1,反应的扩增效率也接近1。经过对136份临床样品检测,鉴别实时荧光RT-PCR能够区分普通RT-PCR检测为阳性的临床样品,并且得到测序验证。
本研究建立的鉴别荧光RT-PCR方法,解决了PPRV疫苗株和野毒株鉴别检测的难题,具有良好的特异性和灵敏度,操作简单、省时省力,提高了检测效率,特别适合在大规模主动病原学监测和流行病学调查中应用。
参考文献:
[1]Wang Z,Bao J,Wu X,et al.Peste des petits ruminants virus in Tibet,China[J].Emerg Infect Dis,2009,15(2):299-301.
[2]Shaila M S,Shamaki D,Forsyth M A,et al.Geographic distribution and epidemiology of peste des petits ruminants virus[J].Virus Res,1996,43(2):149-153.
[3]Kwiatek O,Minet C,Grillet C,et al.Peste des petits ruminants(PPR)outbreak in Tajikistan[J].J Comp Pathol,2007,136(2-3):111-119.
[4]Couacy H E,Bodjo S C,Danho T,et al.Early detection of viral excretion from experimentally infected goats with pestedes-petits ruminants virus[J].Prev Vet Med,2007,78(1): 85-88.
[5]Couacy H E,Roger F,Hurard C,et al.Rapid and sensitive detection of peste des petits ruminants virus by a polymerase chain reaction assay[J].J Virol Methods,2002,100(1-2):17-25.
[6]Bao J,Li L,Wang Z,et al.Development of one-step real-time RT-PCR assay for detection and quantitation of peste des petits ruminants virus[J].J Virol Methods,2008,148(1-2):232-236.
[7]Batten C A,Banyard A C,King D P,et al.A real time RTPCR assay for the specifi c detection of Peste des petits ruminants virus[J].J Virol Methods,2011,171(2):401-404.
[8]Kwiatek O,Keita D,Gil P,et al.Quantitative one-step realtime RT-PCR for the fast detection of the four genotypes of PPRV[J].J Virol Methods,2010,165(2):168-177.
[9]吕建强,杨俊兴,宗卉,等.小反刍兽疫疫苗毒与野毒实时荧光RT-PCR鉴别检测方法的建立[J].中国兽医学报,2012,32 (12):1795-1798.
[10]袁向芬,吴绍强,林祥梅.小反刍兽疫疫苗毒株与强毒株的鉴别性荧光RT-PCR检测方法的建立[J].中国动物检疫,2012,29(7):30-34.
(责任编辑:朱迪国)
Detection and Differentiation of Vaccine and Wild-type Strains of PPRV by Duplex Real-time RT-PCR
Li Lin,Wu Xiaodong,Liu Chunju,Wang Qinghua,Bao Jingyue,Wang Zhiliang
(China Animal Health and Epidemiology Center,National Research Center for Exotic Animal Disease,Qingdao,Shandong 266032)
Abstract:To differentiate vaccine virus and wild-type peste des petits ruminants virus(PPRV)by duplex real-time RTPCR,one pair of primers and two TaqMan probes were designed based on the comparison of PPRV genome sequences available in GenBank.The duplex real-time RT-PCR results showed that the detection limits for vaccine strain and wildtype strains were both 10 copies per reaction.The developed assay also showed high amplifi cation effi ciency,linearity and specifi city in discriminating the two PPRV types.A total of 136 clinical samples tested by the conventional RT-PCR were run again by the duplex real-time RT-PCR.The results were confi rmed subsequently by sequencing the positive conventional RT-PCR products.This reliable and rapid duplex real-time RT-PCR assay would be feasible and attractive for diagnostic laboratories,both for clinical purpose in active surveillance and for epidemiological investigations.
Key words:peste des petits ruminants virus;lineage IV;Nigeria 75/1 vaccine;real-time RT-PCR
中图分类号:S852.65
文献标识码:B
文章编号:1005-944X(2016)02-0069-05
基金项目:公益性行业(农业)科研专项(200903037)
通讯作者:王志亮

