外源氮对小麦离体穗干物质及Zn积累、分配规律的影响
姜丽娜,张 豫,李学梅,徐光武,胡乃月,王亚帆,李春喜
(河南师范大学 生命科学学院,河南 新乡 453007)
外源氮对小麦离体穗干物质及Zn积累、分配规律的影响
姜丽娜,张 豫,李学梅,徐光武,胡乃月,王亚帆,李春喜
(河南师范大学 生命科学学院,河南 新乡 453007)
为分析外源氮与小麦穗部建成的关系,采用离体穗培养的方法,研究了不同质量浓度外源氮(NH4NO3)供给条件下,小麦离体穗部干物质及微量元素Zn的积累和分配规律。结果表明,随培养时间的增加,离体穗干物质积累总量呈增加趋势。外源氮促进了离体穗干物质的积累,培养25 d,周麦18(Z18)和济麦22(J22)穗部干物质积累量均以N0.5处理最高,以N0处理最低。随外源氮水平的增加,旗叶、旗叶鞘、穗下节干物质转运量和转运率变化趋势相同,外源氮供给降低了穗部营养器官干物质对籽粒的贡献率;但高氮处理促进了旗叶干物质向籽粒的转运,N2.0处理下,Z18和J22离体穗干物质转运量均表现为旗叶>旗叶鞘>穗下节。穗离体培养过程中,Z18穗器官Zn积累量峰值早于J22。离体穗器官中,Z18培养20 d、J22培养15 d和20 d时,在所有氮质量浓度处理下均以籽粒Zn积累量较高,旗叶鞘较低。培养25 d,Z18籽粒Zn积累量高于J22,但在N0.5和N1.5处理下其旗叶、穗下节及穗轴+颖壳Zn积累量则低于 J22。外源氮供给对小麦离体穗的Zn积累有促进作用,但是过高质量浓度的氮供应会抑制Zn积累。培养25 d,Z18和J22离体穗的Zn积累量均以N0.5处理最高,籽粒Zn积累量分别以N1.0和 N0.5处理最高。
小麦; 离体穗培养; 干物质; Zn积累
Zn是生物体重要的微量元素之一,与作物生长和人类健康密切相关[1]。谷类食物中Zn等微量元素的利用率仅有20%~40%[2],提高谷类作物籽粒中微量元素的含量以改善人类微营养缺乏的问题,已成为现代农业研究的内容之一[3-4]。
小麦是我国华北地区的主要粮食作物,其产量和品质与我国的粮食安全密切相关。氮素对小麦的生长发育起着重要的调控作用,其与小麦籽粒微量元素的含量亦有一定的相关关系[5]。施用氮肥可以提高植株对Zn的吸收积累[6],改善籽粒对Zn的吸收能力[7-8]。大田试验条件下,氮素与小麦穗部生长关系的研究经常受到各种复杂多变的环境因子及植株器官间相互作用的影响。而采用穗离体培养的方法,可以人为控制“源”,以研究“源”对“库”生长的影响[9-11]。为此,采用离体穗培养的方法,分析了不同浓度外源氮供给对小麦离体穗干物质及穗部Zn积累的影响,以期为外源氮对小麦籽粒建成的调控及提高籽粒Zn含量提供理论和技术支撑。
1 材料和方法
1.1 试验材料
供试材料为周麦18和济麦22(分别以Z18和J22表示)。试验于2011—2012年在河南省浚县矩桥镇刘寨村试验田(35°40′N、114°33′E)进行。土壤含有机质12.01 g/kg、全氮1.12 g/kg、碱解氮36.9 mg/kg、速效磷34.8 mg/kg、速效钾159 mg/kg。选取田间生长一致且同日开花的单茎进行标记,花后5 d将标记单茎从基部剪去,于室内进行离体穗培养。
1.2 离体穗培养方法
将所取单茎从倒2节间剪断,去除倒2叶、倒2节及其叶鞘,保留旗叶、旗叶鞘、穗下节及完整的穗部。于超净工作台上将离体穗的下部依次用75%乙醇溶液、0.1% HgCl2溶液表面消毒,经灭菌水冲洗干净,将离体穗插入装有液体培养基的广口培养瓶中,以医用脱脂棉封口固定麦穗。每瓶6穗,培养瓶置于1~2 ℃浅层水浴中,培养室光照16 h/d。
培养液采用无N培养基[12],蔗糖质量浓度为30 g/L,以NH4NO3为N源,质量浓度分别为0、0.5、1.0、1.5、2.0 g/L(以N0、N0.5、N1.0、N1.5、N2.0表示),每处理重复4次。
1.3 测定项目与方法
于培养10、15、20、25 d,将各处理下培养瓶中的离体穗取出,按器官分开,去离子水冲洗,烘干,称质量。然后将样品粉碎,采用酸消解—原子吸收火焰法测定样品Zn含量[8]。根据各器官Zn含量及干物质积累量,计算各器官Zn积累量。离体穗营养器官干物质转运量、转运率及对籽粒的贡献率以下式[13]计算:
营养器官干物质转运量=离体穗营养器官最大干物质量-成熟时该器官干物质量;
营养器官干物质转运率=离体穗营养器官干物质转运量/该器官最大干物质量×100%;
营养器官干物质贡献率=离体穗营养器官干物质转运量/收获时籽粒干物质量×100%。
1.4 数据分析
试验结果用Excel 2003和SPSS 11.0统计软件进行分析。
2 结果与分析
2.1 外源氮对小麦离体穗干物质积累的影响
离体麦穗干物质积累量随培养时间的增加总体呈增加趋势(图1)。N0.5处理下,离体穗干物质量持续增加,至25 d达到最高值。N0处理下,Z18离体穗干物质积累量在培养10 d和15 d时高于其他处理,之后呈下降趋势;J22在培养10 d时亦高于其他处理,之后增幅较小,至25 d,2个品种穗干物质积累量均以N0处理最低。对于N1.5处理,随着培养时间的增加,两品种离体穗干物质积累量均呈先增后降的变化趋势,均在培养20 d时达到高峰值。说明外源氮对穗部干物质积累有一定的调控作用,2个品种对氮的响应不完全一致。N2.0处理下,J22离体穗干物质积累量随培养时间的增加而持续增加,在培养25 d时达到最高值,其干物质积累量仅低于N0.5处理,而在培养的10~20 d,该处理下穗部干物质积累量均低于其他处理。外源氮对J22离体穗干物质积累的影响主要表现在后期,培养10 d,离体穗干物质积累量随供氮水平的增加而降低,表现为N0>N0.5>N1.0>N1.5>N2.0;培养20~25 d,外源氮促进了穗部干物质的积累,至25 d,表现为N0.5>N2.0>N1.5>N1.0>N0。

图1 不同外源氮供给条件下离体穗干物质积累量
2.2 外源氮对小麦离体穗营养器官干物质转移的影响
随外源氮水平的增加,旗叶、旗叶鞘、穗下节干物质转运量和转运率变化趋势总体相同,品种之间存在差异(表1)。在0.5~1.5 g/L(N0.5、N1.0、N1.5)时,随供氮水平的增加,Z18离体穗旗叶、旗叶鞘和穗下节干物质转运量下降;N2.0处理下,穗下节干物质转运量仍表现为下降,而旗叶、旗叶鞘则表现为增加,总转运量表现为N0>N2.0>N0.5>N1.0>N1.5。N0.5、N1.0、N1.5条件下,Z18干物质转运量以穗下节较高,而高浓度氮(N2.0)下,旗叶干物质转运量较高。J22穗部干物质转运量在N0处理下表现为旗叶鞘>穗下节>旗叶。N2.0处理下,J22离体穗干物质转运量与Z18相同,均为旗叶>旗叶鞘>穗下节。因此,高氮处理促进了旗叶干物质的转运。从穗部总转运量来看,低氮处理下(N0、N0.5)J22和Z18差异较小,N1.0、N1.5、N2.0条件下则表现为J22>Z18。

表1 不同外源氮供给条件下离体穗干物质的转运
离体穗旗叶、旗叶鞘、穗下节干物质对籽粒的总贡献率以N0处理最大,Z18表现为N0>N2.0>N0.5>N1.0>N1.5,J22表现为N0>N1.5>N1.0>N2.0>N0.5,表明外源氮供给降低了营养器官对籽粒干物质的贡献率。从各器官干物质对籽粒贡献率来看,低氮供给下(N0、N0.5、N1.0)旗叶的贡献率较低,高氮供给下(N2.0)旗叶的贡献率较高,Z18和J22旗叶干物质贡献率的高峰值分别出现在N2.0和N1.5处理。2个品种旗叶鞘和穗下节的贡献率以N0处理表现较高。
2.3 外源氮对小麦离体穗营养器官Zn积累量的影响
不同氮质量浓度下,离体穗各器官Zn积累量如表2所示。离体穗器官中,Z18培养20 d,所有处理均以籽粒Zn积累量较高。培养25 d,Z18籽粒Zn积累量及积累百分比均高于J22,但在N0.5和N1.5处理下其旗叶、穗下节及穗轴+颖壳Zn积累量则均低于J22。氮质量浓度的增加有利于提高成熟期离体穗各器官Zn积累,过高则会产生一定的抑制作用。
离体培养过程中,Z18穗器官Zn积累量峰值出现早于J22。Z18旗叶Zn积累量在培养15 d(N1.5处理为培养10 d)达到峰值,之后Zn积累量降低,培养25 d表现为N1.5>N0.5>N1.0>N2.0>N0;J22旗叶Zn积累量除N1.0处理在培养15 d最高外,其他处理均在培养25 d表现最高。旗叶鞘Zn积累量,Z18以N1.0处理培养15 d表现最高,J22以N1.5处理培养20 d表现最高。从穗下节Zn积累量来看,Z18以N1.0处理培养10 d表现最高,J22以N0.5处理培养25 d表现最高。穗轴+颖壳的Zn积累量在培养10~20 d基本上都呈增加趋势,培养20~25 d,Z18在N0.5和N2.0处理Zn积累量仍呈增加趋势,其他处理均下降;J22在N0.5、N1.0处理下培养10~25 d 均表现增加趋势,其他处理在培养10~20 d 呈增加趋势,20~25 d呈下降趋势。籽粒Zn积累量在10~15 d表现为增加,之后因品种和处理而异。Z18籽粒Zn积累量在N0.5处理下持续上升,N1.5和N2.0处理于培养20 d达到峰值,N0、N1.0处理于培养15 d 达到峰值,之后下降,在20~25 d略有增加,但变幅不大。J22籽粒Zn积累量在N0.5、N1.5、N2.0处理下均表现为持续增加,N1.0处理的峰值出现在培养20 d,N0处理在培养15~20 d 略有下降,之后上升,于培养25 d表现最高。
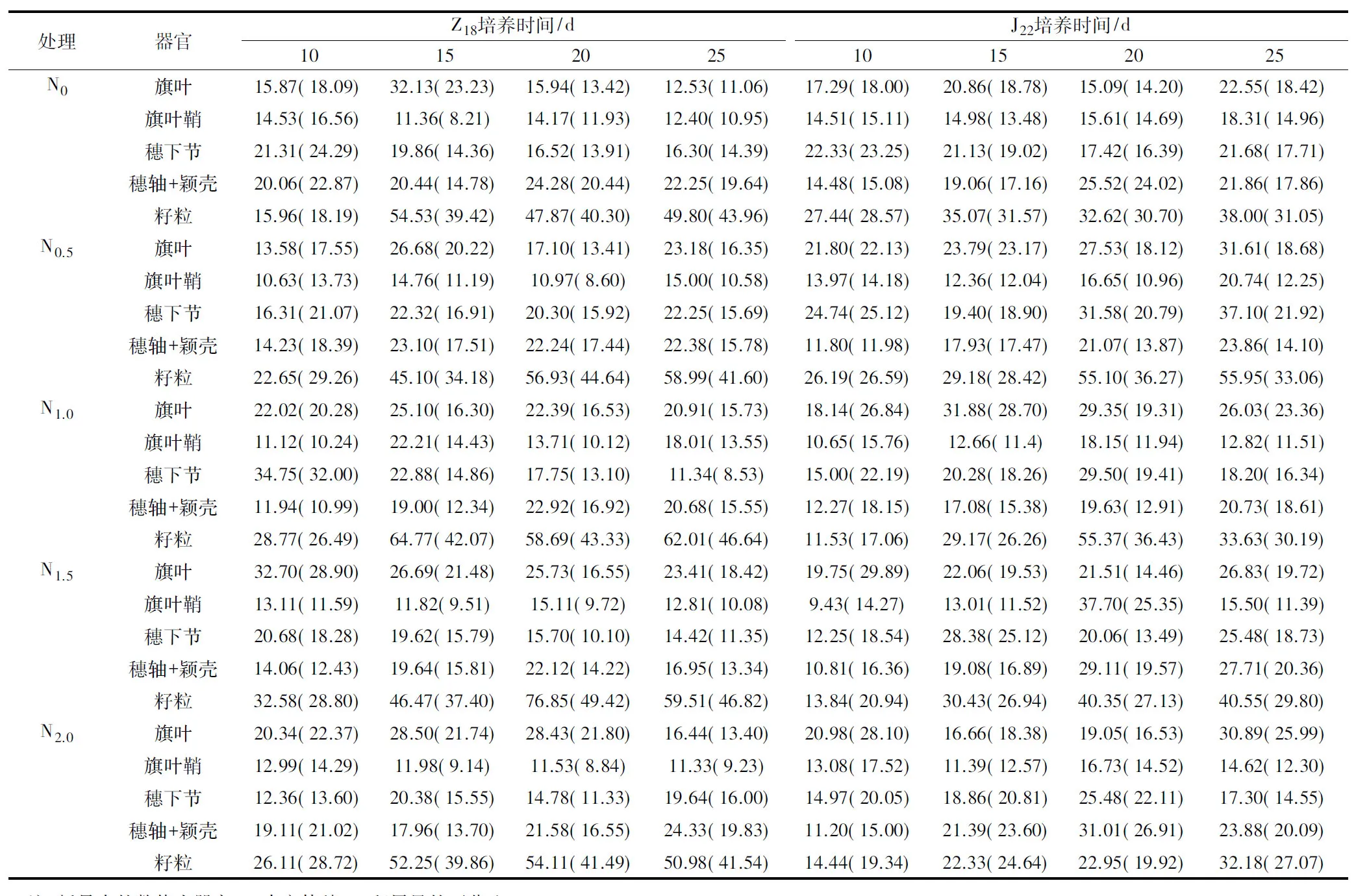
表2 不同外源氮供给条件下小麦离体穗各器官Zn积累量及积累百分比 μg/穗,%
注:括号中的数值为器官Zn占离体穗Zn积累量的百分比。
不同氮水平下离体穗Zn积累量如图2所示。培养25 d,2个品种均以N0.5处理Zn积累量最高。外源氮供给对离体穗Zn积累有一定的促进作用,提高了离体穗Zn积累量,但是过高浓度的氮供应会抑制Zn积累。
不同氮质量浓度下,Z18和J22离体穗Zn积累量增长的幅度虽有一定的差异但积累量差异不大。培养10~15 d,Z18离体穗Zn积累量增加迅速,之后N0、N1.0、N2.03个处理表现为持续下降。培养25 d,穗Zn积累量表现为N0.5>N1.0>N1.5>N2.0>N0。J22离体穗Zn积累量在培养10~15 d均增加,15~20 d除N0处理外亦保持升高趋势,20~25 d,N0、N0.5、N2.0处理仍表现为升高,培养25 d时,穗Zn积累量表现为N0.5>N1.5>N0>N2.0>N1.0。
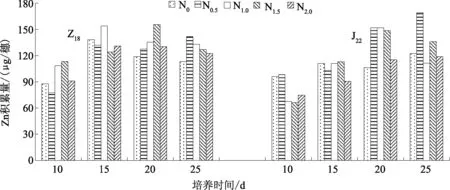
图2 不同氮质量浓度下穗部Zn积累量
3 结论与讨论
氮肥施用与小麦籽粒微营养品质密切相关[7,8,14-15]。离体穗培养作为一种可以避免穗与其他器官相互作用的试验方法,已广泛应用于试验研究[9,10,13,16-17]。本研究结果表明,随培养时间的增加,外源氮供给促进了Z18和J22离体穗干物质的积累,高质量浓度氮处理对Z18和J22穗干物质积累虽有一定的抑制作用,但其效果仍优于缺氮处理。小麦籽粒的形成除了取决于营养器官花前积累的干物质在花后向籽粒的运转,还来源于叶片、茎鞘等营养器官在花后形成的光合同化物的再分配。本研究结果表明,从转运量上看,离体穗培养下Z18和J22旗叶干物质的转运量均表现为N2.0处理最高,旗叶鞘干物质转运量以N0处理较高。从转运率上看,Z18离体穗旗叶和旗叶鞘干物质转运率以N2.0处理最高,穗下节干物质转运率以N0处理最高;J22旗叶干物质转运率以N1.5处理最高,而旗叶鞘和穗下节干物质转运率表则以N0处理最高。由此可以看出,高质量浓度外源氮供给提高了Z18和J22离体穗旗叶干物质转运量和转运率,无外源氮供给(N0)下Z18旗叶鞘干物质转运量和J22旗叶鞘干物质转运量和穗下节转运率均较高。这与之前的研究结果基本一致[13]。Z18离体穗营养器官对籽粒的总贡献率表现为N0>N2.0>N0.5>N1.0>N1.5,J22离体穗营养器官对籽粒的总贡献率表现为N0>N1.5>N1.0>N2.0>N0.5,表明在籽粒形成过程中,外源氮供给增加,营养器官对籽粒干物质的贡献率反而降低,这可能是营养器官为了保证自身生长而吸收充足的营养物质,延缓了其衰老进程。
Z18和J22离体穗Zn积累量总体上呈先增后降的变化趋势。随外源氮供给浓度增加,培养25 d,Z18离体穗Zn积累量表现为N0.5>N1.0>N1.5>N2.0>N0;J22离体穗Zn积累量表现为N0.5>N1.5>N0>N2.0>N1.0。这表明外源氮供给对离体穗Zn积累有促进作用,但是过高质量浓度的氮供应会抑制Zn积累。籽粒是离体穗Zn分配的主要器官,随着外源氮质量浓度增加,离体穗籽粒中Zn积累量亦有所上升,有利于改善籽粒的微营养品质。本研究表明,Z18和J22以籽粒Zn积累量较高,培养25 d,Z18籽粒Zn积累量表现为N1.0>N1.5>N0.5>N2.0>N0;J22籽粒Zn积累量表现为N0.5>N1.5>N0>N1.0>N2.0。培养25 d,两品种各器官Zn积累量表现不一致,Z18籽粒Zn积累量及积累百分比均高于J22,但在N0.5和N1.5处理下其旗叶、穗下节及穗轴+颖壳Zn积累量则低于J22。
综合来看,籽粒建成过程中,一定质量浓度的外源氮供给(N0.5)促进了离体穗部发育和籽粒Zn积累。因此,在小麦植株生长的后期,需要保证一定的氮素供应以促进籽粒的Zn营养品质。本研究是在离体穗培养条件下,通过控制不同的外源氮供给,研究了其对穗部生长的影响,其结果对指导小麦田间栽培有一定的意义。大田所处生态环境条件较为复杂,光、温、水等气象要素,栽培管理技术,自然灾害等不可控因素较多,小麦籽粒发育和营养品质建成均受到这些因素的影响。因此,在后续的研究中,仍需进一步研究小麦穗部干物质及Zn积累对氮肥的响应机制,建立相应的调控模型,并在田间试验中进行验证。
[1] White P J,Broadley M R.Biofortifying crops with essential mineral elements[J].Trends in Plant Science,2005,10(12):586-593.
[2] 曹新有,刘建军,程敦公,等.小麦子粒铁、锌元素含量的研究进展[J].植物遗传资源学报, 2012,13(1):125-129,133.
[3] 苏达,王志敏,周顺利,等.碳氮供给对小麦离体穗培养粒重、微量元素及蛋白质含量的影响[J].麦类作物学报,2009,29(6):1072-1077.
[4] Welch R M,Graham R D.Breeding for micronutrients in staple food crops from a human nutrition perspective [J].Journal of Experimental Botany,2004,55(396):353-364.
[5] 王允青,汪建来,郭熙盛,等.氮肥不同施用方法对小麦生长、养分吸收利用的影响[J].土壤通报,2007,38(5):919-923.
[6] Trethowan R M,Reynolds M,Sayre K,etal.Adapting wheat cultivars to resource conserving farming practices and human nutritional needs [J].Annals of Applied Biology,2005,146(4):405-413.
[7] 李峰,田霄鸿,陈玲,等.栽培模式、施氮量和播种密度对小麦子粒中锌、铁、锰、铜含量和携出量的影响[J].土壤肥料,2006(2):42-46.
[8] 姜丽娜,王亚帆,张豫,等.拔节期追氮对小麦植株地上部Zn吸收和积累的影响[J].麦类作物学报, 2015, 35(4):535-541.
[9] Jenner C F.Synthesis of starch in detached ear of wheat [J].Australian Journal of Biological Sciences,1968,21:597-608.
[10] 王志敏.小麦穗培养系统的建立及其在花、粒发育生理研究中的应用[J].中国农学通报,1995,11(6):1-5.
[11] 周琴,姜东,戴廷波,等.不同浓度糖氮对离体穗培养小麦粒重和叶片膜脂过氧化作用的影响[J].植物生理学通讯,2004,40(4):443-446.
[12] Waters S P,Martin P,Lee B.The influence of sucrose and abscisic acid on the determination of grain number in wheat[J].Journal of Experimental Botany,1984,35:829-840.
[13] 姜丽娜,吕远,侯飞,等.外源氮对离体麦穗干物质及氮素积累的影响[J].河南农业科学, 2010,39(1):11-16.
[14] 张睿,郭月霞,南春芹.不同施肥水平下小麦籽粒中部分微量元素含量的研究[J].西北植物学报,2004,24(1):125-129.
[15] Xue Y F,Eagling T,He J B,etal.Effects of nitrogen on the distribution and chemical speciation of iron and zinc in pearling fractions of wheat grain[J].Journal of Agricultural and Food Chemistry,2014,62:4738-4746.
[16] 董心久,周洪华,王金玲,等.离体培养下锌对春小麦籽粒形成及干物质积累的影响[J].植物营养与肥料学报,2006,12(6):822-825.
[17] 姜丽娜,王志敏,蒿宝珍,等.小麦穗离体培养下干物质及锌元素的积累规律[J].西北农业学报, 2008,17(4):66-70.
Effects of Exogenous Nitrogen on Dry Matter, Zn Accumulation and Distribution Law of Detached Wheat SpikesinvitroCulture
JIANG Lina,ZHANG Yu,LI Xuemei,XU Guangwu,HU Naiyue,WANG Yafan,LI Chunxi
(College of Life Sciences,Henan Normal University,Xinxiang 453007,China)
In order to study the relationship of nitrogen and wheat spike growth,effects of exogenous nitrogen on dry matter and Zn accumulation and distribution law of detached wheat spikesinvitroculture were studied.NH4NO3was the nitrogen source.Zhoumai 18(Z18) and Jimai 22(J22) were chosen as the materialsinvitroear culture.The results showed that dry matter accumulation of detached spikes increased as the culture time went on.Exogenous nitrogen promoted dry matter accumulation of detached spikes. At 25 d after cultivation,dry matter accumulation of detached spikes reached the highest value under N0.5treatment and the lowest value under N0treatment.With the adding of exogenous nitrogen level,the variation trend of dry matter transportation amount appeared as same as transportation rate in flag leaf,flag leaf sheath and peduncle.And exogenous nitrogen reduced the contribution rate of vegetable organs dry matter to grain, while higher nitrogen could accelerate the transportation of dry matter in flag leaf to grain.The order of dry matter transportation amounts of Z18and J22was the same as flag leaf>flag leaf sheath>peduncle under N2.0treatment.During the culture,Zn accumulation maximum in spike organ of Z18appeared earlier than that of J22.Among the organs of detached spike,Z18had the higher Zn accumulation in grain and lower Zn accumulation in flag leaf sheath at 20 d after cultivation,meanwhile,J22showed the same trend at both 15 d and 20 d after cultivation.Zn accumulation in grains of Z18was higher than that of J22,while flag leaf,flag leaf sheath,peduncle,glume and spike-stalk were all lower than that of J22under N0.5and N1.5treatments.Exogenous nitrogen was beneficial to Zn accumulation of detached spike,but too high nitrogen application amount could inhibit the Zn accumulation.At 25 d after cultivation,Zn accumulation of detached spike in both Z18and J22were the highest under N0.5treatment,and for grain,were under N1.0and N0.5,respectively.
wheat; detached spikesinvitroculture; dry matter; Zn(Zinc) accumulation
2015-10-09
国家自然科学基金项目(U1204313);国家科技支撑计划项目(2012BAD14B08,2013BAD07B14,2013BAD07B07)
姜丽娜(1973-),女,河南延津人,教授,博士,主要从事作物高产高效生理研究。E-mail:jianglina73@yahoo.com
S512.1
A
1004-3268(2016)05-0022-06

