肝原位瘤切除术对小鼠一般状态和免疫功能的影响
赵 彤,吕 灿,韩梦飞,张 展,王傅喆,黄 枫,陈 泉,方凡夫,李 柏
(第二军医大学 中医系,上海200433)
肝原位瘤切除术对小鼠一般状态和免疫功能的影响
赵彤,吕灿,韩梦飞,张展,王傅喆,黄枫,陈泉,方凡夫*,李柏*
(第二军医大学 中医系,上海200433)
摘要:目的观察肝原位瘤切除术对小鼠一般状态和免疫功能的影响。方法对小鼠进行肝原位瘤切除术,观察手术对小鼠术后不同时间节点自发活动度,淋巴细胞增殖能力,CD4+/CD8+比例等指标的影响。结果与正常小鼠相比,术后第1天小鼠自发活动度减小,差异有统计学意义(P<0.05);术后第1天和第3天小鼠淋巴细胞增殖能力均小于正常小鼠,且差异有统计学意义(P<0.05);术后第7天及正常小鼠淋巴细胞CD4+/CD8+比值均大于术后第1天小鼠,差异有统计学意义(P<0.01)。结论肝原位瘤切除术对小鼠造成了较大的应激损伤,产生了免疫抑制,小鼠在术后与人类围手术期相似,也需要一定的时间逐步恢复正常状态。
关键词:小鼠;肝原位瘤切除术;自发活动;免疫功能
(ChinJLabDiagn,2016,20:0883)
癌症在我国已成为各类疾病死因之首,原发性肝癌(hepatocellular carcinoma,HCC,简称肝癌)是其中恶性程度极高,预后极差的恶性肿瘤,且与主要癌症的下降趋势相反,随着慢性肝炎、肝硬化、肥胖发生率的升高,肝癌的死亡率有所上升[1]。目前,在肝癌的治疗手段上,最行之有效的手段依然是通过传统的手术切除,其对于患者预后,生存期的延长都有所帮助[2]。尽管如此,除利用手术方法外,对于肝癌的治疗措施依然有限,患者的5年生存率依然没有实质性的提高,而其根本原因还在于利用手术治疗后依然有较高的复发可能。据相关机构统计,肝癌在通过手术切除后5年的复发率依然高于60%,小肝癌经过完整切除后也有40%以上的复发率。研究显示肝癌术后复发与患者免疫功能有着高度相关性,围术期应激反应可抑制患者免疫功能,导致术后肿瘤转移的风险增加[3]。因此,如何避免肝癌的复发和转移成为治疗肝癌的重点,而改善肝癌患者围手术期免疫功能对于提高肝癌患者的长期存活率具有重要意义。但是,肝癌术后围手术期小鼠免疫功能如何恢复尚缺乏相关资料。本研究拟在围手术期内术后不同时间节点观察小鼠一般状态,检测小鼠免疫功能变化,为围手术期内如何改善小鼠免疫功能等临床研究提供前期参考。
1材料与方法
1.1实验动物与分组
健康雄性ICR 小鼠30只,6-8 周龄,体重(20±2)g/只,由上海斯莱克实验动物有限公司提供。于清洁级环境中饲养,恒湿(相对湿度50%),恒温(室温22℃),光照06:00-18:00,分笼饲养,自由饮水及进食,鼠笼规格为25 cm*15 cm*18 cm,每笼饲养5只,无菌手术在第二军医大学实验动物中心屏障动物实验设施进行。将小鼠随机分为6组,每组5只,即正常小鼠和术后小鼠,术后小鼠分别在术后第1天,第3天,第5天,第7天,第9天处死。
1.2小鼠肝原位瘤切除术
将H22细胞进行计数,用PBS悬浮至1-3×106个/ml,腹腔注射接种0.4 ml/mouse至第一代小鼠,8-9 d后当观察到第一代种鼠腹部膨隆,即可传代,传代时取1 ml注射器,种鼠腹部消毒后直接将针头插入抽取0.5 ml腹水,用PBS3-6倍稀释后注入第二代小鼠体内,6-7 d后传代,三代后可用PBS将腹水中H22细胞悬浮至2×106个/ml,0.1 ml/mouse于远端进针于小鼠左前肢,约10 d后肿瘤长至1 cm时进行原位移植。接种前首先取出,确保操作在无菌状态下进行,然后在RPMI-1640溶液中将外周纤维组织及血管清除干净,并且将中央坏死组织剔除,将鱼肉状组织切成2 mm×2 mm瘤块,放置一边备用,且组织要在2 h内用完。取肝内隧道植入法[4],用1%戊巴比妥钠麻醉,采用腹腔麻醉,剂量按小鼠体重的60 mg/kg计算,将小鼠固定在鼠板上,采用仰卧位,腹部皮肤去毛并消毒,用手术剪沿腹中线剪开,暴露肝脏左外肝叶。用显微外科镊在肝左外叶中间部位沿肝叶平面约20°角轻轻戳一个约3 mm深度的隧道,棉签局部轻压止血后夹取瘤块,小心送入,止血。缝合并关腹,涂抹少量青霉素,预防感染。肿瘤种植10 d后沿原切口进腹,在预定切缘后方,用5-0无创带针线结扎缝合肝左叶,并切除荷瘤的肝左外叶部分,切缘距肿瘤边缘大于0.5 cm。手术过程中及术后保证室内温度,并用保温毯和碎木屑及时给小鼠保温,避免由于温度过低导致小鼠无法复温而致的小鼠死亡。
1.3检测指标
1.3.1自主活动度每次实验均在上午9时对小鼠进行自主活动度检测,以便观察手术对小鼠刺激的最大影响。将小鼠按标号依次放置于自发活动仪箱底中心位置,一个自发活动箱内放置一只小鼠,放置稳妥后开始计时连续观察并摄像记录小鼠活动情况,5 min后停止,记录其自发活动总路程。确保自主活动仪置于隔音,光强度温和、湿度适宜的行为实验室内,减少环境对小鼠的影响,实验。
1.3.2小鼠脾淋巴细胞收集颈椎脱臼处死小鼠, 75%乙醇中消毒后,超净台中无菌剥离小鼠脾脏,用 RPMI 1640 完全培养基冲洗两次后将小鼠脾脏置于培养皿中研磨并将脾细胞悬液静置5 min,取2 ml细胞悬液放入10 ml无菌离心管中,离心,1500 r/min*5 min。去上清,缓慢滴入淋巴细胞裂解液(1X)3 ml,反应1-2 min后加1 ml PBS终止反应,用移液枪混匀后离心1 500 r/min*5 min,加入4 ml 1640培养基洗涤1次,离心1 500 r/min *10 min。倾倒上清液,加入含10%胎牛血清的完全1640培养基或PBS。
1.3.3脾淋巴细胞增殖将上述制备好的脾淋巴细胞移入10 ml离心管中,加含10%胎牛血清的完全1640培养基调整至107cell/ml,接种在96孔板中,每孔100 μl,每组设四个副孔,共分10个组,即5组小鼠的脾淋巴细胞分为淋巴细胞组和淋巴细胞+刺激剂组。刺激剂为多克隆刺激剂刀豆蛋白A(concanavalin A,ConA),其终浓度为5 μg/ml。适当细胞浓度后置入37℃,5%的CO2孵育箱中培养。
1.3.4脾淋巴细胞表面CD4+与CD8+的表达
将上述制备好的脾淋巴细胞移入10 ml离心管中,加PBS稀释至106cell/ml后吸取1 ml至流式管中,加入相应抗体,4℃孵育30 min,离心1 500 r/min*5 min,加入PBS洗涤,离心后加入PBS上机检测。
1.4统计学处理
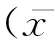
2结果
2.1术后不同时间小鼠自发活动度的区别
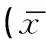
表1 术后不同时期小鼠小鼠自发活动±s,n=5)
注:A:术后第1天,B:术后第3天,C:术后第5天,D:术后第7天,E:术后第9天,F:正常小鼠。下同。
与正常小鼠比较差异有统计学意义:*P<0.05
术后第1、3、5、7、9天小鼠及正常小鼠自发活动总路程见图1、表1。由表1可见各组小鼠自发活动水平均小于正常小鼠,术后第7天组小鼠自发活动水平与正常组小鼠差异较前3组小,但结果经统计学分析后,仅术后第1天组小鼠与正常组小鼠自发活动度相比具有统计学意义(P<0.05),其他各组小鼠间均无统计学差异。
注:A:术后第1天,B:术后第3天,C:术后第5天,D:术后第7天,E:术后第9天,F:正常小鼠。
图1小鼠自发活动检测
2.2术后不同时间小鼠淋巴细胞增殖能力的区别
术后第1、3、5、7、9天小鼠淋巴细胞增殖能力见表2,正常小鼠为172.38±0.21%。可知各组小鼠淋巴细胞增殖能力均小于正常小鼠,术后第1天组小鼠淋巴细胞增殖能力远小于正常组小鼠组(P<0.01),术后第3天组小鼠与正常组小鼠相比也存在统计学差异(P<0.05),其他各组小鼠间均无统计学差异。
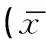
表2 术后不同时期小鼠淋巴细胞增殖能力±s,n=5)
注:与正常小鼠比较差异有统计学意义:*P<0.05,ΔP<0.01
2.3术后不同时间小鼠CD4+/CD8+比例的区别
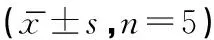
表3 术后不同时期小鼠CD4+/CD8+比例
注:与正常小鼠比较差异有统计学意义:ΔP<0.01;与D组比较差异有统计学意义:#P<0.01
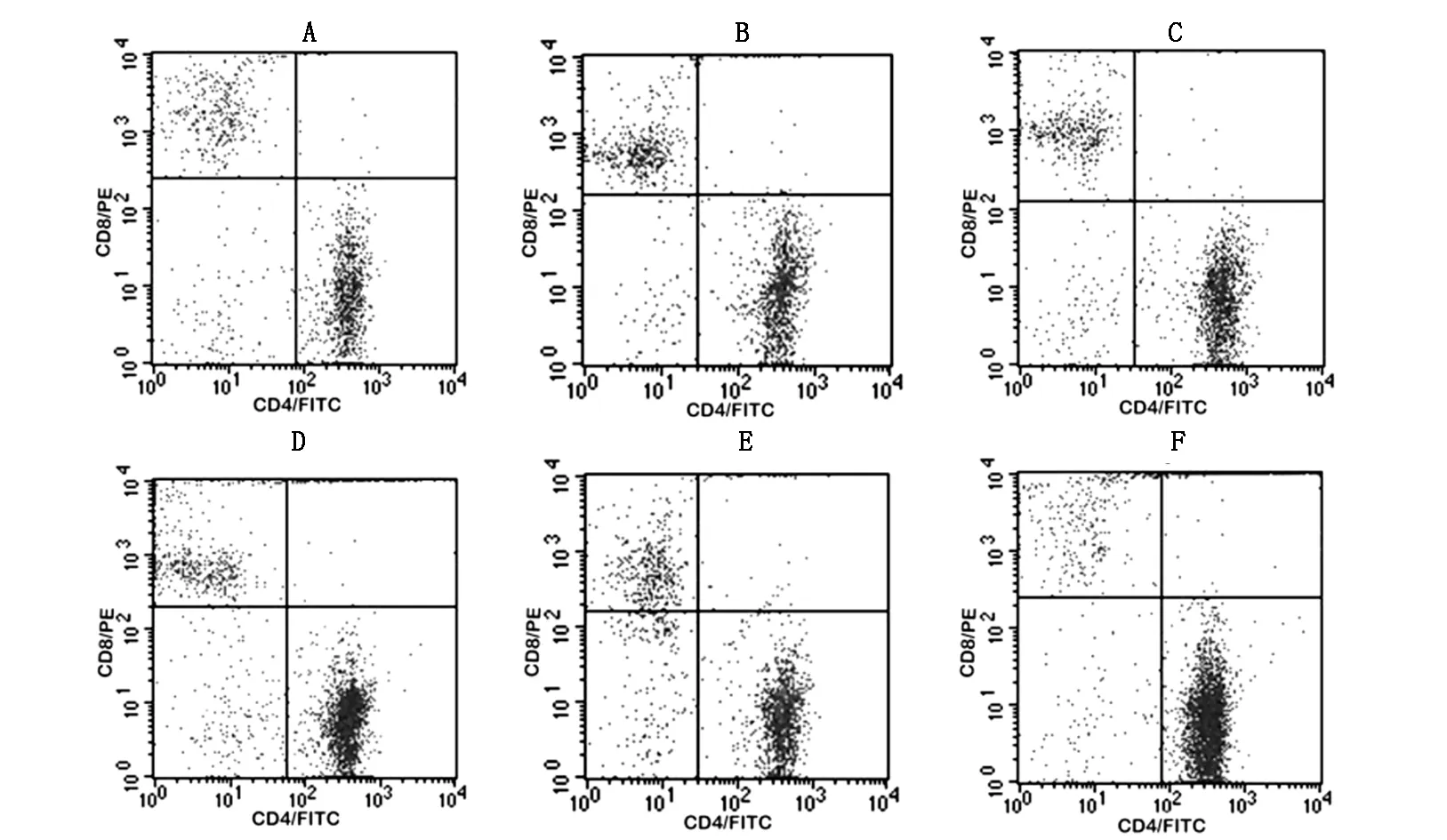
注:A:术后第1天,B:术后第3天,C:术后第5天,D:术后第7天,E:术后第9天,F:正常小鼠。
术后第一天组小鼠淋巴细胞CD4+/CD8+比值为1.61±0.33,正常组小鼠为5.46±1.07,两者之间差异有统计学意义(P<0.01)。且术后第7天组小鼠也高于术后第一天组小鼠,差异具有统计学意义(P<0.01),见表3,图2。
3讨论
围手术期是围绕手术的一个治疗经过,具体包括手术前期、手术中期、手术后期,其中,手术后期包括术后的7-12 d的一段时间[5],围术期患者的免疫功能往往因手术过程中引起的应激状态等而受到抑制[6]。对肿瘤术后患者而言,短暂的术后免疫抑制期可能会对残留的肿瘤细胞产生巨大的影响,大量动物实验结果证实手术能促进肿瘤转移,这些研究同时表明,在手术中受到越大的创伤,则术后越有可能发生其他部位的转移[7]。小鼠肝原位瘤切除术模型中肝癌株的形态特点和病理组织变化较人类肝细胞癌而言极其类似,与其他模型相较[8-11],较好的模拟人类肝细胞癌的手术过程。有大量文献报道这一模型的建立及生物学特性,该模型中对小鼠进行两次开腹手术,对小鼠造成巨大创伤,小鼠在围手术期免疫抑制在何时得以改善却缺乏相关研究。本研究通过制备小鼠肝原位瘤模型[4],观察术后小鼠的一般状态和免疫功能发现,小鼠在术后第1天一般状态较差,与正常小鼠相比自发活动能力较弱,体内的淋巴细胞增殖减弱,CD4+/CD8+比例失调。在第7天后,虽然各个指标显示仍较正常小鼠有较大差距,但和第1天、第3天、第5天比较,有很大程度的改善。
在已有术后康复评价指标中,自发活动度作为行为学经典指标被广泛应用[12,13],其测量是通过记录视频并跟踪评估光电束断裂的频率或小鼠活动的距离进行的。自发活动度检测作为无创检测手段,常用于检测小鼠自发活动度和探寻度,已被广泛应用于评价各种实验干预如基因改变和药物干预。且相较于小鼠状态评分表,如是否颤抖,是否舔舐伤口,步态是否正常等更客观,可量化。此外,术后第1天,第3天,第5天,小鼠自发活动度较第7天和正常小鼠有一定差距,可能是由于术后伤口疼痛和术间麻醉对小鼠造成影响,降低其自发活动度。在7 d后,小鼠自发活动度仍低于正常小鼠,但差距较小,第7天和其9天波动不大,说明可能小鼠虽仍未完全恢复,但已与正常状态类似,可进行如给药,运动等相应后续干预。
手术创伤能介导不同程度的免疫功能抑制,包括CD3+下降及CD4+/CD8+比值失调,这是术后感染发生率上升的重要原因[14]。本研究发现小鼠在术后机体淋巴细胞增殖减少,CD4+/CD8+比值失调的情况,表明手术创伤和术后疼痛等应激反应对免疫系统产生了抑制作用,在第1天,第3天尤为明显,与正常组小鼠淋巴细胞增值能力相较差异具有统计学意义,且第7天后,小鼠的免疫功能逐步上升恢复,状态较为稳定,CD4+/CD8+比例与术后第1天组小鼠相比较具有统计学意义。
本研究结果表明,小鼠术后自发活动度为代表的行为学差异较正常小鼠有一定差距,术后第1天较为明显,且免疫功能也有所下降,尤其是第1天和第3天,但也可以看到,小鼠的免疫功能在逐步恢复,尤其是术后第7天,与第1天小鼠的免疫功能差距较大。但在本实验中,除术后第1天组和术后第3天组小鼠较正常组小鼠,第1天组小鼠和第7天组小鼠部分指标有差异之外,其他组小鼠之间的CD4+/CD8+等各项指标的差异并无统计学意义,这可能由于本实验小鼠例数较少,检测指标仍有待完善,以全面观察小鼠免疫功能及其他状态恢复情况。
综上所述,肝原位瘤切除术对小鼠造成了较大的应激损伤,产生了免疫抑制,小鼠在术后与人类围手术期相似,也需要一定的时间逐步恢复正常状态。围手术期内,在小鼠免疫功能低谷予以干预和在小鼠免疫功能峰值予以干预,对免疫功能的恢复是否有差异还需进一步实验探寻。
参考文献:
[1]Chen W.Cancer statistics:updated cancer burden in China Preface[J].Chinese Journal of Cancer Research,2015,27(1):1.
[2]Llovet J M.Updated treatment approach to hepatocellular carcinoma[J].Journal of Gastroenterology,2005,40(3):225.
[4]韩克起,顾伟,胡侠,等.小鼠肝癌原位移植模型的建立及生物学特性[J].Journal of Integrative Medicine,2004,2(5):372.
[5]Hegarty J,Walsh E,Burton A,et al.Nurses' knowledge of inadvertent hypothermia[J].Aorn Journal,2009,89(4):701.
[6]高立生,刘宁宁,邵雪斋.肿瘤对机体免疫功能影响的研究进展[J].河北医学,2008,14(9):1101.
[7]Tsuchiya Y,Sawada S,Yoshioka I,et al.Increased surgical stress promotes tumor metastasis[J].Surgery,2003,133(5):547.
[8]Veena Sharma,Pracheta Janmeda,Ritu Paliwal,et al.金刚纂提取物对N-亚硝基二乙胺诱导小鼠肝癌的抗肝毒性作用(英文)[J].Journal of Integrative Medicine,2012(11):1303.
[9]李晓娟,汤紫荣,李蓓,等.近交系小鼠移植性肝癌模型建立及对比分析[J].中国比较医学杂志,2014,24(9):40.
[10]宋祥福,吕喆,刘欣,等.两种方式接种肝癌模型的比较[J].中国比较医学杂志,2007,17(2):96.
[11]赵文秀,张正奇,许雅苹,等.不同流式抗体分选小鼠原位肝癌模型中髓系来源抑制性细胞的比较[J].中国实验动物学报,2013,21(4):42.
[12]Zacharko R M,Macneil G,Mendella P D,et al.Proactive influence of a surgical stressor on locomotor activity,exploration and anxiety-related behaviour following acute footshock in the mouse[J].Brain Research Bulletin,1999,48(3):283.
[13]Schuler B,Rettich A,Vogel J,et al.Optimized surgical techniques and postoperative care improve survival rates and permit accurate telemetric recording in exercising mice[J].Bmc Veterinary Research,2009,5(3):250.
[14]Khan K N,Masuzaki H,Fujishita A,et al.Peritoneal fluid and serum levels of hepatocyte growth factor may predict the activity of endometriosis[J].Acta Obstetricia Et Gynecologica Scandinavica,2006,85(4):458.
基金项目:国家自然科学基金项目(编号:81503632)
*通讯作者
文章编号:1007-4287(2016)06-0883-04
中图分类号:R735.7
文献标识码:A
(收稿日期:2015-12-09)
The influence of the resection of the tumor in situ liver on general state and the immune function in mice
ZHAOTong,LÜCan,HANMeng-fei,etal.
(DepartmentofTCM,SecondMilitaryMedicalUniversity,Shanghai200433,China)
Abstract:ObjectiveObserve the influence of the resection of the tumor in situ liver on general state and the immune function in mice.MethodsDo the resection of the tumor in situ liver in mice to observe the operation of spontaneous activity of mice after different time node,ability of lymphocyte proliferation and the influence of CD4+/CD8+ ratio and other indexes.ResultsCompared with the normal mice,spontaneous activity in mice reduce on the first postoperative day,with statistical significance(P<0.05);Compared with the normal mice,the reproductive capacity of lymphocytes in mice reduce on the first and third day,with statistical significance(P<0.05);Compared with the first postoperative day mice,CD4+/CD8+ lymphocytes in mice increase on the seventh postoperative day and the normal mice,with?statistical significance(P<0.01).ConclusionResection of the tumor in situ liver caused greater stress injury and immunosuppression in mice.Mice are similar to human perioperative after surgery,also need a certain amount of time gradually returned to normal state.
Key words:Mice;Resection of the tumor in situ liver;Spontaneous activity;Immune function

