秦岭地区不同林分土壤微生物群落代谢特征
曹永昌,谭向平,和文祥,*,耿增超,刘 帅,佘 雕,侯 林
1 西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,杨凌 712100 2 西北农林科技大学水土保持研究所,杨凌 712100 3 西北农林科技大学林学院,杨凌 712100
秦岭地区不同林分土壤微生物群落代谢特征
曹永昌1,谭向平1,和文祥1,*,耿增超1,刘帅1,佘雕2,侯林3
1 西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,杨凌712100 2 西北农林科技大学水土保持研究所,杨凌712100 3 西北农林科技大学林学院,杨凌712100
摘要:利用BIOLOG微孔板法研究了秦岭山脉的锐齿栎(Quercus aliena var. acutidentata)、油松(Pinus tabuliformis)、华山松(Pinus armandii)、松栎混交、云杉(Picea asperata)6个林地5种典型林分土壤微生物群落代谢特征。发现:(1)5种典型林分中,华山松的平均颜色变化率(AWCD)最高,然后是锐齿栎1>云杉>油松>锐齿栎2>松栎混交。位于不同林场的锐齿栎林地土壤AWCD值差异较大;(2)土壤微生物功能多样性指数与平均颜色变化率表现一致,6种林分之间差异显著,且不同的林分土壤微生物对6种碳源利用差异较大。(3)主成分分析显示各土壤微生物功能多样性具有显著差异,其综合因子得分为华山松>锐齿栎1>油松>云杉>锐齿栎2>松栎混交。(4)冗余分析表明土壤pH、有机质、全氮、碱解氮、速效磷和速效钾的综合作用对土壤微生物群落功能多样性有显著影响,其中速效磷和pH与土壤微生物功能多样性最密切。
关键词:秦岭;土壤微生物;代谢特征;BIOLOG
土壤微生物作为凋落物的主要分解者,是森林土壤中最具活力的部分。土壤微生物的分布和活性是森林生产实践综合评价的主要依据之一[1],其特征受到水热条件、季节动态以及海拔、特别是树种组成的影响[2- 4]。土壤微生物对于植被以及环境因子的响应机制因生态系统而异[5]。即便在相同的气候条件和土壤类型下,不同植被下的土壤微生物仍然存在较大差异[3],因为森林中的主要树种可以通过凋落物的数量和质量以及根系分泌物来影响或控制土壤微生物群落的结构和功能[6]。对森林土壤微生物代谢特征的探讨,有助于深入研究森林土壤有机质转化的生物化学机制。
秦岭是我国南北的气候分界线,南北气候差异大,北坡和南坡分属暖温带半湿润气候带和亚热带湿润气候带。其独特的地理位置和复杂的自然环境特点孕育了丰富的天然植物资源,在不同的海拔高度上生长着一些典型的植物,如海拔1400—1800m的锐齿栎,1400—2300m的华山松,1500—2400m的油松,1800m以上的云杉和松栎混交[7]。作为我国地理的代表性山区,但是对秦岭地区林地土壤微生物群落代谢特征研究较少,仅限于对微生物数量的描述[8]。而且在过去的几十年里,该地区森林公园的开发以及土地利用和全球气候的不断变化,直接或间接影响森林土壤营养元素的周转,亟需探明该地区不同典型林分下土壤环境和微生物群落活性的特征及其间关系。
BIOLOG微孔板法是一种以微孔板碳源利用为基础的定量分析方法,可更简单、快速的描述微生物群落代谢特征[9],并广泛应用于评价土壤微生物群落的功能多样性[10- 11]。为此本文拟以秦岭地区五种典型林分为对象,采用BIOLOG微孔板法研究不同林分下土壤微生物代谢特征,以期探明:(1)揭示不同天然林分土壤微生物主要碳源类型以及代谢特征;(2)分析土壤微生物代谢特征与环境因子之间的内在联系。最终为加强秦岭地区天然林生态系统碳循环及土壤肥力的保持提供基础数据和理论依据。
1材料与方法
1.1供试材料
1.1.1供试土样
在秦岭山脉的马头滩林场以及辛家山林场中选取5种典型林分:锐齿栎(Quercusalienavar.acutidentata)、油松(Pinustabuliformis)、华山松(Pinusarmandii)、松栎混交及云杉(Piceaasperata)的6个典型林地(表1)。在每个林地中分别选取20m×20m的3个标准样方,每个样方中设5个采样点(共15个采样点),采样时去除表层的枯枝落叶,S型采取0—10cm的土样,将每个样方中5个采样点所采集到的土壤样品混匀,一部分置于4℃冰箱中保存备用,测定土壤微生物多样性;另部分土壤风干,过筛,常规方法分析土壤基本理化性质,结果见表2。
1.1.2采用BIOLOG微孔板法测定细菌群落代谢特征
取4℃下保存新鲜土样,过筛,称取相当5g烘干土重的新鲜土样加入内有45 mL 0.85%灭菌盐水的三角瓶中后,加无菌棉花塞,振荡30min,转速为200r/min。将得到的微生物悬浮液按逐步稀释法,依次稀释为10-2、10-3梯度液。用10-3稀释液接种ECO生态测试板,接种量为150μL,每样1板,每板3次重复。将接种好的测试板加盖,在(25±1)℃下连续培养120h,每隔12h用BIOLOG自动读数装置在590nm下读数。其中的31种单一碳源分为6大类[12]。含氨基酸类(6种)、羧酸类(5种)、糖类(12种)、胺类(2种)、多聚物类(4种)和芳香化合物类(2种)[13]。
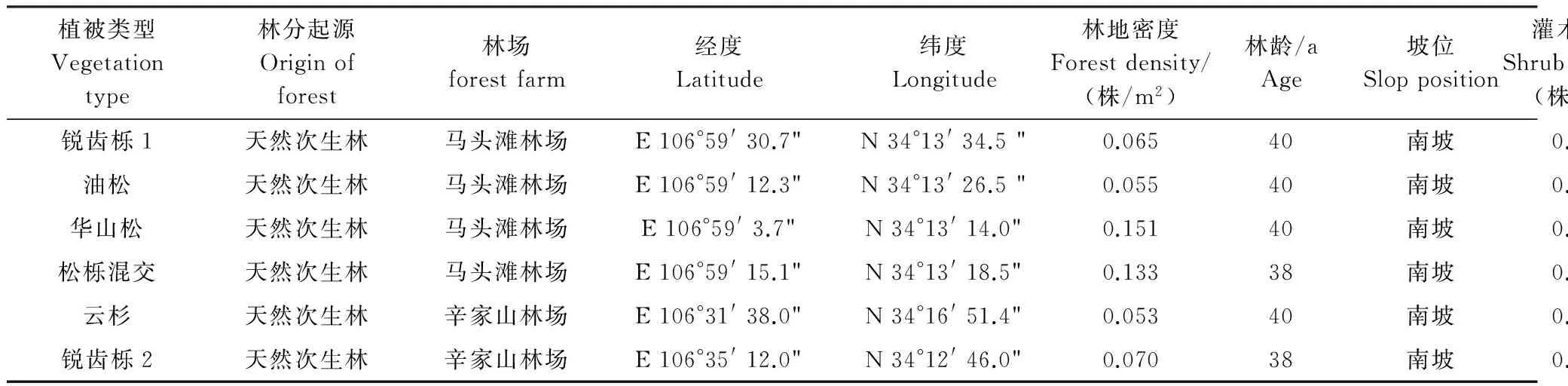
表1 样地基本信息
锐齿栎Quercusalienavar.acutidentata;油松Pinustabuliformis;华山松Pinusarmandii;松栎混交 mixed forests;云杉Piceaasperata

表2 供试土样理化性质
数值为平均值(3次重复)±标准误差
1.2数据处理
1.2.1平均颜色变化率(AWCD)
式中,Ci为各反应孔在590nm下的光密度值;R为ECO板对照孔的光密度值,Ci-R小于零的孔,计算中记为零,即:Ci-R≥0。
1.2.2Gompertz方程曲线[14]。
式中,A为最大吸光度,λ为到达指数增长期所需时间(时滞相),Um为最大吸光度变化率。
1.2.3群落丰富度指数(S)
用碳源代谢孔的数目(AWCD> 0.2,则代表该孔碳源被利用,该孔即为反应孔)表示群落丰富度指数。
1.2.4Shannon多样性指数(H′)及McIntosh多样性指数(U)
式中,Pi为每一孔吸光度除以所有孔吸光度的和。
Ni=Ci-R
1.2.5Gini多样性指数(D)
1.3数据统计
试验数据采用Microsoft Excel 2003进行数据处理和制图,应用SPSS 12.0进行Gompertz方程拟合、单因素方差(One-way ANOVA)分析及主成分分析,分析不同样地间各指标的差异显著性以及对碳源利用模式的差异,采用CANOCO 4.5进行冗余分析(RDA)和制图,分析环境因子对土壤微生物群落碳源利用模式的影响。
2结果与分析
2.1ELISA反应颜色变化率(AWCD)

图1 六个处理平均颜色变化率Fig.1 AWCD of six treatments
平均颜色变化率(AWCD)表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落生理功能多样性。供试土壤AWCD值如图1显示,随培养时间的延长AWCD增大,在24 h之前各处理的AWCD很小,为0.004—0.018,说明在24h之内碳源基本未被利用;培养24h后AWCD快速升高,反映出此后碳源被大幅度利用。在相同培养时间内,AWCD值为华山松>锐齿栎1>云杉>油松>松栎混交>锐齿栎2。
将AWCD值与时间按Gompertz方程曲线进行拟合,结果决定系数R2均大于0.99(表3),可见最大吸光度以及最大吸光度变化率均是华山松最大,其次是锐齿栎1和云杉,而松栎混交和锐齿栎2最低,这表明华山松对31种碳源的利用最快,增长斜率最大。松栎混交和锐齿栎2对31碳源的利用最慢,增长斜率最小。时滞相即达到指数增长期所需要的时间表现为华山松<云杉<锐齿栎1<锐齿栎2<松栎混交<油松,这说明华山松林地土壤微生物能很快的利用碳源,而松栎混交和油松对碳源的利用较慢。
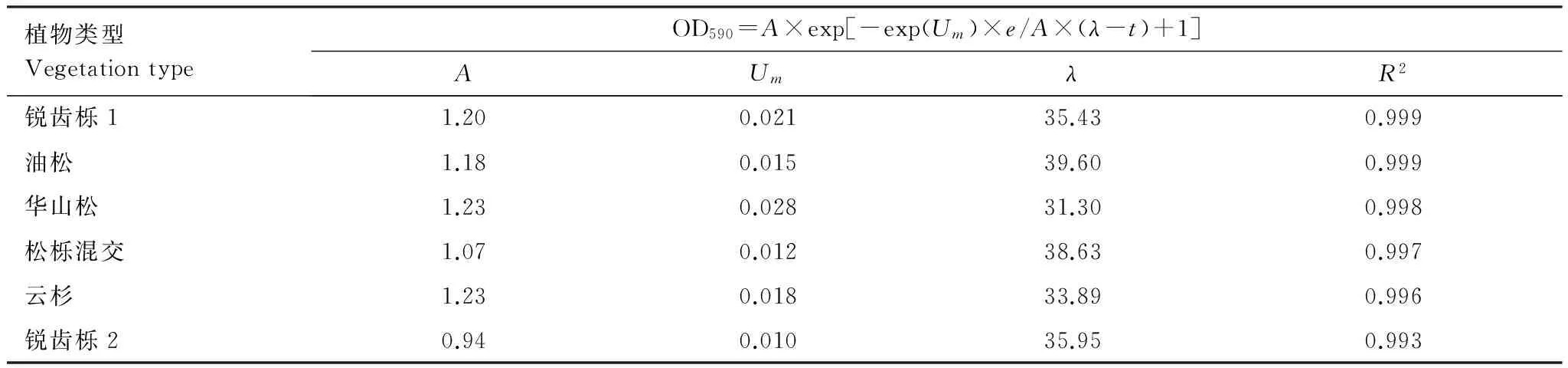
表3 Gompertz方程曲线拟合参数
2.2土壤微生物群落多样性指数
土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征。从表4可看出,BIOLOG微平板培养72h时,华山松的AWCD最高,其次是锐齿栎1,松栎混交和锐齿栎2最低;除松栎混交与锐齿栎2外,其它林区之间均差异显著(P<0.05),这说明华山松林地土壤微生物对碳源消耗量最多,微生物活性最高,锐齿栎1、云杉、油松次之,松栎混交和锐齿栎2土壤微生物对碳源消耗最少,微生物活性较小。且不同处理的微生物群落Shannon指数(H)、丰富度指数(S)、McIntosh指数(U)、Gini指数(D)的变化表现出与AWCD类似的规律,即华山松>锐齿栎1>云杉>油松,松栎混交和锐齿栎2最低。表明华山松的土壤微生物群落丰富度和功能多样性最高,其次是锐齿栎1、云杉、油松,锐齿栎2和松栎混交最低。并且从表1可以看出同一林分不同地理位置对土壤群落丰富度和功能多样性影响较大,锐齿栎1土壤群落丰富度和功能多样性要远大于位于锐齿栎2,可能是土壤性质(如有机质相差41%)差异较大所致(表2)。
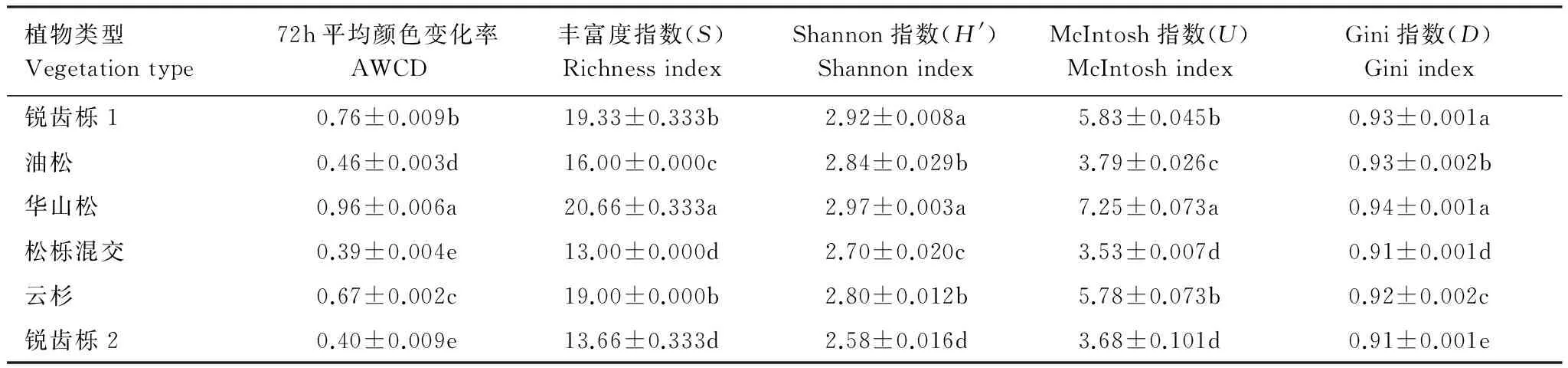
表4 土壤微生物群落多样性指数分析
数值为平均值(3次重复)±标准误差;同列不同字母表示差异显著(P<0.05)
2.3土壤微生物对碳源的利用
土壤微生物对不同碳源的利用反映了微生物的代谢功能类群,研究土壤微生物对不同碳源利用能力的差异,可深入了解不同林分下土壤微生物群落代谢特征。表5看出,不同林分下土壤微生物对六类碳源的利用差异显著,其中锐齿栎1、华山松和云杉林地土壤微生物对碳源的利用主要集中在糖类和氨基酸类,锐齿栎1和华山松对羧酸类的利用程度较低,而云杉对芳香类的利用程度较低。油松和锐齿栎2对碳源的利用主要集中在氨基酸类和多聚物类,对芳香类的利用程度较低。松栎混交对碳源的利用主要集中在胺类和多聚物类,对羧酸类的利用程度较低。可见,不同林分土壤微生物碳代谢群落结构有所不同。
2.4微生物群落功能的主成分分析
主成分分析揭示了不同林地中土壤微生物群落对碳源的利用模式的差别,用培养72h的吸光度数值进行主成分分析(PCA),结果(表6)表明前3个主成分方差贡献率分别为45%、22%和16%,累积方差贡献率达到84%。从中提取可以聚集单一碳源变量的数据变异(累积方差贡献率)为67%的前2个主成分PC1、PC2(特征根值为14.06和6.74)来分析细菌群落功能多样性。由图2可见,6个处理在主成分坐标体系中分布差异十分明显。PC1的方差贡献率最大,主要综合了华山松、锐齿栎1和松栎混交的变异。PC2主要集中了云杉的变异,PC3则综合了油松和锐齿栎2的变异。华山松处于PC1的正端,典型变量值达6.85,油松处于PC2的最正端。PC1典型变量值差异极显著,这种差异表现在: 除了松栎混交与锐齿栎2之间差异不显著外,其它处理相互之间差异均显著。PC2典型变量值差异也达到极显著水平,表现在云杉与其它林分差异显著,锐齿栎1、松栎混交与其它林分差异显著,但是锐齿栎1和松栎混交两者之间差异不显著,油松、华山松和云杉之间差异不显著。六种林区土壤典型变量值的变异(离散)都很小(图2)。
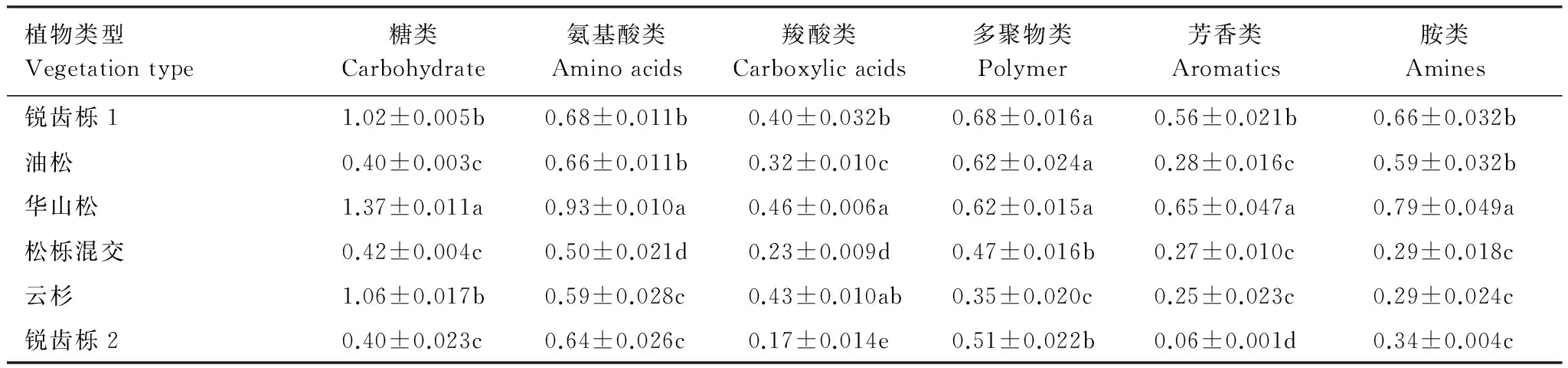
表5 土壤微生物培养72h时6类碳源利用的平均吸光度
数值为平均值(3次重复)±标准误差;同列不同字母表示差异显著(P<0.05)

表6 主成分特征根
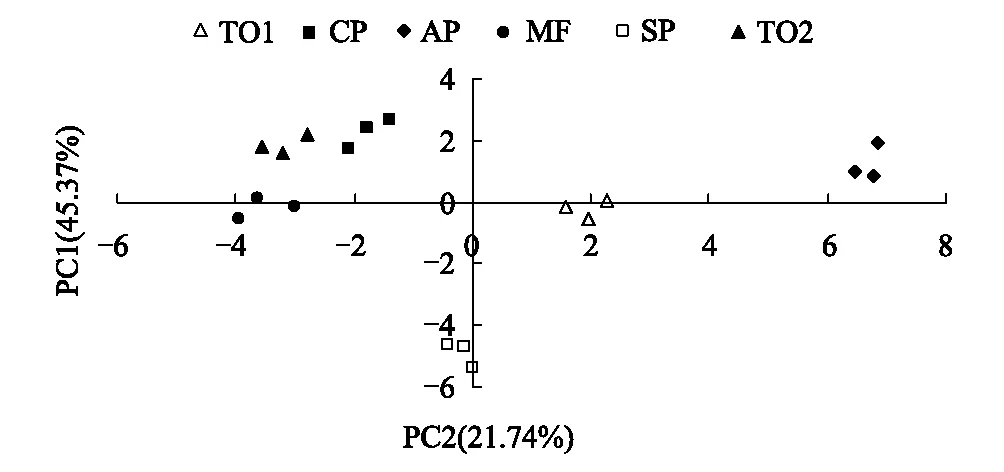
图2 不同林木土壤细菌群落主成分分析 Fig.2 Principal component analysis of soil bacteria communities for different tree species
对主成分得分大于0.25的碳源进一步分析,PC1轴上优势利用碳源是D-纤维二糖(糖类)和D-苹果酸(羧酸类);PC2轴上的优势碳源是L-精氨酸(氨基酸类)、肝糖(多聚物类)和苯乙胺(胺类);PC3轴上的优势利用碳源是D-木糖/戊醛糖(糖类)和肝糖(多聚物类)。
表7显示6种林分主成分分析综合得分华山松最高,其次是锐齿栎1,而松栎混交与锐齿栎2综合得分最低。
2.5冗余分析
通过冗余分析常可用来确定样地中环境因子对土壤微生物群落碳源利用模式的影响。结果(图3)表明,土壤pH、有机质、全氮、碱解氮、速效磷和速效钾的综合作用对土壤微生物群落功能多样性的影响很显著。根据箭头的长度,有机质、全氮、碱解氮、速效磷和速效钾对微生物碳源利用的影响都很大。其中速效磷和pH几乎与所有碳源的箭头呈锐角,说明它们之间呈正相关,有机质、全氮、碱解氮以及速效钾与大多数碳源的箭头呈锐角,因此呈正相关。

表7 6个处理主成分综合得分
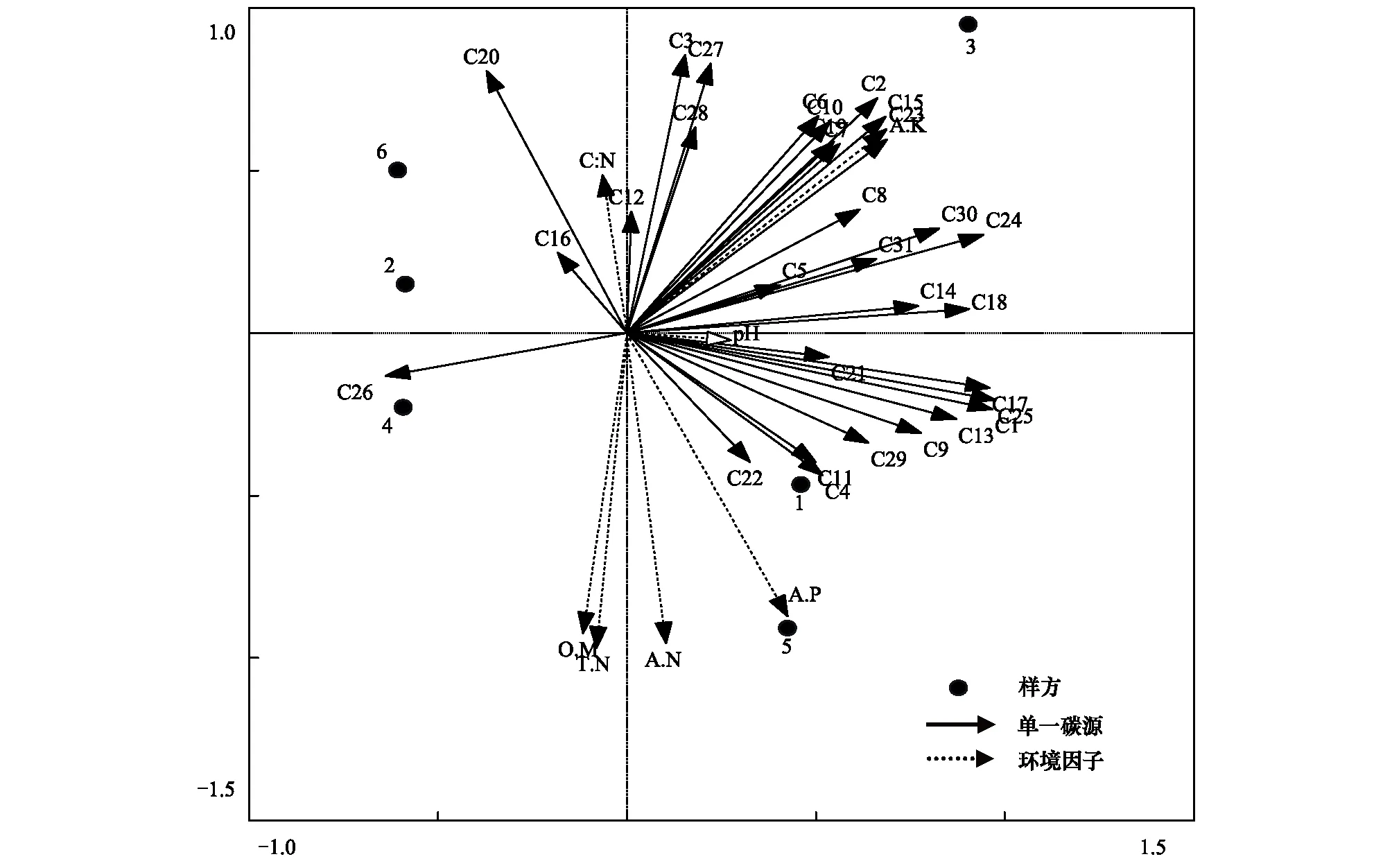
图3 31个单一碳源与环境因子的冗余分析Fig.3 Redundancy analysis of 31 sole-carbon sources and environmental variables
3讨论
在本研究中,位于马头滩林场4种林分中华山松(针叶林)土壤微生物群落代谢特征指标大于锐齿栎1(阔叶林),但通常认为阔叶林土壤微生物功能多样性要高于针叶林土壤微生物功能多样性。这一现象的产生可能是由于林分结构的极大差异所造成的,在6个采样地中,华山松海拔较低,由于采样点靠近河流,造成华山松林地湿度较大,其结果是华山松林下表层土含水量(29.2%)相对于其它样地较高;其次华山松林地的灌木(0.528株/m2)以及草本科植物(0.960株/m2)远远高于锐齿栎1林地的灌木(0.383株/m2)以及草本科植物(0.258株/m2)。Waid等人认为植被的类型、数量和化学组成可能是土壤生物多样性变化的主要推进力量[15]。且华山松林地密度(0.151 株/m2)要远远高于锐齿栎1(0.065 株/m2),较高的林地密度导致华山松凋落物的产生量(6.068t/hm2)要高于锐齿栎1(2.716t/hm2),凋落物作为土壤有机质输入的主要来源,其质量和数量必然会对土壤微生物群落组成产生影响[16- 17]。且华山松根系在0—20cm的土层中分布较多[18],研究表明林木根系对其周围的土壤微生物的数量和活性具有重要的影响[19]。多方面的林分结构差异的综合作用可能是造成了华山松土壤微生物功能多样性高于锐齿栎1的部分原因。辛家山林场中云杉土壤微生物群落代谢特征指标大于锐齿栎2,且不同的地理位置对同一林分土壤微生物功能多样性影响较大,在林分结构差异不大的情况下,养分组成是影响土壤微生物群落结构的主要因素[17]。锐齿栎2的土壤类型虽然为棕壤,但是由于河流冲积导致土壤含沙量较高,与云杉林和锐齿栎1相比,土壤养分含量相对低,养分组成差异较大,微生物种群数量和多样性与土壤养分的含量密切相关[20]。并且植被往往通过影响土壤基本理化性质影响土壤生物区系[21]。一般而言,对于同一土壤而言,养分含量越高,土壤中微生物的数量和多样性也就越高。所以,不同的土壤类型以及土壤养分含量的差异造成了林分土壤微生物功能多样性的巨大差异。
这5种典型林分下土壤微生物的物种丰富度和优势种群均差异显著,总体的功能多样性均有显著性的差异。这可能是因为林分以及地表植物的不同而造成的,林下树种的改变对地下生态系统微生物功能多样性有明显影响[22]。以往的研究表明,微生物群落结构和功能的差异与来源与不同优势树种的枯枝落叶的量和生物化学组成有关,同时与根系分泌物的关系也十分密切[23],根系分泌物对土壤微生物的分布有重要作用[24]。通过对锐齿栎、油松、华山松、云杉和松栎混交5种林地土壤微生物对不同类型碳源的相对利用程度的分析可以看到不同林地对相同碳源的利用程度上存在明显的差异。通过微生物对不同碳源利用的差异分析表明,不同林分土壤微生物的主要功能代谢类群有很大不同,进而可以深入发现不同林分土壤微生物的群落代谢特征存在显著差异。胡婵娟等人发现不同人工林对相同碳源的利用上存在明显的差异,土壤微生物利用率最高的碳源分别为糖类、氨基酸类和羧酸类物质[25]。PCA分析结果发现各林地土壤微生物对碳源的利用是有显著差异的,用RDA对可能造成差异的因子做进一步的分析,发现土壤理化性质(土壤有机质、pH、全氮、碱解氮、速效磷、速效钾)与土壤微生物功能多样性关系密切。这些环境因子的差异所导致的空间异质性则与土壤微生物群落有直接的关系。研究不同林分对土壤功能多样性的影响可以从侧面反映土壤基本理化性质对土壤微生物功能多样性的综合作用。
4结论
通过采样分析,对秦岭地区5种典型林分的土壤微生物功能多样性可得出以下结论:
(1)不同林分对土壤微生物功能多样性以及微生物群代谢特征影响显著,其中华山松土壤微生物功能多样性最高,并且处于不同地理位置相同林分的土壤微生物功能多样性差异显著。
(2)6种林分中,根据主成分分析多样性指数以及综合得分等多种分析可看出林区土壤微生物功能多样性排名从高到低排序为:华山松>锐齿栎1>油松>云杉>松栎混交>锐齿栎2。
参考文献(References):
[1]许光辉, 郑洪元, 张德生, 卢耀波, 李玉坤, 张淑贤, 刘增柱, 吴文芳, 赵振英, 李凤珍, 刘瑞君. 长白山北坡自然保护区森林土壤微生物生态分布及其生化特性的研究. 生态学报, 1984, 4(3):207- 223.
[2]Kara Ö, Bolat I. Soil microbial biomass C and N changes in relation to forest conversion in the Northwestern Turkey. Land Degradation & Development, 2008, 19(4): 421- 428.
[3]Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biological Reviews, 1992, 67(3): 321 - 358.
[4]Van Gestel M, Merckx R, Vlassak K. Microbial biomass and activity in soils with fluctuating water contents. Geoderma, 1993, 56(1): 617- 626.
[5]隋心. 典型温带森林土壤有机碳自然积累与微生物维持关系[D].北京:中国科学院大学, 2013.
[6]Ayres E, Steltzer H, Berg S, Wallenstein M D, Simmons B L, Tree species traits influence soil physical, chemical, and biological properties in high elevation forests. PLoS one, 2009, 4(6): e5964.
[7]赵永华, 雷瑞德, 何兴元, 贾夏. 秦岭锐齿栎林种群生态位特征研究. 应用生态学报, 2004, 15(6):913- 918.
[8]崔芳芳, 刘增文, 付刚段, 而军, 高文俊. 秦岭山区几种典型森林的土壤微生物特征及其对人为干扰的响应. 西北林学院学报, 2008, 23(2):129- 134.
[9]Selmants P C, Hart S C, Boyle S I, Stark J M. Red alder (Alnusrubra) alters community-level soil microbial function in conifer forests of the Pacific Northwest, USA. Soil Biology and Biochemistry, 2005, 37(10): 1860- 1868.
[10]Grayston S J, Campbell C D. Functional biodiversity of microbial communities in the rhizospheres of hybrid larch (Larixeurolepis) and Sitka spruce (Piceasitchensis). Tree Physiology, 1996, 16(11- 12): 1031- 1038.
[11]Bossio D A, Scow K M. Impact of carbon and flooding on the metabolic diversity of microbial communities in soils[J]. Applied and Environmental Microbiology, 1995, 61(11): 4043- 4050.
[12]Papatheodorou E M, Efthimiadou E, Stamou G P. Functional diversity of soil bacteria as affected by management practices and phenological stage ofPhaseolusvulgaris. European Journal of Soil Biology, 2008, 44(4): 429- 436.
[13]Kong W D, Zhu Y G, Fu B J, Marschner P, He J Z. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community. Environmental Pollution, 2006, 143(1): 129- 137.
[14]Verschuere L, Fievez V, Van Vooren L, Verstraete W. The contribution of individual populations to the Biolog pattern of model microbial communities. FEMS microbiology ecology, 1997, 24(4): 353- 362.
[15]Waid J S. Does soil biodiversity depend upon metabiotic activity and influences?. Applied Soil Ecology, 1999, 13(2): 151- 158.
[16]Chapin III F S, Chapin M C, Matson P A, Vitousek P M. Principles of Terrestrial Ecosystem Ecology. Berlin: Springer, 2011.
[17]陈法霖, 郑华, 欧阳志云, 张凯, 屠乃美. 土壤微生物群落结构对凋落物组成变化的响应. 土壤学报, 2011, 48(3): 603- 611.
[18]赵忠, 李鹏, 王乃江. 渭北黄土高原主要造林树种根系分布特征的研究. 应用生态学报, 2000, 11(1): 37- 39.
[19]杨玉盛, 何宗明, 邹双全, 俞新妥. 格氏栲天然林与人工林根际土壤微生物及其生化特性的研究. 生态学报, 1998, 18(2): 198- 202.
[20]傅伯杰, 陈利顶, 王军, 孟庆华, 赵文武等. 土地利用结构与生态过程. 第四纪研究, 2003, 23(3): 247- 255.
[21]Zhang X C, Shao M A. Soil nitrogen loss by erosion as affected by vegetation cover and comprehensive managements in Zhifanggou catchment of hilly Loess Plateau. Acta Geographica Sinica: Chinese Edition, 2000, 55(5): 617- 626.
[22]Augusto L, Ranger J, Binkley D, Rothe A. Impact of several common tree species of European temperate forests on soil fertility. Annals of Forest Science, 2002, 59(3): 233- 253.
[23]Salam A K, Katayama A, Kimura M. Activities of some soil enzymes in different land use systems after deforestation in hilly areas of West Lampung, South Sumatra, Indonesia. Soil science and plant nutrition, 1998, 44(1): 93- 103.
[24]Nayyar A, Hamel C, Lafond G, Gossen B D, Hanson K, Germida J. Soil microbial quality associated with yield reduction in continuous-pea. Applied soil ecology, 2009, 43(1): 115- 121.
[25]胡婵娟, 傅伯杰, 刘国华, 靳甜甜, 刘宇. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性. 生态学报, 2009, 29(2): 727- 733.
The metabolism characteristics of microbial community in different forest soil in Qinling Mountains Area
CAO Yongchang1, TAN Xiangping1, HE Wenxiang1,*, GENG Zengchao1, LIU Shuai1, SHE Diao2, HOU Lin3
1CollegeofResourcesandEnvironment,NorthwestAgricultureandForestryUniversity.KeyLaboratoryofPlantNutritionandtheAgri-environmentinNorthwestChina,MinistryofAgriculture,Yangling712100,China2InstituteofSoilandWaterConservation,NorthwestAgricultureandForestryUniversity,Yangling712100,China3CollegeofForestry,NorthwestAgricultureandForestryUniversity,Yangling712100,China
Abstract:In this study, the BIOLOG microporosity plate technology was employed to investigate the metabolic characteristics of microbial community in six woodlands with five typical types of forest soils, which included forest soils planted with tooth Oak(Quercus aliena var. acutidentata),chinese pine(Pinus tabuliformis),armand pine(Pinus armandii), pine and oak mixed, spruce(Picea asperata). The major findings include: (1) The average well color development (AWCD) of armand pine is the highest among the five kinds of typical forests, followed by tooth Oak1> spruce> chinese pine > tooth Oak2>pine and oak mixed, The AWCD value of tooth Oak woodlands located in different forest farms showed large differences among each other; (2) The index of soil microbial function diversity is consistent with the AWCD. The differences among six forest lands showed significant difference,. Significant difference was also observed for the utilization of six carbon source by soil microorganism in different forest components. (3) The principal component analysis showed that the soil microbial functional diversity among different soils were significant different. The sequence of comprehensive factor scores were armand pine > tooth Oak1> Chinese pine > chinese spruce > tooth Oak2> pine and oak mixed. (4) Redundancy analysis shows that the comprehensive effect of soil pH, organic matter, total nitrogen, alkali hydrolyzable nitrogen, the available phosphorus and available potassium can significantly affect soil microbial community functional diversity, especially the available P and pH which were closely related to soil microbial functional diversity.
Key Words:Qin Ling; soil microorganism,; metabolism characteristics; BIOLOG
基金项目:国家林业公益性行业科研专项(201304307);西北农林科技大学“基本科研业务费科研创新重点项目”(ZD2013012)
收稿日期:2014- 11- 22; 网络出版日期:2015- 09- 28
*通讯作者
Corresponding author.E-mail: wenxianghe@nwsuaf.edu.cn
DOI:10.5846/stxb201411222316
曹永昌,谭向平,和文祥,耿增超,刘帅,佘雕,侯林.秦岭地区不同林分土壤微生物群落代谢特征.生态学报,2016,36(10):2978- 2986.
Cao Y C, Tan X P, He W X, Geng Z C, Liu S, She D, Hou L.The metabolism characteristics of microbial community in different forest soil in Qinling Mountains Area.Acta Ecologica Sinica,2016,36(10):2978- 2986.

