煤低温氧化过程中元素转化行为的动力学分析
贺 凯,张玉龙,时剑文,王富勇
(1.中国矿业大学(北京)机电与信息工程学院,北京 100083;2.太原理工大学煤科学与技术省部共建国家重点实验室,山西太原 030024; 3.安标国家矿用产品安全标志中心技术检验部,北京 100013)
煤低温氧化过程中元素转化行为的动力学分析
贺凯1,3,张玉龙2,时剑文1,王富勇1
(1.中国矿业大学(北京)机电与信息工程学院,北京100083;2.太原理工大学煤科学与技术省部共建国家重点实验室,山西太原030024; 3.安标国家矿用产品安全标志中心技术检验部,北京100013)
摘要:通过把参与氧化反应的复杂的煤有机体,分成C,H,O,S和N元素,并基于氧化过程中这些元素含量的变化,借助于准一级反应模型,Coats and Redfern’s模型和Freeman and Carroll’s模型,对煤低温氧化动力学特性进行研究。研究表明,这些元素转化遵循准一级反应动力学和Coats and Redfern’s模型,并且这两种模型计算得到的活化能比较接近。在煤低温氧化过程中这些元素表现出较低的反应速率,仅为10-5~10-6,这表明中间络合物的生成速率非常缓慢。同时研究证明了不同元素活化能与指前因子之间存在动力学补偿效应。
关键词:煤;低温氧化;元素转化;动力学
贺凯,张玉龙,时剑文,等.煤低温氧化过程中元素转化行为的动力学分析[J].煤炭学报,2016,41(6):1460-1466.doi:10.13225/ j.cnki.jccs.2015.1745
He Kai,Zhang Yulong,Shi Jianwen,et al.Kinetic analysis of element evolution during low-temperature oxidation of coal[J].Journal of China Coal Society,2016,41(6):1460-1466.doi:10.13225/j.cnki.jccs.2015.1745
随着煤田的大规模开发,自燃火灾已成为煤矿生产重大灾害之一,严重地制约着矿井的可持续发展[1]。煤炭自燃的主要根源在于煤的低温氧化。除了安全方面问题外,煤炭低温氧化也给资源和环境方面带来严峻挑战[2-3]。煤低温氧化是一个复杂的过程,涉及到一系列反应步骤,包括煤对氧气的化学吸附、中间络合物的生成、不稳定中间络合物的分解、气相产物和热量的释放以及稳定氧化物的形成等[4]。在这些过程中涉及到煤中元素的迁移转化。煤低温氧化过程中,空气中的氧分子会嵌入到煤大分子结构中,从而形成含氧中间络合物,相应地C,H,O,S和N元素会发生迁移转化,以气相氧化产物的形式释放出来,从而引起煤有机体元素组成的改变。因此在煤低温氧化过程中元素的转化对煤自燃过程起着重要作用。
一般来说,煤低温氧化主要发生在有机大分子结构中,参与反应的物质就是组成煤的主要元素,这些元素包括C,H,O,S和N。这些元素的迁移转化在煤低温氧化过程中发挥着重要作用。尽管不同研究者从不同方面研究煤的低温氧化过程,但是有关煤低温氧化反应热力学和动力学特性方面的研究还较少[5-6]。一方面是由于煤的低温氧化反应的复杂性,另一方面是由于煤组成成分的复杂性,从而无法用传统方法去研究煤低温氧化反应热力学和动力学特性。本文将煤复杂的有机体以其最基本的组成元素C,H,O,S和N作为单体,分别研究这些元素在煤低温氧化过程中的变迁规律和反应动力学特性。煤低温氧化元素转化行为动力学特性的研究对揭示煤的自燃机理具有重要意义。
1 实 验
实验选取神东高挥发分烟煤(高自燃倾向性)作为实验用煤。在实验室制取新煤样时,为剔除运输过程中所形成的表面氧化层,选取大块煤的中心部分,然后粉碎研磨,过筛为平均直径0.125~0.180 mm的碎煤粉作为实验煤样。煤样的工业分析及元素分析见表1。从表1可以看出,实验煤样含有较高的硫铁矿,占总硫量的80%。
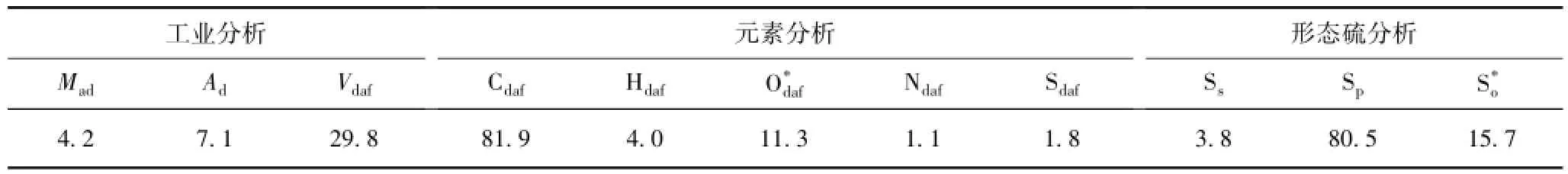
表1 实验煤样的工业分析、元素分析及形态硫分析Table 1 Proximate,ultimate and sulfur forms analyses of coal sample used in the experiments %
煤自燃是一个非常缓慢的过程,因此在自燃过程中煤结构在所处环境温度下是被充分氧化过的[2]。实验氧化煤样在培养皿中进行。放有煤样的培养皿放置在一个专门设计的温控箱内,温控箱具有很好的空气对流性能。在实验过程中,取用7个相同尺寸的培养皿,内径为9 cm,大约3 g煤样均匀分散在每个培养皿中,煤层厚度约为2 mm,从而保证煤样的充分氧化。装有煤样的7个培养皿均匀地放置在温控箱内,进行程序升温氧化实验。从室温开始加热,升温速率为1 K/min,终温为200℃。在加热过程中,分别在50,75,100,125,150,175和200℃时从温控箱内取出一个培养皿。取出的培养皿放置在盛有硅胶的干燥皿内,等冷却至室温时,氧化煤样被装入到一个密封的聚四氟乙烯瓶子里面,防止其进一步氧化。为了降低实验误差以及制备足够的氧化煤样用于元素分析,进行6次重复氧化实验。在同一时间内利用元素分析仪对所有氧化煤样中C,H,O,S和N元素含量进行分析。另外,为了降低分析误差,每个温度下的氧化煤样进行2次分析。
2 动力学模型
为了研究低温氧化过程中煤中各种元素的转化规律,需要研究3种动力学模型,包括准一级反应动力学模型,Coats and Redfern’s模型和Freeman and Carroll’s模型来探讨每种元素的动力学特性。
2.1准一级反应动力学
在氧气充足的条件下,煤的氧化过程可以认为是一种准一级反应[9-10]。准一级反应认为煤氧化过程中氧化煤样的C,H,O,S和N元素的反应速率与其浓度成正比。对于一个含量降低的体系,反应速率R可以用方程式(1)来表示。

其中,Ci和Ci+1分别为两个取样间隔的氧化煤样中某种元素的质量分数(daf),%;t为取样时间间隔,s。类似,对于一个含量增加的体系,反应速率可以用方程式(2)表示。

另外,与温度相关的反应速率k可以用Arrhenius方程进行计算。
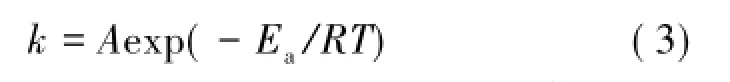
其中,Ea为活化能;A为指前因子;R为气体常数,8.314 J/(mol·k);T为实验温度,K。通过式(3)中ln k对1/T作图得到的直线的斜率及截距同样可以计算出Ea和A。
2.2Coats and Redfern’s模型[7]这种模型最终得到的计算方法如下:

式中,α为转化率,%;n为反应级数,1;β为温升速度,K/s;
依据Coats and Redfern’s模型,在大部分情况下式(4)和(5)中最后的一项是一个常数。对于n≠1 和n=1,用lg{1-(1-α)1-n/[(1-n)T2]}和lg{-ln(1-α)/[(1-n)T2]}分别对1/T作图,Ea可以从所得到的直线的斜率中求得。
2.3Freeman and Carroll’s模型[8]这种模型最终得到的计算方程如下:
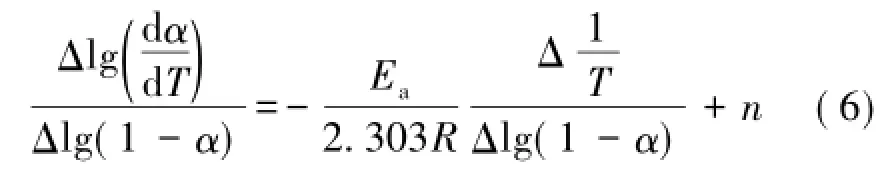
3 结果与讨论
3.1元素转化规律
图1显示的是在煤自燃过程中各种元素含量的变化规律。从图中可以看出,随着氧化温度的升高,氧化煤样C,H,S和N元素的含量呈现降低的趋势,而O的含量呈现增加的趋势。对不同程度的氧化煤样的C,H和O元素分析数据用van Krevelen(H/C 与O/C比值)作图,其结果如图2所示。由图2可以看出,随着氧化温度的增加,H/C呈现近似直线的速度降低,说明在煤氧化过程中煤中H元素含量的减少速率明显高于C元素的减少速率。同时可以看到,O/H增加趋势随着氧化温度的增加呈现降低的趋势。这说明氧化煤中O含量的增加速率呈现降低的趋势。
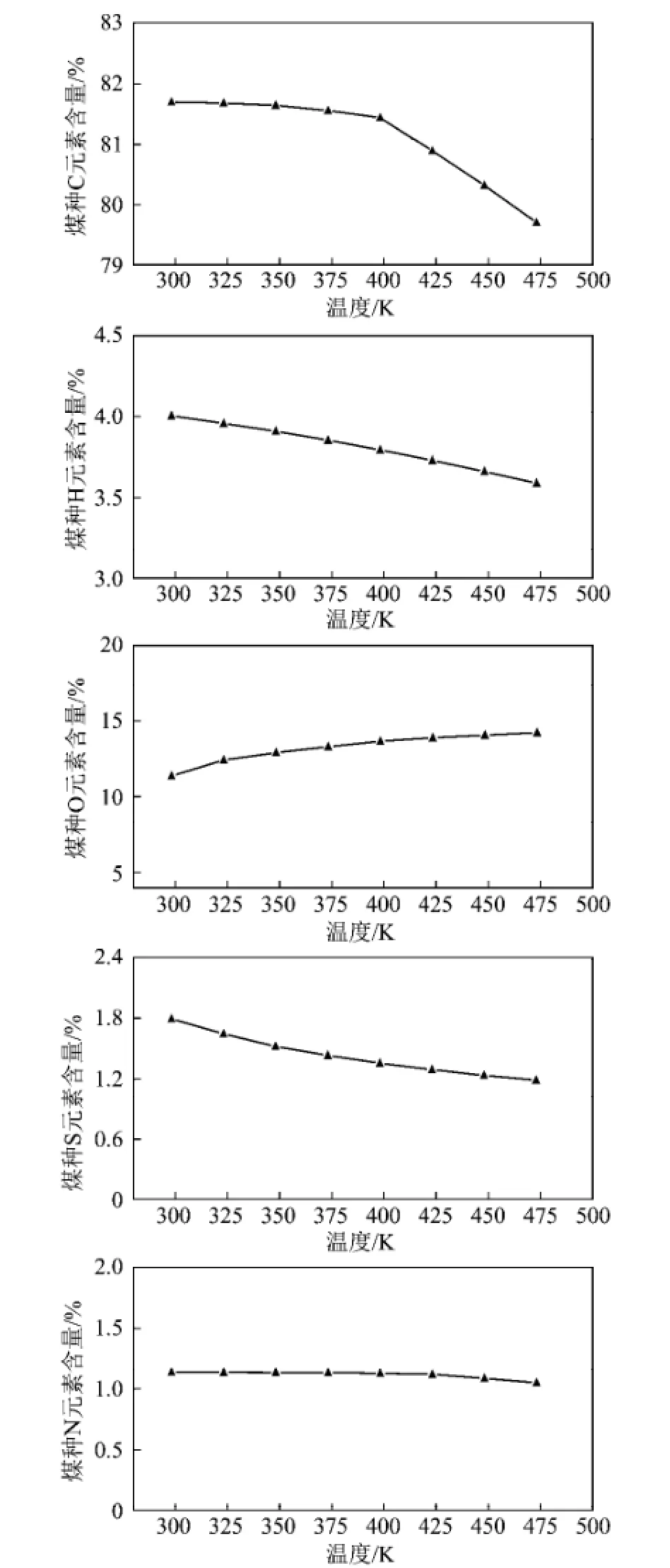
图1 煤自燃过程中各种元素含量的变化规律Fig.1 Evolution of elements during low-temperature oxidation of coal
同时从图2可以看出,随着氧化温度的增加,煤的氧化可以分成3个阶段。在氧化的初期阶段,H/C的变化趋势较小,而O/C呈现较大的变化趋势;当温度高于50℃时H/C的变化趋势稍微增加,而O/C的变化趋势减小;当温度高于100℃时,H/C的变化趋势已超过O/C的变化趋势。这说明在煤样氧化的初期,以O/C的变化为主;而在氧化的后期,以H/C的变化为主。

图2 不同氧化温度下煤样的van Krevelen图Fig.2 Van Krevelen diagram of coal samples oxidised at different temperatures
在氧化过程中每种元素的转化率见表2。元素的转化率显示每种元素在氧化过中的活性组分的含量。从表2可以看出,不同元素的转化率有很大的差别,按转化率的大小排序为S>O>H>N>C。S元素表现出最高的转化率(33.75%),这与煤中硫元素主要以活性较高的硫铁矿有关(含量占总硫量80%)。元素C表现出最低的转化率。元素分析数据显示原煤中C含量大于80%,而其转化率约为2.5%。煤中碳以脂肪性碳和芳香性碳两种形式存在,并且脂肪碳的氧化活性远高于芳香碳的活性。这表明发生氧化反应的C元素主要以脂肪碳为主。

表2 煤中5种元素在非等温氧化过程中转化的动力学参数Table 2 Kinetic parameters for the evolutions of these five elements during non-isothermal oxidation of coal
3.2动力学分析
准一级反应模型及两种动力学模型,用于研究煤低温氧化过程中元素的转化规律,揭示每种元素在氧化过程中的动力学特性。利用准一级反应模型计算得到的各种元素反应速率值见表3。

表3 煤中元素在氧化过程中的转化率Table 3 Conversion rate of elements in coal during low-temperaute oxidation of coal
从表3可以看出,这些元素的反应速率较低,在10-6~10-5之间。一般来说,随着反应温度的增加,反应速率常数相应增加。表3显示,随着反应温度的增加,C,H和N元素的反应速率表现出增加的趋势,而O和S的反应速率呈现出降低的趋势。这是由于在煤氧化过程中,O元素的迁移转化包含2个反应过程:氧的化学吸附过程以及含氧中间络合物的分解。这两个过程共同控制着煤体中O含量的变化。因此氧的反应速率是一个表观速率常数。S元素转化过程反应速率呈现出降低的趋势是由于煤中硫元素的氧化过程涉及的主要是硫铁矿硫,硫铁矿的氧化过程是一个放热过程。增加反应温度会降低放热反应的反应速率,因而S元素反应速率表现出降低的趋势。
图3为不同元素的ln k对1/T作图。从图3可以看出,各种元素的ln k和1/T之间有很好的线性关系,这说明在实验条件下,元素的转化规律可用准一级反应动力学描述。计算得到的每种元素迁移转化过程中动力学参数见表3。从表3还可以看出,C,H 和N元素的活化能为正值,分别为31.70,4.66和37.47 kJ/mol。在煤低温氧化过程中H元素表现出最低的活化能,这说明释放含氢的氧化物需要较低的能量。这与FITR研究结果相一致[9-10],煤的氧化首先涉及到氧分子进攻煤中的脂肪氢,特别是α位的亚甲基氢,氧化生成过氧化物、过氧化氢和羟基等氧化产物。N元素的转化过程表现出较高的活化能,这是由于煤中N物种以较稳定的形成存在,在转化过程中需要较高的能量。O和S元素的活化能为负值,这表明这两种元素的转化过程为放热过程。
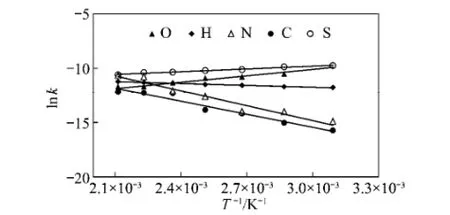
图3 各种元素的ln k对1/T作图Fig.3 Variation of ln k against 1/T for elementsevolution during coal oxidation
为了进一步研究元素的转化行为,将两种模型Coats and Redfern’s模型和Freeman and Carroll’s模型来进行动力学计算,同时对二者计算结果与准一级反应计算结果进行对比。图4和图5分别为这两种模型拟合结果。从图4可以看出,每种元素的转化规律都能很好地符合Coats and Redfern’s模型,其计算得到的活化能见表3中。同时与准一级反应计算结果对比可以看出,Coats and Redfern’s模型计算得到的活化能与准一级反应模型得到的活化能很接近。而图5显示每种元素的转化在Freeman and Carroll’s模型下呈离散关系,说明这些元素的转化规律不符合Freeman and Carroll’s模型。可能由于这两种模型所涉及到的反应机理不同,因而这些元素转化规律不适用于Freeman and Carroll’s反应模型。

图4 Coats and Redfern’s模型对元素转化作图Fig.4 Figures obtained from Coats and Redfern’s treatment for elements evolution
指前因子反映化学反应过程中反应活化物种有效碰撞的频率。每种元素在煤低温氧化过程中转化的频率因子显示在表3中。从表3可以看出,每种元素的指前因子的对数即ln A值均为负值,例如C元素的ln A为-4.02,可以得出C元素指前因子值为0.018,即每100 s的才能有效碰撞1~2次,表现出较低的频率因子,这说明反应速率非常慢。这表明煤的低温氧化过程涉及到中间络合物的生成反应,由于这种反应通常具有较低的频率因子。正是这种较低的指前因子控制着煤低温氧化的进行,控制着中间络合物的生成与分解。较低的指前因子反映了煤低温氧化的反应速率,这与表3中显示的较低的反应速率相一致。
每种元素转化的ln A与Ea关系如图6所示。从图6可以看出,ln A与Ea之间表现出明显的直线关系,这就是所谓的“动力学补偿效应”。它们之间的关系可以用ln A=mEa+c表示。在煤的热解及气化研究中,很早就发现反应活化能与指前因子之间存在这种动力学补偿效应[11],然而,很少研究发现在煤的低温氧化过程中各种元素转化的活化能与指前因子之间也存在这种补偿关系。煤氧化过程中这种动力学补偿效应,表明在煤低温氧化过程中各种元素之间在活性位点的增加的同时伴随着反应能垒的增加。
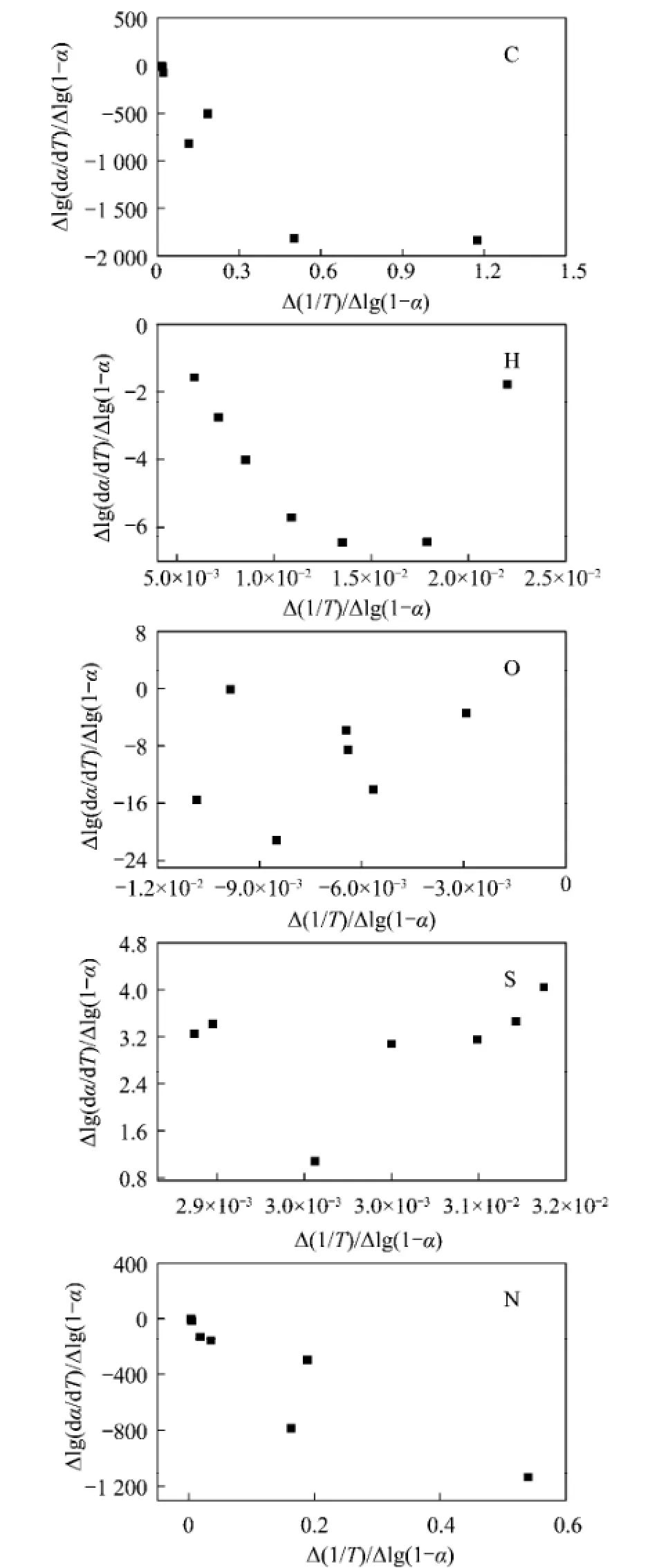
图5 Freeman and Carroll’s模型对元素转化作图Fig.5 Figures obtained from Freeman and Carroll’streatment for elements evolution
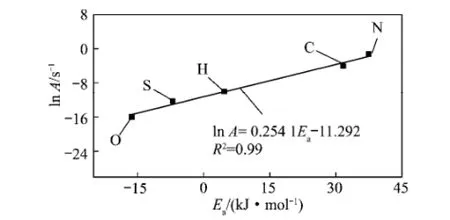
图6 各种元素的ln A对Ea作图Fig.6 ln A versus Eafor evolutions of these elements
4 结 论
(1)煤低温氧化过程中每种元素表现出较低的反应速率和指前因子,表明煤低温氧化过程中间络合物形成和分解速率是非常缓慢的。
(2)对比C,H和N这3种元素,H元素转化过程的活化能最低,N元素活化能最高,这与煤种这些元素的赋存形态有很大关系。这表明,煤中H元素,特别是α位活性氢,具有较高的反应活性,首先受到氧气分子的进攻。相比而言,C和N元素转化过程需要较高的能量。
(3)O元素在煤氧化过程中参与两个过程:中间络合物的形成及其分解。计算得到的活化能为这两种过程的叠加,是一种表观活化能,没有实际意义。但O和S元活化能为负值,表明O和S的转化为放热过程,这与煤氧复合学说以及硫铁矿理论相吻合。O和S的转化为释放的热量为煤与氧气的进一步反应提供能量。
(4)不同元素的活化能与指前因子之间存在动力学补偿效应。表明在煤低温氧化过程中各种元素之间在活性位点的增加的同时伴随着反应能垒的增加。
参考文献:
[1]周福宝.瓦斯与煤自燃共存研究(Ⅰ):致灾机理[J].煤炭学报,2012,37(5):843-849.Zhou Fubao.Study on the coexistence of gas and coal spontaneous combustion(Ⅰ):Disaster mechanism[J].Journal of China Coal Society,2012,37(5):843-849.
[2]Cimadevilla J L G,Álvarez R,Pis J J.Influence of coal forced oxidation on technological properties of cokes produced at laboratory scale [J].Fuel Process Technology,2005,87:1-10.
[3]Mastalerz M,Solano-Acosta W,Schimmelmann A,et al.Effects of coal storage in air on physical and chemical properties of coal and on gas adsorption[J].International Journal of Coal Geology,2009,79:167-174.
[4]Wang H,Dlugogorski B Z,Kennedy E M.Coal oxidation at low temperatures:Oxygen consumption,oxidation products,reaction mechanism and kinetic modeling[J].Progress in Energy and Combustion Science,2003,29:487-513.
[5]戴广龙.煤低温氧化过程中自由基浓度与气体产物之间的关系[J].煤炭学报,2012,37(1):122-126.Dai Guanglong.Relation between free radicals concentration and gas products in process of coal low temperature oxidation[J].Journal of China Coal Society,2012,37(1):122-126.
[6]陆伟,胡千庭.煤低温氧化结构变化规律与煤自燃过程之间的关系[J].煤炭学报,2007,32(9):939-944.Lu Wei,Hu Qianting.Relation between the change rules of coal structures when being oxidized and spontaneous combustion process of coal[J].Journal of China Coal Society,2007,32(9):939-944.
[7]Coats A W,Redfern J P.Kinetic parameters from thermogravimetric date[J].Nature,1964,201:68-69.
[8]Freeman E S,Carroll B J.The application of thermoanalytical techniquestoreactionkinetics:Thethermogravimetricevaluation of the kinetics of the decomposition of calcium oxalate monohydrate [J].Journal of Physical Chemistry,1958,62:394-397.
[9]Yürüm Y,Altunta?N.Air oxidation of Beypazari lignite at 50℃,100℃ and 150℃[J].Fuel,1998,77:1809-1814.
[10]Tahmasebi A,Yu J L,Han Y N,et al.Study of chemical structure changes of Chinese lignite upon drying in superheated steam,microwave,and hot air[J].Energy&Fuels,2012,26:3651-3660.
[11]Yip K,Ng E,Li C Z,et al.A mechanistic study on kinetic compensation effect during low-temperature oxidation of coal chars[J].Proceedings of the Combustion Institute,2011,33:1755-1762.
中图分类号:TD752
文献标志码:A
文章编号:0253-9993(2016)06-1460-07
收稿日期:2015-11-16修回日期:2015-12-08责任编辑:毕永华
作者简介:贺凯(1986—),男,山西晋城人,博士研究生。E-mail:hekai21988@163.com
Kinetic analysis of element evolution during low-temperature oxidation of coal
HE Kai1,3,ZHANG Yu-long2,SHI Jian-wen1,WANG Fu-yong1
(1.School of Mechanical Electronic and Information Engineering,China University of Mining and Technology(Beijing),Beijing100083,China;2.State Key Laboratory Breeding Base of Coal Science and Technology Co-founded by Shanxi Province and the Ministry of Science and Technology,Taiyuan University of Technology,Taiyuan030024,China;3.Technical and Testing Section,Mining Products Safety Approval and Certification Center,Beijing100013,China)
Abstract:The complex macromolecular matrix of coal was divided into the elements of C,O,H,S and N,which were involved in the oxidation reaction.Based on the changes of element contents during coal oxidation process at low temperature,the three kinetic models,including pseudo-first-order kinetics model,Coats and Redfern’s model,and Freeman and Carroll’s model,were introduced to investigate the kinetic characteristics of coal oxidation at low temperature.Kinetic study reveals that the evolutions of these elements during coal oxidation at low temperature follow pseudofirst order kinetics and Coats and Redfern’s model.The activation energies for these elements evolution in the oxidation process by using the pseudo-first order kinetics have been found to be almost similar to those calculated by applying the Coats and Redfern’s equation.The reaction rates computed by the pseudo-first order kinetics are very low and have been found to be 10-5-10-6,suggesting a very low rate of successful collisions for the formation of activated complex.A kinetic compensation effect between the activation energy and exponential facto was also observed for the evolutions of these elements.
Key words:coal;low-temperature oxidation;element evolution;kinetics

