四种倍半萜类化合物广谱抗肿瘤效应的研究进展
乔巍,汪小莞,李晓春,李江,李晓萌Δ
(1.东北师范大学 生命科学学院,吉林 长春 130024;2.吉林大学口腔医院 口腔修复科,吉林 长春 130041)
四种倍半萜类化合物广谱抗肿瘤效应的研究进展
乔巍1,汪小莞1,李晓春1,李江2Δ,李晓萌1Δ
(1.东北师范大学 生命科学学院,吉林 长春 130024;2.吉林大学口腔医院 口腔修复科,吉林 长春 130041)
目的 倍半萜类化合物(sesquiterpenoids)是存在于自然界中的一大类天然化合物,在植物中最为丰富。小白菊内酯、木香烃内酯、异土木香内酯和土木香内酯是4种具有代表性的倍半萜类化合物,它们主要存在于菊科植物小白菊和土木香等药用植物中,具有镇痛、抗菌及消炎的作用。近年来,这类化合物的抗肿瘤特性引起了科学家的重视。它们对正常的细胞无毒害,却表现了对多种肿瘤细胞的广谱的细胞毒和促凋亡效应,提示了其作为重要肿瘤抑制药物的开发前景。为此,本文就这4种倍半萜类化合物的天然来源、结构特征、分子靶点、抗肿瘤关联信号通路的调节机制等方面作以综述。
倍半萜类化合物;癌症;凋亡;信号通路
癌症是威胁着人类健康的重大疾病,每年全球数百万人死于癌症,且死亡率逐年升高[1-2]。天然化合产物在肿瘤的防治中发挥了重要的作用,其中倍半萜类化合物展示了很好的开发前景,并引起医药领域的广泛重视。倍半萜类化合物对正常的细胞无毒害,但展示了对多种肿瘤细胞的显著细胞毒和促凋亡效应,并在表观遗传、基因、细胞和分子水平上发挥抗肿瘤功能[3-4]。本文就4种倍半萜类天然化合物(小白菊内酯、木香烃内酯、异土木香内酯和土木香内酯)的来源、结构特征和在抗癌活性和相关信号通路作以综述。
1 倍半萜类化合物的来源及其结构特征
倍半萜类化合物是指由3分子异戊二烯聚合而成,分子中含有15个C原子的天然萜类化合物类群[5]。倍半萜类化合物按其结构的碳环数分为无环、单环、双环、三环和四环型倍半萜;按构成环的碳原子数分为五元环、六元环和七元环等;也可按含氧官能团分为倍半萜醇、醛、酮和内酯等[6]。倍半萜类化合物广泛存在于植物、微生物、海洋生物及某些昆虫中,在高等植物中最为丰富,具有重要的生物功能和生理活性,如抗菌、抗肿瘤、抗病毒和昆虫激素等生物活性,其功能在萜类化合物中尤为显著[7-8]。小白菊内酯、木香烃内酯、异土木香内酯和土木香内酯是4种具有代表性的倍半萜类化合物,其化学结构见图1。
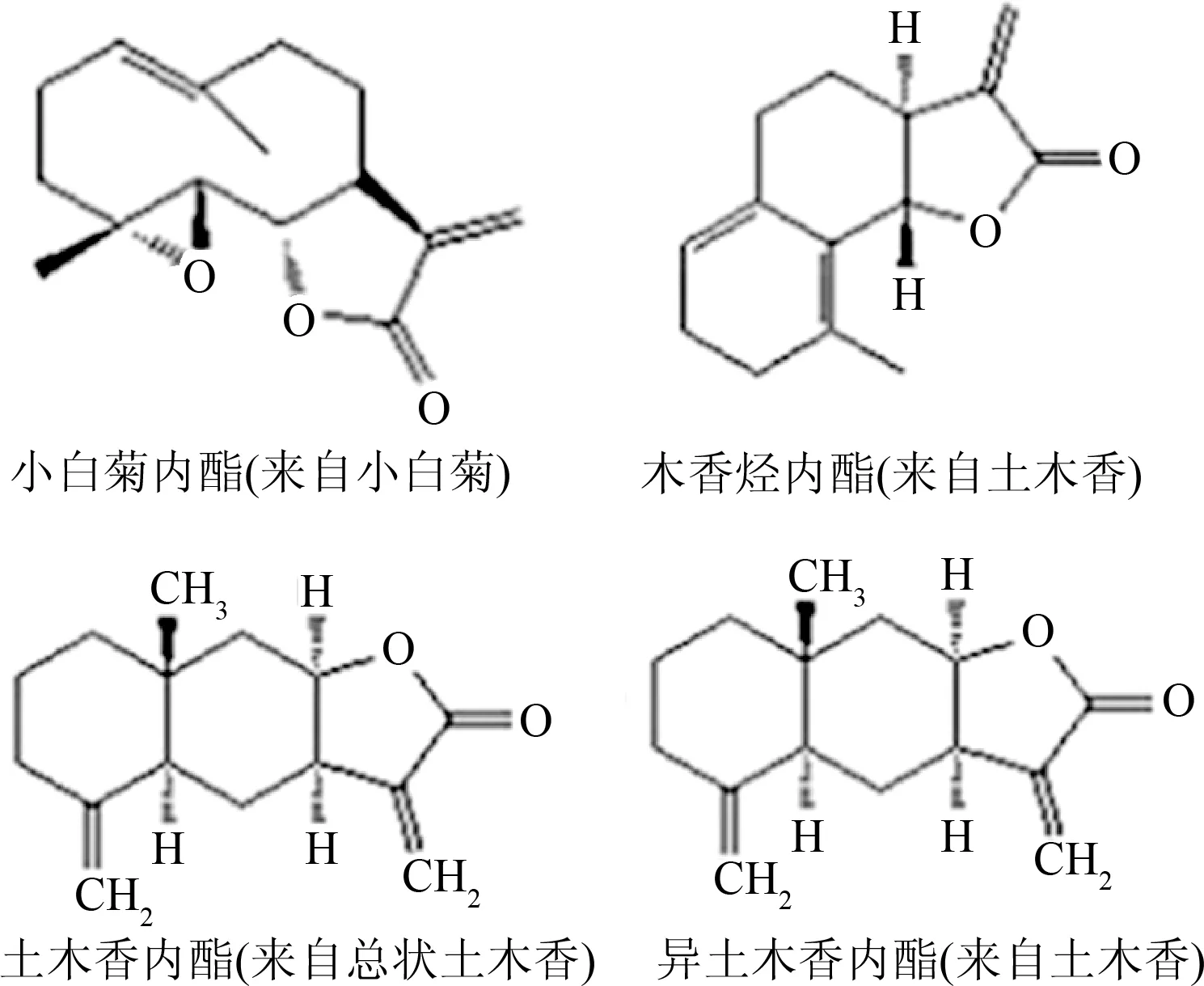
图1 4种倍半萜类化合物的化学结构和主要的天然来源Fig.1 The main natural origin and chemical structure of the four sesquiterpenoids
小白菊内酯是一种从菊科植物中提取出来倍半萜类化合物,具有独特的抗炎及抗肿瘤的生物活性,因此可把它作为一种潜在的药物来进一步的研究和开发[9]。小白菊内酯中的ɑ-甲基-γ-内酯环是其生物活性位点,这种特殊结构可以与细胞中的多种功能性蛋白特异性结合,从而调控信号通路中下游蛋白的表达[10]。
木香烃内酯为另一种倍半萜内酯类化合物,主要来源于多花含笑、木香、荷花玉兰、月桂树等植物,是中药木香的主要化学成分之一[11]。α-亚甲基-γ-内酯环是其发挥生物活性的必需官能团,木香烃内酯水溶性低,体内吸收困难,需要经过结构修饰来提高它的生物利用度[12]。
土木香内酯、异土木香内酯主要来源于土木香,具有抗菌、降血糖、抗炎、驱虫、抗肿瘤和镇痛等多种活性[13]。它们的活性与其结构中的α、β-不饱和五元内酯环有关[14]。
2 倍半萜类化合物在癌症防治中的作用
倍半萜类化合物具有抗肿瘤、抗菌、抗寄生虫等作用[15]。在癌症治疗过程中,它只对癌细胞具有特异性的杀伤作用,而对正常的组织细胞无损害,这使倍半萜类化合物成为一种新型的抗癌药物,其具体作用靶点的探寻以及生物活性的探究可能是今后研究倍半萜类化合物的主要方向[16]。
癌症的发生涉及到多种细胞信号通路的异常,如凋亡蛋白、生长因子、转录因子、抑癌因子等[17]。这些信号通路的改变导致致癌因子的激活和抑癌因子的失活,促进了正常细胞到癌细胞的转变。倍半萜类化合物对不同细胞信号通路的激活,其靶标是不同的。此外,相同的化合物对不同类型的细胞激活的信号通路也不尽相同。倍半萜类化合物通过调节p53、NF-κB、STAT3、线粒体凋亡信号等多种信号通路,调控细胞的增殖和凋亡,发挥广谱的抗肿瘤效应。
2.1 倍半萜类化合物通过p53信号通路的抗肿瘤效应研究 p53基因是一种功能强大抑癌基因,它介导的细胞信号通路细胞正常生命活动的维持过程中发挥重要作用,在所有恶性肿瘤中有50%以上会出现该基因的突变,导致细胞失去了分化能力,并恶性增殖[18]。肿瘤抑制基因p53被视为基因组的守护者,在控制细胞周期、细胞凋亡、基因完整性和DNA修复中起着举足轻重的作用。一旦被激活,p53可以结合控制DNA序列,激活靶基因的表达,这对抑制肿瘤的形成,调节细胞应对DNA损伤是很重要的。p53抑制肿瘤的形成主要通过抑制细胞周期(p21、cyclinG1、GADD45、14-3-3)、抑制血管生成(TSP1、Maspin、BAI1、GD-AIF)、诱导细胞凋亡(PERP、NOXA、PUMA、p53AIP1、ASPP1/2、Fas、BAX、PIDD)和调控遗传稳定性(p21、DDB2、MSH2、XPC)来实现[19]。
最近,有结果表明倍半萜类化合物通过激活p53和它的靶基因抑制细胞周期,引发细胞凋亡[20]。
有研究表明,小白菊内酯在结肠癌细胞HCT116和RKO、肺癌细胞NCI-H1299、成髓细胞瘤HL604个细胞系中,能够激活p53和MDM2调控的肿瘤抑制蛋白,发挥抗肿瘤作用[21]。另外,小白菊内酯通过降低p-Akt和pS166-Mdm2水平,增强p53表达来促进癌细胞凋亡[22]。木香烃内酯能使人前列腺癌细胞细胞核内Ca2+超载,引起DNA损伤和增强p53活性,上调p21表达;促进p21与细胞周期蛋白依赖激酶2/细胞周期蛋白E(CDK2/CyclinE)复合物结合,从而抑制CDK2/CyclinE复合物的活性,使癌细胞的生长停滞于G1期[23]。另一种化合物土木香内酯则通过增强了肝癌HepG2细胞中p53的表达,从而促进其下游靶基因的表达,来发挥抑癌效应[24]。此外,土木香内酯通过p53信号的上调增加了细胞周期蛋白依赖性激酶抑制剂p21的表达,发挥对抗阿霉素人类红白血病细胞株K562/ADR和前列腺癌PC-3细胞的抑制作用[25]。
2.2 倍半萜类化合物通过NF-κB信号通路的抗肿瘤效应研究 NF-κB是一种细胞核转录因子,它介导的细胞信号通路与肿瘤细胞的增殖、凋亡、肿瘤细胞侵袭、转移和血管生成密切相关[26]。NF-κB信号包括5名成员,NF-κB1(p50)、NF-κB2(p52)、c-Rel、RelB和RelA (p65)[27]。通常细胞在无刺激情况下,NF-κB与它的内源抑制剂IκB结合隐藏在细胞质中并且表现为沉默状态;即NF-κB 二聚体通过与细胞质中3个抑制因子(IκBɑ, IκBβ, IκBε)中的一个结合,以无活性的状态存在。但是当某些诱导信号存在时,IκB会由于自身磷酸化影响其对NF-κB的抑制活性,导致NF-κB信号中的Rel成员入核,并调控细胞增殖信号[28-31]。
倍半萜类化合物是一类有效的NF-κB通路的新型抑制剂[32]。研究表明,小白菊内酯能够抑制 IκB 的磷酸化,从而保持 IκB 对 NF-κB 的抑制活性,这样小白菊内酯就能够间接阻断 NF-κB 与 DNA的结合,下调凋亡基因的表达从而抑制肿瘤细胞的生长[33]。人类慢性淋巴细胞白血病细胞存在 NF-κB的过表达,而小白菊内酯通过抑制 NF-κB 的活性抑制细胞增殖,达到治疗白血病的目的[34-37]。另一种倍半萜类化合物木香烃内酯也可作用于NF-κB信号,在子宫内膜癌11Z细胞株中通过抑制NF-κB激活,下调抗凋亡因子Bcl-xL和XIAP的表达,进而抑制癌细胞增殖[38-42]。 而另外2种倍半萜类化合物土木香内酯和异土木香内酯都对NF-κB及其关联蛋白有抑制效果,它们可以抑制NF-κB信号通路及其上游信号级联的一步或多个步骤,从而诱导癌细胞凋亡[43]。
2.3 倍半萜类化合物通过STAT信号通路的抗肿瘤效应研究 STAT信号转导通路与细胞的增殖、分化及凋亡密切相关,此通路持续激活可导致细胞异增殖和恶性转化。STAT家族是一类高度保守的转录因子蛋白家族,有报道指出STAT3和STAT5的组成性活化涉及许多癌症如骨髓瘤、淋巴瘤、白血病和一些实体肿瘤[44]。STAT家族成员包括STAT1、STAT2、STAT3、 STAT4、 STAT5A、STAT5B和STAT6。STATs 能够接受胞外配体的刺激使自身酪氨酸或丝氨酸残基发生磷酸化来介导多种细胞因子和生长因子向细胞核内传导,影响靶基因的转录,调控细胞功能,在肿瘤发生、发展中起重要作用[45]。
过去10年的研究表明,倍半萜类化合物在肿瘤细胞中可调节STAT的激活。小白菊内酯能够通过对 IL-6 的抑制使 STAT-3 蛋白序列中 Tyr705 残基发生磷酸化,从而阻止 STAT 受体二聚体的形成,抑制STAT-3活性并阻止癌细胞核转运过程。小白菊内酯还能够通过抑制STAT-3的活性, 诱导死亡受体的表达,使肝癌细胞对相关 TNF 的凋亡诱导配体 (TRAIL)致敏,激活Caspase-9 和 Caspase-3,从而导致癌细胞凋亡[46]。土木香内酯能够抑制人肝癌细胞HepG2细胞中STAT-3的激活,调节STAT-3信号转导,使癌细胞凋亡[47]。
2.4 倍半萜类化合物以线粒体为媒介的抗肿瘤效应研究 线粒体在癌症的细胞凋亡、信号转导过程中起着非常重要的作用。线粒体是真核细胞的重要细胞器,是动物细胞生成ATP的主要场所,还在细胞凋亡的过程中发挥关键作用。在凋亡过程中,线粒体受到凋亡刺激会产生大量活性氧,使其通透性转换孔开放,引起跨膜电位降低,导致细胞色素c和凋亡诱导因子释放到细胞质中,从而激发下游的凋亡执行者,引起细胞凋亡[48]。
研究表明,倍半萜类化合物可以通过影响线粒体的生物机制来发挥抗肿瘤效应。在前列腺癌细胞中,小白菊内酯能够诱导活性氧(ROS)大量生成,促进细胞色素c释放,降低Bcl-2水平,从而加速细胞凋亡[49]。在人急髓白血病细胞株HL-60细胞中,木香烃内酯能提高ROS水平,诱导线粒体渗透性改变,使细胞色素c释放到细胞质中,增加Bax的表达,下调Bcl-2和生存素的表达水平,激活caspase-3和下游靶标PARP表达,从而促进癌细胞的凋亡[50]。
3 结论与展望
倍半萜类化合物由于对多种肿瘤细胞的杀伤作用引起了科学家的重视。4种代表性的倍半萜类化合物:小白菊内酯、木香烃内酯、异土木香内酯和土木香内酯通过作用于多种信号通路,展示出了广谱的抗肿瘤效应。作为很有前景的生物活性分子,倍半萜类化合物功能的深入研究,有助于其药理作用的阐明和药物研发。此外,利用化学手段进行的倍半萜类融合药物的修饰,也可能成为倍半萜类药物研发的新途径。同时,倍半萜类化合物与与其他小分子的协同抗肿瘤作用研究,也是倍半萜类化合物开发的重要方向。
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer J Clin,2008,58(4):71-96.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics for Hispanics/Latinos[J].CA Cancer J Clin,2012,62(8):283-298.
[3]Wiart C.Goniothalamus species: a source of drugs for the treatment of cancers and bacterial infections[J].Evid Based Complement Alternat Med,2007,4(3):299-311.
[4]Manson MM.Cancer prevention-the potential for diet to modulate molecular signaling[J].Trends Mol Med,2003,9(9):11-18.
[5]Fulda S.Evasion of apoptosis as a cellular stress response in cancer[J].Cell Biol,2010,3(4):835.
[6]Jaganathan SK,Mandal M.Antiproliferative effects of honey and of its polyphenols: a review[J].Biomed Biotechnol,2009,83(6):16.
[7]Amin AR,Kucuk O,Khuri FR,et al.Perspectives for cancer prevention with natural compounds[J].Clin Oncol,2009,27(5):2712-2725.
[8]Cragg GM,Newman DJ.Plants as a source of anti-cancer agents[J].Ethnopharmacol,2005,100(2):72-79.
[9]Elmore S.Apoptosis: a review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
[10]Kim IH,Kim SW,Kim SH,et al.Parthenolide induced apoptosis of hepatic stellate cells ananti-fibrotic effects in an in vivo rat model[J].Experim Molec Med,2012,44(7):448.
[11]Mondrallondra IO,Che CT,mmando AM,et a1.Sesquiterpene lactones and other constituents from a cytotoxic extract of Michelia floribunda[J].Phann Res,1990,7(12):1269-1272.
[12]Johnstone RW,Ruefli AA,Lowe SW.Apoptosis: a link between cancer genetics and chemotherapy[J].Cell,2002,108(11):153-164.
[13]Green DR.Apoptotic pathways: paper wraps stone blunts scissors[J].Cell,2000,102(2):1-4.
[14]Ashkenazi A,Dixit VM.Death receptors: signaling and modulation[J].Science,1998,281(6):1305-1308.
[15]Block G,Patterson B,Subar A.Fruit,vegetables,and cancer prevention: a review of the epidemiological evidence[J].Nutr Cancer,1992,18(3):1-29.
[16]Anichini A,Mortarini R,Sensi M,et al.APAF-1 signaling in human melanoma[J].Cancer Lett,2006,238(9):168-179.
[17]Hengartner MO. The biochemistry of apoptosis[J].Nature,2000,407(10):770-776.
[18]Carr AM.Cell cycle. Piecing together the p53 puzzle[J].Science,2000,287(2):1765-1766.
[19]Lu C,El-Deiry WS.Targeting p53 for enhanced radio-and chemosensitivity[J].Apoptosis,2009,14(4):597-606.
[20]Sherr CJ,Weber JD.The ARF/p53 pathway[J].Curr Opin Genet Dev,2000,10(8):94-99.
[21]Vogelstein B,Kinzler KW.Achilles’ heel of cancer[J].Nature,2001,412(3):865-866.
[22]Gopal YN,Chanchorn E,Van Dyke MW.Parthenolide promotes the ubiquitination of MDM2 and activates p53 cellular functions[J].Mol Cancer Ther,2009,8(5):552-562.
[23]Di Fiore R,Drago-Ferrante R,D′Anneo A, et al.Inhuman retinoblastoma Y79 cells okadaicacidparthenolide co-treatment induces synergisticapoptotic effects, with PTEN as a key Player[J].Cancer Biol Ther,2013,14(7):922-931.
[24]Aggarwal BB.Nuclear factor-kappaB: the enemy within[J].Cancer Cell,2004,6(1):203-208.
[25]Orlowski RZ, Baldwin AS Jr.NF-kappaB as a therapeutic target in cancer[J].Trends Mol Med,2002,8(10):385-389.
[26]Baud V, Karin M.Is NF-kappa B a good target for cancer therapy Hopes and pitfalls[J].Nat Rev Drug Discov,2009,8(5):33-40.
[27]Solt LA,May MJ.The IkappaB kinase complex: master regulator of NF-kappaB signaling[J].Immunol Res,2008,42(7):3-18.
[28]Ghosh S,Hayden MS.New regulators of NF-kappaB in inflammation[J].Nat Rev Immunol,2008,8(2):837-848.
[29]Karin M,Cao Y,Greten FR,et al.NF-kappaB in cancer: from innocent bystander to major culprit[J].Nat Rev Cancer,2002,2(4):301.
[30]Lin WW,Karin MA cytokine-mediated link between innate immunity,inflammation,and Cancer[J].Clin Invest,2007,117(8):1175-1183.
[31]Affara NI,Coussens LM. IKKalpha at the crossroads of inflammation and metastasis[J].Cell,2007,129(9):25-26.
[32]Luo JL,Kamata H,Karin M.IKK/NF-kappaB signaling: balancing life and death-a new approach to cancer therapy[J].Clin Invest,2005,115(5):2625-2632.
[33]Biswas DK,Iglehart JD. Linkage between EGFR family receptors and nuclear factor kappaB (NF-kappaB) signaling in breast cancer[J].Cell Physiol,2006,209(7):645-652.
[34]Tanabe K,Matsushima-Nishiwaki R,Yamaguchi S,et al. Mechanisms of tumor necrosis factor-alpha-induced interleukin-6 synthesis in glioma cells[J].Neuroinflammation,2010,7(3):16.
[35]Legendre F, Dudhia J, Pujol JP, et al.JAK/STAT but not ERK1/ERK2 pathway mediates interleukin (IL)-6/soluble IL-6R downregulation of Type II collagen,aggrecancore,and link protein transcription in articular chondrocytes.Association with a down-regulation of SOX9 expression[J].Biol Chem,2003,278(6):2903-2912.
[36]Mathema VB,Koh YS,Thakuri BC,et al.Parthenolide,asesquiterpene lactone,expresses multiple anti-cancer and antiinflammatory activities[J].Inflammation,2012,35(11):560-565.
[37]Nakshatri H,Rice SE,Bhat-Nakshatri P.Antitumor agent parthenolide reverses resistanceof breast cancer cells to tumor necrosis factor-related apoptosis-inducing ligand through sustained activation of c-Jun N-terminal kinase[J].Oncogene,2004,23(8):7330-7344.
[38]Butturini E, Di Paola R, Suzuki H, et al.Costunolide and Dehydrocostuslactone,two natural sesquiterpene lactones, ameliorate the inflammatory process associated to experimental pleurisy in mice[J].Eur J Pharmacol,2014(730C):107-115.
[39]Kim JH,Yang YI,Lee KT,et al.Costunolide induces apoptosis in human endometriotic cells through inhibition of the prosurvival Akt and nuclear factor kappa B signaling pathway[J].Biol Pharm Bull,2011,34(5):580-585.
[40]Whipple RA, Vitolo MI, Boggs AE, et al.Parthenolide and costunolide reduce microtentacles and tumor cell attachment by selectively targeting detyrosinated tubulin independent from NF-kappaB inhibition[J].Breast Cancer Res,2013,15(2):R83.
[41]Chun J, Choi RJ, Khan S, et al. Alantolactone suppresses inducible nitric oxide synthase and cyclooxygenase-2 expression by down-regulating NF-kappaB, MAPK and AP-1 via the MyD88 signaling pathway in LPS-activated RAW 264.7cells[J].Int Immunopharmacol,2012,14(3):375-383.
[42]Sano S,Itami S,Takeda K,et al.Keratinocyte-specific ablation of Stat3 exhibits impaired skin remodeling, but does not affect skin morphogenesis[J].EMBO,1999,18(3):4657-4668.
[43]Silver DL, Montell DJ. Paracrine signaling through the JAK/STAT pathway activates invasive behavior of ovarian epithelial cells in Drosophila[J].Cell,2001,107(6):831-841.
[44]Grandis JR, Drenning SD, Chakraborty A, et al. Requirement of Stat3 but not Stat1 activation for epidermal growth factor receptor-mediated cell growth In vitro[J].Clin Invest,1998,102(6):1385-1392.
[45]Qiu J,Luo M,Wang J,et al.Isoalantolactone protects against Staphylococcus aureus pneumonia[J].FEMS Microbiol Lett,2011,324(3):147-155.
[46]Schmidt TJ,Brun R,Willuhn G, et al. Anti-trypanosomal activity of helenalin and some structurally related sesquiterpene lactones[J].Planta Med,2002,68(3):750-751.
[47]Steele AJ,Jones DT, Ganeshaguru K, et al.The sesquiterpenelact- oneparthenolide induces selective apoptosis of B-chronic lymphocytic leukemia cells in vitro[J].Leukemia,2006,20(4):1073.
[48]Lee MG. Costunolide induces apoptosis by ROS-mediated mitochondrial permeability transition and cytochrome C release[J].Biol Phann Bull,200l,24(3):303-306.
(编校:王冬梅)
Advances in broad-spectrum antitumor effect of four sesquiterpenoids
QIAO Wei1, WANG Xiao-wan1, LI Xiao-chun1, LI Jiang2Δ, LI Xiao-meng1Δ
(1.School of Life Sciences, Northeast Normal University, Changchun 130024, China; 2.Department of Prosthodontics, Hospital of Stomatology, Jilin University, Changchun 130041, China)
Sesquiterpenoids are a rich source of natural compounds found in nature, most abundantin plants. Parthenolide, Costunolide, Isoalantolactone and Alantolactone are four representative of sesquiterpenoids, found primarily in the medicinal plants such as compositae including fever few and radix Inulae,which has analgesic, anti-bacterial and anti-inflammatory effects. In recent years,sesquiterpenoids’anti-tumor properties attracted the attention of scientists.Especially, sesquiterpenoids have abroadspectrum of cytotoxic effect and promoting apoptosis on various of tumor cells without affecting normal cells, suggesting the development prospects of its important role as an antitumor agents. Therefore, the paper summarized the natural origin, structure,molecular target of the four sesquiterpenoids, as well as their regulating mechanism in anti-tumor associated signaling pathway.
sesquiterpenoids; cancer; apoptosis; signal pathway
科技部国际合作项目(2010DFA31430);吉林省科技厅(20130521010JH; 20150101187JC; 20150414007GH);吉林省教育厅题(2015-526, 2015-551);高校基本科研业务费专项基金(2412015ZH005;130017507); 国家自然科学基金(30871301; 30700827);引智计划(B07017)
乔巍,女,硕士在读,研究方向:肿瘤信号转导,E-mail:qiaow634@nenu.edu.cn;李晓萌,通信作者,女,博士,教授,博士生导师,研究方向:肿瘤信号转导, E-mail:lixm441@nenu.edu.cn;李江,共同通信作者,男,博士,教授,硕士生导师,研究方向:肿瘤信号转导,E-mail:ljiang@jlu.edu.cn。
R285.5
A
10.3969/j.issn.1005-1678.2016.03.02
——结构和生物活性

