新疆石河子规模化牛场多杀性巴氏杆菌的分离鉴定及药敏试验
刘顺磊,何延华,王熙楚,郑婷婷,孔科委,黄 新,韩猛立,周 霞*,钟发刚*
(1.石河子大学动物科技学院,新疆石河子 832003;2.新疆农垦科学院,新疆石河子 832000)
新疆石河子规模化牛场多杀性巴氏杆菌的分离鉴定及药敏试验
刘顺磊1,2,何延华2,王熙楚1,郑婷婷1,孔科委1,黄新2,韩猛立2,周霞1*,钟发刚2*
(1.石河子大学动物科技学院,新疆石河子 832003;2.新疆农垦科学院,新疆石河子 832000)
摘要:为了确定石河子地区某规模化牛场出现呼吸困难、咳嗽、病牛消瘦甚至死亡的病因,本研究以病牛病变组织为研究对象,采用常规细菌分离鉴定和细菌16 S rRNA序列分析来鉴定菌种,以及多杀性巴氏杆菌种特异性基因Kmt-1和各个荚膜血清型特异性基因(hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD)PCR扩增来确定细菌的血清型,同时应用纸片扩散法对分离细菌进行药物敏感性试验和小鼠感染试验。结果表明,从病变的肺组织中分离到1株菌落为灰白色、露珠状、不溶血,染色为革兰阴性球杆状细菌,生化鉴定结果符合巴氏杆菌特征,同时16 S rRNA序列分析与NCBI上已公布的多杀性巴氏杆菌16 S rRNA序列同源性在99%以上;对多杀性巴氏杆菌特异性基因Kmt-1以及各血清型特异性基因PCR扩增只扩增到Kmt-1和hyaD-hyaC特异性基因片段;分离菌株对链霉素、庆大霉素、卡那霉素耐药,对其他30种药物敏感,同时感染小鼠全部死亡。结果显示从病牛体内分离到1株毒力较强的血清A型多杀性巴氏杆菌。
关键词:牛呼吸道感染;病原菌;分离鉴定;A型多杀性巴氏杆菌
多杀性巴氏杆菌(Pasteurellamultocida,Pm)可以引起禽、猪、兔、牛、绵羊、山羊、野生动物和人感染发病,主要表现为禽霍乱、猪萎缩性鼻炎、牛出血性败血症、牛羊地方性流行性肺炎等。根据荚膜抗原和脂多糖的不同,可以将其分别分为5个血清型(A、B、D、E、F)和16个血清型(1~16),不同的血清型常与特定疾病相关联[1-2]。产毒素的血清D型能导致猪的萎缩性鼻炎;而B和E群则主要导致非洲和亚洲地区的牛和水牛出血性败血病[2-4]。我国以前主要以引起牛出血性败血症的荚膜血清B 型Pm为主[5],自2008年马文戈首次报道牛感染荚膜血清A型Pm[6]以来,相继在我国大部分省、市、地区都有报道,牛纤维素性化脓性肺炎是2008年以来引起我国牛高病死率的牛传染病。临床上多以牛精神不振、呼吸困难、咳喘、鼻腔流出水样或黏液样的分泌物,体温升高至40℃~42℃,消瘦为特征,有的还伴有腹泻等症状,甚至突然死亡。荚膜血清A型Pm是牛呼吸道综合征(Bovine respiratory disease complex,BRDC)主要的病原菌之一[7]。BRDC是牛最常见的一类传染病,该病致病因素复杂,发病快,传染快,对养牛业造成巨大的经济损失,又称“运输热”,广泛分布于世界各地,给养牛业造成了巨大的经济损失,据统计,养牛业中65%的疾病与牛呼吸道疾病相关,发病率达50%~100%,病死率可达10%~50%[8-9]。
随着我国养牛业的迅速发展,近年来新疆多地区已投入大量资金以多种形式相继建立多个初具规模的养牛场,但同时以呼吸道症状为主的传染病也频繁发生。本研究以新疆石河子地区某规模化牛场出现呼吸困难、咳嗽、食欲下降、消瘦甚至死亡的病牛为研究对象,采集病变组织,采用细菌常规分离鉴定技术和16 S rRNA序列分析来鉴定菌种,同时用PCR方法检测Pm特异性Kmt-1基因以及各血清型特异基因,为本地区牛场呼吸道疾病病原种类的确定、研制针对性疫苗以及诊断技术的研究提供参考。
1材料与方法
1.1材料
1.1.1病料病料采自新疆石河子地区规模化奶牛场送检的因呼吸道引起死亡的牛肺脏组织。
1.1.2药品试剂和仪器细菌生化鉴定仪及配套设备(VITEK 2 COMPACT);梯度PCR仪(德国Biometra 070-851);常用新药敏纸片(35种)产品编号:C074,购于杭州天和微生物试剂有限公司;Taq酶、buffer、dNTP Mix、Marker等购于Takara公司;麦康凯培养基、Tryptone、Yeast Extract等购于 Oxiod 公司;脑心浸液肉汤(BHI),购于青岛海博生物技术有限公司。
1.2方法
1.2.1病原微生物分离培养与镜检将病料接种于营养肉汤中,于37℃培养24 h后,分别划线于50 mL/L脱纤维绵羊血琼脂和麦康凯琼脂培养基,37℃条件下培养24 h。挑取单菌落进行染色镜检。
1.2.2生化鉴定将分离纯培养物在50 mL/L脱纤维绵羊血琼脂接种划线,37℃过夜培养,挑取单菌落,按照生化鉴定仪使用说明书,使用生化鉴定仪(Vitek 2 Compact)进行生化鉴定。
1.2.316 S rRNA、Kmt-1基因序列测定及Pm血清型鉴定细菌16 S rRNA基因、Pm特异型基因Kmt-1和Pm的各血清型特异性基因引物参考文献[10-11],引物设计见表1,送上海生工生物工程技术服务有限公司合成。采用细菌基因组DNA快速提取试剂盒提取细菌基因组,PCR扩增其16 S rRNA基因序列,扩增条件为:95℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min 20 s,34个循环;72℃延伸10 min。电泳检测PCR产物,并送北京华诺时代科技有限公司测序。用NCBI中的Blast软件对测序结果进行同源性比对。PCR扩增Kmt-1和Pm各特异性血清型基因,扩增条件为:95℃ 5 min;94℃ 30 s,50℃~60℃ 30 s,72℃ 1 min,34个循环;72℃延伸10 min。10 g/L琼脂糖凝胶电泳检测PCR产物。
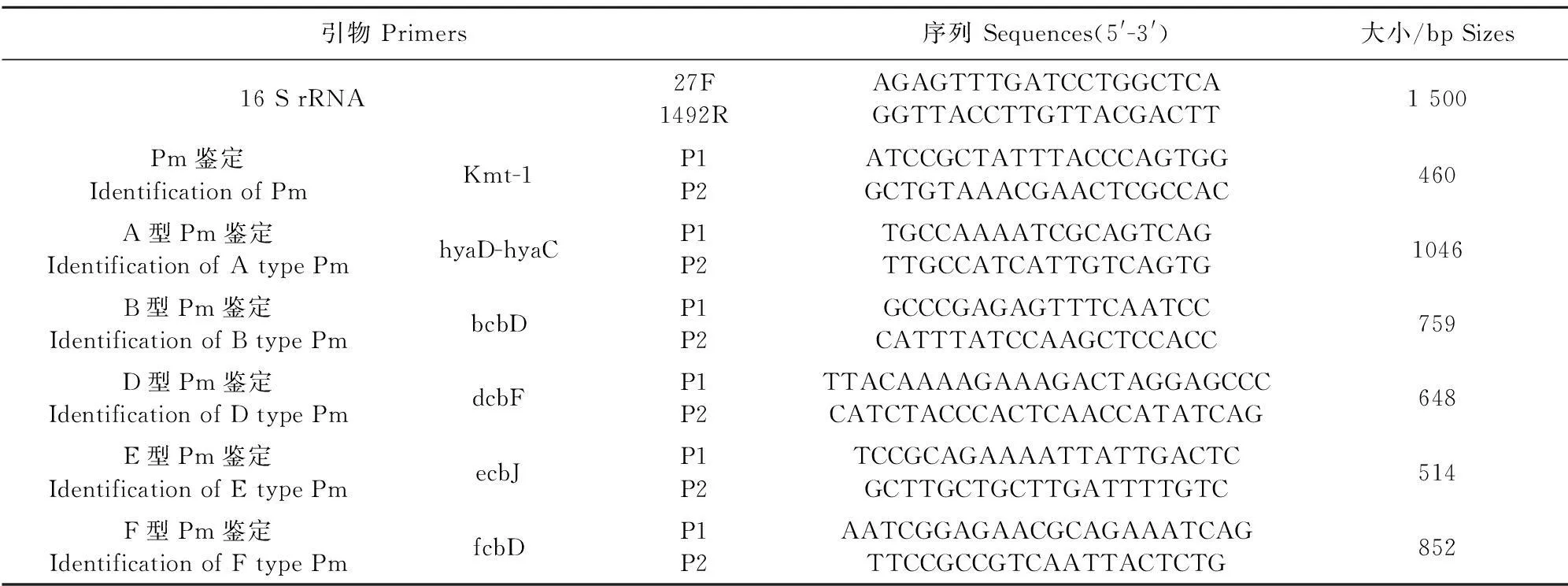
表1 试验中使用的引物
1.2.4药敏试验采用纸片扩散法(K-B法),使用常用35种新药敏纸片,判定标准按照常用新药敏纸片(35种)使用说明书标准。
1.2.5小鼠致病性试验普通级成年昆明小鼠分成试验组和对照组,每组5只。将分离菌接种于肉汤液体培养基,于37℃培养8 h~11 h,试验组小鼠腹腔接种菌液0.2 mL/只,对照组注射等体积肉汤液体培养基,观察其精神状态、食欲等,记录每只小白鼠死亡时间。
2结果
2.1菌株分离培养特性和形态特征
剖检观察病牛的病变在肺脏,整个肺脏肿大、肉变、充血(图1A),病料分离菌株在血平板上生长良好,黏稠而光滑圆润、灰白色、露珠状、不溶血的菌落,挑取革兰染色镜检,为革兰阴性球杆菌(图1B);在麦康凯琼脂上不生长,在绵羊鲜血琼脂培养基和BHI培养基上生长良好。
2.2分离菌株生化特性
经全自动微生物鉴定仪鉴定,分离的菌株与Pm生化反应特点一致(表2)。
2.316 S rRNA基因扩增测序结果比对分析和Pm血清型分型鉴定结果
16 S rRNA基因片段扩增及测序结果分析表明,16 S rRNA基因片段全长均约为1 500 bp,与GenBank中的巴氏杆菌16 S rRNA基因序列AY316317、NR-041809、AY299308、AF224298、JX975401、DQ286927、JQ404476、JX869945、KR006972等同源性达到99%,可以推测分离菌为Pm(图2)。
Pm种特异性基因Kmt-1引物分别和荚膜血清型特异性基因hyaD-hyaC、bcbD、dcbF、ecbJ、fcbD的引物双重PCR扩增,只有Kmt-1和hyaD-hyaC引物扩增出近460 bp和1 046 bp的两条特异性条带,而Kmt-1和bcbD、Kmt-1和dcbF、Kmt-1和ecbJ、Kmt-1和fcbD都只扩增出一条约460 bp特异性条带(图3)。结果表明,该分离Pm为荚膜血清型A型。
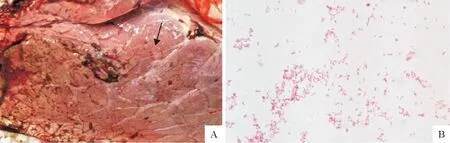
A.箭头指发生肉变的肺脏组织;B.分离菌株革兰染色镜检结果(1 000×)
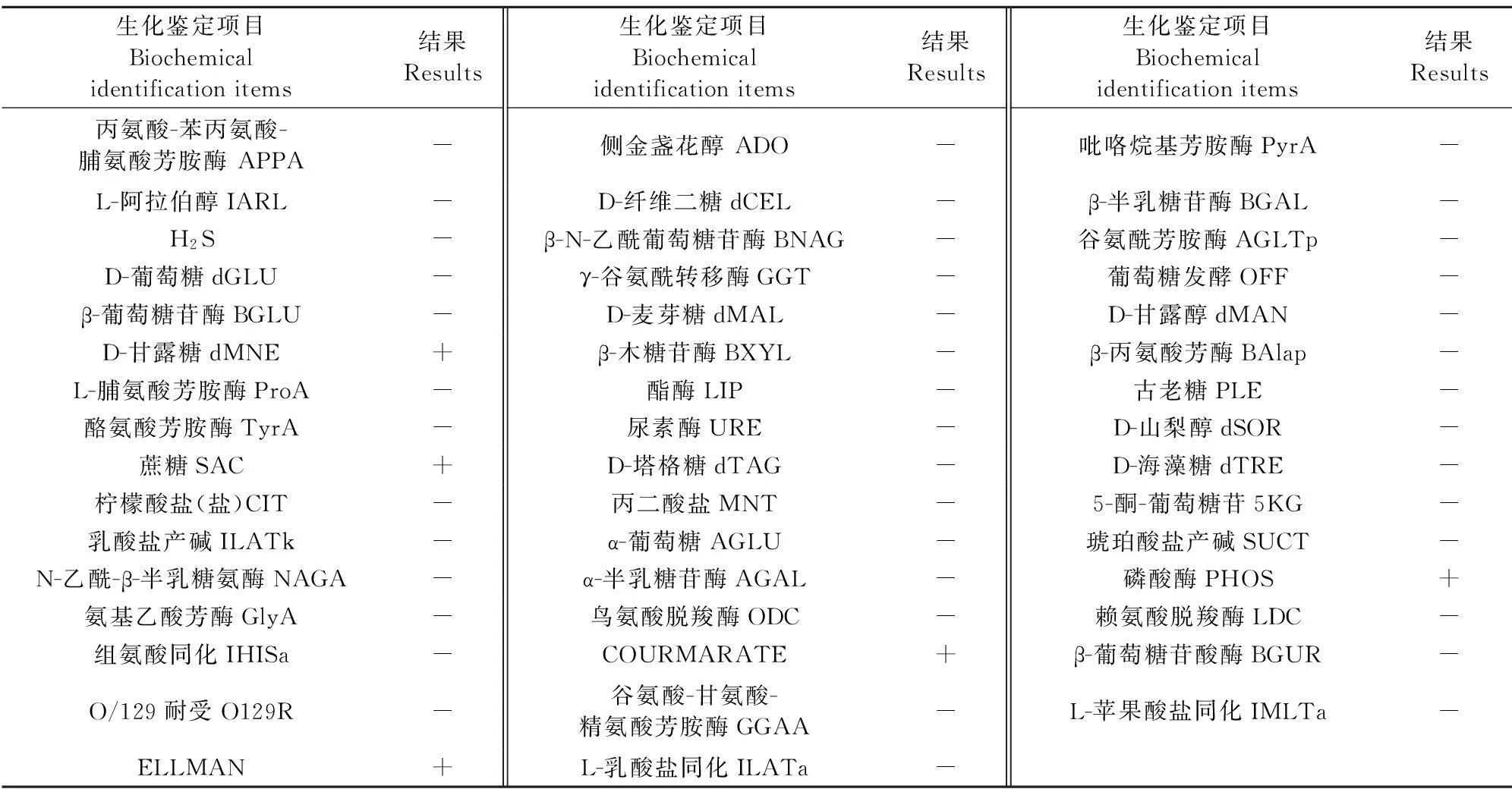
生化鉴定项目Biochemicalidentificationitems结果Results生化鉴定项目Biochemicalidentificationitems结果Results生化鉴定项目Biochemicalidentificationitems结果Results丙氨酸-苯丙氨酸-脯氨酸芳胺酶APPA-侧金盏花醇ADO-吡咯烷基芳胺酶PyrA-L-阿拉伯醇IARL-D-纤维二糖dCEL-β-半乳糖苷酶BGAL-H2S-β-N-乙酰葡萄糖苷酶BNAG-谷氨酰芳胺酶AGLTp-D-葡萄糖dGLU-γ-谷氨酰转移酶GGT-葡萄糖发酵OFF-β-葡萄糖苷酶BGLU-D-麦芽糖dMAL-D-甘露醇dMAN-D-甘露糖dMNE+β-木糖苷酶BXYL-β-丙氨酸芳酶BAlap-L-脯氨酸芳胺酶ProA-酯酶LIP-古老糖PLE-酪氨酸芳胺酶TyrA-尿素酶URE-D-山梨醇dSOR-蔗糖SAC+D-塔格糖dTAG-D-海藻糖dTRE-柠檬酸盐(盐)CIT-丙二酸盐MNT-5-酮-葡萄糖苷5KG-乳酸盐产碱ILATk-α-葡萄糖AGLU-琥珀酸盐产碱SUCT-N-乙酰-β-半乳糖氨酶NAGA-α-半乳糖苷酶AGAL-磷酸酶PHOS+氨基乙酸芳酶GlyA-鸟氨酸脱羧酶ODC-赖氨酸脱羧酶LDC-组氨酸同化IHISa-COURMARATE+β-葡萄糖苷酸酶BGUR-O/129耐受O129R-谷氨酸-甘氨酸-精氨酸芳胺酶GGAA-L-苹果酸盐同化IMLTa-ELLMAN+L-乳酸盐同化ILATa-
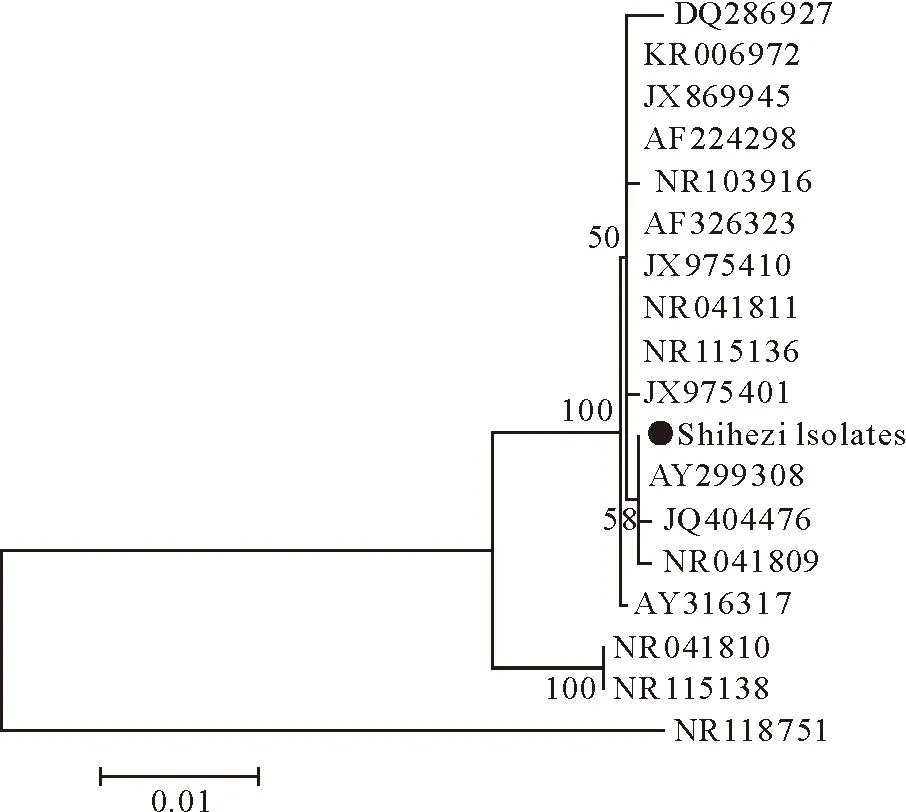
图2 分离菌株16 S rRNA遗传进化分析结果
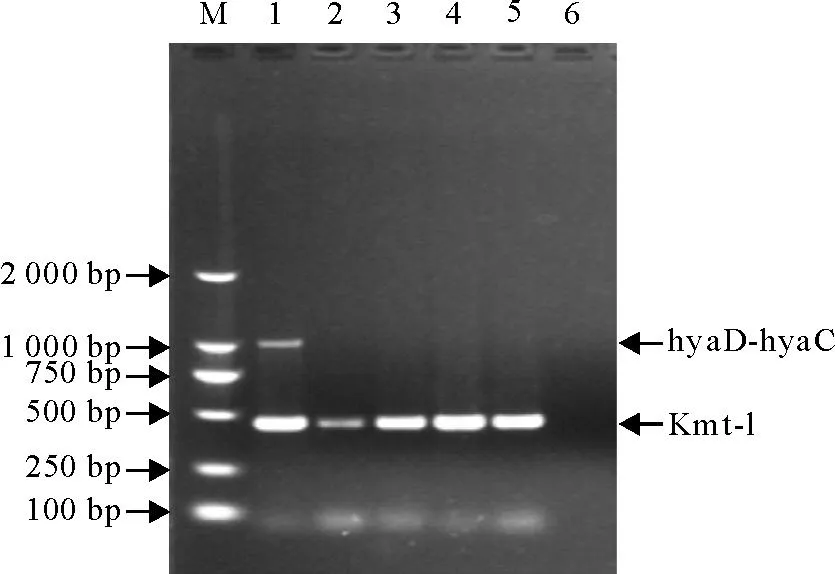
M.DNA标准 DL 2 000;1~5.分别为鉴定Pm A型、B型、D型、E型和F型 6.阴性对照
M.DNA Marker DL 2 000;1-5.Identification of Pm A-type,B-type,D-type,E-type and F-type respectively; 6.Negative control
图3分离Pm的血清型鉴定结果
Fig.3Results of serotype identification of isolated Pm
2.4药敏试验结果
按照常规药敏试验结果如表3。分离的菌株对链霉素、卡那霉素、庆大霉素耐药,对其他30种抗生素敏感。
2.5致病性检测结果
2.5.1小鼠人工感染结果注射菌液1 h后,小鼠出现精神不振,食欲下降; 4.5 h后,注射Pm的小鼠有1只死亡;5.5 h后,小鼠全部死亡,剖解发现肝脏充血肿大,对照组小鼠正常。
2.5.2感染小鼠的内脏细菌分离鉴定无菌采集死亡小鼠肝脏和脾脏分离到与注射菌相同细菌,PCR均扩增Pm特异性基因Kmt-1和hyaD-hyaC均得到特异性片段(460 bp和1 046 bp),对照组小鼠肝脏、脾脏未检测到相应条带(图4)。
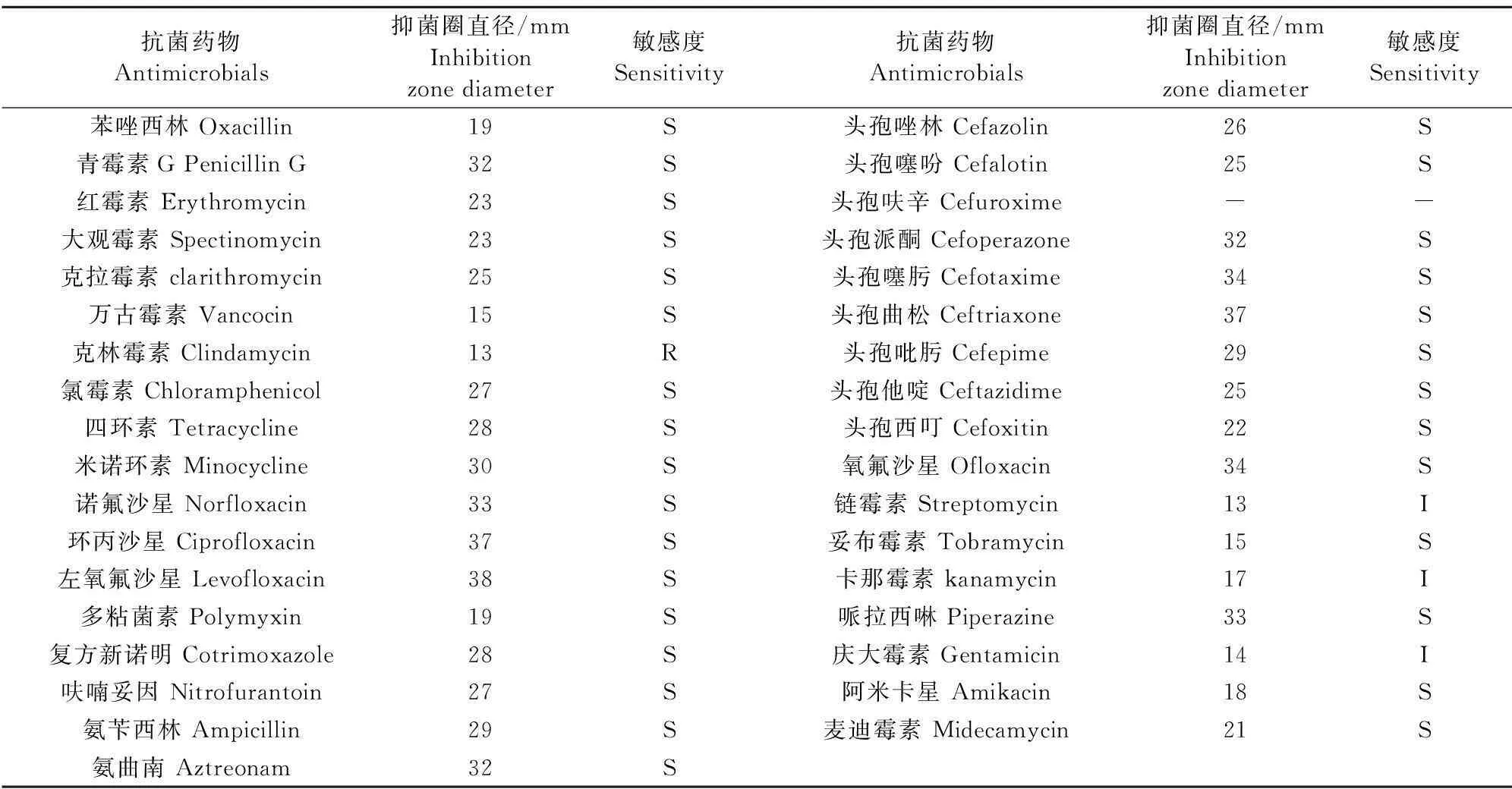
表3 分离菌株的药敏试验结果
注:“R”耐药;“I”中介;“S”敏感;“-”结果判定失败。
Note:"R"Resistance;"I"Intermedium;"S"Sensitive;"-" Results failed.
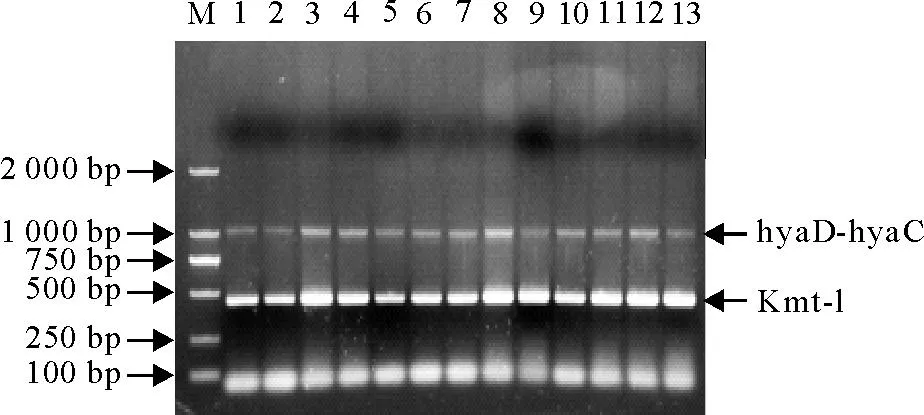
M. DNA标准 DL 2 000;1~13.小鼠内脏分离菌株
3讨论
Pm为需氧或兼性厌氧菌,生长最适的温度为37℃,pH7.2~7.4。对营养要求较严格,在普通培养基上生长贫瘠[12]。本次分离株在初始分离纯化时,在新鲜绵羊血琼脂平板和加入葡萄糖的普通液体培养基生长良好。250 mL/L甘油、-80℃保存后,再次接种培养时,只在高营养条件下生长,这可能是在传代培养时,由于动物体内生长与体外的培养环境的差异,致使菌株的某些生长特性发生变化,对营养条件的要求也出现差异。分离菌株只对链霉素、庆大霉素、卡那霉素耐药,这与牛场对发病牛长期大剂量的使用抗生素治疗不无关系,该菌株对四环素、喹诺酮类、头孢类、青霉素敏感,结果与杨宝凤等人在2014年的试验结果相似。小鼠腹腔注射后,5.5 h内小鼠就全部死亡,说明该Pm对小鼠有极强的致病性。研究提示,A型Pm可能是牛群发生呼吸系统疾病的主要病原,并且通过16S rRNA遗传进化分析,本研究分离的Pm与AY299308(Scotland)、JQ404476(XinJiang)、NR-041809(USA)都有较高的同源性。本试验也同时分离到了大肠埃希菌,在致病性试验中,小鼠在26 h后出现死亡,相对于分离的Pm,其致病性较弱。
牛A型Pm是引起牛呼吸道细菌感染的主要病原之一,由于广泛的存在于牛的各个生长阶段,也经常导致牛的产奶量下降,生长性能减低,甚至死亡,给养牛业带来巨大的影响。最近几年我国的养牛业呈现快速集约化发展,国内外引种的不断加大,各地区的牛只频繁跨区域调动,也因此引起牛的应激,造成牛系统性疾病与日俱增。Pm的致病性主要跟菌株的脂多糖、荚膜及相关蛋白、外膜蛋白和产毒素有关[3];Pm具有的外膜蛋白其功能受到各种选择压力的影响,能从不同程度展示不同菌株间的变化,常用来评定菌株间的差异,从而确定与流行病学的关联,它作为一种选择性屏障,可以阻止多种有毒分子进入细菌细胞,使细菌能在多种环境下生存[2]。我国目前商品化的疫苗主要以B型为主,而不同的血清型Pm之间的交叉免疫保护率较低,致使在临床上预防Pm的传统疫苗效果不佳[13-14]。因此,研制针对A型Pm的疫苗对防治牛呼吸道疾病,减少经济损失十分迫切。本研究临床分离的A型Pm对研制相应的疫苗及诊断技术提供参考。
参考文献:
[1]Carter G R,Chengappa M M. Recommendations for a standard system of designating serotypes ofPasteurellamultocida[J].Asso Vet Lab Diagn,1981,24:37-42.
[2]裴志花,曲桂娟,马红霞,等.多杀性巴氏杆菌外膜蛋白研究进展[J].中国兽医杂志,2013,49(1):48-50.
[3]蔡广强.多杀性巴氏杆菌毒力因子研究进展[J].上海畜牧兽医通讯,2013(6):7-9.
[4]汪漫,胡长敏,陈颖钰.牛A型多杀性巴氏杆菌分离株的鉴定和免疫原性研究[J].中国兽医杂志,2013,49(10):3-10.
[5]杨宝凤,李能章,邹灵秀,等.6株牛源A型多杀性巴氏杆菌的分离与鉴定[J].中国预防兽医学报,2014,36(6):487-489.
[6]马文戈,于力.牛源荚膜血清A型多杀性巴氏杆菌的分离鉴定[J].中国预防兽医学报,2008,30(10):747-750.
[7]马文戈,姜志刚,于力.牛荚膜血清A型巴氏杆菌病的分子流行病学调查[J].中国预防兽医学报,2010,32(5):360-364.
[8]冯思源,马建伟,杜慧慧,等.牛源A型多杀性巴氏杆菌pm0979和pm0442基因编码蛋白对小鼠的免疫保护性研究[J].中国预防兽医学报,2014,36(10):797-800.
[9]范颖,张继瑜,周绪正,等.牛呼吸道疾病的病原学与防制研究进展[J].中国畜牧兽医,2013,40(1):157-163.
[10]Townsend K M, Boyce J D, Chung J Y, et al.Genetic organization ofPasteurellamultocidacap loci and development of a multiplex capsular PCR typing system [J].J Clin Microbiol,2001,39(3):924-929.
[11]肖淦文,陈颖钰,彭清洁,等.牛支原体、巴氏杆菌A型和化脓隐秘杆菌多重PCR快速检测方法的建立[J].中国奶牛,2012,21:4-9.
[12]杨正时,房海.人及动物病原细菌[M].河北石家庄:河北科学技术出版社,2003:820-842.
[13]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:136.
[14]王洪梅,赵贵民,候佩莉,等.牛呼吸道疾病综合征流行现状及防控技术研究进展[J].中国畜牧杂志,2015,51(16):33-39.
Isolation,Identification and Drug Sensitivity Test ofPasteurellamultocidafrom A Large-scale Cattle Farm in Shihezi Xinjiang
LIU Shun-lei1,2,HE Yan-hua2,WANG Xi-chu1,ZHENG Ting-ting1,KONG Ke-wei1,ZHOU Xia1,ZHONG Fa-gang2
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China;2.XinjiangAcademyofAgriculturalandReclamationScience,Shihezi832000,China)
Abstract:To identify the pathogeny of causing dyspnea,cough,emaciation and death of cattle in an intensive cattle farm in Shihezi region,we isolated bacteria from tissue lesions and used routine isolation and identification methods and 16S rRNA sequence analysis to identify its species.With the use of primers fromPasteurellamultocidaspecies-specific gene Kmt-1 and serotype-specific genes(hyaD-hyaC,bcbD,dcbF,ecbJ,fcbD),we employed PCR to amplify relevant genes for the identification.K-B disk diffusion method and a murine infection model were also used. Results showed that we isolated a strain with a hoar,dewdrop-like,none hemolysis clone which is a type of Gram-negative rhabditiform bacteria.Biochemical identification showed that it is consistent withPasteurella.And alignments to published sequences on NCBI showed a 99% identity withP.multocida; only Kmt-1 and hyaD-hyaC genes were amplified with PCR; The isolate was resistant to streptomycin,gentamicin,kanamycin and susceptible to 30 other antimicrobials,and all the infected mice died after challenge. Results showed we isolated a strain of serotype AP.multocidawith strong virulence from a sick cattle.
Key words:bovine respiratory tract infection; pathogenic bacterium; isolation and identification;serotype APasteurellamultocida
收稿日期:2015-10-14
基金项目:兵团重大科技攻关项目(2014AA001-3);兵团第八师科技创新团队建设项目(2015TD07); 国家科技支撑计划项目(2012BAD43B00); 国家自然科学基金项目(31460663)
作者简介:刘顺磊(1990-),男,河南罗山人,硕士研究生,主要从事动物传染病诊断与防治工作。*通讯作者
中图分类号:S852.612
文献标识码:A
文章编号:1007-5038(2016)06-0040-05

