北海近岸养殖海域3种弧菌的分离鉴定及耐药性分析
陈盛峰,陈 佳,禤金彩,龙 寒,袁汉文,何秀苗,2*
(1.广西民族大学海洋与生物技术学院/广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族大学广西林产化学与工程重点实验室,广西南宁 530006)
北海近岸养殖海域3种弧菌的分离鉴定及耐药性分析
陈盛峰1,陈佳1,禤金彩1,龙寒1,袁汉文1,何秀苗1,2*
(1.广西民族大学海洋与生物技术学院/广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族大学广西林产化学与工程重点实验室,广西南宁 530006)
摘要:对北海近岸养殖海域的3种弧菌(Vibrio)进行了分离鉴定,并对鉴定的弧菌进行耐药性分析。通过从北海近岸养殖海域随机采集水样,利用TCBS培养基对所采水样进行弧菌的分离和纯化,采用PCR方法和序列分析对弧菌进行鉴定,并对鉴定出的3种弧菌进行了常用抗菌药物耐药性的检测。共分离获得67株疑似弧菌菌株,经鉴定,19株为副溶血性弧菌(Vibrioparahaemolyticus),4株为霍乱弧菌(Vibriocholera),4株为河流弧菌(Vibriofluvialis)。耐药性分析研究表明,19株副溶血性弧菌总体显示对10种常用抗菌药物具有耐药性,其中100%的菌株对四环素、卡那霉素和红霉素表现耐药,94.7%的菌株对氨苄西林耐药、84.1%的菌株对左氧氟沙星和78.9%的菌株对环丙沙星耐药;4株霍乱弧菌和4株河流弧菌对10种抗菌药物的耐药性均较强,但敏感度低,两者对复方新诺明均表现为中介敏感。本研究提示,北海近岸养殖海域中弧菌种类较多,其中以副溶血性弧菌为主,大多对常用抗菌药物具有耐药性,对北海近岸海水养殖疾病防治具有一定的指导意义。
关键词:弧菌;分离;鉴定;养殖海域;耐药性
海洋弧菌广泛分布在各类河口海区、近岸养殖海域、湾和远洋海域等,主要泛指异营养、好盐性海洋细菌中具有发酵葡萄糖等糖类能力的革兰阴性杆菌,其数量巨大,在海洋环境中占据着优势地位。其中部分弧菌种类,如副溶血性弧菌、霍乱弧菌、溶藻弧菌和创伤弧菌等对海洋鱼类、虾和贝类等水产养殖动物和人类具有致病性[1]。近年来人类因食用感染了病原菌的水产养殖动物而导致的急性腹泻,呕吐等疾病屡见不鲜。刘秀梅[2]等研究了国家食源性疾病监测网的数据资料,发现目前微生物引起的食源性疾病是中国主要的食品安全问题,其中副溶血性弧菌是最主要的食源性致病菌[3];由创伤弧菌引起的致死率超过半数[4],如果未在72 h内处理,致死率可达到100%[5];霍乱弧菌引发的急性病在中国国内各大城市中也常被报道[6-7];由河流弧菌引起的症状与霍乱引起的症状相似,临床表现为呕吐、发烧、脱水等症状,在欧洲、美国、中东及东南亚地区均有发生[8],使得这些弧菌逐渐成为公共卫生关注的焦点。广西北部湾位于中国南海西北部,海产资源丰富,生态环境多样化。随着海洋资源的不断开发和利用,海水养殖规模也不断扩大,海水养殖环境中由弧菌引起的病害日益盛行,严重制约着该地区海水养殖业的发展。因此,加强北部湾海水养殖海域弧菌的流行病学监测,如弧菌的分离鉴定及其耐药性分析对于弧菌病的防控具有重要意义。本研究从广西北海地区近岸海水养殖比较集中的水域采集水样,对弧菌进行初步分离,并对较常见的具有致病潜力的副溶血性弧菌、霍乱弧菌和河流弧菌进行鉴定,同时对3种弧菌的耐药情况进行检测,旨在初步了解北海近岸养殖海域部分弧菌,特别是副溶血性弧菌、霍乱弧菌和河流弧菌的污染及其耐药情况,为该地区水产养殖疾病防治提供依据。
1材料与方法
1.1材料
2014年8月份从广西北海海水养殖产业较集中的营盘、竹林和石头埠采集海水样品。以养殖海域中心方圆30 m为采样区域,以正方形的4个点和中心点设置5个采样点,每个采样点以2 m纵深采集水样,3个不同海域各采集5个水样,每个水样将各采样点随机采集的3个样品混合作为1个水样进行分析,每份各取50 mL,共15份,所采集的样品4℃低温保存。硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium,TCBS)购自青岛高科园海博生物技术有限公司;药敏试纸购自杭州天和微生物试剂有限公司;Lysis buffer for microorganism to direct PCR、Taq酶和dNTP均购自宝生物工程(大连)有限公司;其他所用化学试剂均为国产分析纯。LB液体基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠(NaCl) 5 g/L,蒸馏水0.5 L,人工海水0.5 L,pH7.0;LB固体培养基:在LB液体培养基中加入琼脂20 g/L制成,pH7.0;TCBS培养基按说明进行配制;所有培养基均需经过高压灭菌锅121 ℃灭菌30 min。
1.2方法
1.2.1引物设计与合成根据副溶血性弧菌、霍乱弧菌和河流弧菌的相关基因[9]设计3对引物用于相应弧菌的分子鉴定,引物序列如表1所示,由中国华大基因公司合成。
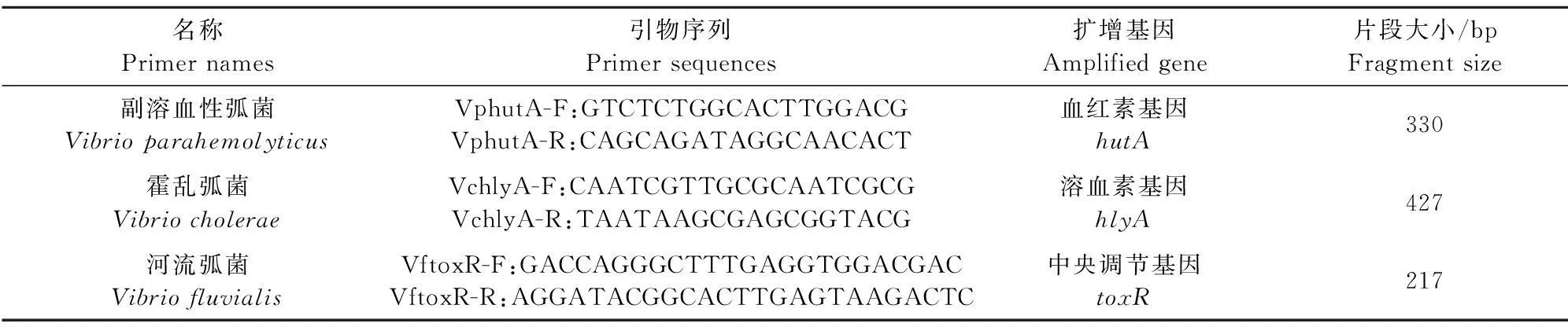
表1 引物序列
1.2.2菌株筛选与纯化将采集的水样与无菌海水充分混合后,连续做10倍递进稀释,得到10-1~10-6的不同稀释度。每个稀释度分别取100 μL涂布于TCBS固体平板中,每个稀释度做5个平行,37 ℃恒温箱中培养24 h。挑取特征菌落,分别划线至新的TCBS培养基平板,倒置于恒温箱中培养24 h,进一步分离得到单一、纯化的菌落。将所分离的所有菌落进行编号,并记录其大小、形状、颜色、黏度等形态特征。获得的单菌落进行甘油冷冻保存,备用。
1.2.3PCR鉴定及序列分析将分离保存菌株接种TCBS平板,37 ℃恒温箱中培养24 h,挑取单菌落进行PCR鉴定,具体如下:挑取单菌落置于含有50 μL Lysis buffer for microorganism to direct PCR的1.5 mL离心管中,80 ℃水浴锅中变性15 min,取5 μL上清液做PCR模板。PCR反应体系为10×PCR buffer 2.5 μL,dNTP 2.5 mmol/L 1.0 μL,引物各0.5 μL,Taq酶1.25 μL,补灭菌双蒸水至25 μL。按以下反应程序进行PCR扩增:94℃ 5 min;94 ℃ 30 s,62 ℃ 45 s, 72 ℃ 1 min,循环30次;最后72 ℃延伸10 min。产物经12 g/L琼脂糖凝胶电泳鉴定,阳性产物经试剂盒纯化后送中国华大基因有限公司测序,序列与NCBI上已发表的相应弧菌的相应序列利用Lasergene软件进行同源性比较,以证实PCR产物的正确性,所用的参考株序列如下:副溶血弧菌NZ-AWJG01000125、NZ-AWHT01000101、NA-JNTJ01000249、NZ-AWMD 01000068和NZ-AWMC01000092;河流弧菌AF 170885、ASXS01000001和ASXT01000022;霍乱弧菌X51746、AF117836、Y00557、AF194418和AF117833。
1.2.4弧菌药物敏感性试验鉴定后的弧菌通过纸片扩散法(K-B法)进行常用药物的敏感性检测。菌液均匀涂布LB固体培养基平板,无菌夹取药敏试纸纸片分别贴于培养基表面,每个培养皿放置5个药物纸片,相邻纸片等距离>2.0 cm。然后倒置于37 ℃恒温培养箱中培养24 h~48 h后,游标卡尺测量抑菌圈的直径,每株菌进行3次重复试验,取其抑菌圈直径平均值。所用药敏试纸包括头孢他啶、复方新诺明、四环素、氯霉素、链霉素、卡那霉素、红霉素、氨苄西林、环丙沙星和左氧氟沙星10种抗菌药物。按照美国临床和实验室标准化协会(CLSI)标准对分离弧菌对相应药物的敏感、中介敏感和耐药情况进行判定[10]。
2结果
2.1弧菌的分离
通过TCBS培养基从采集的水样中分离纯化得到67株疑似弧菌菌株,菌株在TCBS平板中呈黄色或绿色,不同菌株菌落大小略有不同。其中黄色菌落中直径最大的达到2 mm~4 mm,较小为1 mm~2 mm;绿色菌落都比较大,直径为3 mm~5 mm。黄色和绿色单菌落形状都是圆形,边缘规则,菌落光滑有光泽,表面凸起,质地黏稠。
2.2PCR鉴定结果及序列分析
提取67株分离纯化所得的菌株的DNA分别进行PCR鉴定,结果显示67株菌株中有19株出现330 bp的目的条带,与副溶血性弧菌的鉴定结果一致,随机挑取其中5株的PCR产物进行序列测定,并与NCBI上已经公布的副溶血性弧菌菌株的hutA基因进行同源性比对,结果5株分离弧菌与参考株的同源性均达到98%~99%之间;有4株出现427 bp的目的条带,与霍乱弧菌一致,4株分离株的PCR产物序列与霍乱弧菌的hlyA基因的同源性达到96%~100%;有4株出现217 bp的目的条带,与河流弧菌的鉴定结果一致,4株分离株的PCR产物序列与河流弧菌参考株的toxR基因的同源性则达到91%~93%;其余菌株未能成功扩增出如上目的片段,而阴性对照组均无阳性条带扩出(图1)。
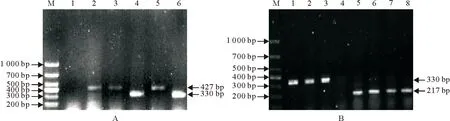
A.M.DNA 标准DL1 000;1.阴性对照;2、3、5 .霍乱弧菌;4、6.副溶血弧菌
2.3药敏试验结果
2.3.119株副溶血弧菌药敏试验结果19株副溶血性弧菌对头孢他啶等10种抗菌药物的敏感性试验结果见表2。所有鉴定出的19株副溶血性弧菌均表现为对四环素、卡那霉素和红霉素耐药;表现为对氨苄西林、左氧氟沙星和环丙沙星耐药的分别达到18株、16株和15株,耐药率较高;表现为对头孢他啶和氯霉素中介敏感的达到11株和10株;表现为对链霉素、复方新诺明和氯霉素高度敏感的分别为5株、4株和3株。
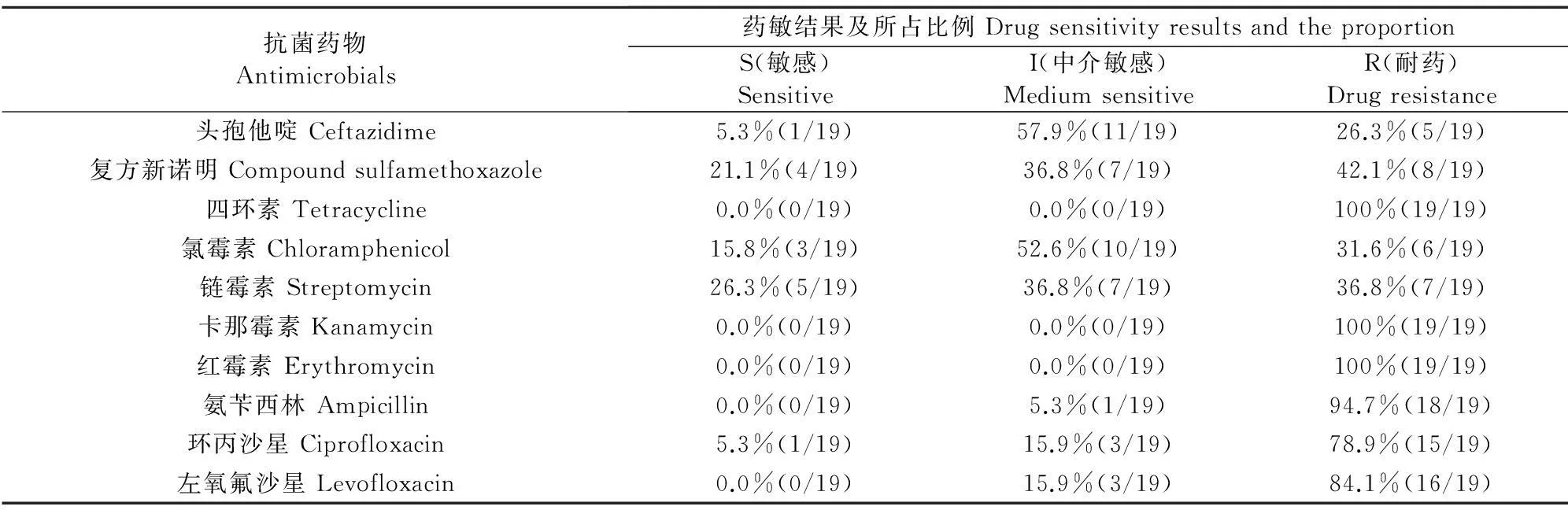
表2 副溶血性弧菌药敏试验结果
2.3.24株霍乱弧菌药敏试验结果4株霍乱弧菌对头孢他啶等10种抗菌药物的敏感性试验结果见表3。4株霍乱弧菌对头孢他啶、四环素、卡那霉素、红霉素、氨苄西林和左氧氟沙星均表现为耐药,对复方新诺明均表现为中介敏感,其中有3株对链霉素表现为耐药,有3株表现为对氯霉素中介敏感,4株霍乱弧菌对所用的10种抗菌药物均不敏感。
2.3.34株河流弧菌药敏试验结果4株河流弧菌对10种常用抗菌药物的敏感性试验结果见表4。4株河流弧菌对四环素、链霉素、卡那霉素、红霉素、氨苄西林、环丙沙星和左氧氟沙星均表现为耐药,对复方新诺明表现为中介敏感;其中有3株对头孢他啶表现为耐药,对氯霉素表现为耐药和中介敏感的分别有2株,4株河流弧菌对10种抗菌药物均不敏感。
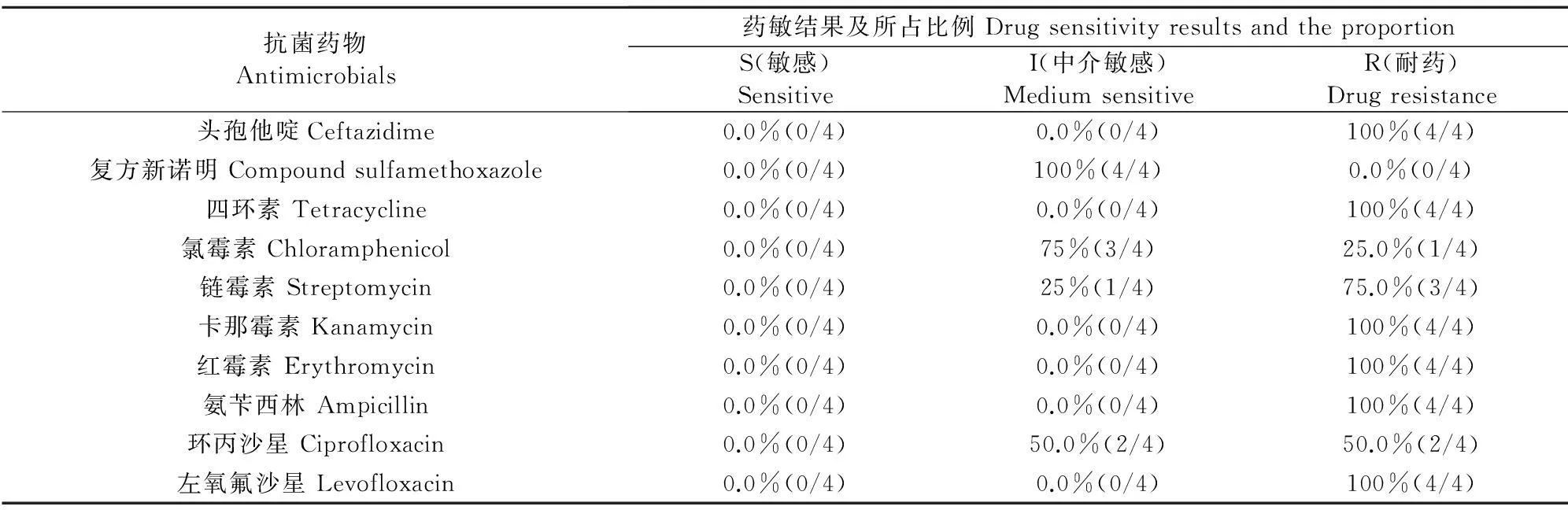
表3 霍乱弧菌药敏试验结果
3讨论
弧菌是广泛存在于各类河口海区和近岸养殖海域等的革兰阴性杆菌,副溶血弧菌、霍乱弧菌和河流弧菌均已被报道引起人类的腹泻等疾病,并已在包括广西在内的海产品中检出[8,11-12]。因此,对海产养殖海域进行弧菌的分离鉴定及耐药情况分析对于提高食品安全性具有重要参考意义。本研究利用TCBS培养基从北海近岸同一片养殖海域随机采集水样中成功分离获得67株疑似弧菌菌株,并根据部分弧菌的特有基因,即河流弧菌的中央调节基因(toxR)、霍乱弧菌的溶血素基因(hlyA)以及副溶血弧菌的血红素利用基因(hutA)设计引物对弧菌进行PCR鉴定。Vinothkumar[9]等分别利用针对这3个基因的三重PCR成功完成了对来自227个样品中主要弧菌,即河流弧菌、副溶血性弧菌和霍乱弧菌的鉴定,并证实,针对这3个基因的三重PCR方法对于河流弧菌、副溶血性弧菌和霍乱弧菌弧菌的检测是特异、敏感和简便的,可以用于临床和环境样品的检测。通过PCR方法,本研究从分离纯化的67株弧菌中鉴定出19株副溶血性弧菌、4株霍乱弧菌、4株河流弧菌,三者的检出率达到40.3%(27/67)。此外,尚有40株疑似弧菌未能获得最终鉴定,很有可能是其他种类的弧菌,有待进一步的鉴定。本研究结果表明,广西北海近岸养殖海域有弧菌污染,且弧菌的种类具有多样性(3种以上)的趋势,该结果与刘军义[13]等和何苹萍[14]等对广西沿海海产品中弧菌的研究调查结果相似。此外,在本研究所鉴定的弧菌类型中,副溶血弧菌比例占了近70.4%(19/27),与该地区周边海域的检测结果相似[15],进一步证实北海近岸养殖海域副溶血性弧菌污染严重。副溶血性弧菌作为海水中广泛存在的一种人畜共患病原菌,对水产养殖业和人类公共卫生都将是重要的威胁[16-17],本研究结果对于北海近岸海域的海水养殖的防御提供了基础资料。
本试验结果表明,北海近岸水产养殖海域水样中分离鉴定的副溶血性弧菌、霍乱弧菌和河流弧菌对头孢他啶等8种抗菌药物具有耐药性,仅对复方新诺明和氯霉素表现出一定的敏感度,与相关学者的弧菌耐药性研究结果相似[6,18]。研究结果还发现同一样品中的副溶血性弧菌、霍乱弧菌和河流弧菌具有相近的耐药性,不同样品中的相同弧菌类型表现的耐药性基本一致,不同样品的不同弧菌类型其耐药性有所差异,但对大多数的抗菌药物都显示了耐药性。研究所用的10种抗菌药物大部分为海水养殖常用抗菌药物。姚小娟[19]对分离自中国江苏、福建、浙江和海南地区发病动物和养殖池塘的106株弧菌进行了包括复方新诺明、氯霉素、链霉素、卡那霉素、和红霉素在内共14种水产常用抗菌药物的耐药性分析,结果表明分离的弧菌对常用的抗菌药物大多表现出高度耐药性,从北海地区水域分离的3种弧菌的耐药性分析结果与该研究结相似,而这些耐药性出现的原因有待于进一步研究。
参考文献:
[1]滕勇勇,王琪,吴雷,等.致病性弧菌的生物学特性和致病因子研究进展[J].热带医学杂志,2014(10):1396-1399.
[2]刘秀梅,陈艳,王竹天,等.2005年中国食源性疾病暴发事件监测资料分析[J].中国食品卫生杂志,2008,20(6):506-509.
[3]纪懿芳,胡文忠,姜爱丽,等.海产品中副溶血弧菌检测方法研究进展[J].2015,36(5):365-369.
[4]Horseman M A,Salim S.A comprehensive review ofVibriovulnificus:an important cause of severe sepsis and skin and soft-tissue infection[J].Int J Infect Dis,2010,15(3):e157-e166.
[5]Margot A,Melissa K,Edwin F,et al.FatalVibriovulnificussepsis in vertically acquired hepatitis C[J].J Pediat Gastroenterol Nutri,2012,56(5):32-33.
[6]屠丽红,张曦,陈洪友,等.2005-2014年上海市O139群霍乱弧菌的分子特征和耐药性研究[J].疾病监测,2015(3):223-227.
[7]权怡,方锦嵩,李翠云,等.广西2000-2010年O139群霍乱弧菌毒力检测及耐药性分析[J].中国热带医学,2012(9):1068-1070.
[8]黄玉柳,黄国秋,叶欣宇,等.文蛤中1株河流弧菌的分离·鉴定以及药敏试验[J].安徽农业科学,2012,40(9):5234-5242.
[9]Vinothkumar K,Bhardwaj A K,Ramamurthy T,et al.Triplex PCR assay for the rapid identification of 3 majorVibriospecies,Vibriocholerae,Vibrioparahaemolyticus,andVibriofluvialis[J].Diagn Microbiol Infect Dis,2013,76(4):526-528.
[10]美国临床和实验室标准协会(CLSI)Document M02-A11-2012.KB法执行标准M02-A11-1[S].
[11]权怡,方锦嵩,李翠云,等.广西2000-2010年O139群霍乱弧菌毒力检测及耐药性分析[J].中国热带医学,2012(9):1068-1070.
[12]李叶青,吴科明,黄嘉,等.防城港市2011年-2013年食品中副溶血性弧菌污染状况与分析[J].中国卫生检验杂志,2015(05):725-727.
[13]刘军义.广西沿海文蛤及其生境中细菌菌群的初步调查[J].水产科技情报,1996(2):80-83.
[14]何苹萍,黄玉柳,陈秀荔,等.南宁市售文蛤中弧菌的分离鉴定[J].南方农业学报,2013(2):328-332.
[15]李叶青,吴科明,黄嘉,等.防城港市2011年-2013年食品中副溶血性弧菌污染状况与分析[J].中国卫生检验杂志,2015(5):725-727.
[16]江艳华,姚琳,李风铃,等.副溶血性弧菌的耐药状况及耐药机制研究进展[J].中国渔业质量与标准,2013(4):96-102.
[17]梁炳健,蔡周梅,黎柱荣.食品中副溶血性弧菌的危害分析与检验[J].中国保健营养(上旬刊),2013,23(6):3371-3372.
[18]江艳华,姚琳,李风铃,等.青岛市售养殖海水虾中副溶血性弧菌的分离及耐药性分析[J].中国人兽共患病学报,2013(5):516-519.
[19]姚小娟.海水养殖源弧菌耐药性检测与整合子分析[D].上海:上海海洋大学,2014.
Isolation,Identification and Drug Resistance Analysis of ThreeVibrioSpecies in Aquaculture Area of Beihai
CHEN Sheng-feng1,CHEN Jia1,XUAN Jin-cai1,LONG Han1,YUAN Han-wen1,HE Xiu-miao1,2
(1.SchoolofMarineSciencesandBiotechnology/GuangxiCollegesandUniversitiesKeyLaboratoryofUtilizationofMicrobialandBotanicalResources,GuangxiUniversityforNationalities,Nanning,Guangxi,530006,China;2.GuangxiKeyLaboratoryofChemistryandEngineeringofForestProducts,Nanning,Guangxi,530006,China)
Abstract:This study aimed to isolate and identify marineVibrioin aquaculture area of Beihai,and then drug resistances of theVibriowere analyzed.Water samples were randomly collected from the aquaculture area of Beihai.Vibriowere isolated and purified from those water samples by TCBS medium.The PCR technique and sequence alalysis were used for further identification of theVibrio.Finally,antimicrobial sensitivity tests were carried out for these identifiedVibrio.The results indicated that 67 strains ofVibriowere successfully isolated,19 strains were identified asVibrioparahaemolyticus,4 strains wereVibriocholeraand 4 strains wereVibriofluvialis.Drug resistance results indicated that all of the 19Vibrioparahaemolyticusshowed overall performance of antimicdrobial resistance,100% ofVibrioparahaemolyticuswere resistant to tetracycline,kanamycin and erythromycin,94.7% of strains were resistant to ampicillins,84.1% of strains were resistant to levofloxacin and 78.9% of strains were resistant to ciprofloxacin. All of theVibriocholeraesandVibriofluvialisalso showed resistance to the 10 kinds of antimicrobials. Both of them were medium sensitive to compound sulfamethoxazole. The results showed that there are different kinds ofVibrioprevalent in aquaculture area of Beihai.Vibrioparahaemolyticusis the most commonVibrio. Most of the isolates display resistance to commonly used antimicrobials. This result would be an important guide for disease control in the aquaculture area of Beihai.
Key words:Vibrio; isolation; identification; aquaculture area; drug resistance
收稿日期:2015-10-30
基金项目:广西民族大学2015研究生教育创新计划项目(gxun-chxs2015090);2014广西民族大学相思湖青年学者创新团队资助项目;广西林产化学与工程协同创新高水平研究项目(2013B01)
作者简介:陈盛峰(1990- ),男,福建泉州人,硕士研究生,主要从事动物微生物与免疫学研究。*通讯作者
中图分类号:S852.613;Q939.91
文献标识码:A
文章编号:1007-5038(2016)06-0029-06

