H3N2亚型猪流感病毒HA和HA1蛋白的原核表达
纪方晓,陈济铛,石庆伟,王 衡,张桂红
(华南农业大学兽医学院,广东广州 510642)
H3N2亚型猪流感病毒HA和HA1蛋白的原核表达
纪方晓,陈济铛,石庆伟,王衡,张桂红*
(华南农业大学兽医学院,广东广州 510642)
摘要:为原核表达H3N2亚型猪流感病毒(SIV)的HA和HA1蛋白,通过RT-PCR方法获得SIV的HA和HA1基因,克隆至原核表达载体pMAL-c5X,并转化至原核表达菌Rosetta(DE3)中,表达菌经IPTG诱导表达后进行SDS-PAGE和Western blot分析。结果显示,成功表达了H3亚型SIV的HA和HA1蛋白,目的蛋白均以可溶性蛋白和包涵体两种形式存在,并与H3N2亚型SIV的HA单克隆抗体反应,说明HA和HA1蛋白具有良好的反应原性。
关键词:H3N2亚型猪流感病毒;HA蛋白;HA1蛋白;原核表达
猪流感(Swine influenza,SI)是由猪流感病毒(Swine influenza virus,SIV)引起的一种急性、热性、高度接触性呼吸道传染病,临床上以突发、高热、咳嗽、 呼吸困难、 精神沉郁、 高发病率、 低病死率为特征[1]。目前,全球猪群中主要以H1N1、H1N2和H3N2亚型SIV广泛流行,对养猪业造成巨大的经济损失[2-3]。猪是人流感病毒、禽流感病毒的易感宿主,是流感病毒跨种传播的中间宿主,是流感病毒基因重组的“混合器”,是引起流感大暴发重要原因,因此,对于猪流感的研究具有重要的公共卫生学意义[4]。
A型流感病毒为正黏病毒科病毒,基因组为分节段的单股负链RNA病毒,长约13.6 kb,编码11种蛋白质。其中片段4编码的血凝素(HA)蛋白为流感病毒重要的糖蛋白之一,其一级结构含有4个结构域,即信号肽、胞浆域、跨膜域、胞外域。HA蛋白空间结构呈三聚体组成的棒状,分头、颈部,头部由HA1构成,含受体结合位点和抗决定簇原,颈部由部分HA1和HA2构成[5]。HA蛋白可识别宿主细胞表面的病毒受体结合位点,介导病毒进入宿主细胞,并刺激机体产生抗体,该抗体可以中和流感病毒[6]。因此,H3N2亚型SIV HA和HA1蛋白的研究对H3亚型SIV血清学诊断方法的建立以及疫苗的开发有重要意义。
1材料与方法
1.1材料
1.1.1毒株、菌种、质粒H3N2亚型猪流感病毒A/Swine/Guangdong/L22/2010 (H3N2)由华南农业大学兽医学院传染病教研室分离并保存;pMAL-c5X原核表达载体购自纽英伦生物技术有限公司;Rosetta (DE3)感受态细胞购自康为世纪生物科技有限公司。
1.1.2试剂H3N2亚型猪流感病毒血凝素(Hemagglutinin/HA)鼠单抗购自义翘神州生物有限公司;羊抗鼠荧光二抗(IRDye800标记)购自LI-COR biosciences 公司;总RNA极速提取试剂盒购自上海飞捷生物技术有限公司;限制性内切酶NotⅠ和SalⅠ购自纽英伦生物技术有限公司;质粒提取试剂盒、凝胶DNA回收试剂盒购自美国Omega公司;T4 DNA连接酶、高保真TaqDNA聚合酶等购自宝生物工程有限公司。
1.2方法
1.2.1引物设计应用Signal P V2.0.b2 和TMHMM Server v.2.0生物学软件对H3N2亚型猪流感病毒的HA基因进行信号肽、跨膜区、胞外区分析,根据去除信号肽、跨膜区、胞外区的HA基因序列,用生物学软件Oligo7.0分别设计HA、HA1两对引物(表1),由英潍捷基(上海)公司合成,上游引物加上NotⅠ的酶切位点,下游引物加上SalⅠ的酶切位点和HIS标签。
1.2.2HA、HA1基因的扩增按总RNA极速抽提试剂盒说明书提取病毒RNA,利用随机引物反转获得cDNA,再利用HA、HA1的特异性引物经PCR获得HA和HA1基因。
1.2.3重组表达质粒的构建和鉴定HA、HA1基因经NotⅠ和SalⅠ酶切后,克隆至pMAL-c5X表达载体,构建pMAL-c5X-HA和pMAL-c5X-HA1重组质粒,将重组质粒转化至Rosetta(DE3)感受态细胞,挑取单个菌落进行PCR鉴定,将阳性菌液送英潍捷基公司测序并进行酶切鉴定。
1.2.4重组质粒的诱导表达和可溶性分析阳性菌液培养至OD600 nm为0.5~0.6时,加入终浓度为0.8 mmol/L IPTG,于30 ℃、 200 r/min诱导5 h。收集菌体在冰浴条件下超声破碎,取沉淀和上清进行SDS-PAGE分析。
1.2.5重组蛋白的Western blot分析重组蛋白HA、HA1进行SDS-PAGE后电转至硝酸纤维素膜(NC),用50 g/L脱脂奶粉封闭2 h,与1∶700稀释的鼠源抗体4 ℃孵育过夜,再与1∶8 000稀释IRDye 800 CW Goat anti-Mouse IgG (H+L) 二抗室温孵育1 h,将NC膜放入双色激光分析系统中扫膜分析。

表1 引物及其序列
2结果
2.1HA、HA1基因的PCR扩增结果
PCR扩增的HA和HA1基因经10 g/L琼脂糖凝胶电泳后,出现与目的基因大小一致的2条特异性条带,分别为1 539 bp和987 bp(图1)。
M.DNA 标准 DL 2 000;1~2.HA PCR扩增产物;3~4.HA1 PCR扩增产物
M.DNA Marker DL 2 000;1-2.PCR products of HA gene;3-4.PCR products of HA1 gene
图1HA、HA1基因的PCR扩增结果
Fig.1PCR amplification of HA and HA1 genes
2.2重组质粒的鉴定
重组质粒pMAL-c5X-HA、pMAL-c5X-HA1测序结果与目的基因一致,并经NotⅠ和SalⅠ双酶切后经10 g/L琼脂糖凝胶电泳,可见与目的基因一致的条带(图2),证明重组质粒构建成功。
2.3重组质粒的诱导表达
阳性菌液经IPTG诱导后经SDS-PAGE,用考马斯亮蓝显色后可见与目的蛋白大小一致的条带(图3),HA1和HA蛋白加上MBP标签(40 ku)大小分别约为80 ku和100 ku。
2.4目的蛋白的可溶性分析
诱导后的菌液超声破碎后,取上清和沉淀进行SDS-PAGE分析,上清和沉淀均存在目的蛋白(图4),即重组蛋白具有可溶性。
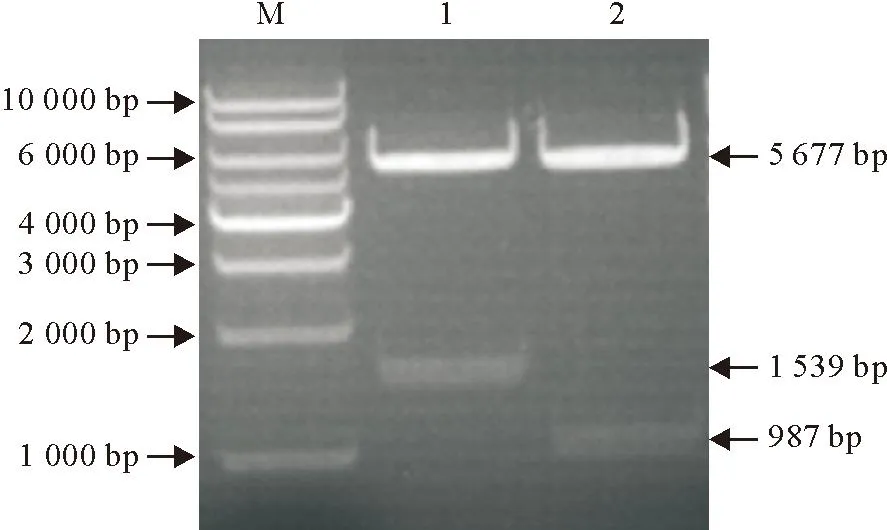
M.DNA标准DL 10 000;1.pMAL-c5X-HA双酶切;2.pMAL-c5X-HA1双酶切
M.DNA Marker DL 10 000;1.Products of pMAL-c5X-HA digested byNotI andSalI;2. Products of pMAL-c5X-HA1 digested byNotⅠ andSalⅠ
图2重组质粒的酶切鉴定
Fig.2Enzyme digestion identification of the recombinant plasmid
2.5重组蛋白的免疫原性分析
重组蛋白HA和HA1与H3N2亚型猪流感病毒血凝素鼠单抗反应后,在NC膜上分别见到约为100 ku和80 ku的特异性条带,证实了HA和HA1蛋白具有良好的反应原性(图5)。
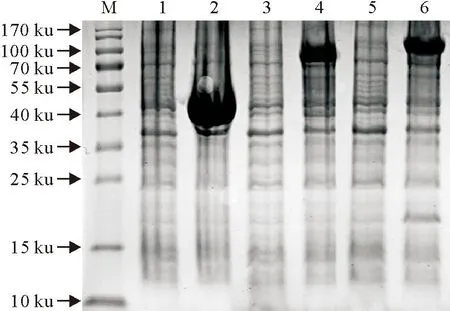
M.蛋白分子质量标准;1.pMAL-c5X空载体诱导前;2.pMAL-c5X空载体诱导后;3.重组质pMAL-c5X-HA1诱导前;4.重组质粒pMAL-c5X-HA1诱导后;5.重组质粒pMAL-c5X-HA诱导前;6.重组质粒pMAL-c5X-HA诱导后
M.Protein molecular weight Marker;1.Products of pMAL-c5X without induction;2.Products of pMAL-c5X induced;3.Products of pMAL-c5X-HA1 without induction;4.Products of pMAL-c5X-HA1 induced;5.Products of pMAL-c5X-HA without induction;6.Products of pMAL-c5X-HA induced
图3重组蛋白表达的SDS-PAGE分析
Fig.3SDS-PAGE analysis of the recombinant proteins
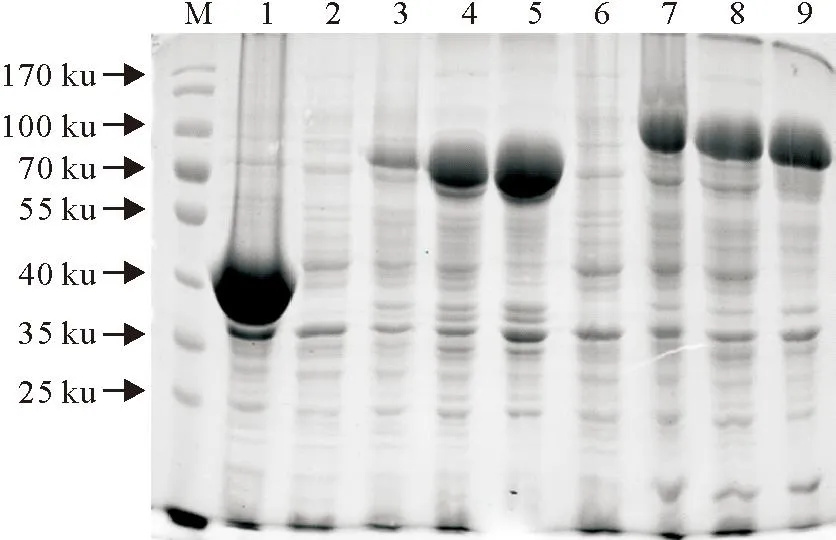
M.蛋白分子质量标准;1.pMAL-c5X空载体诱导后;2.pMAL-c5X-HA1诱导前;3.pMAL-c5X-HA1诱导后;4.pMAL-c5X-HA1菌液超声破碎上清;5.pMAL-c5X-HA1菌液超声破碎沉淀;6.pMAL-c5X-HA诱导前;7.pMAL-c5X-HA诱导后;8.pMAL-c5X-HA菌液超声破碎上清;9.pMAL-c5X-HA菌液超声破碎沉淀
M.Protein molecular weight Marker;1.Products of pMAL-c5X induced;2.Products of pMAL-c5X-HA1 without induction;3.Products of pMAL-c5X-HA1 induced;4.Supernatant of expression products of pMAL-c5X-HA1;5.Precipitates of pMAL-c5X-HA1;6.Products of pMAL-c5X-HA without induction;7.Products of pMAL-c5X-HA induced;8.Supernatant of expression products of pMAL-c5X-HA;9.Precipitates of pMAL-c5X-HA
图4重组蛋白的可溶性分析
Fig.4Solublility analysis of the recombinant proteins
3讨论
目前,猪流感病毒的抗体检测主要用血凝抑制(HI)试验和酶联免疫吸附试验(ELISA)。HI试验操作简单,但是血清中含有非特异性的红细胞凝集因子,容易出现假阳性,需要用受体破坏酶(receptor destroying enzyme,RDE)或胰酶、高碘酸钾等方法处理血清[7]。ELISA是实验室常用的一种检测方法,其简单、易行,适用于大批量的血清检测。美国IDEXX公司于2006年研发了检测猪流感病毒H1N1和H3N2亚型抗体的ELISA试剂盒,但现在已停产。因此,表达H3N2亚型流感病毒HA、HA1蛋白为建立H3亚型猪流感病毒抗体的检测方法提供了基础。
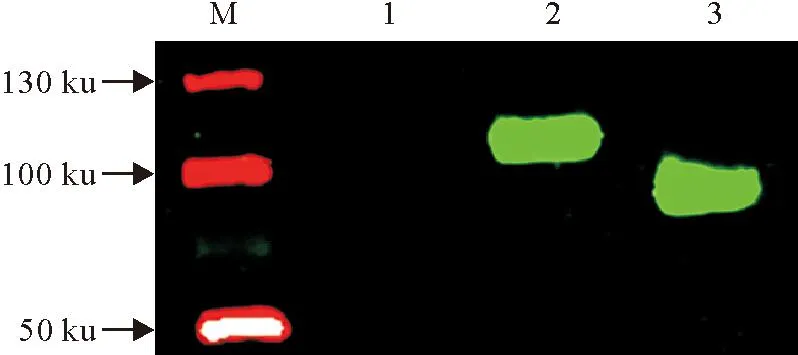
M.蛋白分子质量标准;1.阴性对照;2.HA重组蛋白;3.HA1重组蛋白
M.Protein molecular weight Marker;1.Negative control;2.Recombinant protein HA;3.Recombinant protein HA1
图5重组蛋白的Western blot分析
Fig.5Western blot analysis of the recombinant proteins
在现有的表达系统中,原核表达是实验室最为成熟的表达蛋白的系统,具有遗传背景清楚、成本低、时间短、表达量高等优点,是表达外源基因的首选系统[8]。相对于真核表达系统,大肠埃希菌表达系统的加工、修饰体系不完善,目的蛋白不能形成正确的空间结构,但抗体可以识别具有线性表位的抗原,因此,大肠埃希菌表达的蛋白仍具有反应原性。有多名学者成功表达了H3N2猪流感病毒的HA蛋白,验证了该蛋白具有反应原性,并以此建立了ELISA检测方法,但HA蛋白多以包涵体形式存在[9-11]。
麦芽糖结合蛋白(MBP)标签由大肠埃希菌K12的malE基因编码,大小约为40 ku,在大肠埃希菌表达系统中可增加目的蛋白的溶解性,现有多名学者利用MBP标签成功表达了可溶性蛋白[12-13]。又因HIS标签易于蛋白的纯化,本研究通过引物设计构建了带有HIS6-MBP组合标签的原核表达质粒pMAL-c5X-HA和pMAL-c5X-HA1,成功表达了HA和HA1蛋白,并能与H3N2亚型猪流感病毒HA单克隆抗体发生反应,说明了HA和HA1蛋白具有良好的反应原性,为H3亚型猪流感病毒的检测试剂和疫苗的研发奠定了基础。
本试验是在华南农业大学兽医学院/国家生猪种业工程技术研究中心,人兽共患病防控制剂国家地方联合工程实验室,农业部兽用疫苗创制重点实验室,广东省动物源性人兽共患病预防与控制重点实验室完成。
参考文献:
[1]宫晓倩,汪秀会,阮宝阳,等.H3N2亚型猪流感病毒反向遗传操作技术平台的建立[J].中国兽医科学,2015(8):781-786.
[2]Lyoo K S,Kim J K,Jung K,et al.Comparative pathology of pigs infected with Korean H1N1,H1N2,or H3N2 swine influenza A viruses[J].Virol J,2014, 11(1):170-170.
[3]Ma J,Shen H,Liu Q,et al.Pathogenicity and transmissibility of novel reassortant H3N2 influenza viruses with 2009 pandemic H1N1 genes in pigs[J].J Virol,2015,89(5):2831-2841.
[4]Urbaniak K,Kowalczyk A,Markowska-Daniel I.Influenza A viruses of avian origin circulating in pigs and other mammals[J].Acta Biochim Pol,2014,61(3):433-439.
[5]董浩,李林,胡桂学.猪流感病毒的分子生物学研究进展[J].黑龙江畜牧兽医,2011(7):31-33.
[6]McKean D,Huppi K,Bell M,et al.Generation of antibody diversity in the immune response of Balb/c mice to influenza virus hemagglutinin[J].Proc Natl Acad Sci USA,1984,81(10):3180-3184.
[7]王方昆,王一成,袁秀芳,等.猪流感诊断方法研究进展[J].动物医学进展,2006(4):17-21.
[8]邓春梅,葛玉强,刘丽,等.外源基因表达系统的研究进展[J].现代生物医学进展,2010(19):3744-3746.
[9]刘天强,于海,张强,等.H3N2亚型猪流感病毒血凝素基因的原核表达及间接ELISA诊断方法的建立[J].中国预防兽医学报,2008(10):795-799.
[10]丁选亚,乔传玲,陈艳,等.H3N2亚型猪流感病毒重组HA1蛋白间接ELISA诊断方法的建立[J].畜牧兽医学报,2008(9):1230-1234.
[11]Cho H J,Lee Y,Chang R S,et al.Maltose binding protein facilitates high-level expression and functional purification of the chemokines RANTES and SDF-1alpha fromEscherichiacoli[J].Protein Expr Purif,2008,60(1):37-45.
[12]Sluchanko N N,Tugaeva K V,Faletrov Y V,et al.High-yield soluble expression,purification and characterization of human steroidogenic acute regulatory protein (StAR) fused to a cleavable maltose-binding protein (MBP)[J].Protein Expr Purif,2016,119:27-35.
[13]Hu J,Qin H,Gao F P,et al.A systematic assessment of mature MBP in membrane protein production:overexpression,membrane targeting and purification[J].Protein Expr Purif,2011,80(1):34-40.
Prokaryotic Expression of HA and HA1 Genes of H3N2 Swine Influenza Virus
JI Fang-xiao,CHEN Ji-dang,SHI Qing-wei,WANG Heng,ZHANG Gui-hong
(CollegeofVeterinaryMedicine,SouthChinaAgricultureUniversity,Guangzhou,Guangdong,510642,China)
Abstract:To express the HA and HA1 proteins of H3N2 swine influenza virus,the HA and HA1 genes were amplified by RT-PCR and cloned into prokaryotic expression vector pMAL-c5X.Recombinant plasmid pMAL-c5X-HA and pMAL-c5X-HA1 were transformed toE.coliRosetta (DE3) and induced with IPTG.The HA and HA1 proteins were expressed successfully in the forms of soluble proteins and inclusion bodies.What′s more,both of the HA and HA1 proteins could be recognized by HA antibody of H3N2 subtype,it revealed that the HA and HA1 proteins have good antigenicity.
Key words:H3N2 swine influenza virus; HA protein; HA1 protein; prokaryotic expression
收稿日期:2015-10-17
基金项目:现代农业产业技术体系建设专项资金项目(CARS-36)
作者简介:纪方晓(1990-),女,山东德州人,硕士,主要从事动物传染病研究。*通讯作者
中图分类号:S852.659.5
文献标识码:A
文章编号:1007-5038(2016)06-0022-04

