氧化应激对PRRSV致PAM细胞TLR3/NF-κB分子转录的影响
闫晓霞,藏雅婷,谢丽君,刘欢欢,高 洪,黄建新,严玉霖*
(1.云南农业大学动物科学技术学院,云南昆明 650201; 2.大理农林职业技术学院,云南大理 671003)
氧化应激对PRRSV致PAM细胞TLR3/NF-κB分子转录的影响
闫晓霞1,藏雅婷1,谢丽君1,刘欢欢1,高洪1,黄建新2,严玉霖1*
(1.云南农业大学动物科学技术学院,云南昆明 650201; 2.大理农林职业技术学院,云南大理 671003)
摘要:为探讨氧化应激对猪繁殖与呼吸综合征病毒(PRRSV)感染猪肺泡巨噬细胞(PAM)TLR3/NF-κB信号分子转录的影响,体外分离培养PAM,分为对照组、PRRSV感染组、抗氧化剂NAC+PRRSV组,促氧化剂H2O2+RRRSV组。分别在培养6、12、24、48、72 h收集细胞,观察各组的细胞病变、real-time PCR检测PRRSV、TLR3、TRIF和NF-κB mRNA转录量的变化。结果显示,PRRSV感染组PRRSV、TLR3、TRIF及NF-κB mRNA的转录量与对照组相比随感染时间的延长显著升高(P<0.05),48 h达到最大值;NAC处理接毒组各信号分子mRNA的转录量比PRRSV感染组同时间点略低;H2O2处理接毒组比PRRSV感染组的略高。结果表明,氧化应激可增强PRRSV致PAM细胞TLR3/NF-κB分子mRNA的转录量, NF-κB的活化可能是PRRSV导致细胞损伤的机制之一。
关键词:猪繁殖与呼吸综合征病毒;猪肺泡巨噬细胞;氧化应激;Toll样受体3;NF-κB
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的危害养猪业的重要病毒性传染病,以怀孕母猪早产、流产、死胎、木乃伊胎等繁殖障碍以及仔猪和育肥猪呼吸道疾病为特征[1]。PRRSV为单股正链RNA病毒,属于动脉炎病毒科动脉炎病毒属[2-3]。PRRSV主要侵害肺泡巨噬细胞(pulmonary alveolar macrophage,PAM),从而导致弥散性间质性肺炎,损害机体免疫机能,进一步对机体造成继发性感染[4]。PAM被认为是急性感染期PRRSV复制的主要位点[5],但其确切的发病机制还有待进一步阐明。
Toll样受体(Toll-like receptors,TLRs)是一类病原相关分子模式识别受体(pattern recognition receptors,PRRs),是免疫系统抵抗病原微生物感染的天然受体[6-7]。特别是被病毒双股RNA(double-stranded RNA,dsRNA)激活的Toll 样受体3 (Toll-like receptor 3,TLR3)在病毒感染呼吸系统中发挥着着关键的作用[8-9]。活化的TLR3募集转接蛋白(TIR-domain-containing adaptor-inducing interferon-β,TRIF)以后诱导的NF-κB的活化是通过TRIF的氨基端与肿瘤坏死因子受体相关因子6(tumour-necrosis-factor receptor-associated factor 6,TRAF6)的羧基端结合,最终诱导NF-κB的活化。NF-κB是先天性和适应性免疫应答中的一个重要的调节因子,它可以调节促炎细胞因子的表达以及细胞的增殖和凋亡,是决定急性肺损伤严重程度的重要细胞因子[10]。
近年来发现,机体疾病的发生、发展与机体的氧化应激状态密切相关[11]。本实验室先前的研究发现PRRSV体外感染PAM后活性氧自由基(reactive oxygen species,ROS)含量显著增加[12],但氧化应激是否增强了TLR3/NF-κB信号分子的表达还未被阐明。本文分别通过用抗氧化剂NAC和促氧化剂H2O2处理PAM再行PRRSV感染,初步研究氧化应激对PRRSV致PAM TLR3/NF-κB分子转录的影响,揭示PRRSV致PAM损伤的作用机制。
1材料与方法
1.1材料
1.1.1病毒PRRSV云南株YN-2011(登录号:JX857698)由本实验室分离纯化保存。
1.1.2实验动物经ELISA 和RT-PCR方法检测PRRSV血清抗体和抗原均为阴性的6周龄健康仔猪1头。
1.1.3主要仪器与试剂XDS-2倒置显微镜,重庆光电仪器总公司产品;CO2培养箱,美国Thermo scientific公司产品; CFX荧光定量PCR仪和PCR仪,美国Bio-Rad公司产品;RPMI-1640培养基、胎牛血清,美国Hyclone公司产品;UltraPowerTM核酸染料,北京百泰克生物有限公司产品;Trizol试剂,北京百泰克生物有限公司产品;PRRSV抗体ELISA检测试剂盒,北京爱德士元亨生物科技有限公司产品;One-step gDNA removal and cDNA synthesis superMix,北京全式金生物技术有限公司产品;SuperReal荧光定量预混试剂盒,北京天根生化科技有限公司产品。
1.2方法
1.2.1肺泡巨噬细胞的制备将PRRSV阴性健康猪从颈动脉放血致死,无菌摘除肺,采用支气管肺泡灌洗法分离和培养PAM。RPMI-1640培养液重悬细胞并计数,将细胞稀释成106个/mL浓度后,以每孔2 mL铺在6孔细胞培养板上培养24 h待用。
1.2.2试验分组与处理将培养的细胞分为4组:①未感染PRRSV的细胞为正常对照组;②PRRSV感染组;③抗氧化剂NAC+PRRSV组:加入10 mmol/L NAC,置于37℃、体积分数为5%的CO2培养箱中预先孵育1 h后,再行PRRSV感染;④促氧化剂H2O2+RRRSV组:加入50 μL H2O2,置于37℃、体积分数为5% CO2培养箱中预先孵育1 h后,再行PRRSV感染,每组设3个重复,试验组加入的病毒量为200 μL。分别于培养后6、12、24、48、72 h观察细胞出现的病理变化(CPE);同时收集PAM分别置于无菌EP管中,置-80 ℃保存,用于荧光定量PCR检测。
1.2.3荧光定量PCR检测PRRSV、TLR3、TRIF和NF-κB mRNA转录水平使用Trizol提取总RNA,用紫外可见光核酸蛋白分析仪检测总RNA的纯度和含量。One-step gDNA Removal and cDNA Synthesis SuperMix试剂盒逆转录总RNA成为cDNA,于-20℃保存。引物由北京华大基因生物科技有限公司合成,引物序列如表1。在realtime-PCR专用八联排管中依次加入cDNA 2 μL,引物1.5 μL,无菌水9 μL,Mix 12.5 μL,在CFX荧光定量PCR仪上反应,每个样本设置3个重复空。反应条件为: 95℃ 15 min;95℃ 20 s,60℃ 40 s,72℃ 30 s,共40个循环;最后72℃延伸5 min,4℃终止反应。

表1 TLR3/NF-κB基因和内参基因的引物序列及参数
1.2.4NF-kB与PRRSV mRNA转录水平相关性分析根据各试验组各时间点NF-κB与PRRSV mRNA相对表达量,以NF-κB mRNA相对表达量为纵坐标,PRRSV mRNA相对表达量为横坐标,作转录水平相关性分析。
2结果
2.1PRRSV感染PAM 的CPE情况
倒置显微镜下观察不同试验组于6、12、24、48、72 h细胞出现的肉眼可见的CPE。48 h时未感染PRRSV的PAM无CPE出现,细胞呈圆形或椭圆形;感染PRRSV的PAM出现CPE,细胞变形聚集;NAC处理感染PRRSV的PAM,少量细胞变形聚集;H2O2处理感染PRRSV的PAM,细胞大量变形聚集,脱落(图1)。其余时间段CPE基本一致。
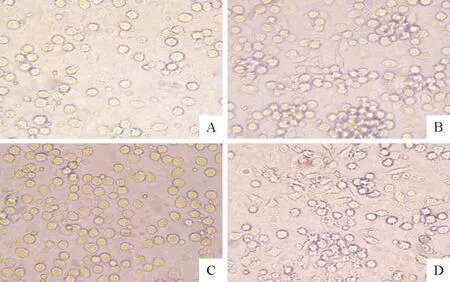
A.对照组; B.PRRSV感染组;C.NAC处理组;D.H2O2处理组
2.2细胞中PRRSV mRNA转录结果
用2-△△Ct法计算PRRSV mRNA相对表达量。各时间点 PRRSV感染组、NAC+PRRSV组、H2O2+RRRSV组PRRSV mRNA的转录量均显著高于对照组,在48 h达到最大值。与对照组相比,PRRSV感染组PRRSV mRNA的表达量随着感染时间的延长逐渐升高,6 h起差异极显著具有统计学意义;在抗氧化剂NAC+PRRSV组中PRRSV mRNA的转录量与相同时间点PRRSV感染组相比有所降低;而在促氧化剂H2O2+RRRSV组PRRSV mRNA的转录量与相同时间点PRRSV感染组中PRRSV mRNA的转录量相比明显上调,12 h差异极显著(图2)。
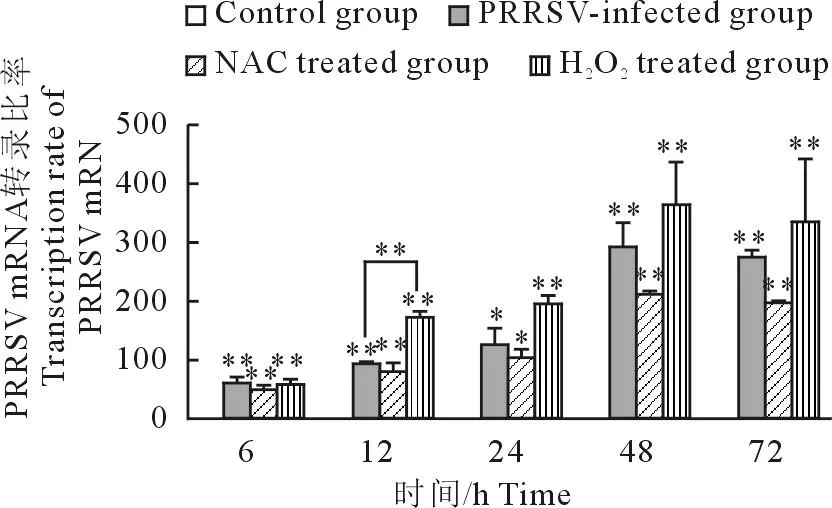
*P<0.05;**P<0.01
2.3细胞中TLR3、TRIF mRNA转录结果
用2-△△Ct法计算TLR3、TRIF mRNA相对表达量。各时间点PRRSV感染组、NAC+PRRSV组、H2O2+RRRSV组TLR3、TRIF mRNA转录水平均高于对照组。与对照组相比,PRRSV感染组TLR3、TRIF mRNA的表达量随着感染时间的延长逐渐增加,48 h后有下降趋势,但仍显著高于对照组;NAC+PRRSV组TLR3、TRIF mRNA的表达量与对照组相比升高,但与相同时间点的PRRSV感染组相比降低;而H2O2+PRRSV组TLR3、TRIF mRNA的表达量与PRRSV感染组相比明显升高(图3)。
2.4细胞中NF-κB mRNA转录结果
各时间点试验组NF-κB mRNA转录水平均高于对照组。与对照组相比,PRRSV感染组NF-κB mRNA的转录量随着感染时间的延长逐渐增加,12 h具有极显著差异,48 h后有下降趋势,但仍高于对照组;NAC+PRRSV组NF-κB mRNA的转录水平与对照组相比升高,但与相同时间点的PRRSV感染组相比有所降低;H2O2+PRRSV组NF-κB mRNA的转录量与同时间点的PRRSV感染组相比略升高,48 h后有下降趋势(图4)。
2.5NF-kB与PRRSV mRNA转录水平相关性分析
不同试验组之间NF-kB与PRRSV mRNA相关性分析见图5。PRRSV感染组R2=0.503,R=0.709,强相关;抗氧化剂NAC+PRRSV组R2=0.342,r=0.585,中等程度相关;促氧化剂H2O2+RRRSV组R2=0.068,r=0.261,呈弱相关。
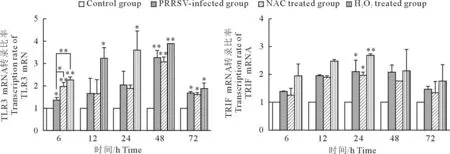
*P<0.05;**P<0.01
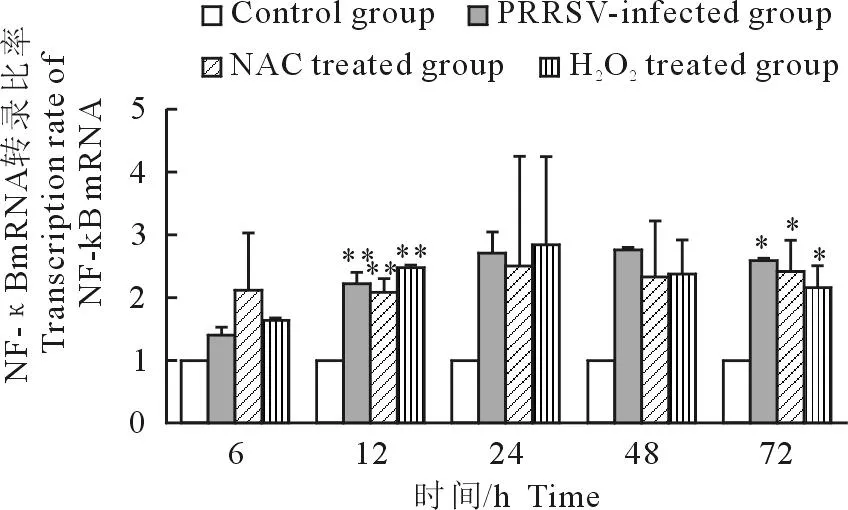
*P<0.05;**P<0.01
3讨论
随着对氧自由基的深入研究, 曹纯章[13]等利用H2O2的强氧化性研究了其对心肌细胞损伤的作用,发现H2O2的浓度与心肌细胞损伤的程度存在互作效应。研究发现,氧化应激的标志物H2O2在慢性阻塞性肺炎患者的呼吸道中上升,并且随着病情的加重产生更多的H2O2[14]。此外,N-乙酰半胱氨酸(N-Acetyl-L-cysteine,NAC)可以抑制慢性阻塞性肺炎的恶化[15]。这些研究表明机体疾病的发生、发展与机体的氧化应激状态密切相关。本试验分别用抗氧化剂NAC和氧化剂H2O2处理PAM,改变细胞的氧化应激状态,发现用NAC处理PAM后的CPE与正常接毒组CPE相比,细胞变形、聚集数量及范围明显减少;而用H2O2处理PAM后的CPE与正常接毒组CPE相比,细胞变形、聚集数量及范围增多。这与原红艳等[16]用NAC、H2O2处理耳蜗毛细胞的CPE描述基本一致,表明氧化应激参与PAM的CPE效应。
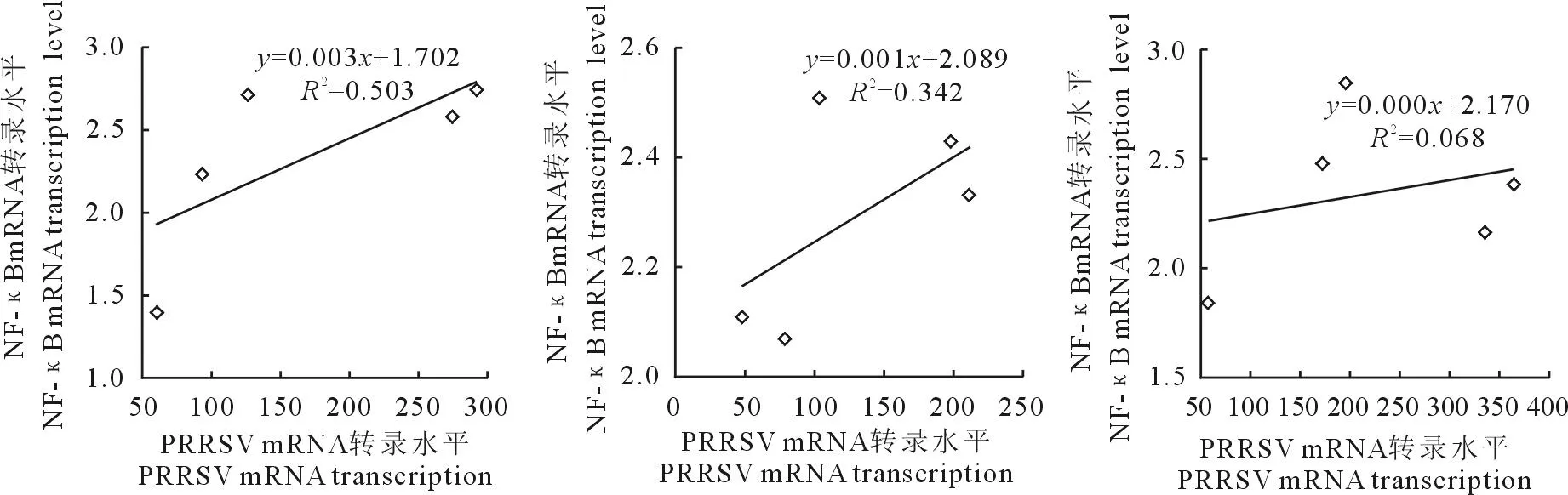
图5 不同试验组NF-κB与PRRSV转录水平相关性分析
研究表明氧化应激参与NF-κB的活化[17]。人类免疫缺陷病毒、乙型肝炎病毒、丙型肝炎病毒、日本脑炎病毒和流感病毒通过产生ROS来激活NF-κB通路[18]。但H2O2增强NF-κB信号的分子机制还不明确。 Takada Y等[19]研究表明,H2O2通过酸磷酸化IkBa酪氨酸和NF-κB p65亚基的丝氨酸来激活NF-κB。也有人报道H2O2通过磷酸化I-κB激酶(IkB kinases,IKKs)的丝氨酸残基激活NF-κB[20]。 本试验用氧化剂H2O2和抗氧化剂NAC改变细胞的氧化应激状态,发现TLR3/NF-κB信号通路中相关分子的转录水平发生变化。在抗氧化剂NAC+PRRSV组TLR3/NF-κB信号通路中相关分子的转录量较正常接毒组有所降低;在促氧化剂H2O2+RRRSV组TLR3/NF-κB信号通路中相关分子的转录水平较正常接毒组明显升高,说明氧化应激增强了NF-κB的活化,这与Akira K等[21]报道的氧化应激增强NF-κB的信号可能来源于表TLR3的表达相符。结果表明PRRSV产生的氧化应激可能是通过增强TLR3的表达进而使NF-κB活化。
NF-κB在病毒感染细胞凋亡中发挥着关键作用,它既可以通过延长宿主细胞的生存来发挥抗凋亡的作用,又可以通过促细胞凋亡的作用促进病毒的扩散。PRRSV对体内的旁邻细胞主要发挥促凋亡作用[18]。但PRRSV感染时活化的NF-κB 对PAM的作用还有待进一步研究。本试验通过对PRRSV与NF-κB mRNA相对表达量进行相关性分析,得出PRRSV在PRRSV感染组与NF-κB呈强相关,在抗氧化剂NAC+PRRSV组、促氧化剂H2O2+RRRSV组依次为中等程度相关与弱相关。由此可知,随着时间的延长,PRRSV mRNA转录水平与信号分子NF-κB转录水平呈正相关,而相关性依次减弱。揭示PRRSV在PAM中的复制与增殖可能与NF-κB的表达量有关,这一结果为PRRSV引起的病理学分子通路提供了重要依据。
参考文献:
[1]Wang R,Zhang Y J.Antagonizing interferon-mediated immune response by porcine reproductiveand respiratory syndrome virus[J].Biomed Res Int,2014:315470. doi: 10.1155/2014/315470.
[2]冉智光,杨汉春.猪繁殖与呼吸综合征研究进展[J].猪业科学,2006(5):21-22.
[3]Faaberg K S,Balasuriyam U B R,Brinton A,et al.Family Arteriviridae in Virus Taxonomy,Ninth Report of the International Committee on Taxonomy of Viruses[M].London,UK,2011.
[4]Chen Y,He S,Sun L,et al.Genetic variation,pathogenicity,and immunogenicity of highly pathogenic porcine reproductive and respiratory syndrome virus strain XH-GD at different passage levels[J].Arch Virol,2015,1-10.doi:10.1007/s00705-015-2597-6.
[5]Kavanova L,Prodělalova J,Nedbalcova K,et al.Immune response of porcine alveolar macrophages to a concurrent infection with porcine reproductive and respiratory syndrome virus and Haemophilus parasuisinvitro[J].Vet Microbiol,2015,180(1-2):28-35.
[6]Marshak R A,Rifkin I R.Immunologically active autoantigens:the role of Toll-like receptors in the development of chronic inflammatory disease[J].Annu Rev Immunol,2007,25:419-441.
[7]Chi H,FlavellL R A.Innate recognition of non-self nucleic acids[J].Genome Biol,2008,9(3):211.
[8]Kuzemtseva L,Martín G,Soldevila F,et al.Regulation of Toll-like receptors 3,7 and 9 in porcine alveolar macrophages by different genotype 1 strains of porcine reproductive and respiratory syndrome virus[J].Vet Immunol Immunopathol,2014,158(3-4):189-198.
[9]Huang S H,Wei W,Yun Y.Upregulation of TLR7 and TLR3 gene expression in the lung early after respitatory syncytial virus infection of mice[J].Acta Microbiologica Sinica,2009,49(2):239-245.
[10]Thomas R,Mark M.A Triffic perspective on acute lung injury[J].Cell,2008,4 (6):208-210.
[11]Valyi N T,Olson S J,Nagy K,et al.Herpes simplex virus type I latency in the murine nervous system is associated with oxidative damage to neurons[J].Virology,2000,278:309-321.
[12]刘倩.PRRSV感染对仔猪体内氧化应激状态的影响[D].云南昆明:云南农业大学,2009.
[13]曹纯章.心肌细胞死亡的氧化应激机制及其防治学的研究[D].吉林长春:白求恩医科大学, 2000.
[14]Rahman I.Oxidative stress in pathogenesis of chronic obstructive pulmonary disease:cellular and molecular mechanisms[J].Cell Biochem Biophys, 2005,43:167-188.
[15]Zheng J P,Kang J,Huang S G,et al.Effect of carbocisteine on acute exacerbation of chronic obstructive pulmonary disease (PEACE study):a randomised placebo-controlled study[J].Lancet,2008,371:2013-2018.
[16]原红艳,张淑香,李兴启,等.N-乙酰半胱氨酸对活性氧诱导耳蜗毛细胞凋亡的抑制作用的观察[J].听力学及言语疾病杂志,2012,20(3):266-268.
[17]Sankay G,Michael K.Missing pieces in the NF-κB puzzle[J].Cell,2002,109:S81-S96.
[18]Lee S M,Steven B,Kletboeker S.Porcine arterivirus actives the NF-κB pathway through IkB degradation[J].Virology,2005,342:47-59.
[19]Takada Y,Mukhopadhyay A,Kundu G C,et al.Hydrogen peroxide activates NF-kB through tyrosine phosphorylation of IkB-alpha and serine phosphorylation of p65:evidence for the involvement of IkB kinase and SYK protein-tyrosine kinase[J].J Biol Chem,2003,278:24233-24241.
[20]Enesa K,Phua C,Dean J,et al.Hydrogen peroxide prolongs nuclear localization of NF-kB in activated cells by suppressing negative regulatory mechanisms[J].J Biol Chem,2008,283:18582-18590.
[21]Akira K,Hisatoshi S,Satoru Y,et al.Oxidative stress enhances Toll-like receptor 3 response to double-stranded RNA in airway epithelial cells[J].Am J Respir Cell Mol Biol,2010,42(6):651-660.
Effect of Oxidative Stress on Transcription of TLR3/NF-κB Molecules in PRRSV Infected PAM
YAN Xiao-xia1,ZANG Ya-ting1,XIE Li-jun1,LIU Huan-huan1,GAO Hong1,HUANG Jian-xin2,YAN Yu-lin1
(1.CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming,Yunnan,650201,China;2.DaliCollegeofAgriculturalandForestry,Dali,Yunnan,671003,China)
Abstract:To explore the effect of oxidative stress on transcription of TLR3/NF-κB signaling pathway induced by porcine reproductive and respiratory syndrome virus (PRRSV) infected pulmonary alveolar macrophage (PAM).The PAM were isolated aseptically and divided into four groups,pretreated PAM with oxidants and antioxidants before PRRSV infection groups,PRRSV-infected group and the uninfected PAM as control group and culturedinvitro.The PAM were collected at 6,12,24,48 and 72 hours after infection.The cell pathogenic effect (CPE) was observed in the experimental groups and the control group at all time points; the mRNA transcription of PRRSV,TLR3,TRIF and NF-κB in different groups were detected by real-time PCR.The results showed that the mRNA levels of PRRSV,TLR3,TRIF and NF-κB in PRRSV-infected group were significantly higher compared with the control group over time (P<0.05 )and the maximum was 48 hpi; In NAC treated group,the mRNA levels of PRRSV,TLR3,TRIF and NF-κB were slightly lower than that in PRRSV-infection group; pretreatment oxidative stress with specific agonist H2O2,the mRNA transcription of PRRSV,TLR3,TRIF and NF-κB were higher.The results indicated that oxidative stress augments the mRNA levels of TLR3/NF-κB molecule in PAM infected with PRRSV,the activation of NF-κB may be one of the significant aspect of PRRSV pathogenesis.
Key words:PRRSV;PAM;oxidative stress;TLR3;NF-κB
收稿日期:2015-11-02
基金项目:国家自然科学基金项目(31160496,31360599);正大大学生科技创新行动基金;云南农业大学2015年研究生科技创新项目(2015ykc4)
作者简介:闫晓霞(1990-),女,山西五台人,硕士研究生,主要从事畜禽传染病病理研究。*通讯作者
中图分类号:S852.659.6
文献标识码:A
文章编号:1007-5038(2016)06-0007-06

