高致病性猪繁殖与呼吸综合征病毒双重液相基因芯片检测方法的建立
陈 茹, 于晓璐, 高小博, 薛春宜, 宋长绪, 邱 杨, 刘志玲, 王 莹, 段燕喻
(广东出入境检验检疫局技术中心,广东广州 510623; 2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623; 3.中山大学生命科学大学院,广东广州 510275;4.国家卫生计生委科学技术研究所,北京 100081; 5.广东省农业科学院动物卫生研究所,广东广州 510640)
研究论文
高致病性猪繁殖与呼吸综合征病毒双重液相基因芯片检测方法的建立
陈茹1,2, 于晓璐3, 高小博4, 薛春宜3, 宋长绪5, 邱杨1, 刘志玲1,2, 王莹1,2, 段燕喻1,2
(广东出入境检验检疫局技术中心,广东广州 510623; 2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623; 3.中山大学生命科学大学院,广东广州 510275;4.国家卫生计生委科学技术研究所,北京 100081; 5.广东省农业科学院动物卫生研究所,广东广州 510640)
摘要:为了实现快速检测猪繁殖与呼吸综合征病毒(PRRSV)并同步鉴别高致病性PRRSV毒株(HP-PRRSV),根据PRRSV囊膜蛋白GP2基因保守序列和HP-PRRSV 特有的Nsp2基因区保守序列设计特异扩增引物和杂交探针,通过双重一步法RT-PCR不对称扩增和双重微球杂交反应,建立了双重液相基因芯片方法。对12株PRRSV以及其他12种猪病原体的检测显示,该法能特异性检测12株PRRSV毒株并准确鉴别其中7株HP-PRRSV,与其他病原体无交叉反应;对PRRSV、HP-PRRSV病毒液的检测低限均小于每个反应0.5 TCID50;其组内、组间检测变异系数均<10%;检测55份疑似临床样品并与商品化荧光RT-PCR试剂盒比较检测结果,符合率达98.2%(54/55)。研究结果为适应临床快速检测PRRSV提供了一种新的分子生物学检测方法。
关键词:猪繁殖与呼吸综合征病毒;高致病性猪繁殖与呼吸综合征病毒;xMAP液相芯片
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是一种高度传染性疾病,引起母猪流产、死胎、木乃伊胎等繁殖障碍症状,以及猪的呼吸道症状。该病自20世纪80年代末期开始流行,曾迅速传遍全球各主要养猪国家,已成为严重威胁我国养猪业发展的重要传染病之一。其病原为猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)。依据血清学试验及基因序列分析研究可将PRRSV划分为欧洲型和美洲型两种基因型。自1991年初中国台湾报道暴发该病以来,猪繁殖与呼吸综合征已在我国大陆普遍存在[1]。2006年我国暴发“猪高热症”,研究表明其主要致病病原是具有高致病性的美洲型PRRSV变异毒株(Highly pathogenic PRRSV, HP-PRRSV)[2]。HP-PRRSV相对于经典美洲型PRRSV在非结构蛋白Nsp2区域缺失了多个氨基酸, 是其特有的分子标志[3]。HP-PRRSV具有极强的致病性,是近年来对养猪业危害最严重的病毒之一。养殖领域为了控制疫情大量使用疫苗,但也带来了疫苗株毒力返强产生疫苗衍生毒株等问题。
加强检测PRRSV并区分HP毒株对于猪场预防PRRSV急性暴发、监测活疫苗免疫及排放、辅助调整免疫方案等防控措施具有积极作用,并能为进境种猪实施PRRS检疫把关提供技术支持。在检测鉴别PRRSV毒株方面国内已报道固相基因芯片方法[4]、环介导间接PCR检测方法[5]、荧光定量RT-PCR方法[6]等,但未见报道液相基因芯片方法。
液相芯片技术又称微球悬浮芯片技术或灵活的多指标集成检测技术,是新一代高通量分子检测技术平台,具有高通量、高灵敏度、稳定、快速、体系灵活等优点[7-8]。近年来国内外已有建立液相芯片方法检测人或动物疫病病原[9-12]或其抗体[13]等的研究报道。
1材料与方法
1.1材料
1.1.1病毒PRRSV-VR2332株由广东出入境检验检疫局技术中心保藏;PRRSV-JXA1-R株疫苗样品购自大华农生物技术有限公司;PRRSV-AMERVAC疫苗样品(欧洲型毒株)购自HIPPA公司;PRRSV-CH1a株由中山大学动物病毒分子生物学实验室提供;PRRSV-CH1R株疫苗样品购自上海海利生物药品有限公司;6株PRRSV分离株核酸(PRRSV-BLC、PRRSV-XF、PRRSV-ZLT-H、PRRSV-QY B8-20、PRRSV-JX、PRRSV-YF)由广东省农业科学院动物卫生研究所提供。
猪瘟病毒兔化弱毒活疫苗为哈尔滨维科生物技术开发有限公司产品;猪圆环病毒2型(PCV-2)分离株核酸由广东省农业科学院动物卫生研究所提供;猪细小病毒、猪伪狂犬病病毒、猪传染性胃肠炎病毒(TGEV-H株、M6株)、猪布鲁菌核酸样品由广东出入境检验检疫局技术中心保藏;副猪嗜血杆菌病灭活疫苗、猪传染性胸膜肺炎三价灭活疫苗、猪萎缩性鼻炎灭活疫苗、猪链球菌病灭活疫苗为武汉科前动物生物制品有限公司产品;猪乙型脑炎活疫苗为中牧实业股份有限产品;猪支原体肺炎活疫苗为吉林正业生物制品股份有限公司产品;猪肉粉标准物质购自国家标准物质中心;猴肾细胞(Marc-145细胞、HS2H细胞)、猪肾细胞(PK-15细胞)、猪睾丸细胞(ST细胞)样品由广东出入境检验检疫局技术中心保藏。
1.1.2临床样品共收集75份临床样品,其中55份疑似临床样品采自广东省内多家猪场,包括血样15份、组织样品22份及精液样品18份,均来自疑似患病猪,另有20份经PRRSV实时荧光定量RT-PCR检测(试剂见1.1.3)呈阴性的临床样品(包括血样8份,组织样品5份,精液样品7份),均由本课题组收集保存。
1.1.3主要试剂及设备病毒DNA/RNA提取试剂盒(货号#DP315)购自天根生化科技(北京)有限公司;一步法RT-PCR试剂(货号#81401180)购自英潍捷基(上海)生物有限公司;PRRSV实时荧光定量RT-PCR检测试剂盒(毒株通用型)购自北京赛维克斯公司;MES(2-(N-吗啡基)乙磺酸)、5 mol/L TMAC(氯化四甲基胺)、Tween-20(吐温-20)均购自Sigma公司;EDC(1-乙基-(3-二甲基-丙烷)氢氯化二酰亚胺)购自Pierce公司;SAPE(链霉亲和素)购自英潍捷基(上海)生物有限公司。液相芯片检测仪(Liquid Chip 200 Reader)购自Qiagen公司;PCR扩增仪(ABI 9902)为美国ABI公司产品;舒适型恒温混匀仪购自德国Eppendorf公司。
1.2方法
三七互娱大宗折价成交:本周三七互娱(002555)成交1笔大宗交易,共450万股,合计成交金额4396.5万元,折价率为12.77%,买方为西南证券安徽分公司,卖方为国元证券南陵青铜路营业部。
1.2.1核酸提取细胞增殖病毒液:取接种病毒后细胞病变达90%以上细胞培养物,反复冻融3次,低速离心去除细胞碎片,取上清按照病毒核酸提取试剂盒说明书进行核酸提取;干粉状疫苗:加适量ddH2O溶解,取溶解液采用相同核酸提取试剂盒进行核酸提取;油乳状疫苗:反复冻融3次后12 000 r/min离心5 min,取下层清液按照上述试剂盒说明提取核酸;组织样品:将样品剪碎并液氮研磨,加入PBS制成匀浆,反复冻融3次,低速离心取上清液,按照上述试剂盒说明进行核酸提取;血液样品直接按照试剂盒说明进行核酸提取;新鲜精液及商品化精液样品:按照文献方法[14]提取。所提取的核酸置于-20 ℃保存。
1.2.2引物设计与合成采用Array Designer 4.0 Software软件设计扩增引物及杂交探针。PRRSV GP2基因特异的引物及探针序列按照文献[12]合成;HP-PRRSV特异引物及探针序列以高致病性毒株特有的非结构蛋白Nsp2基因序列(即相对于经典PRRSV毒株为缺失了多个氨基酸序列后形成的闭合序列,参考标准序列GenBank accession no.: KT198714.1)为模板设计,上游引物序列:5′-CGCGTAGAACTGTGACAAC-3′,下游引物序列:5′-GAAAGCCTCATATTCCGTCTG-3′,探针:5′-GACGCACCAGGATGAGCC-3′。其中下游引物5′端标记生物素基团,探针序列5′端标记氨基基团。所有标记引物及探针均为HPLC纯化,非标记引物为PAGE纯化,由英潍捷基(上海)生物有限公司合成。
1.2.3微球活化与核酸探针偶联取少量微球原液分装至1.5 mL离心管中,加入600 μL MES(0.1 mol/L,pH 4.5),15 000 r/min离心10 min弃掉上清;加入3 μL探针(10 μmol/L)、10 μL EDC溶液(10 mg/L),振荡混匀后室温避光摇床温和振荡30 min;分别用0.2 g/L的Tween-20溶液、1 g/L SDS溶液、1×TE溶液进行洗涤;最后将微球溶于100 μL 1×TE溶液中,并进行微球计数。
1.2.4双重核酸扩增反应体系与条件提取的病毒核酸按照以下体系进行RT-PCR反应: 2×reaction buffer 25 μL,RT/Platinum (1 units/μL)2 μL,生物素标记引物每条0.8 μmol/L,非标记引物每条0.1 μmol/L,核酸模板用量5 μL,用ddH2O补至50 μL。扩增反应条件:50 ℃ 20 min;94 ℃ 2 min;94 ℃ 10 s,55 ℃ 15 s,72 ℃ 10 s,40个循环;72 ℃ 1 min。
1.2.5双液相杂交与检测分析取1.5×TMAC溶液将偶联微球稀释为工作液,每个PCR管分装33 μL,其中含有每种微球1 000个,每个样品孔加入5 μL PCR产物,12 μL 1×TE(pH 8.0)至总体积50 μL,混合均匀后按以下条件进行杂交反应:95 ℃ 5 min, 57 ℃、300 r/min 10 min。杂交结束后,用1×TMAC 将微球洗涤3次,SAPE报告液用1×TMAC稀释至6.7 mg/L(150倍稀释),每管微球沉淀中加入80 μL 1×TMAC-SAPE报告液,振荡混匀后置恒温混匀仪中57 ℃、300 r/min 恒温孵育10 min。将完成杂交反应后的样品液全部加入液相芯片仪器载板中(预热57 ℃)进行读数检测,检测结果以中位荧光强度(median fluorescence intensity,MFI)荧光值表示。
1.2.6判定阈值依据对已知样品和空白对照样品的检测试验以及统计分析结果,确定判定阈值如下:规定试验组样品孔所读取的MFI值与该组空白
对照MFI值之差为MFI净值,当该值与该组空白对照MFI值的比值大于等于2时,判定为阳性,否则判为阴性。
2结果
2.1特异性试验结果
采用双重液相芯片方法对所收集到的12株PRRSV分离株或疫苗株样品(除PRRSV-AMERVAC疫苗为欧洲型PRRSV样品外,其余11株样品均属美洲型),猪瘟病毒等其他12种常见猪病原体、阴性猪精液提取核酸、猪肉粉标准物质提取核酸(猪基因组核酸)以及4种细胞核酸样品进行检测。结果显示,12株PRRSV均呈GP2基因检测阳性,其中7株同时呈现HP-PRRSV 特异Nsp2基因检测阳性,分别为PRRSV JXA1-R株、PRRSV-BLC、PRRSV-XF、PRRSV-ZLT-H、PRRSV-QY B8-20、PRRSV-JX、PRRSV-YF,均判定为HP-PRRSV毒株。其他13种常见猪病原样品、猪精液提取核酸、猪基因组核酸、以及细胞核酸样品均呈现两种基因检测阴性(图1)。
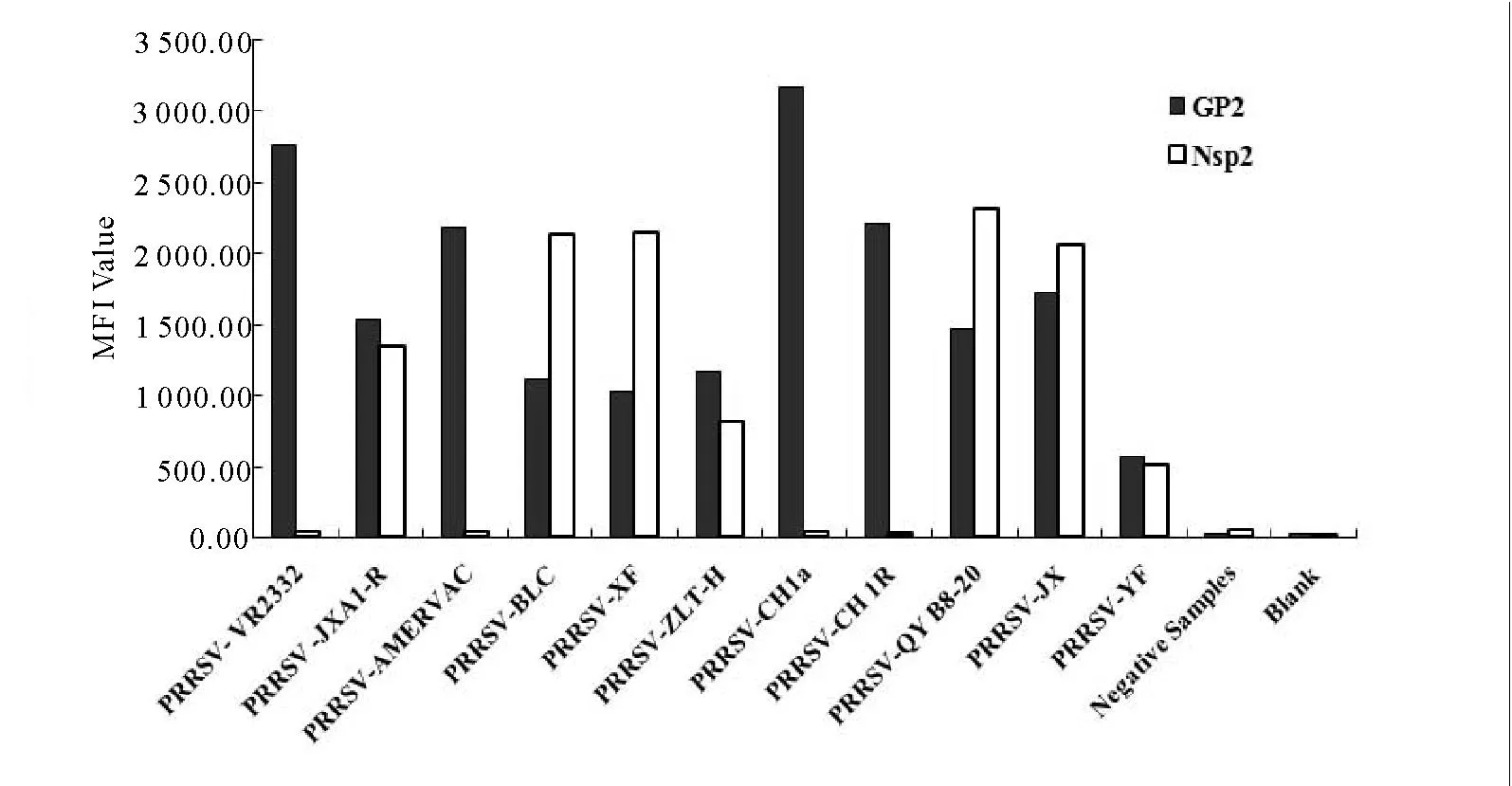
图1 双重液相芯片方法特异性检测试验结果
2.2敏感性试验结果
取经典PRRSV毒株(PRRSV-VR2332株)、HP-PRRSV毒株(PRRSV-JXA1-R株)纯化核酸,测量核酸浓度,并用PCR反应用水进行10倍梯度稀释。采用双重液相基因芯片方法对上述各稀释度核酸样品进行检测,每个稀释度均做3次重复试验,并计算样品的检测终点所对应的RNA模板用量。结果显示,该方法对PRRSV 基因组核酸中GP2基因的检测低限达每个反应0.25 pg,对HP-PRRSV 基因组核酸中Nsp2基因和GP2基因的检测低限一致,均为每个反应0.60 pg。对上述用于核酸纯化的病毒液样品按常规进行毒价(TCID50)测定,根据核酸提取时的样品用量和检测反应中核酸模板用量来换算各稀释度样品对应的检测病毒量,换算结果显示,该法对上述两种毒株的检测低限均小于每个反应0.5 TCID50。
2.3重复性试验结果
采用双重液相芯片方法对PRRSV(VR 2332株)、HP-PRRSV(JXA1-R株)纯化核酸分别进行6组平行检测试验(包括双重扩增和双重微球杂交检测),对2株病毒核酸样品分别计算其6组试验测得的阳性MFI值变异系数(组间变异系数,Inter assay CV%);对上述2株病毒核酸样品的同1管PCR扩增产物分别进行6组平行液相杂交检测试验,并分别计算其6组试验测得的阳性MFI值变异系数(组内变异系数,Intra-assay CV%)。结果显示,该法对两株病毒核酸样品对应的目标基因所测得MFI数值组内变异系数为2.8%~6.8%,组间变异系数为3.1%~5.2%(表1)。
2.4临床样品检测结果
采用上述双重液相基因芯片方法与PRRSV实时荧光定量RT-PCR检测试剂盒分别对55份疑似临床样品进行检测,并比较检测结果。结果显示,采用双重液相芯片方法检出54份阳性,其中52份(占96.3%)呈HP-PRRSV阳性;而采用实时荧光定量RT-PCR方法检出55份阳性;两种方法对疑似样品的检测符合率达98.2%(54/55)(表2)。
此外,采用双重液相基因芯片方法对20份经实时荧光定量RT-PCR检测呈阴性的样品(1.1.2)进行检测,均呈阴性反应。
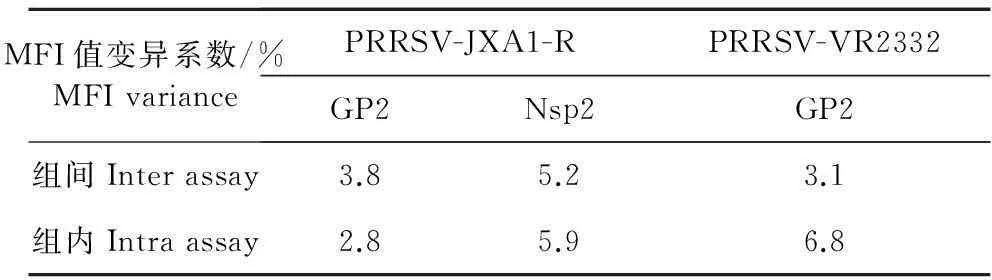
表1 重复性试验结果

表2 双重液相芯片方法与实时荧光定量RT-PCR对疑似样品的检测结果
注:“*” 仅GP2基因检测阳性;“**” GP2和Nsp2 两种基因检测阳性。
Note: "*" GP2 gene positive; "*" Positive of GP2 and Nsp2.
3讨论
目前国内外在检测或鉴别PRRSV毒株方面已建立多种方法,如常规或实时荧光定量RT-PCR方法、环介导等温RT-PCR扩增方法、固相基因芯片方法等,但通常适用于检测美洲型PRRSV,不明确能否适用于检测欧洲型PRRSV毒株。本研究所采用的方案在设计引物时充分考虑了对欧洲型毒株的检测能力,实际检测结果证实所建立的双重液相基因芯片方法能够覆盖两种基因型毒株的检测,为确保不漏检PRRSV提供充分技术保障。
国内外已建立的特异性检测鉴别PRRSV与HP-PRRSV的核酸检测方法普遍依据HP-PRRSV相对于经典毒株在Nsp2的基因缺失这一分子特征。对于HP-PRRSV毒株,本研究设计特异性引物与探针时,采用毒株Nsp2基因区域缺失了30个氨基酸后形成的保守序列为模板设计。该区域由对应经典PRRSV毒株中Nsp2变异区外侧两端的基因序列组成,因此,所设计的特异性探针不能与经典毒株的基因组杂交,对其检测结果为阴性。根据对引物和探针序列的BLAST检索分析结果,本研究针对HP-PRRSV所设计筛选的引物和探针能够特异性识别高致病性毒株,并能覆盖GenBank 收录的各种HP-PRRSV分离株序列。
在现有各种核酸检测方法中,固相基因芯片方法通常由于检测步骤繁琐造成背景信号值不稳定,试验重复性和稳定性不理想,并导致检测敏感性不理想;实时荧光定量PCR方法快速灵敏,但多重荧光定量PCR方法试剂成本高,且其多重检测常伴随检测敏感性下降问题。而xMAP液相基因芯片技术整合了多重核酸扩增技术、流式细胞术、荧光信号检测技术以及自动化数据分析技术,根据碱基配对原理通过液相环境中微球偶联的DNA探针特异识别待测样本核酸的目标基因序列,并通过自动化检测杂交信号强度来进行定性和定量分析,确保检测结果特异灵敏,并且能够灵活组合多重反应;其对每种目标的检测值取50个~100个目标微球的中值,相当于每个样本重复检测了50次~100次,有利于保障检测结果的稳定性;xMAP液相基因芯片技术还具有操作简单、快速和样品消耗量少等优点,由于分子杂交是在悬浮溶液中借助微球体进行,大大提高了检测速度和反应效率,并且在同一个反应体系中能同步检测多达100种目标。
为确保检测高效准确,本研究对反应条件进行细致的优化,在探针与微球偶联过程中,通过适当增加EDC的使用量保证了微球与探针偶联效率;在杂交反应以及杂交结束后显色反应阶段,采用恒温涡旋振荡器在恒温且恒速温和振荡状态下进行,使偶联微球与PCR产物充分接触,提高了杂交和显色反应效率;为了降低杂交的背景信号值,在杂交反应后,增加了洗涤步骤,即加入1×TMAC杂交液低速离心,洗去引物二聚体、非特异扩增产物等杂质,有效降低了检测背景值。
本研究旨在应用液相基因芯片技术建立快速特异检测猪繁殖与呼吸综合征病毒并鉴别高致病性毒株的方法。研究过程对所建立的方法进行了特异性、敏感性、重复性检测验证以及临床检测和比对试验,检测结果显示该法准确可靠。特异性试验结果显示,双重液相芯片法特异检出包括欧洲型毒株在内的12株PRRSV疫苗株及分离株,并准确鉴别其中的7株高致病性毒株,与其他多种猪病原体和猪基因组核酸、传代细胞核酸无交叉反应。该法对PRRSV及HP-PRRSV纯化核酸的检测低限分别达0.25 pg和0.60 pg,由于病毒核酸提取过程中会残留一定量的细胞核酸,因此该法对于病毒核酸的实际检测低限应低于上述测得的数值;根据对所用病毒液的毒价测定与换算结果,该法对2种毒株的检测低限均小于每个反应0.5 TCID50,能够满足临床检测要求;此外,临床检测与比对试验结果显示,该法与实时荧光定量RT-PCR方法对临床样品的检测结果基本一致;以上试验结果充分说明本研究建立的双重液相基因芯片法检测灵敏度高;重复性试验结果显示,本研究所建立的液相芯片方法检测PRRSV及HP-PRRSV的组内、组间重复性变异系数均小于10%,说明检测反应稳定,重现性好。
临床检测结果显示,本方法对PRRSV的检出率与商品化实时荧光定量RT-PCR试剂盒的基本一致,并能够同步鉴别HP-PRRSV,而单重实时荧光定量RT-PCR方法无法区分PRRSV与HP-PRRSV。目前我国猪场广泛应用HP-PRRSV毒株制备弱毒疫苗进行预防免疫及疫病净化,本研究建立的双重液相基因芯片方法虽然不能区分HP-PRRSV中的野毒与疫苗毒株,但其应用于临床检测仍具有重要的实用价值,特别是能够用于快速检疫未经免疫的进口种猪,确保不漏检;在养殖生产中也可用于协助监测疫苗毒排放情况,有助于及时发现疫苗毒力返强情况。对于临床检测呈HP-PRRSV核酸阳性的猪只是否为野毒感染,仍需结合猪只个体临床状况、猪场免疫情况等多方面因素进行综合判断。
综上所述,本研究建立的双重液相基因芯片方法实现快速检测PRRSV并鉴别HP-PRRSV,可在2 h内完成对纯化核酸样品的检测,借助液相芯片技术平台实现高通量自动化检测大量样品,准确灵敏并且快速,满足临床快速诊断以及进出境动物检疫快速检测需求,可用于PRRSV早期及隐性感染的快速检测鉴定,也可用于对活疫苗免疫的跟踪监测,协助调查研究疫苗毒株在动物体内的排放情况,有助于及时发现疫苗衍生毒株。本研究为预防、诊断和监控猪繁殖与呼吸综合征及进出口活猪检疫把关提供了新的技术手段。
参考文献:
[1]代军,雷蕾,任志华. 猪繁殖与呼吸综合征防控研究进展[J]. 动物医学进展, 2014, 35(4): 97-101.
[2]童光志,周艳君,郝晓芳, 等. 高致病性猪生殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007, 27(5):333-336.
[3]Zhou L, Chen S, Zhang J, et al. Molecular variation analysis of porcine reproductive and respiratory syndrome virus in China [J]. Virus Res, 2009, 145(1): 97-105.
[4]郭焕成. 猪繁殖与呼吸综合征病毒、猪瘟病毒寡核苷酸芯片的研究与应用[D]. 吉林长春: 中国人民解放军军事医学科学院, 2010.
[5]郑鸣,李华玮,边传周, 等. 环介导间接PCR鉴别高、低致病性猪繁殖与呼吸综合征病毒方法的建立[J].病毒学报, 2013, 29(4): 364-370.
[6]宴勇邦,龚中贵,王俊峰, 等. 猪蓝耳病病毒变异株TaqMan 探针实时荧光定量RT-PCR鉴别诊断方法的建立[J]. 中国动物检疫, 2013, 30 (1):57-60.
[7]杨洋,汤华. 液相芯片技术在检验医学和生物医学中的应用[J]. 中国生物化学与分子生物学报,2007,32(4): 256-261.
[8]Dunbar S A. Applications of Luminex xMAP technology for rapid, high-throughput multiplexd nucleic acid detection [J].Clin Chim Acta, 2006, 363: 71-82.
[9]Righter D J, Rurangirwa F R, Call D, et al. Development of a bead-based multiplex PCR assay for the simultaneous detection of multipleMycoplasmaspecies [J]. Vet Microbiol, 2011, 153: 246-256.
[10]陈茹,毕英佐,刘志玲, 等. 建立液相芯片方法检测鉴别结核分枝杆菌复合群、鸟分枝杆菌与副结核分枝杆菌[J]. 微生物学通报, 2011, 38(6):908-915.
[11]范丽. Luminex液相芯片技术检测六种虫媒病毒方法的研究[D]. 陕西西安:陕西师范大学,2012.
[12]Chen R, Yu X L, Gao X B, et al. Bead-based suspension array for simultaneous differential detection of five major swine viruses [J]. Appl Microbiol Biotechnol, 2015, 99: 919-928.
[13]Lin K,Wang C, Murtaugh M P, et al. Multiplex method for simultaneous serological detection of porcine reproductive and respiratory syndrome virus and porcine circovirus type 2 [J]. J Clin Microbiol, 2011, 49: 3184-3190.
[14]于晓璐,陈茹,薛春宜, 等. 3种从猪精液中提取病毒核酸方法的比较[J]. 中国畜牧兽医杂志, 2014,41(2):189-193.
Development of a Duplex xMAP Assay for Highly Pathogenic Porcine Reproductive and Respiratory Syndrome Virus
CHEN Ru1,2, YU Xiao-lu3, GAO Xiao-bo4, XUE Chun-yi3, SONG Chang-xu5,QIU Yang1, LIU Zhing-ling1,2Wang Ying1,2, DUAN Yan-yu1,2
(1.TechnicalCenter,GuangdongEntry-exitInspectionandQuarantineBureau,Guangzhou,Guangdong,510623,China;2.GuangdongKeyLaboratoryofImportandExportTechnicalMeasuresofAnimal,PlantandFood,Guangzhou,Guangdong,510623,China; 3.SchoolofLifeSciences,SunYat-SenUniversity,Guangzhou,Guangdong,510275,China;4.NationalResearchInstituteforFamilyPlanning,Beijing,100081,China; 5.ResearchInstituteofAnimalHealth,GuangdongAcademyofAgriculturalSciences,Guangzhou,Guangdong,510640,China)
Abstract:A duplex xMAP bead-based assay was developed for rapid detection of porcine reproductive and respiratory syndrome virus (PRRSV) and differentiation of highly pathogenic strains (HP-PRRSV). The xMAP assay could simultaneously detect two target sequences, including the GP2 envelope protein gene of PRRS and the Nsp2 gene conserved region specific for HP-PRRSV strains. The assay detected 12 PRRSV strains used in this study and identified 7 strains as HP-PRRSV, without cross-reactions with 12 non-target swine pathogens. The lower detection limit of the assay on PRRSV, HP-PRRSV strains was determined as below 0.5 TCID50per reaction, respectively. The inter-assay and intra-assay variances (CV%) were both lower than 10%. The assay was applied to test 55 suspected field samples and compared with a commercialized single-plex real-time RT-PCR method. The detection results of the two methods were 98.2% (54/55) in consistency. The study provided a novel molecular method for rapid diagnosis of PRRSV infection.
Key words:Porcine reproductive and respiratory syndrome virus (PRRSV); highly pathogenic PRRSV (HP-PRRSV); xMAP LiquiChip
收稿日期:2015-12-04
基金项目:国家质量监督检验检疫总局科研项目(2013IK029); 广东省农业攻关项目(2012B020305003)
作者简介:陈茹(1968-),女,海南海口人,研究员,博士,主要从事进出境动物疫病分子生物学检测研究与应用。
中图分类号:S852.659.6
文献标识码:A
文章编号:1007-5038(2016)06-0001-06

