植物乳杆菌诱导绵羊瘤胃上皮细胞SBD-1表达的信号通路途径初探
范燕茹,金 鑫,田巧珍,张 曼,刘 骄,杨银凤*
植物乳杆菌诱导绵羊瘤胃上皮细胞SBD-1表达的信号通路途径初探
范燕茹1,2,金 鑫1,2,田巧珍1,2,张 曼1,2,刘 骄1,2,杨银凤1,2*
(1.内蒙古农业大学兽医学院,呼和浩特010018;2.农业部动物疾病临床诊疗技术重点实验室,呼和浩特010018)
摘 要:本试验旨在探索乳酸杆菌诱导绵羊瘤胃上皮细胞SBD-1表达的可能途径。采用实时荧光定量PCR(RT-qPCR)的方法,对已建立的诱导SBD-1表达模型中Toll样受体2(Toll like receptor 2,TLR2)及其相关因子的基因表达变化进行检测;然后选用3种信号通路抑制剂,即NF-κB信号通路抑制剂PDTC、ERK 1/2信号通路抑制剂PD98059和JNK信号通路抑制剂SP600125,将细胞分为8组:细胞组:不作处理;阳性对照组:只添加植物乳杆菌P-8(L.plantarum P-8)诱导;PDTC组:只添加PDTC预处理细胞(PDTC);PDTC+L.plantarum P-8组:PDTC +L.plantarum P-8诱导;PD98059组:PD98059;SP600125组:SP600125;PD98059+L.plantarum P-8组:PD98059+L.plantarum P-8;SP600125+L.plantarum P-8组:SP600125+L.plantarum P-8。采用RT-qPCR的方法检测各组SBD-1mRNA表达水平。结果表明,绵羊瘤胃上皮细胞被L.plantarum P-8诱导后,TLR2及其转接蛋白MyD88、NF-κB和ERK1/2、JNK各基因的mRNA水平都较空白组细胞内的表达极显著增加(P<0.01);添加抑制剂后再诱导,发现抑制剂PD98059和SP600125均能极显著(P<0.01)抑制细胞内SBD-1mRNA的表达,而PDTC仅能显著抑制(P<0.05)SBD-1的表达。结果表明,L.plantarum P-8可促进绵羊瘤胃上皮细胞TLR2、MyD88、NF-κB、JNK和ERK1/2基因的mRNA表达;添加NF-κB信号通路抑制剂PDTC、ERK 1/2信号通路抑制剂PD98059和JNK信号通路抑制剂SP600125,可抑制L.plantarum P-8对SBD-1mRNA的诱导作用。综上表明,L.plantarum P-8有可能通过激活绵羊瘤胃上皮细胞内NF-κB、JNK、ERK1/2等信号通路促进SBD-1的表达。
关键词:β-防御素-1;瘤胃上皮细胞;乳酸杆菌;Toll样受体2;实时荧光定量PCR
抗菌肽(Antimicrobial peptides,AMPs)是广泛存在于生物体内的一种具有强抗菌作用的阳离子多肽,由于其独特的抗菌机制,病原微生物不易对其产生耐药性[1-2]。防御素(Defensins)是抗菌肽中较为重要的一种,包括5个亚家族:α-防御素、β-防御素和θ-防御素、昆虫防御素和植物防御素[3]。β-防御素由哺乳动物上皮细胞产生,分布在机体宿主-环境的界面位置,构成机体抵御外界微生物侵袭的第一道化学屏障,参与宿主的先天性免疫及获得性免疫,其在宿主体内的表达分为组成型和诱导型[4-5]。目前研究发现,绵羊体内有两种β-防御素,即绵羊β-防御素-1(Sheep beta defensin-1,SBD-1)和SBD-2,采用Northern杂交和RT-PCR技术证实,SBD-1在绵羊的呼吸道和整个消化道(除远端回肠)内有广泛的表达,而SBD-2主要在远端回肠表达,舌也有少量表达[6]。因此SBD-1可能是绵羊胃肠道免疫应答的重要组成。益生菌(Probiotics)是在发酵乳制品有助于健康长寿的理论发展起来的,研究表明,益生菌对调节肠道微生物平衡、提高胃肠道上皮的屏障功能、干扰致病菌在肠黏膜的定植和感染、调节局部或全身免疫反应、调节细胞因子等起作用[7-9]。大量研究证实,益生菌可诱导调节宿主体内诱导型防御素的表达[10-11]。益生菌可以促进上皮细胞表达Toll样受体(Toll like receptors,TLRs)以及各种细胞因子、抗菌肽来参与宿主的先天性免疫防御[12-14]。TLRs为模式识别受体的一员,是介导天然免疫及病原体信号转导与细胞活化信号转导的重要跨膜信号传递受体,通过识别病原和其细胞壁中的类脂特殊结构即病原相关分子模式(PAMP)来介导相关因子的表达和相应的免疫应答发生。由TLRs介导的信号转导通路可诱导多个快速反应基因的活化,所有的TLRs受体家族成员均依赖于TLRs的TIR结构域经MyD88依赖途径或非MyD88依赖途径向细胞内转导其识别的信号,最终活化NF-κB和丝裂原蛋白激酶(MAPKs)。研究发现,乳酸杆菌可通过诱导Hela上皮细胞TLR2和TLR4的表达,促进细胞分泌人β防御素2(HBD2)和HBD3以抵抗白色念珠菌对细胞的感染[15];乳酸杆菌应用于雏鸡的肠炎治疗时,检测到TLR2受体表达增高,表明TLR2参与宿主的免疫应答,同时提示TLR2可能是乳酸杆菌的跨膜受体[10]。研究表明,TLR2可活化核转录因子(NF-κB)、激活MAPKs信号转导通路,并使被转染的细胞合成和释放细胞因子[11]。
在前期试验中,发现乳酸杆菌可有效的诱导绵羊瘤胃上皮细胞中SBD-1的表达,但关于乳杆菌与SBD-1之间诱导机制的研究尚未见报道,那么是否同其他哺乳动物防御素相似也是由TLR2识别PAMP来激活下游的信号转导实现对SBD-1的调控作用?因此,本研究在已建立的诱导SBD-1表达的模型中,对TLR2受体及其相关因子的基因表达变化进行检测;进一步检测信号通路抑制剂对SBD-1诱导表达的影响,研究结果可作为揭示乳酸杆菌诱导绵羊瘤胃上皮细胞中SBD-1表达的信号转导途径的理论基础与依据。
1 材料与方法
1.1 材料
1.1.1 瘤胃组织 从呼和浩特市北亚清真屠宰场挑选健康状况良好的绵羊,屠宰后立即剪取瘤胃内面乳头密集处组织一块,用生理盐水冲洗干净后放入磷酸盐缓冲液(PBS)中,低温保存备用。
1.1.2 供试菌株 植物乳杆菌P-8(Lactobacillus plantarum P-8,L.plantarum P-8)由内蒙古农业大学乳品生物技术与工程教育部重点实验室分离保存。
1.1.3 主要试剂及仪器设备 主要试剂:DMEM/F12培养基(Hyclone)、MRS肉汤培养基(广东环凯)、RNA fast200总RNA极速抽提试剂盒(上海飞捷)、PrimeScript RT reagent Kit with gDNA Eraser (DRR047A)(TaKaRa)、SYBR?Premix Ex TaqTMⅡ(DRR820A)(TAKARA)、NF-kB抑制剂PDTC(Sigma)、ERK 1/2抑制剂PD98059(Sigma)、JNK抑制剂SP600125(Sigma)等。
仪器设备:-80℃冰箱、二氧化碳培养箱(Thermo,美国)、移液器(Eppendorf,德国)、多功能酶标仪(SynergyTMH4,Biotek)、冷冻离心机(Eppendorf,德国)、倒置相差显微镜(Olympus,日本)、电子天平(Sartorius,德国)、立式自动高压灭菌锅(TOMY,日本)、实时荧光定量PCR仪(VⅱA 7,ABI,美国)、普通电冰箱(海尔,青岛)、水平离心机(北京医疗器械厂)、超净工作台(苏净,苏州)、数显鼓风干燥箱(上海博讯)。
1.2 方法
1.2.1 L.plantarum P-8的活化培养 L.plantarum P-8置于灭菌脱脂乳中,-80℃保存,使用前接种于MRS肉汤培养基,37℃无氧条件下静置培养24h,活化传代。在MRS琼脂培养基上连续倍比稀释,菌落计数,以确定菌液浓度,用于后续试验。使用前用基础培养基洗两次,调整制成合适浓度的菌液。
1.2.2 绵羊瘤胃上皮细胞的培养与处理 采用本实验室已成熟的绵羊瘤胃上皮细胞原代培养的方法,从新鲜的瘤胃组织中获得并培养上皮细胞,待原代细胞汇合度为80%以上时,将细胞以1×106个·mL-1接种于细胞六孔培养板,培养3d,待细胞汇合度达80%~90%时,细胞饥饿处理24h后,添加107cfu·mL-1L.plantarum P-8进行诱导,阴性对照组只加同等体积的细胞基础培养液,每组有3个平行样。在37℃、5%CO2饱和湿度的环境中作用2h后,以灭菌无Ca2+、Mg2+的PBS溶液(含100 U·mL-1青霉素,0.05mg·mL-1链霉素)洗3次,洗去细胞表面的乳酸杆菌,再换以新鲜的基础培养基(含100U·mL-1青霉素和0.05mg·mL-1链霉素),再在培养箱(37℃、5%CO2饱和湿度)中继续培养8h。根据RNA Fast200说明书提取上述细胞总RNA,提取的RNA用核酸测定仪检测吸光度A260nm和A280nm,测定RNA浓度和纯度,同时用1%琼脂糖凝胶电泳鉴定RNA的质量。
1.2.3 信号通路抑制剂对细胞的干预 将已经饥饿24h的细胞分为8组(表1):细胞组:不作处理;阳性对照组:只添加植物乳杆菌P-8(L.plantarum P-8)诱导;PDTC组:只添加PDTC预处理细胞;PDTC+L.plantarum P-8组:先添加PDTC预处理细胞1h,再用L.plantarum P-8诱导;PD98059组和SP600125组的处理同PDTC组;PD98059+L.plantarum P-8组和SP600125+L.plantarum P-8组的处理同PDTC+L.plantarum P-8组。其中,L.plantarum P-8的添加浓度为107cfu·mL-1,诱导方法同上;PDTC的工作浓度为50μmol·L-1[16],PD98059和SP600125的工作浓度均20μmol·L-1[17]。各组细胞均在37℃、5% CO2饱和湿度的环境中培养8h后,提取RNA。
1.2.4 反转录及RT-qPCR检测 细胞提取总RNA按PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)说明书进行反转录,4℃保存反转录所得cDNA。
根据GenBank中,各目的基因的基因序列,设计引物(表2)并送至生工生物工程有限公司(上海)合成。以cDNA为模板,用实时荧光定量PCR(RT-qPCR)的方法检测各基因的mRNA表达含量。

表1 细胞分组Table 1 Groups

表2 各基因的引物序列Table 2 Primer sequences of genes for RT-qPCR
1.2.5 数据统计与分析 试验中,RT-qPCR的数据采用ΔΔCt法计算各目的基因的相对表达量,以β-actin基因作为内参,设每个基因阴性对照的表达量为1,经Excel计算整理后,采用GraphPad Prism 5.0统计软件根据试验需求分别进行t检验和单因素方差分析,并根据分析结果进行绘图,图中*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结 果
2.1 L.plantarum P-8诱导下细胞中SBD-1及其通路基因mRNA的变化
107cfu·mL-1L.plantarum P-8直接作用于培养的绵羊瘤胃上皮细胞2h,又继续培养8h后,对细胞中SBD-1及其相关信号通路基因TLR2、MyD88、ERK1/2、JNK以及NF-κB的RT-qPCR检测结果进行统计,设每个基因阴性对照的表达量为1。如图1所示,在诱导细胞中的SBD-1mRNA水平极显著高于未处理细胞中的水平(P<0.01);用相同的方法检测多个可能涉及到的信号转导通路中的关键基因TLR2、MyD88、ERK1/2、JNK以及NF-κB的mRNA相对表达量,也有类似结果:诱导细胞的膜表面受体TLR2及其转接蛋白MyD88的mRNA相对表达量的水平显著高于未处理细胞(P<0.01),诱导细胞胞质内关键因子ERK1/2、JNK和NF-κB的mRNA水平也较未处理细胞的表达显著增高(P<0.01)。而各基因表达量的增加幅度相比,差异不显著(P>0.05)。
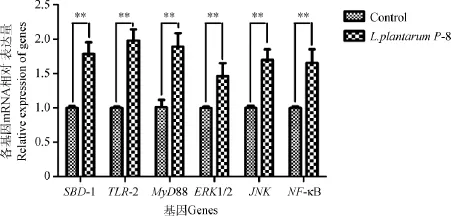
图1 L.plantarum P-8对绵羊瘤胃上皮细胞中SBD-1及其通路基因mRNA表达的影响(±s)Fig.1 Genes expression of SBD-1and pathway in sheep rumen epithelial cells induced by L.plantarum P-8(±s)
2.2 添加不同信号通路抑制剂对细胞内SBD-1 mRNA表达的影响
用3种不同的信号通路抑制剂对绵羊瘤胃上皮细胞预处理后,再进行诱导培养,RT-qPCR方法检测细胞中SBD-1的表达,数据统计分析结果如图2。添加ERK1/2信号通路抑制剂的PD98059结果可见图2A,在不添加L.plantarum P-8诱导的细胞中,PD98059抑制SBD-1的表达,差异显著(P<0.05);L.plantarum P-8诱导的情况下,细胞接受PD98059的预处理后,细胞中SBD-1的表达较不添加组的极显著降低(P<0.01),同样用PD98059预处理的细胞组中,L.plantarum P-8不能有效诱导SBD-1的表达(P>0.05)。添加JNK信号通路的抑制剂SP600125,统计结果如图2B所示,SP600125的添加对细胞本身SBD-1的表达没有影响(P>0.05);而同在L.plantarum P-8的诱导下,SP600125抑制SBD-1的表达,差异极显著(P<0.01);L.plantarum P-8不能引起SP600125预先处理的细胞组中SBD-1的表达(P>0.05)。在研究NF-κB信号通路的抑制剂PDTC对细胞中SBD-1表达的影响中发现,PDTC对细胞本身表达SBD-1有一定的抑制作用(P<0.05),同时也能极显著的抑制由L.plantarum P-8诱导的SBD-1的表达(P<0.01),但试验结果也表明,L.plantarum P-8仍会显著的诱导PDTC预处理过的细胞中SBD-1的表达(图2C)。在L.plantarum P-8诱导细胞时,PD98059、SP600125和PDTC均能极显著的抑制SBD-1的表达(P<0.01),但相对于未处理细胞或只用抑制剂处理的细胞却有不一样的情况,结果表明,在L.plantarum P-8促进绵羊瘤胃上皮细胞SBD-1的表达这一过程中,ERK1/2、JNK和NF-κB信号通路都有参与,但参与程度不尽相同。
3 讨 论
防御素是一种广泛存在于动物体的呼吸道、消化道以及生殖道的具有广谱抗菌作用的阳离子多肽,在动物体的天然免疫和获得性免疫中扮演着重要的作用。SBD-1是广泛表达于绵羊整个消化道的一种重要防御素,多种益生菌可不同程度的促进其在绵羊瘤胃上皮细胞中的表达[18-19],但其机制尚不清楚。
益生菌可被TLRs识别,可以介导细胞内的信号转导通路诱发很多反应的快速活化,产生抗菌肽包括防御素等效应分子,激活炎症反应,参与机体防御反应。N.T.Funderburg等[20]证实HIV病人易患黏膜感染与TLR1表达减少,导致HBD-3表达的应答障碍,进而机体免疫防御减弱;D.R.Hill等[21]以HT-29结肠上皮细胞为载体,研究HBD-2的表达与TLR4的相关性,表明HBD-2的表达是依赖于TLR4的,并且TLR4缺失会降低HBD-2的表达;在以仔猪腹泻为模型的研究中,发现pBD-2的表达是受多种TLRs共同调控的[22]。在本研究中,在mRNA的水平上证实,L.plantarum P-8在诱导SBD-1表达的同时会促进TLR2及其转接蛋白MyD88的基因表达,表明L.plantarum P-8诱导的SBD-1表达是与TLR2信号通路相关的,同时有可能激活了胞内的MyD88依赖性途径。
TLRs家族成员可向细胞内转导识别信号,与转接蛋白结合,活化NF-κB、JNK等转录因子,最终诱导靶基因的表达。研究发现,金黄色葡萄球菌可经TLRs激活NF-κB、MAPKs信号转导通路诱导小鼠成骨细胞内MBD-14的表达[23];R.Paolillo等[24]就植物乳杆菌对人结肠上皮细胞的免疫作用研究发现,HBD-2的表达与植物乳杆菌是依赖TLR2-NF-κB/AP-1(MAPKs)途径促进HBD-2的表达的,均提示细胞内防御素的表达可能是多条信号转导通路共同介导的。
本研究表明,L.plantarum P-8具有提高NF-κB、JNK、ERK1/2的mRNA表达水平的作用;选用这3个因子的抑制剂来进一步验证其参与信号转导的情况,结果表明,这3种抑制剂均可以有效的抑制L.plantarum P-8诱导SBD-1表达的作用。L.plantarum P-8首先可被绵羊瘤胃上皮细胞的TLR2识别并结合,然后将信号转导至细胞内,再经MyD88依赖途径激活下游NF-κB、JNK、ERK1/2等信号通路,最终实现对SBD-1表达的调控。但本研究仍需在后续的试验中从蛋白水平的层面验证不同信号通路的参与情况,也要进一步探索不同信号通路间是否存在交互作用,以期更加全面的揭示L.plantarum P-8诱导SBD-1表达的机制。
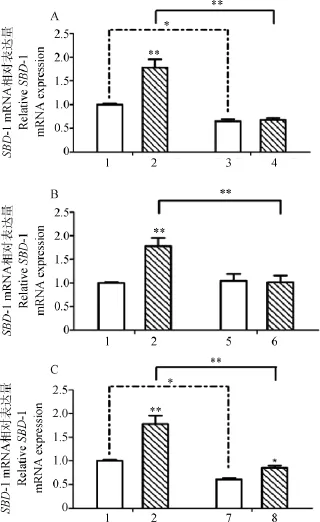
图2 不同信号通路抑制剂对细胞SBD-1mRNA表达的影响(±s)Fig.2 Effect of various antagonists on SBD-1mRNA expression(±s)
4 结 论
本研究结果表明,L.plantarum P-8可促进绵羊瘤胃上皮细胞TLR2、MyD88、NF-κB、JNK和ERK1/2的基因表达;而信号通路抑制剂的添加进一步证明,L.plantarum P-8促进SBD-1的分泌与NF-κB、JNK、ERK1/2信号通路的激活有关。
参考文献(References):
[1] SCHRÖDER J M,HARDER J.Human beta-defensin-2[J].Int J Biochem Cell Biol,1999,31(6):645-651.
[2] SØRENSEN O E,COWLAND J B,THEILGAARDMÖNCH K,et al.Wound healing and expression of antimicrobial peptides/polypeptides in human keratinocytes,a consequence of common growth factors[J].J Immunol,2003,170(11):5583-5589.
[3] YANG Y F,WANG C Y,ZHAO Y F,et al.Reindeer beta-defensin-1:full-length cDNA cloning and tissue expression[J].Vet Immunol Immunopathol,2009,131(1-2):137-139.
[4] TANG Y Q,YUAN J,OSAPAY G,et al.A cyclic antimicrobial peptide produced in primate leukocytes by the ligation of two truncatedα-defensins[J].Science,1999,286(5439):498-502.
[5] CHANG T L,FRANÇOIS F,MOSOIAN A,et al.CAF-mediated human immunodeficiency virus(HIV)type 1transcriptional inhibition is distinct fromα-defensin-1HIV inhibition[J].J Virol,2003,77(12):6777-6784.
[6] HUTTNER K M,BREZINSKI-CALIGURI D J,MAHONEY M M,et al.Antimicrobial peptide expression is developmentally regulated in the ovine gastrointestinal tract[J].J Nutr,1998,128(2Suppl):297S-299S.
[7] HICKEY D K,FAHEY J V,WIRA C R.Mouse estrous cycle regulation of vaginal versus uterine cytokines,chemokines,α-/β-defensins and TLRs[J].In-nate Immun,2013,19(2):121-131.
[8] DENG J,LI Y,ZHANG J,et al.Co-administration of Bacillus subtilis RJGP16and Lactobacillus salivarius B1strongly enhances the intestinal mucosal immunity of piglets[J].Res Vet Sci,2013,94(1):62-68.
[9] SCHLEE M,WEHKAMP J,ALTENHOEFER A,et al.Induction of humanβ-defensin 2by the probiotic Escherichia coli Nissle 1917is mediated through flagellin[J].Infect Immun,2007,75(5):2399-2407.
[10] PENHA FILHO R A,DíAZ S J,FERNANDO F S,et al.Immunomodulatory activity and control of Salmonella Enteritidis colonizationin the intestinal tract of chickens by Lactobacillus based probiotic[J].Vet Immunol Immunopathol,2015,167(1-2):64-69.
[11] OZES O N,MAYO L D,GUSTIN J A,et al.NF-κB activation by tumour necrosis factor requires the Akt serine–threonine kinase[J].Nature,1999,401 (6748):82-85.
[12] HERSHBERG R M.The epithelial cell cytoskeleton and intracellular trafficking.V.Polarized compartmentalization of antigen processing and Toll-like receptor signaling in intestinal epithelial cells[J].Am J Physiol Gastrointest Liver Physiol,2002,283(4):G833-G839.
[13] GEWIRTZ A T.Intestinal epithelial toll-like receptors:to protect.And serve?[J].Curr Pharm Des,2003,9(1):1-5.
[14] ABREU M T.Immunologic regulation of toll-like receptors in gut epithelium[J].Curr Opin Gastroenterol,2003,19(6):559-564.
[15] RIZZO A,LOSACCO A,CARRATELLI C R.Lactobacillus crispatus modulates epithelial cell defense against Candida albicans through Toll-like receptors 2 and 4,interleukin 8and humanβ-defensins 2and 3 [J].Immunol Lett,2013,156(1-2):102-109.
[16] 温世勇.17-β雌二醇调控绵羊输卵管上皮细胞β-防御素1基因表达过程中NF-κB信号通路的研究[D].呼和浩特:内蒙古农业大学,2014.WEN S Y.Studys about NF-κβsignaling pathways in the course of the 17β-estradiol regulatingβ-defensin gene 1expression in the ovine oviduct epithelial cells [D].Hohhot:Inner Mongolia Agricultural University,2014.(in Chinese)
[17] 贾永杰.鼠李糖乳杆菌对鸡小肠上皮细胞β-防御素9基因表达的影响及其信号转导途径[D].南昌:江西农业大学,2012.JIA Y J.Effects of Lactobacillus rhamnosus onβ-defensin 9expression and its signal transduction pathway in chicken small intestinal epithelial cells[D].Nanchang:Jiangxi Agricultural University,2012.(in Chinese)
[18] 王 佩,范燕茹,金 鑫,等.枯草芽孢杆菌对绵羊瘤胃上皮细胞β-防御素-1表达的影响[J].畜牧兽医学报,2015,46(5):760-767.WANG P,FAN Y R,JIN X,et al.Effects of Bacillus subtilis on the expression of SBD-1in cultured ruminal epithelial cells of sheep[J].Acta Veterinaria et Zootechnica Sinica,2015,46(5):760-767.(in Chinese)
[19] 金 鑫,张 曼,范燕茹,等.酿酒酵母菌对绵羊瘤胃上皮细胞β-防御素-1(SBD-1)基因表达的影响[J].中国农业科学,2015,48(19):3910-3918.JIN X,ZHANG M,FAN Y R,et al.Effects of Saccharomyces cerevisiae on the expression of SBD-1in cultured ruminal epithelial cells of sheep[J]Scientia Agicultura Sinica,2015,48(19):3910-3918.(in Chinese)
[20] FUNDERBURG N T,SIEG S F.Diminished responsiveness to humanβ-defensin-3and decreased TLR1 expression on monocytes and mDCs from HIV-1-infected patients[J].J Leukoc Biol,2012,92(5):1103-1109.
[21] HILL D R,KESSLER S P,RHO H K,et al.Specificsized hyaluronan fragments promote expression of humanβ-defensin 2in intestinal epithelium[J].J Biol Chem,2012,287(36):30610-30624.
[22] LI X Q,ZHU Y H,ZHANG H F,et al.Risks associated with high-dose Lactobacillus rhamnosus in an Escherichia coli model of piglet diarrhoea:intestinal microbiota and immune imbalances[J].PLoS One,2012,7(7):e40666.
[23] ZHU C,QIN H,CHENG T,et al.Staphylococcus aureus supernatant induces the release of mouseβ-defensin-14from osteoblasts via the p38MAPK and NF-κB pathways[J].Int J Mol Med,2013,31(6):1484-1494.
[24] PAOLILLO R,ROMANO CARRATELLI C,SORRENTINO S,et al.Immunomodulatory effects of Lactobacillus plantarumon human colon cancer cells [J].Int Immunopharmacol,2009,9(11):1265-1271.
(编辑 程金华)
Preliminary Study on the Pathway of SBD-1Expression in Sheep Rumen Epithelial Cells Induced by Lactobacillus plantarum
FAN Yan-ru1.2,JIN Xin1.2,TIAN Qiao-zhen1.2,ZHANG Man1.2,LIU Jiao1.2,YANG Yin-feng1.2*
(1.College of Veterinary,Inner Mongolia Agricultural University,Hohhot 010018,China;2.Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease,Ministry of Agriculture,Hohhot 010018,China)
Abstract:This study aims to explore the possible approach that lactobacilli induce the expression of SBD-1in sheep rumen epithelium cells.Real-time fluorescence quantitative PCR(RT-qPCR)was conducted in this study to determine mRNA expressive variation of the toll like receptor 2 (TLR2)and its related factors in the established model to induce SBD-1.Three signaling pathway inhibitors were chosen which named NF-κB signaling pathway inhibitor PDTC,ERK 1/2signaling pathway inhibitor PD98059and JNK signaling pathway inhibitor SP600125,respectively.The tested cells were divided into 8groups:cell group:without treatment;positive groups:L.plantarum P-8;PDTC groups:PDTC pretreatment cells only;PDTC+L.plantarum P-8 group:PDTC+L.plantarum P-8;PD98059group:PD98059;SP600125group:SP600125;PD98059+L.plantarum P-8group:PD98059+L.plantarum P-8;SP600125+L.plantarum P-8 group:SP600125+L.plantarum P-8.RT-qPCR method was used for detecting the expression levels of SBD-1mRNA.The results indicated that the mRNA expression of TLR2,MyD88,NF-κB,ERK1/2and JNK had significant increase compared with the cell groups(P<0.01)after the sheep rumen epithelial cells were induced by L.plantarum P-8,PD98059and SP600125could significantly inhibited the mRNA expression of SBD-1in cells(P<0.01)with pretreatment that adding the inhibitors and were induced by L.plantarum P-8,however,the expression of SBD-1 was only inhibited significantly by the inhibitor PDTC(P<0.05).The results in this paper implied that L.plantarum P-8could promote the mRNA expression of TLR2,MyD88,NF-κB,JNKand ERK1/2.To add NF-κB signaling pathway inhibitor PDTC,ERK 1/2signaling pathway inhibitor PD98059and JNK signaling pathway inhibitor SP600125could inhibit the effect of L.plantarum P-8on inducing SBD-1mRNA.Thus,L.plantarum P-8could improve the SBD-1 expression by activating the signaling pathways of NF-κB,JNK and ERK1/2.
Key words:β-defensin-1;rumen epithelium cells;lactobacillus;toll-like receptor 2;real-time quantitative PCR
中图分类号:S826;S852
文献标志码:A
文章编号:0366-6964(2016)05-1026-07
doi:10.11843/j.issn.0366-6964.2016.05.021
收稿日期:2015-10-22
基金项目:国家自然科学基金(31160491);内蒙古自治区人才开发基金项目
作者简介:范燕茹(1988-),女,内蒙古呼和浩特人,博士生,主要从事动物解剖学与黏膜免疫研究,E-mail:shining_fyr@126.com
*通信作者:杨银凤,教授,博士,主要从事动物解剖学与黏膜免疫研究,E-mail:julie1963@163.com

