邓恩桉下胚轴不定芽再生体系建立的影响因素
陆荣生,韩美丽,梁志强,覃建林
(广西农业科学院 植物保护研究所/广西作物病虫害生物学重点实验室,广西 南宁 530007)
邓恩桉下胚轴不定芽再生体系建立的影响因素
陆荣生,韩美丽,梁志强,覃建林
(广西农业科学院 植物保护研究所/广西作物病虫害生物学重点实验室,广西 南宁 530007)
摘要:以邓恩桉种子萌发的实生苗下胚轴为材料,研究了不同激素种类与浓度及多胺对下胚轴经愈伤组织阶段产生不定芽过程的影响,以建立一种下胚轴不定芽再生快繁体系。结果表明,以MS为基本培养基,在培养基中添加2,4-D 1.0~1.5 mg/L可诱导邓恩桉下胚轴产生高质量的愈伤组织;愈伤组织增殖的适宜培养基为MS+TDZ 0.5~1.0 mg/L,愈伤分化产生不定芽的适合培养基为MS+TDZ 1.0 mg/L+腐胺15~25 mg/L,愈伤不定芽分化率达77.1%~79.2%,且外植体褐化率得以降低。愈伤组织块移入分化培养基初期,3~7 d暗培养可使愈伤不定芽分化率提高到82.8%以上。
关键词:邓恩桉;下胚轴;不定芽;愈伤;分化
邓恩桉是一个重要的耐寒桉树品种,可以耐受-5 ℃左右的低温,因此它的推广对于桉树种植由南向北的推广具有较大的促进作用[1]。邓恩桉推广种植中的主要问题是苗木供应量不能满足生产需求。由于邓恩桉生长周期长,开花所需时间达13年之久,且结实率低,难以获得大量种子,目前国内的实生苗生产造林用种主要从国外购进,加上扦插苗生根困难,这2种因素严重制约了邓恩桉的推广种植。因此,积极开展邓恩桉组织培养研究,是解决造林中种苗供需矛盾的有效途径。
自1996年起,国内外已有数起邓恩桉组培快繁技术研究报道[2-5],在愈伤培养基筛选、继代及生根苗获得方面取得了一定的进展,但仍存在一些问题。多数研究采用大龄实生苗腋芽增殖方式进行快繁,所取得的不定芽增殖系数较低,通常30 d为继代周期下只有3.5倍左右;以器官形成愈伤分化产生不定芽过程中,愈伤组织再分化不定芽百分率较低,同时继代过程存在较为严重的褐化现象,从而导致外植体死亡率高,间接造成有效分化率低。
针对上述问题,本文采用邓恩桉种子萌发无菌实生苗下胚轴为研究材料,从诱导下胚轴产生愈伤组织、提高愈伤分化不定芽百分比、减轻外植体褐化现象3个方面为切入点,以最大限度地提高愈伤分化不定芽百分率,建立一种邓恩桉下胚轴分化不定芽的组培快繁再生技术体系。
1材料与方法
1.1材料
取邓恩桉种子15 d苗龄的实生苗,种子购自广西林科院。
1.2试验方法
1.2.1邓恩桉无菌实生苗的获得邓恩桉种子消毒方法:清水冲洗60 min→无菌水浸泡4 h→70%酒精浸泡30 s→10% NaClO3消毒30 min→无菌水洗3次。消毒后的种子放于MS固体培养基中黑暗培养,萌发后待用。
1.2.2不同种类、浓度激素对下胚轴愈伤形成的影响取15 d苗龄的邓恩桉无菌苗下胚轴,切成0.5 cm长的片段,放置于添加不同浓度二氯苯氧乙酸(2,4-D)、奈乙酸(NAA)、吲哚乙酸(IAA)的培养基上,每个处理接种16个外植体,3次重复。黑暗下培养7 d后移入光下培养至第25天,调查外植体愈伤发生率。
1.2.3不同种类、浓度激素组合对愈伤组织继代增殖的影响将1.2.2诱导出的愈伤组织切下,放置于添加不同浓度苯基噻二唑基脲(TDZ)、6-苄基腺嘌呤(6-BA)、6-呋喃甲基腺嘌呤(KT)的培养基上,光下培养25 d后,调查愈伤组织恢复生长率、愈伤增殖量、愈伤褐化率。
1.2.4不同种类、浓度多胺化合物与TDZ结合对愈伤分化不定芽的影响将愈伤组织块转入添加不同种类、浓度多胺化合物,并添加TDZ 1.0 mg/L的分化培养基上,光下培养25 d后,观察不定芽发生率与外植体褐化率。
1.2.5暗培养时间对愈伤组织分化过程中不定芽发生与褐化现象的影响将愈伤组织转入继代分化培养基上,先在黑暗中培养1、3、5、7、9、11 d,然后光下培养至第25天,观察外植体不定芽的发生率、褐化率。
以上研究内容均以改良MS为基本培养基,每天光照16 h,培养温度26~28 ℃。
愈伤诱导率(%)=产生愈伤组织的外植体数/接种的外植体数×100%
不定芽诱导率(%)=产生不定芽的外植体数/接种的外植体数×100%
愈伤褐化率(%)=褐化的愈伤组织数/接种愈伤组织总个数×100%
愈伤恢复生长率(%)=恢复生长的愈伤组织数/接种愈伤组织总个数×100%
愈伤组织增长量(mm)=继代培养25 d后愈伤组织直径-接种当天愈伤组织直径
数据处理采用方差分析及Duncan’s新复极差测验。
2结果与分析
2.1不同种类、浓度激素对愈伤组织形成的影响
将下胚轴切段水平放置于添加不同种类与浓度激素的培养基上培养7 d时,可以看到外植体切口处有轻微膨大,10~15 d左右可观察到部分下胚轴切口处开始形成淡黄色愈伤组织;随着培养时间的延长,切口处的愈伤不断长大。至20 d左右时,愈伤组织发生达高峰(图1),具体结果见表1。

图1 邓恩桉下胚轴切口形成的愈伤组织
从表1可看出,添加不同浓度2,4-D、NAA、IAA的培养基对下胚轴愈伤诱导效果不同,添加2,4-D的各处理愈伤诱导率均高于添加NAA与IAA的各处理。在添加2,4-D的各处理中,M3、M4愈伤发生率最高,分别达到89.6%、91.7%,极显著高于另外3个处理及对照,所形成的愈伤组织为淡黄色,质地较为紧密。当2,4-D浓度为2.0 mg/L时,所形成的愈伤较为疏松,不能用于继代转移。
添加NAA的不同处理愈伤诱导率较低,其中M7、M8处理的愈伤诱导率分别仅达45.8%、52.1%,愈伤组织为白色粉末状,质地紧密。添加IAA的处理愈伤诱导率最高为22.9%,且随着愈伤长大,外植体褐化严重,以致死亡。
因此综合考虑各种因素,在培养基中添加1.0~1.5 mg/L 2,4-D,有利于邓恩桉下胚轴愈伤组织的高效发生。
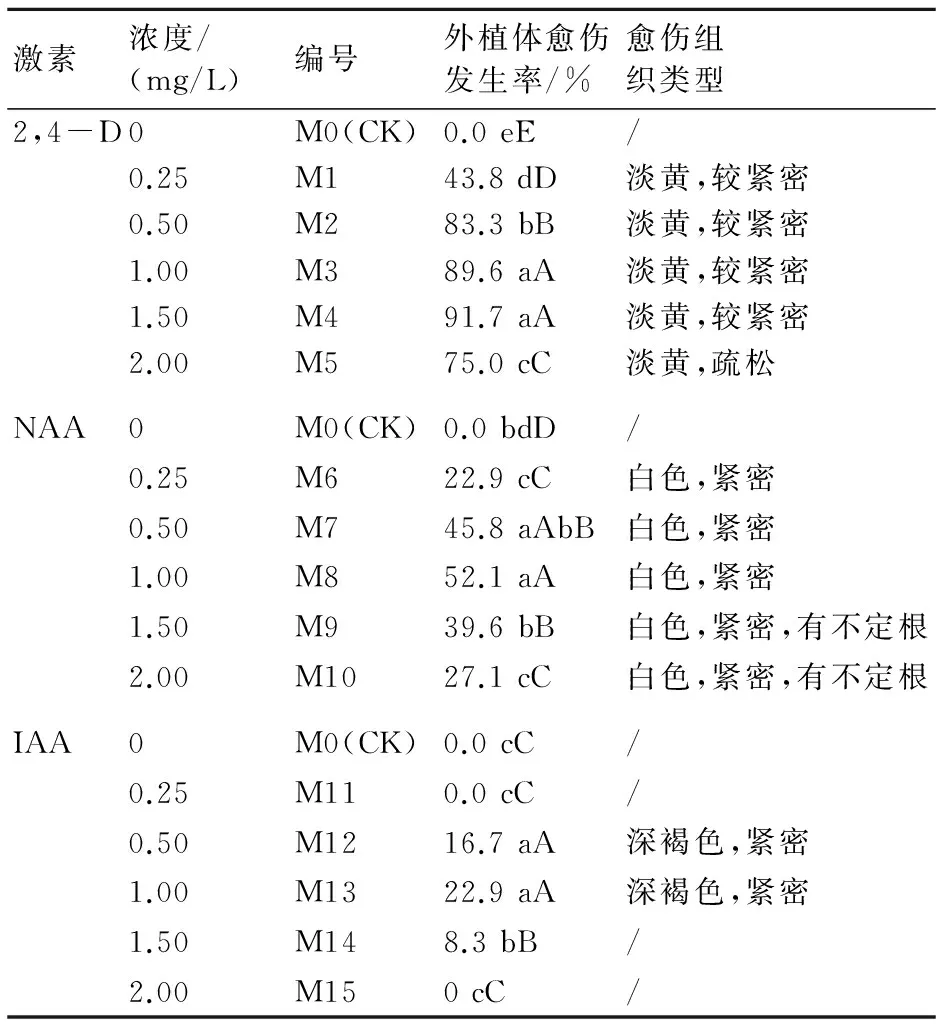
表1 不同种类、浓度激素对下胚轴愈伤组织诱导的影响
注:不同大、小写字母分别表示在P<0.01、P<0.05上的差异显著性。下同。
2.2不同种类、浓度激素组合对愈伤继代增殖的影响
将下胚轴上诱导产生的淡黄色愈伤组织继代于添加不同浓度TDZ、6-BA、KT的愈伤继代增殖培养基中,以观察不同种类、浓度细胞分裂素对愈伤恢复生长与增殖生长的影响。
从表2可看出,在添加6-BA的处理中,愈伤组织生长最初为淡黄色,至20 d左右变为黄褐色(图2-A)。各处理中,6-BA 1.0 mg/L处理愈伤恢复生长率与愈伤组织增长量最高,分别达45.8%、3.2 mm,但愈伤褐化率也达37.5%。其他处理愈伤褐化率也在33.3%~58.3%之间。添加KT的各处理愈伤恢复生长率与愈伤组织增长量均较低,且褐化率在35.4%~60.4%之间。
在添加不同TDZ浓度的处理中,多数外植体愈伤组织发育至外部颜色为润红色,且具有分化成芽能力的愈伤组织(图2-B)。TDZ浓度0.5、1.0 mg/L的处理愈伤恢复生长率与愈伤组织增长量在所有处理中最高,愈伤恢复生长率分别达87.5%、91.7%,愈伤组织增长量分别达5.1、5.5 mm,明显高于对照及其他处理。
通过比较发现,在添加TDZ 0.5~1.0 mg/L的培养基中愈伤组织能得到较好的增殖。

图2 邓恩桉愈伤组织在添加TDZ、6-BA对愈伤继代增殖的影响
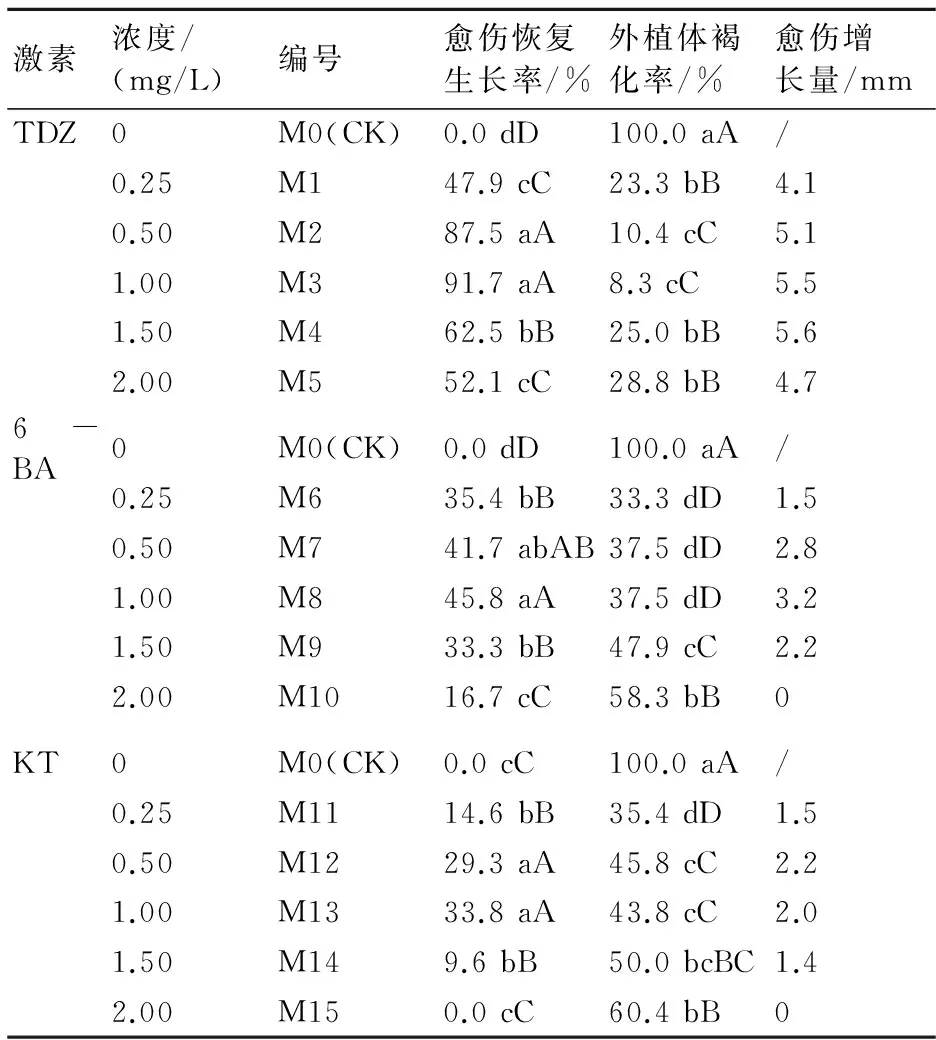
激素浓度/(mg/L)编号愈伤恢复生长率/%外植体褐化率/%愈伤增长量/mmTDZ0M0(CK)0.0dD100.0aA/0.25M147.9cC23.3bB4.10.50M287.5aA10.4cC5.11.00M391.7aA8.3cC5.51.50M462.5bB25.0bB5.62.00M552.1cC28.8bB4.76-BA0M0(CK)0.0dD100.0aA/0.25M635.4bB33.3dD1.50.50M741.7abAB37.5dD2.81.00M845.8aA37.5dD3.21.50M933.3bB47.9cC2.22.00M1016.7cC58.3bB0KT0M0(CK)0.0cC100.0aA/0.25M1114.6bB35.4dD1.50.50M1229.3aA45.8cC2.21.00M1333.8aA43.8cC2.01.50M149.6bB50.0bcBC1.42.00M150.0cC60.4bB0
注:M0(CK)培养基为MS+2,4-D 0.5 mg/L。
2.3不同种类、浓度多胺对愈伤分化不定芽的影响
腐胺、亚精胺是2种常用的多胺。试验中在添加TDZ 1.0 mg/L的培养基中分别加入不同浓度的腐胺、亚精胺,观察其对愈伤分化不定芽的影响,不定芽分化过程见图3。
从表3可以看出,腐胺加入浓度为15、25 mg/L的愈伤分化不定芽的百分率最高,分别达77.1%、79.2%,显著高于对照和其他处理,褐化率分别为16.7%、14.6%,显著低于对照及其他处理。其他3个处理愈伤分化不定芽的百分率在45.8%~60.4%之间,同时褐化率也较高。
亚精胺加入浓度25、35、50 mg/L的愈伤不定芽分化率分别为62.5%、66.7%、60.4%,高于对照及其他处理,3个处理之间无显著差异,这3个处理褐化率在25.0%~33.3%之间。
综上所述,愈伤组织在含1.0 mg/L TDZ,并添加15~25 mg/L腐胺的MS培养基中培养,可获得较高的不定芽发生率,且愈伤褐化率也明显下降。
2.4暗培养与盐浓度对不定芽形成的影响
将已具备不定芽分化能力的红色愈伤组织块移入前面选出的分化培养基中,在不同时间的暗培养后,移入光下培养,接种25 d后调查不定芽发生情况。
从表4可以看出,一定时间的暗培养时间可促进愈伤分化不定芽百分率的提高,并有助于减轻外植体的褐化程度,其中暗培养时间为3、5、7 d处理的不定芽分化率提高幅最大,不定芽分化率分别为85.6%、87.5%、82.8%,外植体褐化率也分别降至12.5%、8.3%、6.3%。当暗培养时间为9~11 d时,褐化率虽然较低,但愈伤分化率急剧下降。因此,暗培养时间以3~7 d为宜,时间过长,不利于愈伤分化率的提高。
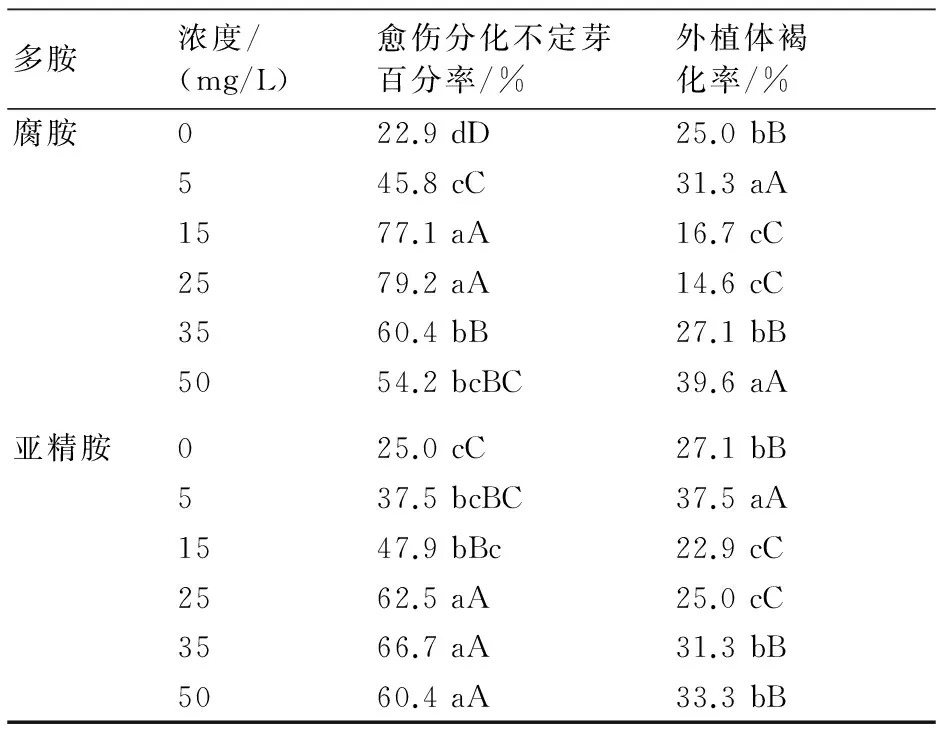
多胺浓度/(mg/L)愈伤分化不定芽百分率/%外植体褐化率/%腐胺022.9dD25.0bB545.8cC31.3aA1577.1aA16.7cC2579.2aA14.6cC3560.4bB27.1bB5054.2bcBC39.6aA亚精胺025.0cC27.1bB537.5bcBC37.5aA1547.9bBc22.9cC2562.5aA25.0cC3566.7aA31.3bB5060.4aA33.3bB

表4 不同暗培养天数对愈伤组织不定芽分化率的影响
注:所用分化培养基为MS+TDZ 1.0 mg/L+腐胺15.0 mg/L。
3结论与讨论
本文以邓恩桉种子萌发的15 d苗龄实生苗下胚轴为材料,研究了不同激素种类与浓度及多胺对下胚轴经愈伤组织阶段产生不定芽的影响,结果表明:以MS为基本培养基,培养基中添加1.0~1.5 mg/L的2,4-D可诱导邓恩桉下胚轴产生高质量的愈伤组织。愈伤组织增殖的适合培养基为:MS+TDZ 0.5~1.0 mg/L,在添加TDZ的情况下,愈伤组织褐化率也较对照与其他激素低。将在TDZ培养基上增殖获取的愈伤组织移入MS+TDZ 1.0 mg/L+腐胺15~25 mg/L的分化培养基中,愈伤不定芽分化率达77.1%~79.2%,愈伤褐化率进一步减轻。愈伤组织块移入分化培养基初期,3~7 d暗培养可使愈伤不定芽分化率提高到82.8%以上。
2,4-D、NAA是诱导桉树愈伤组织形成过程中的2种常用激素。国内外有关不同激素对诱导桉树愈伤组织的影响报道主要集中在不同浓度的2,4-D、IBA、NAA对桉树愈伤组织诱导的影响[6-7]。3种激素中以2,4-D对愈伤组织的诱导效果最好,在2,4-D浓度为1.0~1.5 mg/L时,愈伤组织诱导率达89.6%~91.7%,这与前人报道的2,4-D可以促进幼嫩组织产生愈伤组织的结果一致。
作为一种新型植物生长调节剂,TDZ具有很强的细胞分裂素活性,近年在植物组织培养中应用较多[8-10],但在桉树组织培养中应用还很少[11]。在本试验中,TDZ的添加对愈伤组织增殖与分化具有较好的效果,且褐化率低于添加6-BA与KT的处理,这说明TDZ对于植物伤口愈合反应与细胞的恢复性生长也有一定的帮助,这与有关报道TDZ增加花生幼苗中IAA与色胺酸含量一致[12]。
腐胺又名丁二胺,是生物体内促进细胞生长的重要物质之一。它能直接参与生物体内的多种生理活动,是生物体生长和细胞代谢所必需的痕量生物活性物质,具有促进细胞分裂分化及促进DNA、蛋白质等大分子物质合成的作用。陈小飞等研究发现,在石刁柏离体培养过程中观察到石刁柏继代培养基中添加一定浓度的外源腐胺可保持继代胚性愈伤组织的胚性,且能有效地降低愈伤组织的褐化率[13]。周亚琦等研究杂种榛的继代培养条件时发现,培养基中添加多胺对组培苗茎段增殖具有良好的效果[14];程云清等在平榛茎段不定芽诱导与快速繁殖研究发现,多胺与亚精胺同时加入可提高不定芽增殖率并加快生长。笔者的研究发现,15~25 mg/L的腐胺与TDZ 1.0 mg/L结合使用,可以极大地促进邓恩桉愈伤分化不定芽的比率,这对于愈伤组织较难分化的物种具有重要意义。
植物愈伤组织继代培养时,由于材料切割经常会发生褐变现象,进而引起接种块褐化死亡。减轻褐化方法主要有材料培养初期暗培养、改变基本培养基盐浓度及添加防褐剂等[15-16]。本文主要就暗培养对邓恩桉愈伤分化不定芽的影响进行了研究。结果表明,一定时间的暗培养不仅促进了愈伤组织不定芽分化能力的提高,而且对外植体褐化作用有一定的抑制,但暗培养时间过长时,愈伤分化不定芽比例下降,这可能是暗培养时间过长导致愈伤生长过快,从而影响了邓恩桉的形态建成有关。
本研究为以邓恩桉种子下胚轴为材料的快速繁殖工厂化育苗提供了技术基础,同时所建立的再生体系也为通过转基因技术进行邓恩桉遗传改良的研究创建了良好的再生条件。
参考文献:
[1] 刘彦伟,马玲,衡保清,等.汉中市耐寒桉树引种繁殖试验[J].陕西林业科技,2014(4):11-14.
[2] 王以红,吴幼媚,蔡玲,等.邓恩桉茎段离体培养再生植株的研究[J].林业科技开发,2007,21(6):49-52.
[3] 管朝旭,施彬,曾德贤,等.邓恩桉组培技术研究[J].桉树科技,2012,29(4):21-28.
[4] 燕丽萍,夏阳,毛秀红,等.邓恩桉的组织培养[J].林业科学,2011,47(5):157-161.
[5] 饶红欣,彭信海,陈灵,等.邓恩桉组织培养体系的建立与优化[J].桉树科技,2008,25(2):1-6.
[6] Diwakar A, Kumar A, Reddy M S. Shoot organogenesis in elite clones ofEucalyptustereticornis[J]. Plant Cell Tissue and Organ Culture, 2010, 102(1): 45-52.
[7] Andrade G, Shah R, Johansson S, et al. Somatic Embryogenesis as a tool for forest tree improvement: a case- study inEucalyptusglobulus[J]. BMC Proc, 2011, 5(7): 128-129.
[8] Amjad M, Abdin M Z. Interactive effect of light, temperature and TDZ on the regeneration potential of leaf discs ofFragaria×ananassaDuch[J]. In Vitro Cellular & Developmental Biology-Plant, 2007, 43(6): 576-584.
[9] 于树宏,张嫡群,杨双革.TDZ和CPPU在虎杖组织培养中的应用[J].热带亚热带植物学报,2010,18(3):13-17.
[10] 张宇. TDZ 在林业科研与生产上的应用探讨[J].林业科技情报,2015,47(2):12-13.
[11] S Zhihui, M Tzitzikas, K Raemakers, et al. Effect of TDZ on plant regeneration from mature seeds in pea (Pisumsativum)[J]. In Vitro Cellular & Developmental Biology-Plant, 2009, 45(1): 776-782.
[12] 范春节,王象军,裘珍飞,等.TDZ对尾细桉叶片离体再生的影响[J].热带农业科学,2015,35(9):37-41.
[13] 陈小飞,萧浪涛,鲁旭东,等.外源腐胺对石刁柏愈伤组织胚性能力的影响[J].植物生理学通讯,2007,43(3):461-464.
[14] 周亚琦,梁丽松,黄绵佳,等.平欧杂种榛的继代培养条件优化研究[J].中国农学通报,2013,29(1):17-23.
[15] 刘剑锋,程云清,陈智文,等.平欧杂交榛组织培养与快速繁殖技术研究[J].园艺学报,2009,36(3):409-414.
[16] 李菲菲,易春,李青峰,等.兰花组织培养的褐化现象及控制研究进展[J].南方园艺,2014,25(4):50-52.
[17] 郭艳,杨海玲.植物组织培养中的褐化现象及解决途径[J].山西农业科学,2009,37(7):14-16,31.
(责任编辑:曾小军)
Factors Affecting System Establishment of Adventitious Bud Regeneration from Hypocotyls ofEucalyptusdunnii
LU Rong-sheng, HAN Mei-li, LIANG Zhi-qiang, QIN Jian-lin
(Institute of Plant Protection, Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests, Nanning 530007, China)
Abstract:The hypocotyls from 10-day-old aseptic seedling, were used as explants to investigate the influence of callus formation and adventitious buds differentiation in media adding different types of hormone and ploy-amine, in order to establish a rapid propagation regeneration system of hypocotyls by adventitious bud. The results showed that high quality callus were obtained from hypocotyls in medium with basal MS salt contained 2,4-D 1.0~1.5 mg/L. The medium with basal MS salt adding TDZ 0.5~1.0 mg/L, were most suitable for callus proliferation. The optimal medium for adventitious buds differentiation, was basal MS salt supplemented TDZ 1.0 mg/L and putrescine 15~25 mg/L, and 77.1%~79.2% of adventitious buds differentiation rate were achieved in this medium, meanwhile browning rate of explants were alleviated. Darkness culture for 3~7 d at the early stage of callus subculture, could make adventitious buds differentiation rate increase to 82.8%.
Key words:Eucalyptusdunnii; Hypocotyls; Adventitious bud; Callus; Differentiation
收稿日期:2015-11-18
基金项目:广西自然科学基金资助项目(2013GXNSFAA019074);广西作物病虫害生物学重点实验室资助项目(13-051-47-KF-3)。
作者简介:陆荣生(1962─),男,高级工程师,主要从事植物组织培养及遗传转化研究。
中图分类号:Q813.12
文献标志码:A
文章编号:1001-8581(2016)06-0031-05

