心脏磁共振评估2型糖尿病患者左心室整体功能及其与临床指标相关性研究
吴 昊,高子晴,唐丽萍,伍建林
(1.大连大学 临床学院,辽宁 大连 116622;2.大连大学附属中山医院 医学影像部, 辽宁 大连 116001)
心脏磁共振评估2型糖尿病患者左心室整体功能及其与临床指标相关性研究
吴昊1,2,高子晴2,唐丽萍1,2,伍建林2
(1.大连大学 临床学院,辽宁 大连 116622;2.大连大学附属中山医院 医学影像部, 辽宁 大连 116001)
[摘要]目的探讨心脏磁共振(CMR)对2型糖尿病患者左心室整体功能评价的临床应用价值。方法应用心脏磁共振真实稳定进动序列(True SSFP)对 23例2型糖尿病患者进行扫描,并通过磁共振电影技术获得心脏位置、形态及瓣膜运动等情况,同时选取25例健康志愿者作对照。采用Argus心功能处理软件自动描绘左室从心底至心尖范围的心肌内、外膜轮廓,并对其进行测量及运算得出左室整体收缩及舒张功能指标。随后观察其与心率、收缩压、舒张压、HBA1C、BMI之间的相关性。结果舒张末期质量指数(EDMI)糖尿病组(28.10±12.72)kg/m2小于对照组(35.64±11.01)kg/m2,差异有显著性意义(P<0.01);高峰充盈率(PFR)糖尿病组(283.55±64.35)小于对照组(349.79±66.92),差异有显著性意义(P<0.01);高峰充盈时间(TPFR)糖尿病组 (227.42±103.80)ms大于对照组(159.21±27.36)ms,差异有显著性意义(P<0.05)。相关性分析显示:PFR与体重指数(BMI)呈负相关(r=-0.695,P=0.026);PFR与糖化血红蛋白(HBA1C)呈负相关(r=-0.528,P=0.006);PFR与低密度脂蛋白(LDL)呈负相关(r=-0.755,P=0.007)。结论CMR能够准确评价2型糖尿病患者的左心室整体功能改变情况,主要表现为舒张功能障碍早于收缩功能障碍,且BMI、HBA1C及LDL增高均可影响2型糖尿病患者左心室舒张功能。
[关键词]心脏磁共振成像;2型糖尿病;左心室整体功能
[引用本文]吴昊,高子晴,唐丽萍,等.心脏磁共振评估2型糖尿病患者左心室整体功能及其与临床指标相关性研究[J].大连医科大学学报,2016,38(2):134-138.
糖尿病(diabetes mellitus,DM)的发病率已从1980年的0.68%,上升到2010年的9.7%[1]。而DM合并心血管事件是其死亡的首要因素,约占70%。流行病学研究表明,DM患者心血管疾病的发病率较非糖尿病患者高2~4倍[2]。左心室重构是2型DM患者心脏结构早期改变主要表现。虽然超声、CT及磁共振成像等影像学方法均可以评价DM左心室(left ventricle, LV)功能情况,但心脏磁共振(cardiac magnetic resonance, CMR)检查因其安全无创、无电离辐射、空间、时间分辨率高及可重复性好等特点近年来发展迅速,明显优于超声等其他影像学检查[3],是目前公认的测定左心室功能的“金标准”[4]。但国内鲜见应用CMR对2型DM的LV整体功能与临床对照研究的报道。本研究旨在探讨CMR对2型DM的LV整体功能评估的应用价值及其与临床指标的相关性。
1资料与方法
1.1一般资料
连续选取大连大学附属中山医院2013年10月至2015年9月入院的2型DM患者及同期健康志愿者共48例。糖尿病组(DM组):依据2007年美国糖尿病协会(American Diabetes Association, ADA)的2型糖尿病诊断标准[5],经过临床确诊2型DM患者23例,其中男性13例,女性10例,年龄28~78岁,平均(52.78±9.64)岁,病程6个月至20年;平均病程(13.36±7.24)年。收集的临床指标包括:心率、收缩压、舒张压、糖化血红蛋白(HBA1C)、体重指数(BMI)、低密度脂蛋白(LDL)等。对照组:健康志愿者25例,男性13例,女性12例,年龄42~67岁,平均(55.63±6.48)岁。两组年龄、性别、身高、体重、体重指数(BMI)、体表面积(BSA)及心率比较差异均无显著性意义(P>0.05);而HBA1C、LDL两指标在 DM组均小于对照组,差异有显著性意义(P<0.001)。本研究经过医院伦理委员会批准且签署知情同意书。见表1。
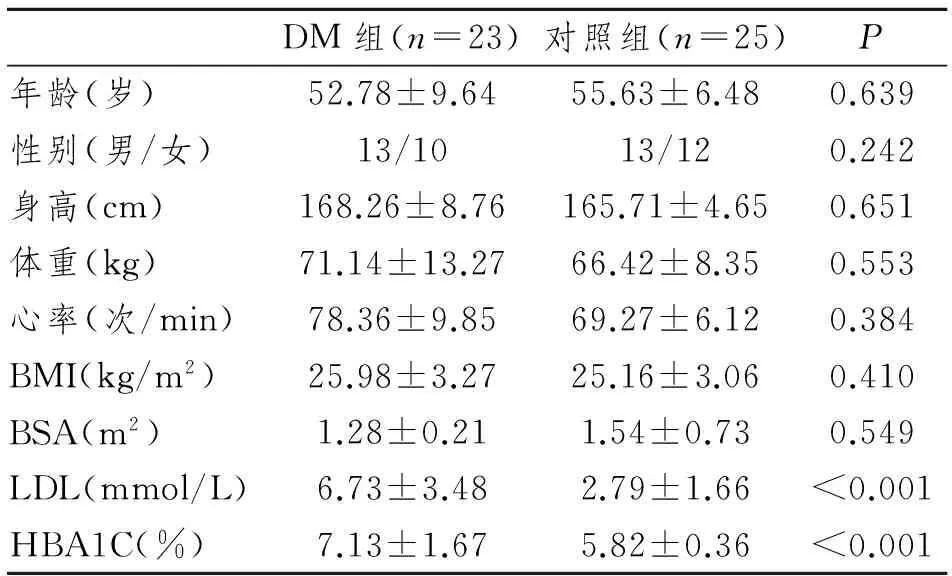
表1 DM组与对照组一般临床资料对比
BSA(m2)=0.0061×身高(cm)+0.0128×体重(kg)-0.1529;BMI(kg/m2)=体重(kg)/身高2(cm)
1.2纳入及排除标准
纳入标准:(1)糖尿病组均无明显临床心功能不全表现,均正在进行口服降糖药和/或注射胰岛素治疗;(2)正常对照组选取无糖尿病及心血管家族史,且心电图、超声心动图等检查的指标均正常者;(3)对此研究表示理解和支持,同意配合检查且无禁忌证者。
排除标准: (1)既往心肌炎、原发性心肌病、冠心病患者;(2)高血压患者;(3)心律失常患者;(4)风湿性瓣膜病患者;(5)肾功能不全者;(6)MRI图像质量差不能用于评价者;(7)幽闭恐惧症患者;(8)有金属内置物患者,如心脏起搏器、动脉瘤夹、动脉支架植入等。
1.2实验方法
1.2.1扫描设备
采用德国Siemens Verio 3.0T磁共振扫描仪,8通道心脏线圈,最大梯度场强40 mT/m,最大梯度切换率200 mT·m-1·s-1。心电门控采用MR兼容的无线矢量心电门控板。扫描前对所有入选者进行充分的屏气训练[6],使其每次扫描时心脏处于相对固定的位置,以提高扫描效率,获得真实而高质量的图像[7]。在屏气状态采用回顾性心电门控真实稳定进动序列(true fast imaging with steady-state free-procession, True SSFP)从心底至心尖逐层扫描,连续采集左心室短轴位多层电影图像,每心动周期采集25帧图像。总采集时间25~30 min。采集参数:TR 48.00 ms,TE 1.50 ms,反转角15°,FOV 340 mm×340 mm,矩阵257×192,层厚8 mm。
1.2.2左心室图像处理及整体功能分析
所有短轴位电影序列均采用Argus软件分析(Syngo MMWP VE30A workstation,Siemens,德国)。选取左心室基底部、正中部及心尖部三层短轴位图像[8],选入层面自动勾画出心内膜与心外膜范围(图1)。由两名熟练操作软件的放射科医师分别进行两次手工调整,使其更加精确,可将乳头肌算入血池内。软件自动确认收缩末期及舒张末期,生成左心室舒张末容积和收缩末容积,进而测量并计算出左心室整体收缩功能指标[9]:舒张末期容积(end diastole volume,EDV)、收缩末期容积(end systole volume,ESV)、每搏输出量(stroke volume,SV)、心输出量(cardiac output,CO)、射血分数(eject fraction,EF)。以上指标的绝对值经过体表面积(BSA)校正,即左心室整体功能参数绝对值/BSA分别得出舒张末期容积指数(end diastole volume index,EDVI)、收缩末期容积指数(end systole volume index,ESVI)、每搏输出量指数(stroke volume index,SVI)、心脏指数(cardiac index,CI)、舒张末期质量指数(end diastole mass index,EDMI)。以及左心室整体舒张功能指标:高峰射血率(peak ejecting rate,PER)、高峰射血时间(time of peak ejecting rate,TPER)、高峰充盈率(peak filling rate,PFR)和高峰充盈时间(time of peak filling rate,TPFR)参数,并自动生成出左室舒张末期心室壁厚度“牛眼图”。见图2。
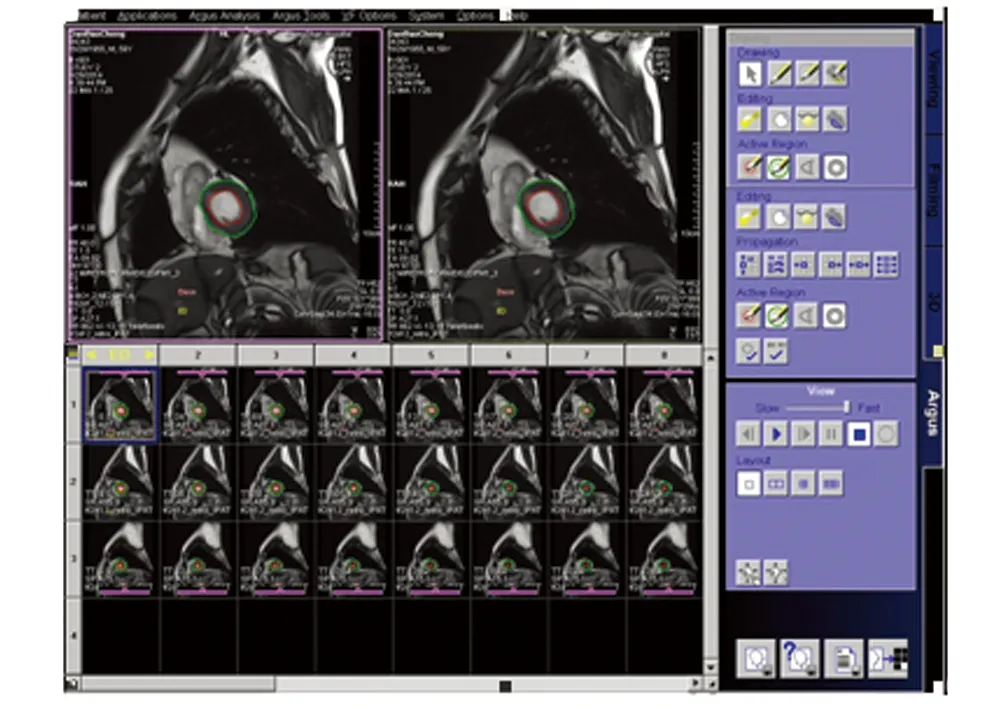
图1 Argus心功能处理软件工作界面Fig 1 Argus heart function processing software working interface
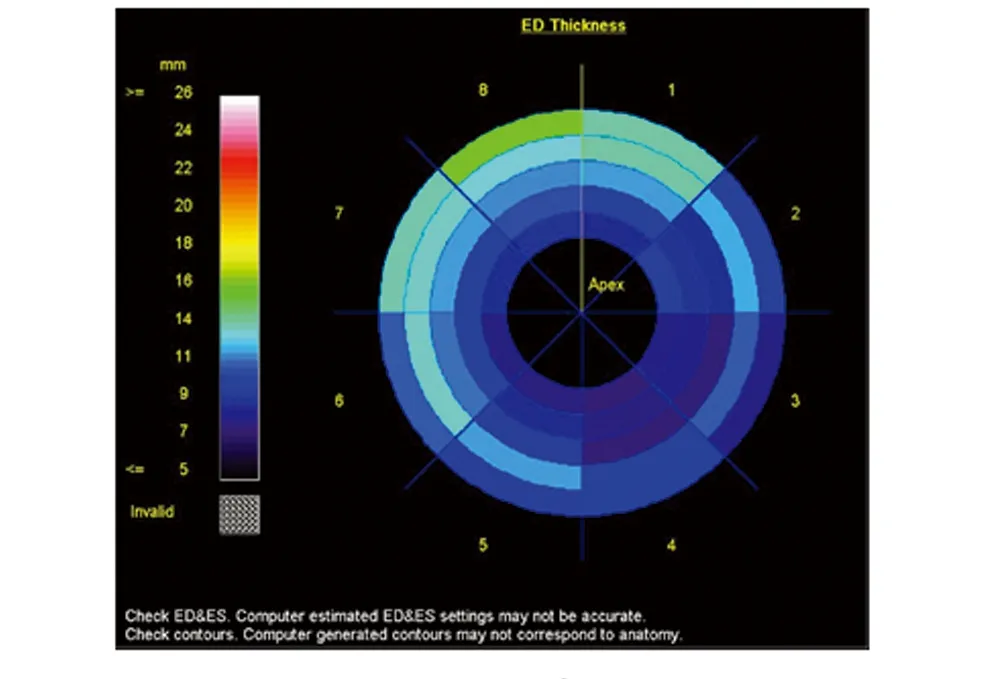
图2 左心室舒张末期心室壁厚度“牛眼图”Fig 2 Bulls-Eye map of left ventricular end-diastolic ventricular wall thickness
1.3统计学方法
应用SPSS 19.0分析软件,所测连续变量表示为均数±标准差。采用独立样本t检验比较DM组与对照组左心室整体功能参数,并应用Pearson相关分析法检验DM患者左心室整体心功能参数与心率、收缩压、舒张压、HBA1C、BMI之间是否存在相关性。P< 0.05为有统计学意义。
2结果
2.1DM组与对照组左心室整体功能比较
DM组EDMI、PFR和TPER与对照组比较,差异均有显著性意义(P<0.05)。见表2。
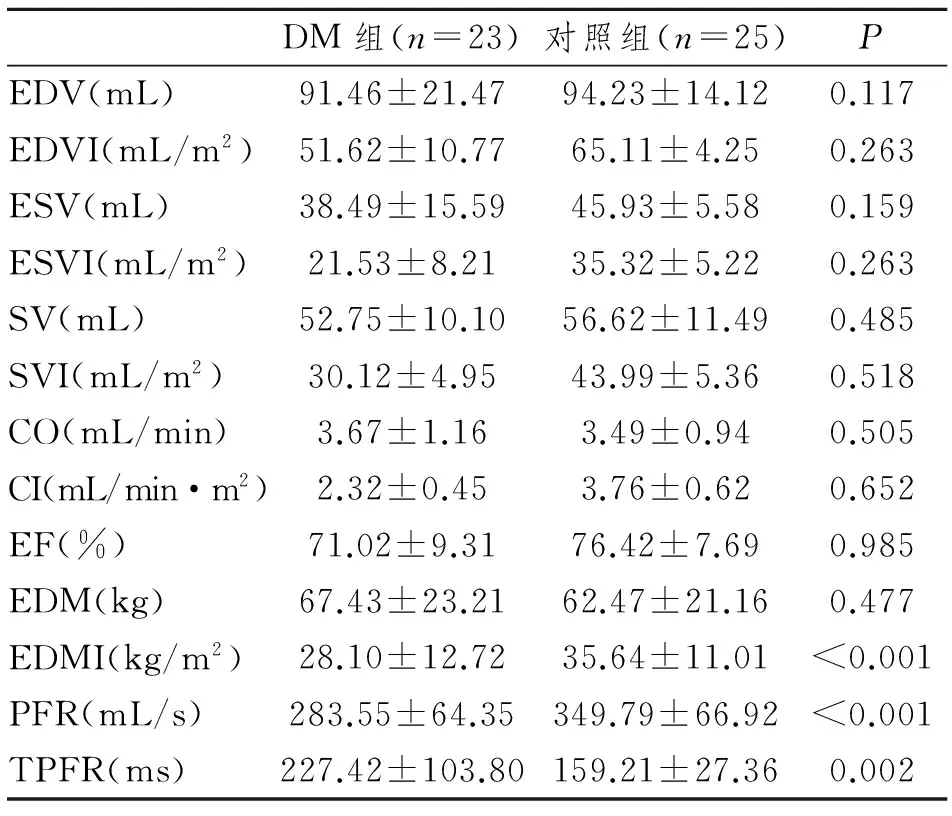
表2 DM组与对照组左室心功能指标对比
2.2DM组左心室PFR与临床指标的相关性
Pearson相关性分析显示:PFR与HBA1C、BMI及LDL均呈负相关。见表3。
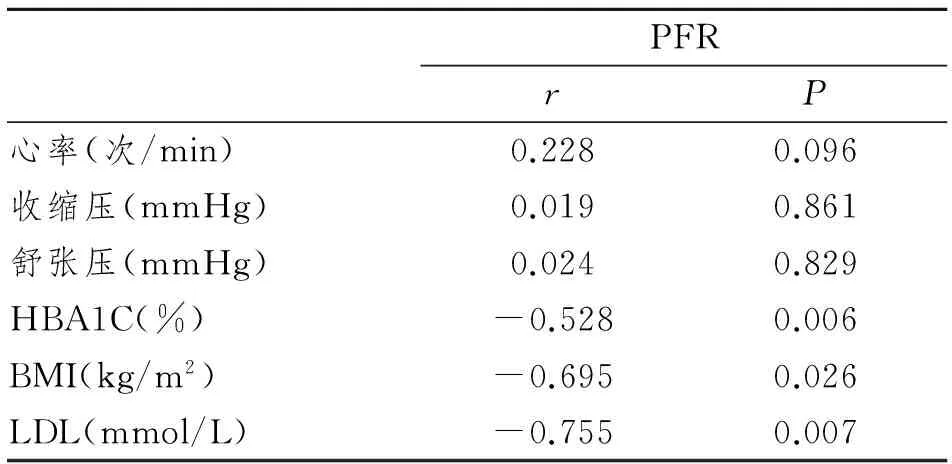
表3 PFR与糖尿病组患者各临床指标的相关性分析
3讨论
3.12型DM左心室整体功能改变及CMR诊断价值
1974年Robert等[10]研究发现糖尿病患者心肌细胞出现不同于缺血性心脏病患者心肌细胞的特异性损伤。近年来研究认为,该种损伤系心肌细胞的原发性损伤致左心室肥厚、舒张期及(或)收缩期功能障碍导致的充血性心力衰竭[11]。因此,糖尿病心肌损伤被定义为糖尿病引起的心脏微血管病变和心肌代谢紊乱所致心肌广泛的局灶性坏死[11]。临床上无心脏病证据的2型DM患者首先出现左心室舒张功能减低以及内皮功能障碍,其机制可能为早期DM 患者胰岛素缺乏,葡萄糖利用率减低,糖异生作用相应加强,导致脂肪酸氧化增加,其代谢产物对钙离子调节酶的摄取下降,肌浆网内钙的转运发生异常,钙离子和钠离子的浓度升高,最终导致心室壁的硬度增大[12-13]。本文的研究亦发现2型DM患者出现代表左心舒张功能的PFR及TPFR水平下降(P<0.01),但两组之间的左心室整体收缩功能差异无显著性意义(P>0.05),这与之前文献报道结果相似[14]。以上结果表明糖尿病患者首先引起左心舒张功能的改变,因此是导致左心室舒张功能下降重要临床影响因素。目前2型糖尿病左心室功能改变相关研究大多应用超声检查手段[15-16],笔者应用CMR动态监测与评估左心室功能改变情况,其优势在于应用True SSFP序列,一次屏气即可采集完整的心动周期(25~50幅图像),较传统的Turbo FISP序列在对比度、信噪比以及时间分辨率方面更加优越,从而在形态学及定量指标上更早发现异常;其次Argus心功能后处理软件可以多层面、多角度对心脏结构进行勾画与测量,自动得出相应心功能指标,其结果较超声与CT等检查更加客观与准确。因此,利用CMR方法检测左室整体功能指标,尤其对2型DM患者左心功能损伤的评估具有重要的临床价值。
3.2左心室舒张功能与临床相应指标相关性
本研究发现2型糖尿病患者PFR、TPFR、EDMI均较健康成人不同程度减低(P<0.05),其中PFR主要反映左心房室间的压力梯度,受左心室负荷状态和顺应性影响,是目前反映左室舒张功能情况的主要指标,其评价作用更加敏感与可靠[17]。经统计学分析发现,PFR与BMI、HBA1C、LDL等临床指标均具有明显的相关性(P<0.05)。国外Iribarren等[18]研究证明心脏舒张功能受损的严重程度与HBA1C水平有关,本研究结果亦发现二者之间具有显著负相关性(r=-0.528,P<0.05),说明随着HBA1C的增高,左心舒张功能指标PFR降低,其可能机制是血管内皮因子与胶原大分子物质结合,加剧成纤维细胞因子的释放,增加心肌细胞发生炎症反应的机率,进而导致心肌弥漫性纤维化;当左心房室间压力梯度、左心室负荷以及左心室顺应性下降时,PFR是早期发现和反映其降低程度的主要量化指标。故可以通过测定心脏舒张功能指标PFR反映2型DM患者HBA1C的控制情况,对临床血糖控制及对症治疗具有重要的指导作用。随诊生活水平的提高,合并肥胖的糖尿病患者越来越多,并且肥胖也是导致心血管疾病风险的独立因素[19]。BMI是衡量及评判人体肥胖程度常用指标之一,本研究发现其与PFR呈显著负相关(r=-0.695,P<0.05),与佟欣等[20]的研究结果相符。本研究中,DM组LDL水平较对照组显著升高(P<0.001),可能与长期高血糖状态导致血液循环中LDL的非酶促糖基化,使单核巨噬细胞在血管壁沉积并转变成泡沫细胞,损伤血管内皮细胞功能和血小板异常所致[21-22]。本研究中显示LDL与PFR呈负相关(r=-0.755 ,P<0.05),说明左心舒张功能随LDL水平的升高而降低,可能与血浆中高浓度LDL氧化和/或糖化对血管内皮细胞造成持续性损伤有关,该指标有助于指导临床治疗和评估病情。
尽管CMR被认为是评价心功能的“金标准”,但其应用普及率远不如心脏超声检查。本研究不足之处,一是未能进行两者之间的比较,两种方法在评价2型DM患者左心脏功能方面优劣尚有待于进一步深入研究;二是本组病例均经过临床治疗,如果增加非治疗对照组的患者则更加具有说服力;三是本研究的样本量还较少,将在后续的研究中进一步补充和完善。总之,本研究利用临床型3.0T MRI对2型DM患者左心脏功能进行定量评估证明是行之有效的,并发现其左心舒张功能障碍早于收缩功能,BMI、HBA1C及LDL是影响左心室舒张功能重要因素。该技术有望成为临床上早期评估2型DM患者左室功能的理想方法。
参考文献:
[1] Yang WY, Lu JM, Weng JP,et al.Prevalence of Diabetes among Men and Women in China[J]. N Eng J Med,2010,362(25):1090-1011.
[2] Paneni F, Beckman JA, Creager MA,et al.Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I[J]. Eur Heart J, 2013,34(31):2436-2443.
[3] Grothues F,Gillian CS,James CC,et al.Comparison of Interstudy Reproducibility of Cardiovascular Magnetic Resonance with Two-Dimensional Echocardiography in Normal Subjects and in Patients with Heart Failure or Left Ventricular Hypertrophy [J].Am J Cardiol,2002, 90(1):29-34.
[4] Mille S,Simoneti OP,Carr J,et al.MR imaging of the heart with cine true fast imaging with steady-state precession: influence of spatial and temporal resolution on left ventricular functional parameters[J].Radiology,2002,223(1):263-269.
[5] American Diabetes Association. Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2007,30:42-47.
[6] 贺莉,李曦,程巍,等.病房内呼吸训练对心脏增强磁共振图像质量评价的影响[J].四川大学学报(医学版),2015,46(3):497-499.
[7] Ku hi HP,Spuentrup E,Wall A,et al. Assessment of myocardial function with interactive non-breath-hold real-time MR imaging: comparison with echocardiography and breath-hold cine MR imaging [J].Radiology,2004,23(1): 198-207.
[8] Christopher N,Edward K,Stefan R,et al.Reliability and reproducibility of quantitative assessment of left ventricular function and volumes with 3-slice segmentation of cine steady-state free precession short axis images[J].Eur J Radiol,2015,3(19):720-748.
[9] 赵希刚,李坤成,王彩荣.屏气电影法MRI评价左心室功能的价值[J].中华放射学杂志,2002,36(6):545-548.
[10] Hamby RI, Zoneraich S, Sherman L. Diabetic Cardiomyopathy[J]. JAMA,1974,229(13):1749-1754.
[11] Galderisi M. Diastolic dysfunction and diabetic cardiomyopathy:evaluation by Doppler echocardiography[J]. J Am Coll Cardiol,2006,48(8):1548-1551.
[12] Chiu HC,Kovacs A,Blanton RM.Trmlsgenie expression of fatty acid transport protein in the hearl causes lipotoxlc cardiomyopathy[J].Circ Res,2005,96(2):225-233.
[13] Leung M, Phan V, Leung DY.Endothelial function and left ventricular diastolic functional reserve in type 2 diabetes mellitus[J].Open Heart,2014,1(1):e000113.
[14] Bajraktari G,Qirko S,Rexhepaj N,et al.Non-insulin depent diabetes as an indepengt predictor of asymptomatic left ventricular diastolic dysfunction[J].Croat Med J,2005,46(2):225-231.
[15] Jellis CL, Stanton T, Leano R, et al. Usefulness of at rest and exercise hemodynamics to detect subclinical myocardial disease in type 2 diabetes mellitus[J]. Am J Cardiol, 2011,107(4):615-621.
[16] Kim SA, Shim CY, Kim JM, et al. Impact of left ventricular longitudinal diastolic functional reserve on clinical outcome in patients with type 2 diabetes mellitus[J]. Heart,2011,97(15):1233-1238.
[17] Rodriguez-Granillo GA, Mejia-Campillo MA, Rosales MA,et al. Left ventricular filling patterns in patients with previous myocardial infarction measured by conventional cine cardiac magnetic resonance[J].Int J Cardiovasc Imaging,2012,28(4):795-801.
[18] Iribarren C, Karter AJ, Go AS, et al. Glycemic control and heart failure among adult patients with diabetes[J].Circulation,2001,103(2): 2668-2673.
[19] Kenchaiah S, Evans JC, Levy D, et al. Obesity and the risk of heart failure[J]. N Eng J Med, 2002,347(5):305-313.
[20] 佟欣,李磊,姜克新,等.肥胖者减肥前后血压及心脏结构和功能的变化[J].江苏医药,2008,34(9):948-949.
[21] Cohen MP, Jin Y, Lautenslager GT. Increased plasma glycated low-density lipoprotein concentrations in diabetes: a marker of atherogenic risk[J].Diabetes Technol Ther, 2004,6(3):348-356.
[22] Virella G,Thorpe SR, Alderson NL, et al.Autoimmune response to advanced glycosylation end-products of human LDL[J].J Lipid Res,2003,44(3):487-493.
Evaluation of left ventricular global function in patients with type 2 diabetes mellitus by cardiac magnetic resonance imaging and correlation with clinical parameters
WU Hao1,2,GAO Zi-qing2,TANG Li-ping1,2,WU Jian-lin2
(1.ClinicalDepartment,DalianUniversity,Dalian116622,China; 2.DepartmentofRadiology,AffiliatedZhongshanHospitalofDalianUniversity,Dalian116001,China)
[Abstract]Objective To evaluate left ventricular global function in patients with type 2 diabetes by cardiac magnetic resonance imaging(CMR) and analyze its correlation with clinical indicators. Methods Cardiac magnetic resonance imaging true and steady-state free-precession (True SSFP) was performed on 23 cases of type 2 diabetic patients (10 males, 13 females, mean age (52.78±9.64) years, mean duration (13.36±7.24) years, according with American Diabetes Association and the American Diabetes Association (2007, ADA) of type 2 diabetes diagnostic criteria) and 25 cases of normal volunteers (13 males, 12 females). The average age was (55.63±6.48) years. Cine magnetic resonance technique was used to obtain heart position, valve movement and so on. After the scan, the Argus software was used to automatic described the left ventricular endocardium and epicardium, and the left ventricular systolic function and diastolic function were measured. The correlation of heart rate, systolic blood pressure, diastolic blood pressure, BMI and HBA1C was analyzed in the patients with diabetes mellitus. SPSS 19.0 analysis software was used for statistical analysis, the difference was statistically significant with P< 0.05. Results End diastolic mass index (EDMI) in diabetes group (28.10±12.72)kg/m2, was significantly different from normal control group(35.64±11.01)kg/m2, P<0.01; peak filling time(PFR) in diabetes group (283.55±64.35)mL/s,was significantly different from normal control group(349.79±66.92)mL/s, P<0.01; time of peak filling time (TPFR) in diabetes group (227.42±103.80)ms, was significantly different from normal control group(159.21±27.36)ms, P<0.05. Correlation analysis revealed PFR was negatively correlated with BMI(r=-0.695, P=0.026), PFR was negatively correlated with HBA1C(r=-0.528, P=0.006), and PFR was negatively correlated with LDL(r=-0.755,P=0.007). Conclusion CMR technique can accurately evaluate the left ventricular global function in patients with type 2 diabetes mellitus. The changes of left cardiac function in type 2 diabetes mellitus patients were mainly caused by the dysfunction of diastolic dysfunction. BMI, HBA1C and LDL increased can all influence cardiac diastolic function in type 2 diabetes mellitus patients.
[Key words]cardiac magnetic resonance; type 2 diabetes mellitus; left ventricular global function
[中图分类号]R445.2
[文献标志码]A
文章编号:1671-7295(2016)02-0134-05
(收稿日期:2015-11-10;修回日期:2016-03-20)

