基于实时细胞分析技术检测前列腺癌细胞药物敏感性
靳亚西,孙彩显,高 虹,张连峰,张 丽
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
基于实时细胞分析技术检测前列腺癌细胞药物敏感性
靳亚西,孙彩显,高 虹,张连峰,张 丽
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
【摘要】目的 基于实时细胞分析技术发展,以更加简便稳定的方法进行药物敏感性评估,为前列腺癌临床治疗提供参考。方法 选取VCaP、DU145、PC-3、PC-3M-2B4和PC-3M-IE8五株人前列腺癌细胞,选用多西他赛、卡巴他赛和醋酸阿比特龙三种前列腺癌治疗药物,分别梯度浓度给药,利用RTCA检测给药前后的细胞生长情况,确定药物对前列腺癌细胞的半抑制浓度(IC50)。结果 多西他赛对VCaP、DU145、PC-3、PC-3M-2B4、PC-3M-IE8五种细胞系24 h的IC50分别为8.81 nmol/L、11.61 nmol/L、1.78 nmol/L、1.44 nmol/L、8.69 nmol/L。卡巴他赛24 h的IC50依次为3.73 nmol/L、3.96 nmol/L、10.41 nmol/L、5.43 nmol/L、7.37 nmol/L。醋酸阿比特龙24 h的IC50依次为8.34 μmol/L、8.60 μmol/L、24.20 μmol/L、8.59 μmol/L、13.21 μmol/L。结论 PC-3M-2B4及DU145、VCaP及PC-3可作为多西他赛、卡巴他赛及醋酸阿比特龙的对照,建立体外筛选药物的细胞模型,为临床推广提供参考。
【关键词】前列腺癌;化疗药物;实时细胞分析;药物敏感性
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,是一种常见的影响男性健康的疾病[1]。前列腺癌常见的治疗方法包括内分泌治疗、前列腺癌根治术、放射治疗及化学药物治疗等。手术治疗只适用于癌症早期患者,激素治疗初期效果较好,然而在经过18~24月的治疗后,大部分患者会发展成为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[2,3]。CRPC患者的特征包括前列腺特异性抗原水平升高、血清睾酮的水平在去势范围内(<50 ng/dL)[4]。一旦发展为CRPC,中位生存期大约为16~18个月[5]。
因此,化疗仍然是治疗CRPC的最重要的手段,对化疗药物的正确选择将直接影响疗效。不同病人对不同药物敏感性不同,治疗前对药物敏感性进行评估,可以为临床治疗提供参考,提高治疗效果,而发展简便稳定的评估方法是对临床患者药物敏感性评估的关键。
由于分子生物学、细胞生物学技术的不断发展,现已发展出体内和体外两大系列10多种药敏试验方法。目前肿瘤药敏实验有单细胞体外培养法、人肿瘤细胞原代裸鼠移植瘤模型法、胶原凝胶包埋培养法、微组织块培养法等方法[6]。然而,体内肿瘤药敏试验大多周期长,费用高,成功率低,不易在临床药敏试验中推广。体外肿瘤药敏试验目前最常用的MTT法虽然简便,并可同时进行多种化疗药物的敏感性检测[7],但是细胞用量大,且只能观察实验终点[8]。而近年发展起来的实时细胞分析系统(real-time cell analysis system,RTCA)是一种通过检测培养环境中阻抗的变化而动态监测细胞生长情况的技术,与传统方法相比,有耗时短、细胞用量少、高通量和操作简单便捷等优点[9]。因此,RTCA能更加快速简便且实时动态地观察到细胞对药物的反应,制作药物应答依赖性曲线,更加真实反应药物对肿瘤细胞生长与活性的影响。
1 材料和方法
1.1细胞培养
VCaP人前列腺癌腰椎转移细胞、DU145人前列腺癌脑转移细胞、PC-3人前列腺癌骨转移细胞、PC-3M-2B4和PC-3M-IE8人前列腺癌上皮细胞,均购自中国医学科学院基础医学研究所基础医学细胞中心,采用含10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,于5%CO2,37℃细胞培养箱内常规培养。实验前1 d进行细胞传代,细胞满度在60%~80%之间,收集细胞制备细胞悬液,浓度为5 x 105cells/mL,接种在E-plate 16检测板上进行细胞生长和药物敏感性分析。
1.2药物
多西他赛(Selleckchem公司)溶于DMSO中,并稀释一万倍于RPMI-1640中成为1 μmol/L的储液;卡巴他赛(西安天丰生物科技有限公司)溶于乙醇中,并稀释一万倍于RPMI-1640中成为500 nmol/L的储液;醋酸阿比特龙(武汉贝尔卡生物医药有限公司)溶于乙醇中并稀释10倍于RPMI-1640中成为1 mmol/L的储液;分装存于-20℃备用。
1.3RTCA实时细胞分析
实时细胞分析系统采用xCELLigence细胞功能分析仪DP系统,购自艾森生物(杭州)有限公司,用于细胞增殖分析。检测板E-Plate 16的底部整合有微金电子传感器芯片,当贴壁生长在微电极表面的细胞引起电极界面阻抗的改变时,该阻抗值的变化直接反映细胞的生物学状态。其主要分析参数为细胞指数(cell index),与细胞覆盖面积成正比。
检测板每孔加入50 μL培养基,放入 RTCA Station(艾森生物)中测定基线,保证每孔接触正常并且细胞指数在正常值之内。取制备好的前列腺癌细胞悬液,分别以每孔1×103个、2.5×103个、5 ×103个、1×104个接种于检测板E-Plate 16中,在超净台中静置30 min后,置于培养箱中的RTCA工作站中,每隔 15 min记录细胞指数,总时长96 h[10]。
1.4RTCA药物敏感性评价
取对数生长期的前列腺癌细胞,分别以每孔5 ×103个(VCaP、PC-3、PC-3M-2B4)和每孔1×104个(DU145、PC-3M-IE8)接种于检测板 E-Plate 16中,放到培养箱中的RTCA Station中培养并检测,24 h后添加药物。使实验组药物终浓度为:多西他赛:0.1、0.5、1、10、50、100(nmol/L),卡巴他赛:0.5、1、2、5、10、50(nmol/L),醋酸阿比特龙:5、10、25 (μmol/L);对照组中加入无药物的溶解液,空白组中加入RPMI-1640培养基。给药后继续在RTCA Station中进行培养并检测。药物作用24 h后,分析药物半数抑制浓度[11]。
1.5统计学方法
使用RTCA Software 2.0系统软件和Student's t-tests分析处理数据,实验数据以平均数±标准差表示,n=6,*P<0.05为差异有显著性。
2 结果
2.1细胞最佳接种量确定
五株前列腺癌细胞,均制备细胞悬液,梯度稀释,采用每孔1×103个、2.5×103个、5×103个、1× 104个不同接种量,接种于检测板E-plate 16中,检测96 h内细胞指数变化,观察细胞的生长增殖过程。如图1所示,以96 h内形成最佳S型增值曲线为标准,VCaP最佳接种量为每孔5×103个,DU145最佳接种量为每孔1×104个,PC-3最佳接种量为每孔5×103个,PC-3M-2B4最佳接种量为每孔5× 103个,PC-3M-IE8最佳接种量为每孔1×104个。
2.2前列腺癌细胞对多西他赛敏感性对比分析
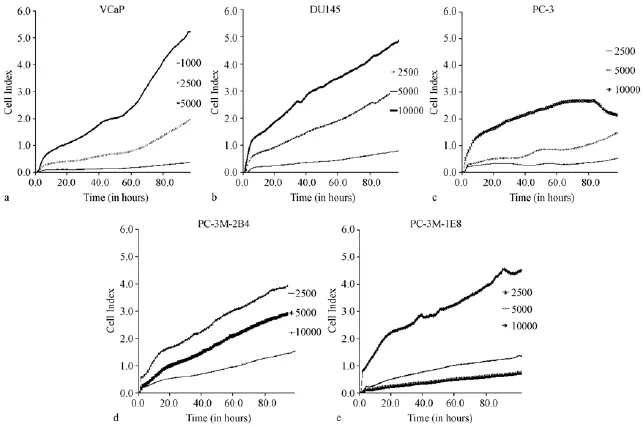
图1 前列腺癌5种细胞系96 h增殖曲线Note.Cells of the five cell lines are seeded in the E-plate16 wells.The CI(cell index)values reflecting the cell activities are recorded by the RTCA.The CI value is proportional to the cell number,the more amount of cells,the higher the CI value is. Because of the characteristics of cell proliferation,when the number of cells in the hole reaches a certain amount,there is a platform period,the CI value no longer increases any more,so the cell proliferation curve may be changed into“S”.a:the cell proliferation curve of VCaP cells;b:the cell proliferation curve of DU145 cells;c:the cell proliferation curve of PC-3 cells;d:the cell proliferation curve of PC-3M-2B4 cells;e:the cell proliferation curve of PC-3M-IE8 cells.Fig.1 The cell proliferation curves of the five prostate cancer cell lines cultured for 96 hours
取对数生长期的前列腺癌细胞,按上述实验确定的最佳接种浓度,VCaP、PC-3、PC-3M-2B4以5× 103个细胞/孔,DU145、PC-3M-IE8以1×104个细胞/孔接种于检测板E-Plate 16中,培养24 h后给药,RTCA分析细胞增殖曲线。多西他赛药物终浓度分别为 0.1 nmol/L、0.5 nmol/L、1 nmol/L、10 nmol/L、50 nmol/L、100 nmol/L。另设药物溶剂对照和空白对照。给药后继续培养并检测CI变化(图2a-e)。结果表明多西他赛对VCaP、DU145、PC-3、PC-3M-2B4、PC-3M-IE8五种细胞系24 h的IC50分别为(8.81±0.06)nmol/L,(11.61±1.67)nmol/ L,(1.78n±0.13)nmol/L,(1.44±0.10)nmol/L,(8.69±0.22)nmol/L。其中PC-3和PC-3M-2B4对多西他赛最敏感敏感,而DU145最不敏感,VCaP和PC-3M-IE8中度敏感。
2.3前列腺癌细胞对卡巴他赛敏感性对比分析
取对数生长期的前列腺癌细胞,按上述实验确定的最佳接种浓度,VCaP、PC-3、PC-3M-2B4以5× 103个细胞/孔,DU145、PC-3M-IE8以1×104个细胞/孔接种于检测板E-Plate 16中,培养24 h后给药,RTCA分析细胞增殖曲线。卡巴他赛药物终浓度分别为0.5 nmol/L、1 nmol/L、2 nmol/L、5 nmol/ L、10 nmol/L、50 nmol/L。另设药物溶剂对照和空白对照。给药后继续培养并检测CI变化(图3ae)。结果表明卡巴他赛对VCaP、DU145、PC-3、PC-3M-2B4、PC-3M-IE8五种细胞系24 h的IC50分别为(3.73±0.25)nmol/L,(3.96±0.13)nmol/L,(10.41±0.35)nmol/L,(5.43±0.21)nmol/L,(7.37±0.06)nmol/L。其中VCaP和DU145对卡巴他赛最敏感敏感,而PC-3最不敏感,PC-3M-2B4 和PC-3M-IE8中度敏感。
2.4前列腺癌细胞对醋酸阿比特龙敏感性对比分析
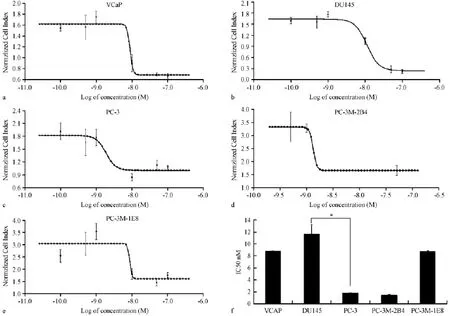
图2 前列腺癌5种细胞对多西他赛剂量反应曲线(变斜率)Note.a:Docetaxel showed IC50 of 8.81 nmol/L for VCaP cells;b:Docetaxel showed IC50 of 11.61 nmol/L for DU145 cells;c:Docetaxel showed IC50 of 1.78 nmol/L for PC-3 cells;d:Docetaxel showed IC50 of 1.44 nmol/L for PC-3M-2B4 cells;e:Docetaxel showed IC50 of 8.69 nmol/L for PC-3M-IE8 cells;f:Statistical comparison of IC50 of docetaxel for the five cell lines.N=6,*P<0.05.Fig.2 Sigmoidal dose-response(wariable slope)curve of docetaxel for the 5 prostate cancer cell lines
取对数生长期的前列腺癌细胞,按上述实验确定的最佳接种浓度,VCaP、PC-3、PC-3M-2B4以5× 103个细胞/孔,DU145、PC-3M-IE8以1×104个细胞/孔接种于检测板E-Plate 16中,培养24 h后给药,RTCA分析细胞增殖曲线。醋酸阿比特龙药物终浓度分别为5、10、25(μmol/L)。另设药物溶剂对照和空白对照。给药后继续培养并检测CI变化(图4a-e)。结果表明醋酸阿比特龙对 VCaP、DU145、PC-3、PC-3M-2B4、PC-3M-IE8五种细胞系24 h的IC50分别为(8.34±0.24)μmol/L、(8.60±0.15)μmol/L、(24.20±0.09)μmol/L、(8.59±0.32)μmol/L、(13.21±0.95)μmol/L。其中 VCaP、DU145和PC-3M-B4对醋酸阿比特龙最敏感敏感,而PC-3最不敏感,PC-3M-IE8中度敏感。

图3 前列腺癌5种细胞对卡巴他赛剂量反应曲线(变斜率)Note.a:Cabazitaxel showed IC50 of 3.73 nmol/L for VCaP cells;b:Cabazitaxel showed IC50 of 3.96 nmol/L for DU145 cells;c:Cabazitaxel showed IC50 of 10.41 nmol/L for PC-3 cells;d:Cabazitaxel showed IC50 of 5.43 nmol/L for PC-3M-2B4 cells;e:Cabazitaxel showed IC50 of 7.37 nmol/L for PC-3M-IE8 cells;f:Statistical comparison of IC50 of cabazitaxel for the five cell lines.n=6,*P<0.05.Fig.3 Sigmoidal dose-response(wariable slope)curve of cabazitaxel for the 5 prostate cancer cell lines
3 讨论
实时细胞分析系统是可实现实时监测、高信息量、高灵敏度和高准确性细胞分析的新技术。通过嵌在检测板E-plate 16上孔底的微电子感应器阻抗变化感受细胞的有无以及贴壁、黏附和生长程度的改变。在细胞毒性检测中,可实时、直观的反映细胞增殖、存活、凋亡、形态变化等细胞生物学变化[6]。基于实时细胞分析系统优势,该技术在基础生命科学领域具有广泛的应用,如细胞质量控制、细胞毒性检测、细胞粘附和细胞伸展以及临床药物开发、高通量药物筛选等[12]。本研究将实时细胞分析系统应用于前列腺癌细胞药物敏感性实验当中,选用3种前列腺癌化疗药物,对5种前列腺癌细胞系的药物敏感性进行对比分析,证明该方法真实有效且更加简单灵敏,可以应用于临床患者药物敏感性评价。
化学治疗是治疗肿瘤的一种重要手段。但由于遗传背景的差异,患者对化疗的反应各不相同,有的患者经化疗后可达到完全缓解,有的却表现为无效甚至病情进展[13-15]。不同种类的肿瘤,对抗癌药物的敏感性不同,即使同一种类型的肿瘤,甚至其临床分期、病理类型、患者基本状态也相同,不同的患者对药物的敏感性及预后也不相同,这就决定了必须化疗药物个体化[16]。在治疗前或治疗过程中进行肿瘤药敏试验对于化疗药物的选择和制订化疗的策略有着十分重要的意义,为实现化疗药物的个体化提供依据[17-20]。
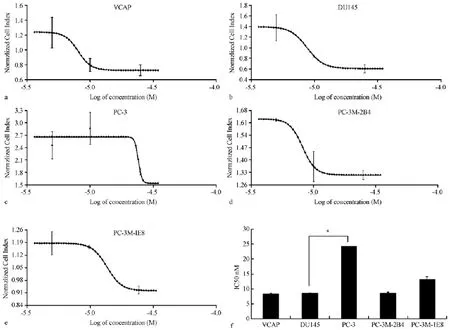
图4 前列腺癌5种细胞对醋酸阿比特龙剂量反应曲线(变斜率)Note.a:Abiraterone acetate showed IC50 of 8.34 μmol/L for VCaP cells;b:Abiraterone acetate showed IC50 of 8.60 μmol/L for DU145 cells;c:Abiraterone acetate showed IC50 of 24.20 μmol/L for PC-3 cells;d:Abiraterone acetate showed IC50 of 8.59 μmol/L for PC-3M-2B4 cells;e:Abiraterone acetate showed IC50 of 13.21 μmol/L for PC-3M-IE8 cells;f:statistical comparison of IC50 of Abiraterone Acetate for five cell lines.n=6,*P<0.05.Fig.4 Sigmoidal dose-response(wariable slope)curre of abiraterone acetate for the 5 prostate cancer cell lines
目前治疗前列腺癌的主要药物是多西他赛,主要作用于细胞微管,通过阻碍细胞有丝分裂,进而引起细胞凋亡,是治疗CRPC患者的一线用药[21];卡巴他赛是第二代紫杉醇类抗肿瘤药,同样具有抑制微管的作用,并且对多西他赛耐药患者有良好疗效[22];醋酸阿比特龙是一种细胞色素氧化酶CYP17的高选择性不可逆强效抑制剂,能显著降低CRPC患者体内的睾丸酮水平。III期随机对照研究证实对于多西他赛失败的CRPC,醋酸阿比特龙联合泼尼松可以显著提高PSA缓解率,肿瘤客观缓解率,延长肿瘤进展时间和总生存时间,为多西他赛失败的CRPC提供了新的治疗方法,且安全性好[23]。
本实验采用实时细胞分析技术检测了3种常用化疗药物对5种前列腺癌细胞的体外抑制率。结果证明,PC-3M-2B4对多西他赛敏感性最强,而DU145敏感性最差;VCaP对卡巴他赛敏感性最强,而PC-3敏感性最差;VCaP对醋酸阿比特龙敏感性最强,而PC-3敏感性最差。可将PC-3M-2B4作为高度敏感对照,DU145作为不敏感对照,建立对多西他赛的体外药物筛选体系;可将VCaP作为高度敏感对照,PC-3作为不敏感对照,建立对卡巴他赛及醋酸阿比特龙的体外药物筛选体系,具有向临床推广,进行个体化药物敏感性实验的价值。且本实验结果与已有研究具有一致性[24]。另有其他多项研究证明,RTCA在药物敏感性实验中具有可靠性,与传统的MTT等方法测定的结果吻合[25-29]。
参考文献:
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics [J].CA Cancer J Clin,2011,61(2):69-90.
[2] Crawford ED,Eisenberger MA,McLeod DG,et al.A controlled trial of leuprolide withandwithoutflutamide inprostatic carcinoma[J].N Engl J Med,1989,321(7):419-424.
[3] Eisenberger MA,Blumenstein BA,Crawford ED,et al.Bilateral orchiectomy with or without flutamide for metastatic prostate cancer[J].N Engl J Med,1998,339(15):1036-1042.
[4] Suzman DL,AntonarakisES.Castration-resistantprostate cancer:latest evidence and therapeutic implications[J].Ther Adv Med Oncol,2014,6(4):167-179.
[5] Pienta KJ,Bradley D.Mechanisms underlying the development of androgen-independent prostate cancer[J].Clin Cancer Res,2006,12(6):1665-1671.
[6] 沈续松.肿瘤药敏试验方法的研究进展[J].肿瘤研究与临床,2012,1:64-66.
[7] 杨善民,郑耘,颜江华,等.MTT法检测裸鼠实体瘤药物敏感试验研究[J].中国实验动物学报,1996,1:21-26.
[8] 米彦军,张传钊,符立梧.肿瘤药敏试验指导个体化治疗的研究进展 [J].药学学报 Acta Pharmaceut Sin,2009,44 (11):1187-1192.
[9] Marlina S,Shu MH,AbuBakar S,et al.Development of a realtime cell analysing(RTCA)method as a fast and accurate screen for the selection of chikungunya virus replication inhibitors[J]. Parasit Vectors,2015,8:579.
[10] 唐莉莉,曾祥斌,卢国栋,等.番茄红素对人前列腺癌细胞(DU145)生长抑制的离体和整体水平研究 [J].毒理学杂志,2001,1:1-4.
[11] Pawar VK,Gupta S,Singh Y,et al.Pluronic F-127 stabilised docetaxelnanocrystalsimproveapoptosisbymitochondrial depolarization in breast cancer cells:Pharmacokinetics and toxicity assessment[J].J Biomed Nanotechnol.2015,11(10):1747-1763.
[12] Xi Z,Khare S,Cheung A,et al.Mode of action classification of chemicalsusingmulti-concentrationtime-dependentcellular response profiles[J].Comput Biol Chem,2014,49:23-35. [13] Topol EJ.Individualized medicine from prewomb to tomb[J]. Cell,2014,157(1):241-253.
[14] Shastry BS.Pharmacogenetics and the concept of individualized medicine[J].Pharmacogenomics J,2006,6(1):16-21.
[15] Ogino S,Galon J,Fuchs CS,et al.Cancer immunology—analysis of host and tumor factors for personalized medicine[J]. Nat Rev Clin Oncol,2011,8(12):711-719.
[16] Samson DJ,Seidenfeld J,Ziegler K,et al.Chemotherapy sensitivity and resistance assays:a systematic review[J].J Clin Oncol,2004,22(17):3618-3630.
[17] Michalski CW,Erkan M,Sauliunaite D,et al.Ex vivo chemosensitivity testing and gene expression profiling predict response towards adjuvant gemcitabine treatment in pancreatic cancer[J].Br J Cancer,2008,99(5):760-767.
[18] Singh B,Li R,Xu L,et al.Prediction of survival in patients with head and neck cancer using the histoculture drug response assay[J].Head Neck,2002,24(5):437-442.
[19] Hudson TJ.Genome variation and personalized cancer medicine [J].J Intern Med,2013,274(5):440-450.
[20] Ogino S,Fuchs CS,Giovannucci E.How many molecular subtypes?Implicationsoftheuniquetumorprinciplein personalized medicine[J].Expert Rev Mol Diagn,2012,12 (6):621-628.
[21] Galsky MD,Vogelzang NJ.Docetaxel-based combination therapy for castration-resistant prostate cancer[J].Ann Oncol,2010,21(11):2135-2144.
[22] Hwang C.Overcoming docetaxel resistance in prostate cancer:a perspective review[J].Ther Adv Med Oncol,2012,4(6):329 -340.
[23] Gartrell BA,SaadF.Abirateroneinthemanagementof castration-resistant prostate cancer prior to chemotherapy[J]. Ther Adv Urol,2015,7(4):194-202.
[24] Ting HJ,Hsu J,Bao BY,et al.Docetaxel-induced growth inhibition and apoptosis in androgen independent prostate cancer cells are enhanced by 1alpha,25-dihydroxyvitamin D3[J]. Cancer Lett,2007,247(1):122-129.
[25] Quereda JJ,Martínez-Alarcón L,MendoÇa L,et al.Validation of xCELLigence real-time cell analyzer to assess compatibility in xenotransplantation with pig-to-baboon model[J].Transplant Proc,2010,42(8):3239-3243.
[26] Dürr S,Lyer S,Mann J,et al.Real-time cell analysis of human cancer cell lines after chemotherapy with functionalized magnetic nanoparticles[J].Anticancer Res,2012,32(5):1983 -1989.
[27] Xing JZ,Zhu L,Jackson JA,et al.Dynamic monitoring of cytotoxicity on microelectronic sensors[J].Chem Res Toxicol,2005,18(2):154-161.
[28] Atienzar FA,Tilmant K,Gerets HH,et al.The use of real-time cell analyzer technology in drug discovery:defining optimal cell cultureconditionsandassayreproducibilitywithdifferent adherent cellular models[J].J Biomol Screen,2011,16(6):575-587.
[29] Cheah SC,Appleton DR,Lee ST,et al.Panduratin A inhibits the growth of A549 cells through induction of apoptosis and inhibition of NF-kappaB translocation[J].Molecules,2011,16 (3):2583-2598.
〔修回日期〕2016-02-19
Assessment of drug sensitivity of the prostate cancer cells based on real-time cell analysis system
JIN Ya-xi,SUN Cai-xian,GAO Hong,ZHANG Lian-feng,ZHANG Li
(Key Laboratory of Human Disease Comparative Medicine,Ministry of Health,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100021,China)
【Abstract】Objective To develop a more convenient and stable method for assessment of drug sensitivity of prostate cancer based on real-time cell analysis system as a reference for clinical treatment.Methods Human prostate cancer VCaP,DU145,PC-3,PC-3M-2B4 and PC-3M-IE8 cells were chosen to detect the sensitivity to three drugs,docetaxel,cabazitaxel and abiraterone acetate.Serial dilutions of the three drugs were used to treat the cell culture for 24 hours.The drug-induced effects on the cell lines after an incubation of 24 hours were recorded by the real-time cell analysis system to determine the half maximal inhibitory concentration(IC50).Results Docetaxel showd IC50 of 8.81 nmol/L,11.61 nmol/L,1.78 nmol/L,1.44 nmol/L,8.69 nmol/L for VCaP,DU145,PC-3,PC-3M-2B4,PC-3M-IE8 cells,respectively.Cabazitaxel showed IC50 of 3.73 nmol/L,3.96 nmol/L,10.41 nmol/L,5.43 nmol/L,and 7.37 nmol/L,respectively,for the five cell lines.Abiraterone acetate showed IC50 of 8.34 μmol/L,8.60 μmol/L,24.20 μmol/L,8.59 μmol/L,and 13.21 μmol/L for the five cell lines.Conclusions PC-3M-2B4 and DU145,VCaP and PC-3 cellscan be used as control for docetaxel,cabazitaxel and abiraterone acetate to establish cell models for the drug screening in vitro and to provide reference for clinical applications.
【Key words】Prostate cancer;Chemotherapy drugs;Real-time cell analysis system;Drug sensitivity
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016)04-0046-07
doi:10.3969.j.issn.1671-7856.2016.04.008
[基金项目]卫生行业科研专项(201402001)。
[作者简介]靳亚西,女,硕士生,研究方向:比较医学。E-mail:Jinyaxi@yeah.net。
[通讯作者]张丽(1981-),女,助理研究员,研究方向:比较医学。E-mail:zhangl@cnilas.org。

