高温对茶树叶片光合及抗逆特性的影响和恢复*3
韩 冬,杨 菲,杨再强**,金志凤
(1. 南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2. 浙江省气候中心,杭州 310017)
高温对茶树叶片光合及抗逆特性的影响和恢复*3
韩 冬1,杨 菲1,杨再强1**,金志凤2
(1. 南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2. 浙江省气候中心,杭州 310017)
摘要:以4个茶树品种福鼎大白茶、鸠坑、龙井43和乌牛早7a生植株为研究对象,采用人工气候箱模拟高温(35℃和40℃)处理6、12、18、24、48h,取出后置于人工气候箱中(25℃)恢复3、6、9d,以未经高温处理置于人工气候箱中(温度25℃)的各品种茶树为对照(CK),测定茶树叶片的最大净光合速率、荧光参数、抗氧化酶活性以及细胞伤害率。结果表明:高温胁迫显著抑制了茶树的最大净光合速率(Pnmax)和最大光化学效率(Fv/Fm),处理时间越长、温度越高,Pnmax和Fv/Fm下降越快,除35℃处理的福鼎大白茶外,其它3种茶树经过高温处理后,在恢复期间其Fv/Fm无法恢复至正常水平;茶树叶片的SOD酶活性在高温处理的前12h迅速上升,随着处理时间的延长,其活性降低;叶片MDA含量的平均值在高温处理第48小时达到最大,恢复期间缓慢下降;随着处理温度的升高和处理时间的延长,各茶树叶片的细胞伤害率均呈增加趋势。4种茶树耐热性的强弱由高到低依次为福鼎大白茶>乌牛早>鸠坑>龙井43。
关键词:高温;最大净光合速率;抗氧化酶活性;细胞伤害率
韩冬,杨菲,杨再强,等.高温对茶树叶片光合及抗逆特性的影响和恢复[J].中国农业气象,2016,37(3):297-306
茶树(Camellia sinensis)属山茶科山茶属植物,为多年生常绿木本植物,是中国南方传统的经济植物[1-2]。江南茶区是主要产茶区,夏季高温对茶树生长产生不利影响,使茶叶产量下降,品质降低。
关于高温灾害对作物光合生理的影响已有大量研究,表明高温胁迫在不同程度上影响玉米[3]、黄瓜[4]、葡萄[5-6]等的生长发育。Karim等[3]对玉米苗期的研究表明,高温胁迫使玉米叶片光合强度降低,最大光化学效率(Fv/Fm)和量子产量(φPS II)均下降。王冬梅等[7]研究发现,高温使番茄花器的发育受到阻碍,温度超过40℃时番茄完全停止生长。刘爱荣等[8]研究发现,番茄植株在受到高温胁迫后,叶片净光合速率显著下降,胞间CO2浓度和气孔导度均发生改变,但究竟是气孔因素还是非气孔因素,各研究结论并不一致[9-11]。关于高温胁迫对作物抗氧化酶活性的影响,国内外学者也作过相关研究[12-15],Martineau等[16]研究表明,植物细胞膜在高温伤害下,膜的通透性会增加,电导率升高,产生大量自由基,引起膜脂过氧化加剧,改变酶活性。Martina等[17]研究了逆境环境下植物酶活性的变化,证实当植物接受适度的逆境诱导过程(促氧化)后,作为植物对外界逆境因子的适应性反应才表现出上升的态势。李建建等[18]研究了高温胁迫对黄瓜幼苗叶片质膜透性及保护酶活性的影响,认为高温胁迫使黄瓜幼苗叶片MDA含量均上升,SOD活性呈下降趋势,电解质渗漏率升高。张桂莲等[19]研究了高温对灌浆期水稻生理特性的影响,认为高温胁迫下水稻功能叶抗氧化酶活性降低,膜透性增加,且影响程度依品种的不同而异。
虽然前人在高温对植物的影响方面作过不少研究,但关于高温影响茶树光合生理及抗氧化酶系统的研究还未见报道,关于茶树生理的研究多集中在肥料[20]、遮阴[21]、干旱[22]等方面,对于不同品种茶树的耐热性则鲜有报道,本文就高温对江南茶区4种茶树品种光合特性、荧光参数和抗氧化酶活性、细胞伤害率的影响进行研究,以期为指导江南茶区茶树风险区划和科学引种提供技术依据。
1 材料与方法
1.1 试验设计
试验于2014年5月20日-7月1日在南京信息工程大学农业气象试验站内的人工气候箱(TPG1260,Australian)中进行,人工气候箱容积1260L,光照控制范围0~1000mmol·m-2·s-1,温度控制范围0~45℃,湿度控制范围30%~90%。以7a生4个茶树品种龙井43、鸠坑、乌牛早、福鼎大白茶为研究对象,选取长势基本一致的植株各4株放入人工气候箱中。于5月20日将试验茶树放入人工气候箱中进行高温处理,高温设计2个处理水平(35℃和40℃),均分别处理6、12、18、24和48h,处理期间箱内相对湿度控制在85%,光合有效辐射为800mmol·m-2·s-1。以25℃为对照(CK),其处理及恢复时间与高温处理相同。每个处理结束后,将试验植株置于Venlo可调温人工玻璃温室中,设置温度25℃,相对湿度85%,光合有效辐射800mmol·m-2·s-1,恢复3、6、9d后进行观测,即分别于5月23、26、29日进行测定。试验茶树的基本情况见表1。
1.2 观测项目
(1)光合参数的测定:试验植株高温处理6、12、18、24和48h及恢复3、6、9d后,分别测定4种茶树的光合特性,对茶树从上往下数第3节位的成熟叶片进行观测,用LI-6400便携式光合作用测定系统测定叶片的光合参数,每个处理中选3个叶片,每个叶片重复测定3 次。测定光响应曲线时,CO2浓度设为(400±10)mmol·m-2·s-1,光强梯度设为2000、1600、1400、1200、1000、800、600、400、200、100、50、0mmol·m-2·s-1。每个不同光强值设定数据采集时间为3min。
(2)荧光参数的测定:选取与测定光合参数相同部位的叶片,用FMS-2型便携式荧光仪(英国Hansatech)测定叶片PSII的光化学效率和光合电子传递量子效率,测定前暗适应30min,然后依次测定叶绿素荧光动力学参数PSII的最大光化学效率(Fv/Fm)。每个参数的测定进行3 次重复,取平均值。
(3)酶活性参数的测定:选取植株顶端从上至下第5-8 位叶片,采集后迅速置于液氮中冷却,然后保存于冰箱中冷冻,称取0.5g左右样品放入研钵中,加入5mL pH7.8的磷酸缓冲液(0.2mol·L-1的KH2PO4和0.2mol·L-1的K2HPO4配制)和少量石英砂,冰浴研磨,匀浆倒入离心管中,于0℃,4000r·min-1冷冻离心20min,上清液(酶液)倒入试管中,置于0~4℃下保存,用于酶活性、MDA含量和可溶性蛋白的测定,每次测定重复3次。过氧化氢酶(CAT)活性的测定采用紫外吸收法[23],以每分钟内OD240的减少量表示其活性。过氧化物酶(POD)活性测定用愈创木酚法[24],以每分钟内OD470的增加量表示其活性。丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[25]。可溶性蛋白用考马斯亮蓝G-250染色法测定[26]。
(4)细胞伤害率的测定:将处理后的叶片样品用蒸馏水擦拭干净,晾干,避开主叶脉,每组用打孔器取直径1.5cm叶肉组织三等份(即3次重复),每份5片,置于洁净小烧杯中,加入40mL去离子水浸泡5~6h(尽量避免叶片之间重叠),利用仪器(DDSJ 308,上海产)测定叶片电导率。再将小烧杯用保鲜膜封好放入水浴锅中蒸煮30min,取出冷却后再次测定其电导率,计算细胞伤害率(CIR,%)

式中,Rt为不同温度处理后的电导值,Rm为沸水浴后电导值,Ct为对照煮前的电导值,Cm为对照煮后的电导值,电导值的单位是μS·cm-1。
1.3 数据分析
试验数据运用DPS软件、SPSS18.0软件进行相关统计计算,Excel软件作图。
对光响应测定结果采用文献[27]中的方法,构建非直角双曲线方程计算最大净光合速率。
2 结果与分析
2.1 不同处理茶树叶片最大净光合速率的变化

图1 基于光响应曲线拟合的不同程度高温处理及恢复时长后各品种叶片最大净光合速率(Pnmax)的变化Fig. 1 Variation course of the maximum net photosynthetic rate(Pnmax)based on light response curve after different high temperature and recovery days
由图1可见,高温35、40℃处理48h内,各品种叶片光合作用均受到明显抑制,且40℃处理比35℃处理最大净光合速率降低幅度更大,但二者差异不显著;随着高温处理时间的延长,各品种叶片最大净光合速率也均逐渐降低,与CK的差异逐渐增大,处理温度越高其降低幅度越大。由图1还可看出,相同高温条件下处理18h或24h后,4种茶树品种叶片的最大净光合速率相继降为负值,说明高温导致光系统遭到破坏,植株生长受抑制,其中龙井43的下降幅度最大,说明其对高温的耐受力更低、更敏感,其它3个品种的差异不显著。
图1显示,高温处理结束后将样品置入人工温室中进行恢复,3、6和9d后最大净光合速率均有缓慢上升,说明不同程度、不同时长高温处理结束后,随着恢复时间的延长叶片光合作用均有不同程度的恢复,但各品种的恢复程度明显不同。35℃处理恢复9d后,福鼎大白茶叶片最大净光合速率达到CK的73.15%,鸠坑和乌牛早分别为CK的43.53%和28.67%,而龙井43虽有恢复但仍然为负值;40℃处理恢复9d后,除福鼎大白茶最大净光合速率为正值外,其它品种均为负值,表明茶树叶片的光系统发生不可逆的恢复,光合能力显著下降。可见,4种茶树对高温的敏感性不同,龙井43最敏感,鸠坑、乌牛早次之,福鼎大白茶最不敏感。
2.2 不同处理茶树叶片荧光参数的变化
图2反映了高温处理后4种茶树叶片PSⅡ最大光化学量子产量(Fv/Fm)的变化。正常条件下(CK),4种茶树的Fv/Fm均在0.8~0.85,无显著差异。图2表明不同高温胁迫下4个茶树品种Fv/Fm均显著下降,且处理温度越高,下降幅度越大;处理时间越长,下降幅度越大,35℃处理48h后,福鼎大白茶、鸠坑、龙井43和乌牛早的Fv/Fm分别比CK降低65.97%、67.34%、71.91%和65.55%,40℃处理48h后4个品种的Fv/Fm值分别比CK降低72.16%、75.99%、76.62% 和74.47%,与对照相比,两组高温处理中Fv/Fm下降最多的均为龙井43,说明其对高温的响应最明显。
在恢复期间,4种茶树Fv/Fm均有不同程度的回升,处理温度越高,恢复越慢,其中40℃处理的龙井43其Fv/Fm在恢复期间基本无变化,表明其已受到严重伤害且完全无法恢复,35℃处理经过9d恢复后,福鼎大白茶叶片最大光合速率达到CK的86.74%、鸠坑和乌牛早分别为CK的45.84%和52.30%,说明除35℃处理的福鼎大白茶,其它处理均无法恢复至正常水平。

图2 不同程度高温处理及恢复时长后各品种叶片荧光参数(Fv/Fm)的变化Fig. 2 Variation course of the PSII maximal photochemical efficiency(Fv/Fm) after different high temperature and recovery days
2.3 不同处理茶树叶片抗氧化酶活性的变化
2.3.1 超氧化物歧化酶(SOD)活性
图3反映了高温对4种茶树SOD活性的影响。由图可见,在正常温度下(CK),4种茶树SOD酶活性变化不大,在高温胁迫初期,4个茶树品种叶片中SOD活性呈现较相似的变化,SOD活性显著增加,活性氧清除能力较高,随着胁迫时间的延长,SOD活性下降,清除能力降低;4种茶树以40℃高温处理48h其SOD活性降幅最大,福鼎大白茶、鸠坑、龙井43和乌牛早分别较对照降低40.28%、25.51%、23.98%和43.04%,35℃处理的SOD活性均值小于40℃,且不同品种SOD酶活性出现峰值的时间不同,其中35℃处理的鸠坑和龙井43号在处理6h时SOD活性达到峰值,而福鼎大白茶和乌牛早则在处理12h时才达到峰值,说明在高温胁迫条件下福鼎大白茶和乌牛早有较强的抗膜脂氧化能力。
高温处理后的4种茶树,随着恢复时间的延长,叶片SOD活性缓慢升高,但不同品种恢复程度不同,福鼎大白茶、鸠坑、龙井43和乌牛早在35℃处理恢复9d后活性分别达到CK的90.12%、83.02%、92.76%和91.00%,在40℃处理恢复9d后活性分别达到CK的71.15%、83.78%、74.11% 和74.20%。

图3 不同程度高温处理及恢复时长后各品种叶片SOD酶活性的变化Fig. 3 Variation course of the SOD activities after different high temperature and recovery days
2.3.2 叶片丙二醛(MDA)含量
图4反映了不同高温处理及恢复时长对各品种茶树叶片MDA含量的影响。由图可知,高温胁迫使MDA含量增加,在高温35、40℃条件下,4种茶树叶片MDA含量持续上升,均高于对照(CK),初始MDA含量以35℃处理下的鸠坑为最高,处理48h后40℃龙井43的MDA含量最高,35℃处理下4种茶树MDA含量较对照增幅分别为,福鼎大白茶118.16%,鸠坑169.03%,龙井43129.37%,乌牛早122.56%,40℃处理后增幅分别为,福鼎大白茶137.30%,鸠坑156.57%,龙井43191.19%,乌牛早163.41%,各品种间差异显著。
由图4可见,恢复3、6和9d后叶片MDA含量均呈缓慢下降的过程,说明不同程度、不同时长高温处理结束后,随着恢复时间的延长叶片抗氧化系统均有不同程度的恢复,但是每个品种的恢复程度明显不同,但除35℃处理的福鼎大白茶外,其它处理下各茶树均无法恢复至正常水平。
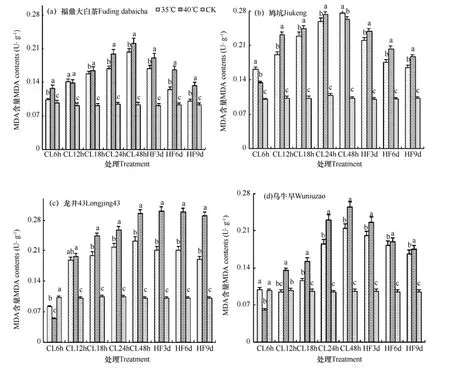
图4 不同程度高温处理及恢复时长后各品种叶片MDA含量的变化Fig. 4 Variation course of the MDA contents after different high temperature and recovery days
2.4 不同处理茶树叶片细胞伤害率的变化
不同高温处理及恢复时长后4种茶树叶片细胞伤害率的变化见表2。由表可见,高温35、40℃处理48h内,各品种叶片细胞伤害率均显著增加,且40℃处理比35℃处理增加更多;随着高温处理时间的延长,各品种叶片细胞伤害率也均逐渐增加,温度越高增加幅度越大,且与CK的差异也逐渐增大。其中35℃处理24h后龙井43叶片细胞伤害率超过50%,35℃处理48h后的鸠坑、乌牛早叶片细胞伤害率超过50%,40℃处理48h后福鼎大白茶叶片的细胞伤害率超过50%,说明福鼎大白茶对高温的耐受力更强,乌牛早、鸠坑次之,龙井43最差。
35℃高温处理恢复9d后,福鼎大白茶、鸠坑、龙井43和乌牛早叶片细胞伤害率为CK的14.82、23.08、24.99和17.96倍,40℃高温处理恢复9d后,福鼎大白茶、鸠坑、龙井43和乌牛早叶片细胞伤害率为CK的28.44、32.88、51.36和29.54倍,可见高温处理及恢复后,龙井43和鸠坑受到伤害较严重且恢复较差,耐热性差于福鼎大白茶和乌牛早。
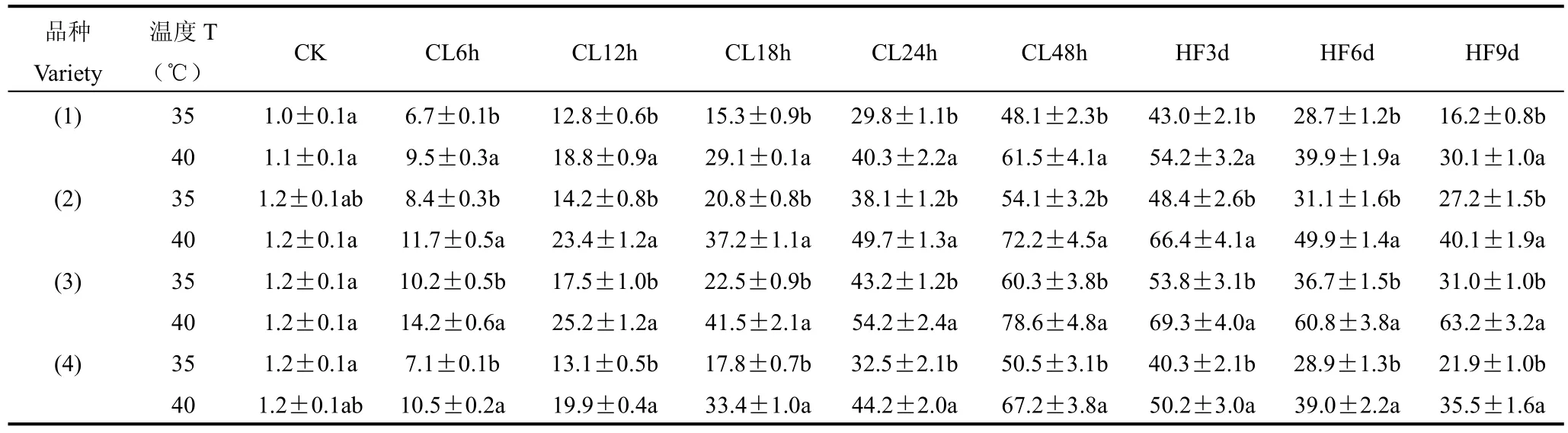
表2 不同高温处理及恢复时长后4种茶树叶片细胞伤害率的变化(%)Table 2 Variation course of the cell injury rates after different high temperature and recovery days (%)
3 结论与讨论
高温胁迫使茶树叶片最大净光合速率、最大光化学效率明显下降,抗氧化酶SOD活性、MDA含量和叶片细胞伤害率明显增加,经适宜温度环境恢复后,各指标均有不同程度的恢复,但基本无法恢复至正常水平,植株受到不可逆转的伤害。
植物的光合作用是一个复杂的过程,且光合作用的强弱受到内外因素的共同影响,内因包括植物本身的特性、个体间的差异;外因包括外界的光强、温度、水分、湿度等[28-29],本研究证实了高温胁迫会抑制茶树叶片的光合作用,使最大净光合速率显著下降,这与李萍萍等[30-31]的研究结果相似,谢晓金等[32]研究认为,高温逆境不仅引起光合电子传递、光合磷酸化等过程,同时还引发光合机构的损伤。罗海波等[33]研究认为,40℃高温胁迫下赤霞珠葡萄净光合速率下降是由非气孔因子导致的,而不是气孔因子,但也有其它学者[11]认为,较轻的高温胁迫导致的净光合速率下降是由气孔因子造成的,而严重的高温胁迫导致的净光合速率下降由非气孔因子造成,这些不同的观点可能与植物的抗性特点有关。
PSII在光合系统的组成中占重要地位,显著影响光合作用中的光能转化,Fv/Fm反映了光系统II反应中心的原初光能转换效率[34]。本研究发现,高温处理后4种茶树的Fv/Fm均显著低于对照,除35℃处理的福鼎大白茶外,其它处理茶树在恢复期间均无法恢复至对照水平,表明高温胁迫损害了茶树叶片的PSII反应中心,使光能转化效率降低,耐热性较强的福鼎大白茶在胁迫期间下降幅度小于其它3种茶树,这也可能是其有较强抗性的原因之一。有研究认为,高温胁迫导致PSII反应中心受到伤害,光合电子链的电子传递速度降低,实际的光化学效率减小,导致光合效率降低[35]。
高温对植物的影响是多方面的,它通过影响植物的光合生理和抗氧化酶系统对作物产生综合影响。高温会引起细胞内活性氧的积累,导致膜脂过氧化,SOD酶具有清除活性氧、维持细胞膜稳定性等功能[36],因此,SOD酶的活性是衡量茶叶是否致灾的标准之一。本试验发现,在高温胁迫初期,SOD活性显著增加,随着胁迫时间延长,活性下降,表明高温胁迫在一定程度可以诱导SOD活性增强,但超过一定强度后,SOD合成下降,细胞膜完整性遭到破坏。可能的原因是温度过高,导致一部分酶变性失活,因此,其在恢复期间也无法回到正常水平。SOD作为活性氧清除的第一道防线,它出现峰值的时间早于过氧化氢酶、过氧化物酶等[36],有研究[37]认为,耐热性强的品种SOD活性上升的幅度大,这与本研究发现的结果相似。茶叶在遭受持续高温胁迫下,细胞内活性氧积累,从而造成膜脂过氧化,丙二醛(MDA)是膜脂过氧化的产物之一[38],因此,可通过测定MDA含量了解膜脂过氧化的程度,以间接测定膜系统受损程度以及茶叶的抗高温能力。本研究表明,高温处理后,各品种MDA含量增加的顺序依次为龙井43>鸠坑>乌牛早>福鼎大白茶,因此,初步认为4个品种耐热性由大到小顺序为福鼎大白茶>乌牛早>鸠坑>龙井43。
当植物受到高温胁迫时,原生质膜透性会发生不同程度的增大,原生质液会有不同程度的外渗,以至于介质电导率会有不同程度的加大,电导率越大,表明受害愈严重[39-40],不断地从细胞体内释放各种物质,细胞膜维持着细胞内外的平衡,使细胞内外的电势均衡,以保护细胞内各种酶的活性和细胞代谢的正常进行。高温使细胞膜上的蛋白质变性失活,改变膜透性,抗热性强的品种,它的细胞膜系统结构的稳定性高,质膜的透性较小,不易受高温的影响。本研究发现4个品种细胞伤害率由小到大的顺序依次为福鼎大白茶>乌牛早>鸠坑>龙井43,与MDA反映的耐热性顺序一致。
本文研究了高温处理对江南茶区4个主要茶树品种的光合特性及抗逆特性的影响,并确定各品种耐热性强弱,但本研究为持续的高温处理,与自然条件高温状况存在一定差异,今后需进一步研究高温处理对江南茶区茶叶品质的影响。
参考文献References
[1]张玉翠,王连翠.低温对茶树叶片膜透性和保护酶活性的影响[J].北方园艺,2010,(9):38-40.
Zhang Y C,Wang L C.Effect of low temperature stress on membrane permeability and protection of activity in tea leaves[J].Northern Horticulture,2010,(9):38-40.(in Chinese)
[2]李浣沧.浙江优质绿茶的气象条件分析[J].茶叶,1982, (3):1-4.
LI H C.An analysis of meteorological conditions of Zhejiang high quality green tea[J].Journal of Tea,1982, (3):1-4.(in Chinese)
[3]Karim M A,Fracheboud Y,Stamp P.Photosynthetic activity of developing leaves of Zea Mays is less affected by heat stress than that of developed leaves[J].Physiology Plant,1999,105: 685-693.
[4]孟令波,秦智伟,李淑敏.高温胁迫对黄瓜幼苗根系生长的影响[J].园艺学报,2003,30(6):694-695.
Meng L B,Qin Z W,Li S M.Effects of high temperature stress on the root of cucumber seeding[J].Acta Horticulturae Sinica,2003,30(6):694-695.(in Chinese)
[5]Howell G S.Sustainable grape productivity and the growth-yield relationship:a review[J].American Journal of Enology and Viticulture,2001,52:165-174.
[6]Caprio J M,Quamme H A.Weather conditions associated with grape production in the Okanagan Valley of British Columbia and potential impact of climate change[J].Canadian Journal of Plant Science,2002,82: 755-763.
[7]王冬梅,许向阳,李景富.番茄耐热性研究进展[J].中国蔬菜, 2003,(2):58-60.
Wang D M,Xu X Y,Li J F.Advances of heat-resistant in tomato[J].China Vegetables,2003,(2):58-60.(in Chinese)
[8]刘爱荣,陈双臣,王森博,等.高温胁迫对番茄幼苗光合作用和叶绿素荧光参数的影响[J].西北农业学报, 2010,19(5): 145-148.
Liu A R,Chen S C,Wang S B,et al.Effects of heat stress on photosynthesis and chlorophyll fluorescence parameters in tomato seedlings[J].Acta Agriculturae Boreali-occidentalis Sinica,2010,19(5):145-148.(in Chinese)
[9]Farquar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Annu Rev Plant Physiol,1982,(33):317-345.
[10]孙宪芝,郑成淑,王秀峰.高温胁迫对切花菊-神马光合作用与叶绿素荧光的影响[J].应用生态学报,2008,19(10): 214-215.
Sun X Z,Zheng C S,Wang X F.Effects of high temperature stress on photosynthesis and chlorophyll fluorescence of cut flower chrysanthemum(Dendranthema grandif lora-Jinba.) [J]. Chinese Journal of Applied Ecology,2008,19(10): 214-215.(in Chinese)
[11]吴韩英,寿森炎,朱祝军.高温胁迫对甜椒的光合作用和叶绿素荧光的影响[J].园艺学报,2001,28(6): 517-521.
Wu H Y,Shou S Y,Zhu Z J.Effects of high temperature stress on photosynthesis and chlorophyll fluorescence in sweet pepper(Capsicum fructescens L)[J].Acta Horticulturae Sinica,2001,28(6):517-521.(in Chinese)
[12]Lu P,Sang W G,Ma K P.Differential responses of the activities of antioxidant enzymes to thermal stresses between two invasive Eupatorium species in China[J].Journal of Integrative Plant Biology,2008,50(4): 393-401.
[13]Shin Y,Ryu J A,Liu R H,et al.Harvest maturity, storage temperature and relative humidity affect fruit quality,antioxidant contents and activity,and inhibition of cell proliferation of strawberry fruit[J].Postharvest Biology and Technology,2008,49:201-209.
[14]Jiang Y W,Huang B R.Drought and heat stress injury to two cool-season turfgrasses in relation to antioxidant metabolism and lipid peroxidation[J].Crop Science,2001,41(2):436-442.
[15]Zhao X,Nishimura Y,Fukumoto,et al.Effect of high temperature on active oxygen species,senescence and photosynthetic in cucumber leaves[J].Environmental and Experimental Botany,2011,70:212-216.
[16]Martineau J R,Specht J E.Temperature tolerance in soy beans[J].Crop Science,1979,(19):75-81.
[17]Martina S,Wolfgang M,Cosima W,et al.Ozone-induced oxidative burst in the ozone bicmonitor plant tobacco BelWs[J].The Plant J,1998,(16):235-245.
[18]李建建,郁继华,常雅君,等.高温胁迫对黄瓜幼苗叶片质膜透性及保护酶活性的影响[J].长江蔬菜,2007,(9):59-61.
Li J J,Yu J H,Chang Y J,et al.Influences of high temperature stress on membrane permeability and activity of cell defence enzymes in leaves of cucumber seedlings[J].Journal ofChangjiang Vegetables,2007,(9):59-61. (in Chinese)
[19]张桂莲,廖斌,汤平,等.灌浆结实期高温对水稻剑叶生理特性和稻米品质的影响[J].中国农业气象,2014,35(6):650-655.
Zhang G L,Liao B,Tang P,et al.Effects of high temperature stress during grain-filling period on physiological characteristics in flag leaves and grain quality of rice[J]. Chinese Journal of Agrometeorology,2014, 35(6):650-655. (in Chinese)
[20]钟芳永.不同肥料处理对茶树生理特性及茶叶品质的影响[D].福州:福建农林大学,2013.
Zhong F Y.Effect of tea plant physiological characteristics and quality under different fertilizer treatments[D]. Fuzhou: Fujian Agriculture and Forestry University,2013.(in Chinese)
[21]赵甜甜,蔡新.不同遮荫度下茶树生理生化特性的研究[J].湖南农业科学,2010,(5):38-41.
Zhao T T,Cai X.Physiological and biochemical characters of tea-plants with different shading degrees[J]. Hunan Agricultural Sciences,2010,(5):38-41.(in Chinese)
[22]肖润林,王久荣,汤宇,等.高温干旱季节遮阳网覆盖对茶园温湿度和茶树生理的影响[J].生态学杂志, 2005,24(3): 251-255.
Xiao R L,Wang J R,Tang Y,et al.Effects of covering with outer shading screens during hot-dry season in tea plantation[J].Chinese Journal o f Ecology,2005,24(3):251-255.(in Chinese)
[23]Chance B,Maehly A C.Assay of catalase and peroxidase: methods of enzymology[J].New York:Academic Press,1955: 764-755.
[24]Rabinowitch H D,Sklan D.Sunscald tolerance in tomatoes: role of superoxide dismutase[J].Planta,1980, 148 (2):162-167.
[25]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001:258-260.
Li H S.Principles and techniques of plant physiological biochemical experiment[M].Beijing:Higher Education Press, 2001:258-260.(in Chinese)
[26]Bradford M M.A rapid and sensitive method for the determination of microgram quantities of protein utilizing the principle of protein-dyebinding[J].Analytical Biochemistry, 1976,72:248-255.
[27]刘建锋,杨文娟,江泽平,等.遮荫对濒危植物崖柏光合作用和叶绿素荧光参数的影响[J].生态学报,2011, 31(20): 5999-6004.
Liu J F,Yang W J,Jiang Z P,et al.Effects of shading on photosynthetic characteristics and chlorophyⅡ fluorescence parameters in leaves of the endangered plant Thuja sutchuenensis[J].Acta Ecologica Sinica,2011,31(20): 5999-6004.(in Chinese)
[28]许大全,张玉忠,张荣铣.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
Xu D Q,Zhang Y Z,Zhang R X.Photoinhibition of photosynthesis in plants[J].Plant Physiology Communications,1992,28(4): 237-243.(in Chinese)
[29]Takakura T.Dynamic simulation of plant growth and environment in the greenhouse[J].Transaction of ASAE,1969, 14(5):964-971.
[30]李萍萍,胡永光,赵玉国.叶用莴苣温室栽培单株光合作用日变化规律[J].园艺学报,2001,28(3):240-245.
Li P P,Hu Y G,Zhao Y G.A study on daily variation of photosynthesis in greenhouse butterhead lettuce[J]. Acta Horticulturae Sinica,2001,28(3):240-245.(in Chinese)
[31]刘玉华,史纪安,贾志宽.旱作条件下紫花苜蓿光合蒸腾日变化与环境因子的关系[J].应用生态学报,2006, 17(10): 231-238.
Liu Y H,Shi J A,Jia Z K.Diurnal dynamics of photosynthetic and transpiration rates of alfalfa under dry farming and their relationships with environmental factors[J].Chinese Journal of Applied Ecology,2006,17(10):231-238.(in Chinese)
[32]谢晓金,李秉柏,朱红霞,等.抽穗期高温对水稻叶片光合特性和干物质积累的影响[J].中国农业气象, 2012,33(3): 457-461.
Xie X J,Li B B,Zhu H X,et al.Impact of high temperature at heading stage on rice photosynthetic characteristic and dry matter accumulation[J].Chinese Journal of Agrometeorology, 2012,33(3):457-461.(in Chinese)
[33]罗海波,马菩,段伟,等.高温胁迫对赤霞珠葡萄光合作用的影响[J].中国农业科学,2010,43(13):2744-2750.
Luo H B,Ma P,Duan W,et al.Influence of heat stress on photosynthesis in Vitis vinifera L cv Cabernet sauvignon [J].Scientia Agricultura Sinica,2010,43(13):2744-2750.(in Chinese)
[34]金春燕.高温胁迫对番茄幼苗生长及生理代谢的影响[D].南京:南京农业大学,2011.
Jin C Y.Study on growth and physiological metabolism of tomato seedlings under high temperature stress[D]. Nanjing:Nanjing Agricultural University,2011.(in Chinese)
[35]杨再强,李伶俐,殷剑敏,等.灌浆初期不同时长高温胁迫对早稻叶片光合和荧光参数的影响[J].中国农业气象,2014, 35(1):80-84.
Yang Z Q,Li L L,Yin J M,et al. Effects of different duration of high temperature stress during filling stages on leaves photosynthetic and fluorescence parameters of early rice[J].Chinese Journal of Agrometeorology, 2014,35(1): 80-84.(in Chinese)
[36]马旭俊,朱大海.植物超氧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
Ma J X,Zhu D H.Functional roles of the plant superoxide dismutase[J].Hereditas,2003,25(2):225-231.(in Chinese)
[37]李天来,李森,孙周平.钙和水杨酸对亚高温胁迫下番茄叶片保护酶活性的调控作用[J].应用生态学报,2009,20(3): 556-590.
Li T L,Li S,Sun Z P.Regulation effect of calcium and salicylicacid on defense enzyme activities in tomato leaves under sub-high temperature stress[J].Chinese Journal of Applied Ecology,2009,20(3):556-590.(in Chinese)
[38]何跃君,薛立,任向荣,等.低温胁迫对六种苗木生理特性的影响[J].生态学杂志,2008,27(4):524-531.
He Y J,Xue L,Ren X R,et al.Effects of low temperature stress on physiological characteristics of six tree spec ies seedlings[J]. Chinese Journal o f Ecology,2008,27(4):524-531.(in Chinese)
[39]黄海涛,余继忠,张伟,等.电导法配合Logistic方程鉴定茶树抗寒性的探讨[J].浙江农业科学,2009,(3):577-579.
Huang H T,YU J Z,Zhang W,et al.Discussion on measurement of cold tolerance based on REC and the Logistic equation in tea tree[J].Journal of Zhejiang Agricultural Science,2009,(3): 577-579.(in Chinese)
[40]Tsarouhas V,Kenney W A,Zsuffa L.Application of two electrical methods for the rapid assessment of freezing resistance in Salix eriocephala[J].Biomass and Bioenergy, 2000,19(3): 165-175.
Effects of High Temperature Stress and Recovery on Photosynthesis and Stress Tolerance of Tea Leaves
HAN Dong1,YANG Fei1,YANG Zai-qiang1,JIN Zhi-feng2
(1. Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2. Zhejiang Meteorological Service Center, Hangzhou, 310017)
Abstract:In order to study the effect of high temperature stress on the photosynthesis rate, fluorescence characteristics, antioxidant enzyme activities and cell injury rates of Camellia sinensis in south region of the Yangtze River, four varieties of tea trees such as Fuding dabaicha, Jiukeng, Longjing 43 and Wuniuzao were investigated under different high temperature stress(35℃ and 40℃,with 25℃ as control)in artificial climate box for 6,12,18,24,48 hours, then recovered for 9 days. The results showed that high temperature stress inhibited the maximum net photosynthetic rate of tea and maximal photochemical efficiency (Fv/Fm) significantly, the maximum net photosynthetic rate and Fv/Fm declined faster when the processing was longer and the temperature was higher. In addition to Fuding dabaicha under 35℃, other varieties of tea could not be recovered to the normal level during a recovery. The SOD activities of Camellia sinensis leaves rose rapidly at the first 12 hours, and then decreased. The average of MDA contents achieved maximum when the temperature were conducted for 48 hours, the leaf cell injury rates increased with high temperature and processing time. The order of the heat resistance among four Camellia sinensis was Fuding dabaicha>Wuniuza>Jiukeng>Longjing 43. The study provided a basis for scientific research of Camellia sinensis.
Key words:High temperature stress;Photosynthetic characteristics;Antioxidant enzyme activity;Cell injury rates
doi:10.3969/j.issn.1000-6362.2016.03.005
* 收稿日期:2015-10-14**通讯作者。E-mail:yzq@nuist.edu.cn
基金项目:公益性行业(气象)科研专项(GYHY201306037)
作者简介:韩冬(1990-),女,硕士,主要从事农业气象灾害预警研究。E-mail:hdistudy@sina.com

