不同镇痛方式对腹腔镜结直肠癌根治术后早期细胞免疫功能的影响
胡超力, 王 芬, 周英杰, 王晖瀛, 傅舒昆
(同济大学附属第十人民医院麻醉科,上海 200072)
·临床研究·
不同镇痛方式对腹腔镜结直肠癌根治术后早期细胞免疫功能的影响
胡超力, 王 芬, 周英杰, 王晖瀛, 傅舒昆
(同济大学附属第十人民医院麻醉科,上海 200072)
目的 比较不同镇痛方式对腹腔镜结直肠癌根治术后早期细胞免疫功能的影响。方法 择期行腹腔镜结直肠癌根治术患者124例,采用随机数字表法随机分为: 硬膜外镇痛组(EA组,n=42)、腹横肌平面阻滞组(TAPB组,n=41)和静脉镇痛组(PCIA组,n=41)。3组患者全身麻醉诱导维持用药相同,EA组行硬膜外阻滞和硬膜外镇痛,TAPB组行双侧TAP阻滞,PCIA组予PCIA镇痛。术前(T0)、全身麻醉诱导后2h(T1)、术后1d(T2)、术后3d(T3)、术后7d或者患者出院前(T4)分别抽取静脉血2ml,采用流式细胞技术检测患者细胞免疫功能。结果 3组患者T2CD4+均比T0显著降低;TAPB组和PCIA组T2CD4+/CD8+均比T0显著降低;EA组T2总T淋巴细胞比T0显著降低(均P<0.05)。与EA组比较,PCIA组T1自然杀伤细胞(NK细胞)显著降低。结论 无论何种镇痛技术,腹腔镜结直肠癌根治术患者术后第1天的T辅助细胞受到明显抑制,全身麻醉联合硬膜外镇痛对患者术中NK细胞数量的减少有益。
镇痛; 结直肠癌根治术; 细胞免疫
恶性肿瘤患者往往处于免疫功能紊乱或低下的状态。手术是肿瘤治疗的重要手段,但长时间手术应激可降低患者的免疫功能,增加肿瘤转移的风险[1]。麻醉是减少手术引起的应激反应的有效方法,但是不同的麻醉方法和麻醉药物本身就会影响肿瘤患者的免疫功能,在一定程度上也影响着肿瘤的治疗和预后,因此麻醉技术对肿瘤患者免疫系统和肿瘤转移的影响不容忽视。本研究旨在探讨不同镇痛方式对腹腔镜结直肠癌根治术患者细胞免疫功能的影响,为临床提供参考。
1 资料与方法
1.1 一般资料
本研究经同济大学附属第十人民医院医学伦理委员会批准,并与患者及家属签署知情同意书。择期同济大学附属第十人民医院拟行腹腔镜结直肠癌根治术患者124例,性别不限,ASA分级 Ⅰ~Ⅱ 级,年龄26~75岁,BMI 18.5~28kg/m2,心、肺、肝、肾和凝血功能正常,无罗哌卡因过敏史,围手术期未使用影响免疫系统的药物。按照随机数字表法随机分为3组: 全身麻醉复合硬膜外镇痛(EA)组42例,全身麻醉复合腹横肌平面阻滞(TAPB)组41例,全身麻醉复合静脉镇痛(PCIA)组41例。
1.2 方法
患者入室后监测SBP、DBP、MAP、HR、ECG、SpO2、BIS,局部麻醉下开放中心静脉通路。麻醉诱导: 咪达唑仑0.05mg/kg、异丙酚1.5~2mg/kg、舒芬太尼0.4μg/kg及苯磺酸顺式阿曲库铵0.15mg/kg,置入一次性气管导管行机械通气,术中BIS维持在40~60。麻醉维持: 七氟醚0.7~1.3MAC 吸入,根据BIS值调节浓度,苯磺酸顺式阿曲库铵4~6mg/h、舒芬太尼5~10μg间断注射。术毕缝皮时停止吸入麻醉药,待患者自主呼吸和意识恢复良好拔除气管导管。术毕盐酸格拉司琼3mg静脉推注预防恶心呕吐。3组患者术后如疼痛剧烈(VAS评分≥7)予哌替啶50mg肌注。
EA组在全身麻醉诱导前于L2~3行硬膜外穿刺,予2%利多卡因4ml作为实验剂量,测试有麻醉平面后推注0.2%罗哌卡因5ml 2次,15min后行全身麻醉诱导,术中0.2%罗哌卡因5ml/h维持。术后行硬膜外镇痛,PCEA配方: 0.2%罗哌卡因,背景输注速率5ml/h,单次剂量5ml,锁定时间为30min,镇痛时间48h。
TAPB组在全身麻醉诱导后行超声引导下双侧TAP阻滞。阻滞方法: 患者取仰卧位,在髂嵴上方肋弓下方之间腋中线水平,背阔肌前缘、腹外斜肌后缘和髂嵴共同组成的三角区即为进针区域[2]。获得清晰的超声图像后,持0.8mm×100mm神经丛刺激针,长轴平面内进针,到达指定位置后,回抽无血无气,注入0.25%罗哌卡因20ml,超声观察药液扩散和渗透。同样方法对侧进行TAP阻滞,TAP阻滞后15min进行手术。
PCIA组不行任何阻滞,术毕给予PCIA镇痛,配方: 舒芬太尼2μg/kg溶入100ml生理盐水中,参数设置为背景输注速率2ml/h,单次剂量0.5ml,锁定时间为15min,镇痛时间48h。
术前(T0)、全身麻醉诱导后2h(T1)、术后1d(T2)、术后3d(T3)、术后7d或者患者出院前(T4)分别抽取静脉血2ml,采用流式细胞技术检测患者细胞免疫功能。
1.3 观察指标
记录每组各时点总T淋巴细胞计数(%)、CD4+、CD8+、CD4+/CD8+、B淋巴细胞计数(%)、自然杀伤细胞计数(NK细胞,%)。
1.4 统计学处理

2 结 果
2.1 3组患者一般情况比较
EA组2例患者术后因硬膜外导管脱落而排除本研究外,入组共40例。3组患者性别、年龄、BMI、手术时间、失血量差异无统计学意义(P>0.05),见表1。
表1 一般情况和手术情况比较

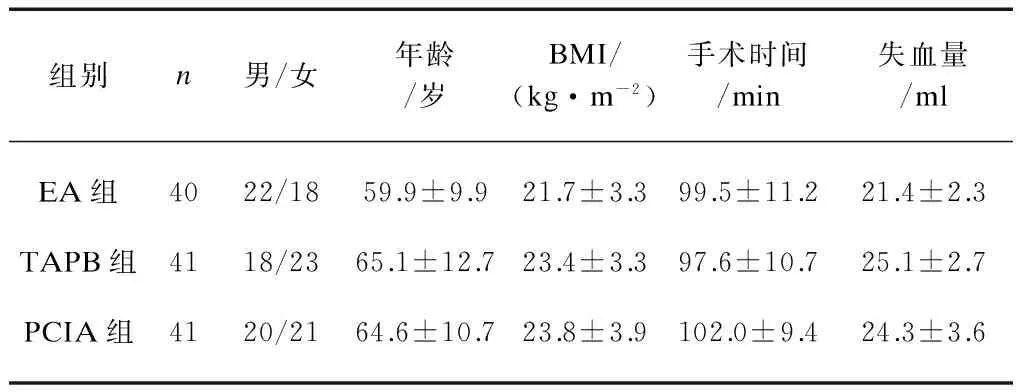
组别n男/女年龄/岁BMI/(kg·m-2)手术时间/min失血量/mlEA组4022/1859.9±9.921.7±3.399.5±11.221.4±2.3TAPB组4118/2365.1±12.723.4±3.397.6±10.725.1±2.7PCIA组4120/2164.6±10.723.8±3.9102.0±9.424.3±3.6
2.2 术中麻醉药与术后哌替啶用量比较
3组舒芬太尼用量和哌替啶追加人次依次增加,且PCIA组显著多于其他两组(P<0.05),见表2。
表2 术中麻醉药和哌替啶用量比较


组别n七氟醚/ml舒芬太尼/μg哌替啶/人次EA组4039.7±5.425.3±4.90TAP组4140.8±5.928.4±5.73aPCIA组4145.3±4.831.2±5.0ab12ab
注: 与EA组比较,aP<0.05;与TAP组比较,bP<0.05
2.3 细胞免疫功能比较
3组T2CD4+均比T0显著降低(P<0.05),TAPB组和PCIA组T2CD4+/CD8+均比T0显著降低,EA组T2总T淋巴细胞比T0显著降低(均P<0.05)。与EA组比较,PCIA组T1NK细胞显著降低(P<0.05),见表3。
表3 3组患者各时点细胞免疫功能比较

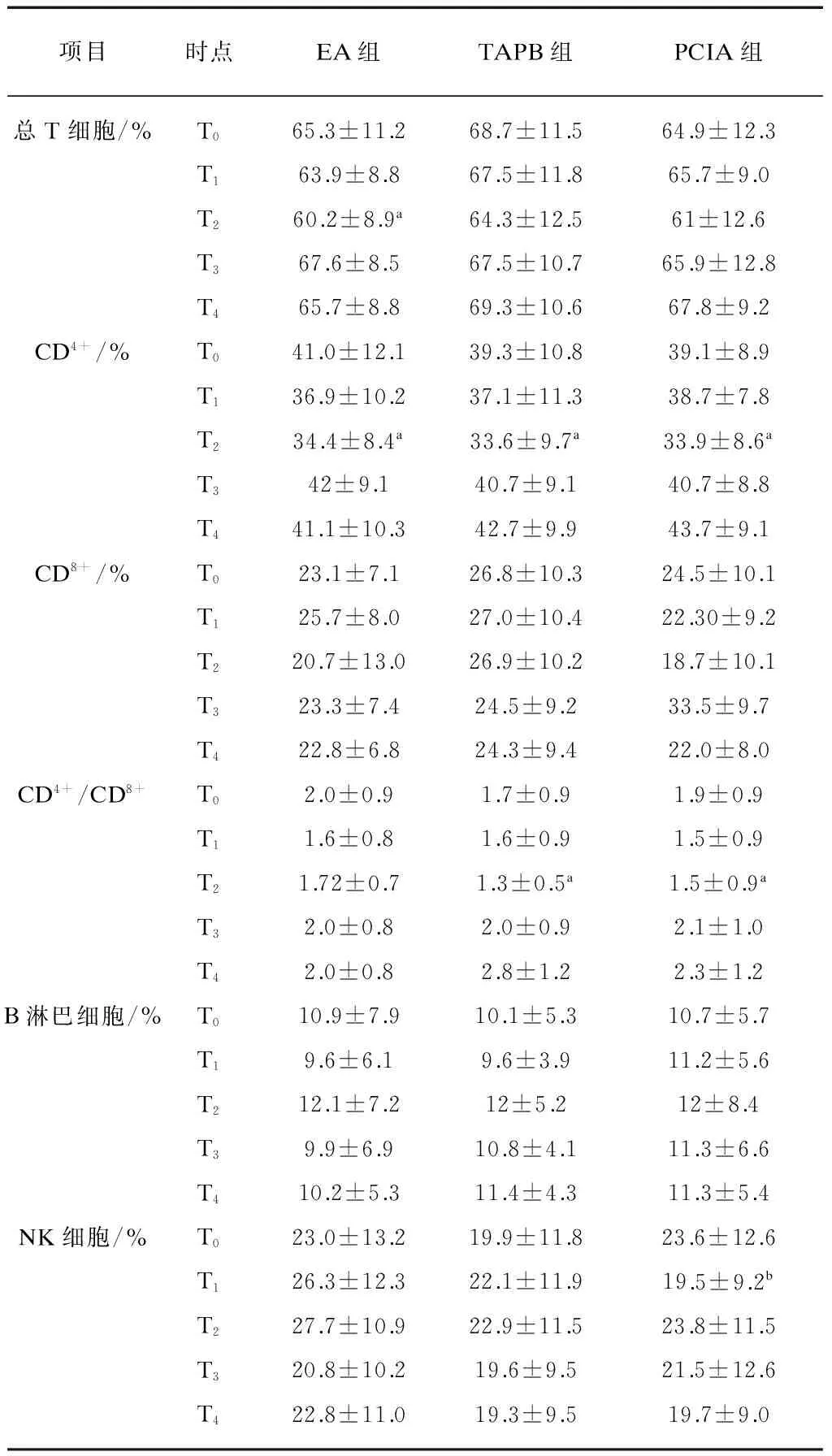
项目时点EA组TAPB组PCIA组总T细胞/%T065.3±11.268.7±11.564.9±12.3T163.9±8.867.5±11.865.7±9.0T260.2±8.9a64.3±12.561±12.6T367.6±8.567.5±10.765.9±12.8T465.7±8.869.3±10.667.8±9.2CD4+/%T041.0±12.139.3±10.839.1±8.9T136.9±10.237.1±11.338.7±7.8T234.4±8.4a33.6±9.7a33.9±8.6aT342±9.140.7±9.140.7±8.8T441.1±10.342.7±9.943.7±9.1CD8+/%T023.1±7.126.8±10.324.5±10.1T125.7±8.027.0±10.422.30±9.2T220.7±13.026.9±10.218.7±10.1T323.3±7.424.5±9.233.5±9.7T422.8±6.824.3±9.422.0±8.0CD4+/CD8+T02.0±0.91.7±0.91.9±0.9T11.6±0.81.6±0.91.5±0.9T21.72±0.71.3±0.5a1.5±0.9aT32.0±0.82.0±0.92.1±1.0T42.0±0.82.8±1.22.3±1.2B淋巴细胞/%T010.9±7.910.1±5.310.7±5.7T19.6±6.19.6±3.911.2±5.6T212.1±7.212±5.212±8.4T39.9±6.910.8±4.111.3±6.6T410.2±5.311.4±4.311.3±5.4NK细胞/%T023.0±13.219.9±11.823.6±12.6T126.3±12.322.1±11.919.5±9.2bT227.7±10.922.9±11.523.8±11.5T320.8±10.219.6±9.521.5±12.6T422.8±11.019.3±9.519.7±9.0
与T0相比,aP<0.05;与EA组比较,bP<0.05
3 讨 论
T辅助细胞(T helper, Th)是CD4+T细胞的一个亚群,帮助其他免疫细胞的激活和介导,参与决定B细胞抗体的转换,激活Te(T cytotoxic)细胞,增强巨噬细胞的吞噬能力,对于免疫系统尤其重要。宿主中若Th型细胞占优势,则提示机体对肿瘤具有活跃的免疫力,而CD8+优势状态将保护肿瘤细胞发生免疫逃逸。NK细胞是一种大粒状淋巴细胞,不需要经过免疫系统的抗原识别反应来确定目标,能主动出击,作用于靶细胞后,杀伤作用出现早,在体外1h、体内4h即可见到杀伤效应,是人体对抗肿瘤和感染的第一道防线。
肿瘤患者细胞免疫功能下降,在肝癌、胃癌等各种肿瘤患者中NK细胞数量减少和活性降低都有报道[3]。手术使围术期免疫抑制,外周的和组织的NK细胞的数量和活性在手术后即刻会有显著的降低[4],增加肿瘤的转移[5]。
麻醉与镇痛是与整个围手术期相伴随的,急性疼痛引起的下丘脑垂体-肾上腺轴激活已经证明能抑制NK细胞活性,Th细胞和细胞因子减少,促进肿瘤在动物中的生长。麻醉技术虽然不能解决手术中肿瘤播散和残留的问题,但通过一些麻醉方法的干预可以改善手术应激引起的一些免疫抑制,包括减少NK细胞活性的降低和维持Th细胞的平衡,改善肿瘤的预后。研究[6-7]显示,七氟烷复合脊麻能显著减少小鼠模型术后NK细胞活性的降低,CD4+免疫功能的抑制程度降低,更好地维持Th细胞的平衡,肿瘤转移几率降低。周荻等[8]指出,和单纯全身麻醉比较,全身麻醉复合EA组Th在术后第2天轻微增加,术后第7天显著增加,通过促进抗肿瘤Th极化使肝细胞癌患者受益。
在本研究中,EA组、TAPB组、PCIA组T2CD4+均比T0显著降低;TAPB组和PCIA组T2CD4+/CD8+比T0显著降低,提示无论何种镇痛技术,腹腔镜结直肠癌根治术患者术后第1天的Th细胞受到明显抑制;硬膜外镇痛有助于CD4+/CD8+向CD4+偏移。与EA组相比,PCIA组T1NK细胞计数显著降低,说明区域阻滞可能对肿瘤患者术中NK细胞数量的减少有益。前期研究[9]发现,EA组、TAPB组、PCIA组舒芬太尼用量和哌替啶追加人次依次增加,且PCIA组显著多于其他两组。区域麻醉改善肿瘤患者免疫功能的机制可以被归纳为以下3点: (1) 区域麻醉通过阻断传入神经递质进入中枢神经系统,减轻了手术引起的免疫抑制;(2) 接 受区域麻醉的患者对全身麻醉药物和阿片类药物的需求减少,可降低阿片类镇痛药物对于免疫系统的抑制;(3) 局部麻醉药可削弱肿瘤细胞转移种植的能力。硬膜外阻滞本身并不直接抑制NK细胞的活性,但可以减轻应激反应对NK细胞的抑制,从而改善患者的早期细胞免疫功能。腹横平面阻滞虽然也属于区域阻滞范畴,但是腹横平面阻滞针对的只是腹壁的镇痛,对内脏器官引发的疼痛缺乏有效的镇痛,故对患者早期细胞免疫功能改善不明显。
综上所述,无论何种镇痛技术,腹腔镜结直肠癌根治术患者术后第1天的T辅助细胞受到明显抑制,全身麻醉联合硬膜外镇痛对患者术中NK细胞数量的减少有益。
[1] Hogan BV, Peter MB, Shenoy HG, et al. Surgery induced immunosuppression[J]. Surgeon, 2011,9(1): 38-43.
[2] McDonnell JG, Donnell B, urley G, et al. The analgesic efficacy of transversus abdominis plane block after abdominal surgery: a prospective randomized controlledtrial[J]. Anesth Analg, 2007,104(1): 193-197.
[3] 文坤明,曾庆良,冯国丽,等.结直肠癌患者免疫功能状态与淋巴结细胞角蛋白20表达的关系[J].中华实验外科杂志,2009,26(6): 800.
[4] Ohira M, Ohdan H, Mitsuta H, et al. Adoptive transfer of TRAIL-expressing natural killer cells prevents recurrence of hepatoeellular carcinoma after partial hepatectomy[J]. Transplantation, 2006,82(12): 1712-1719.
[5] Goldfarb Y, Ben-Eliyahu S. Surgery as a risk factor for breast cancer recurrence and metastasis: mediating mechanisms and clinical prophylactic approaches[J]. Breast Dis, 2006-2007,26: 99-114.
[6] Wada H, Seki S, Takahashi T, et al. Combined spinal and general anesthesia attenuates liver metastasis by preserving Thl/Th2 cytokine balance[J]. Anesthe-siology, 2007,106(3): 499-506.
[7] 周荻,朱兰芳,缪长虹.不同麻醉和术后镇痛方法对大鼠原位肝癌切除术后辅助性T淋巴细胞免疫功能和肿瘤转移影响的比较[J].中华麻醉学杂志,2014,34(1): 19-23.
[8] Zhou D, Gu FM, Gao Q, et al. Effects of anesthetic methods on preserving anti-tumor T-helper polarization following hepatectomy[J]. World J Gastroenterol, 2012,18(24): 3089-3098.
[9] 王芬,胡臻,周英杰.不同麻醉镇痛方式对腹腔镜结直肠癌根治术患者术后转归的影响[J].临床麻醉学杂志,2016,32(1): 34-37.
Effects of different analgesia regimens on early cellular immunity in patients undergoing laparoscopic resection of colorectal cancer
HUChao-li,WANGFen,ZHOUYing-jie,WANGHui-ying,FUShu-kun
(Dept. of Anesthesiology, Tenth People’s Hospital, Tongji University, Shanghai 200072, China)
Objective To compare effects of different analgesia regimens on early cellular immunity in patients undergoing laparoscopic resection of colorectal cancer. Methods One hundred and twenty two patients scheduled to undergo laparoscopic resection of colorectal cancer were randomly divided into three groups. Same anesthesia induction and maintenance medication were used in three groups; 40 patients in EA group received epidural block and epidural analgesia, 41 patients in TAP group received bilateral transverse abdominis plane block and 41 patients in PCIA group received patient-controlled intravenous analgesia. Blood samples were collected in 1d before operation(T0), 2h after induction(T1), 1d(T2), 3d(T3) and 7d(T4) after operation, respectively. Flow cytometry was used to detect cellular immune function. Results The helper T-lymphocyte count(CD4+) at T2was lower than that at T0in all three groups(P<0.05); the ratio of CD4+/CD8+of TAPB group and PCIA group at T2was lower than that at T0. The total T- lymphocyte count at T2was less than that at T0in EA group. Compared to EA group, the NK cell in PCIA group was lower. Conclusion The helper T-lymphocyte account after the first day of laparoscopic resection of colorectal cancer is significantly reduced in all three analgesic regimes. General anesthesia combined with epidural analgesia is beneficial in maintaining NK cell levels during the operation.
analgesic; laparoscopic resection of colorectal cancer; cellular immunity
10.16118/j.1008-0392.2016.05.011
2016-02-21
胡超力(1986—),男,住院医师,学士.E-mail: 49015735@qq.com
傅舒昆.E-mail: shukunfu@163.com
R 614
A
1008-0392(2016)05-0054-04

