光学相关断层摄影技术观察壁冠状动脉的可行性研究
叶 梓, 来 晏, 姚义安, 汤佳旎, 罗 裕, 刘学波
(1. 同济大学附属东方医院心血管内科,上海 200120; 2. 同济大学附属同济医院心血管内科,上海 200065)
·临床研究·
光学相关断层摄影技术观察壁冠状动脉的可行性研究
叶 梓1, 来 晏2, 姚义安2, 汤佳旎1, 罗 裕1, 刘学波2
(1. 同济大学附属东方医院心血管内科,上海 200120; 2. 同济大学附属同济医院心血管内科,上海 200065)
目的 讨论光学相关断层摄影技术观察壁冠状动脉的可行性。方法 选择36名心肌桥(myocardial bridging, MB)患者(即冠脉造影可见“挤奶现象”的患者)行光学相干断层摄影检查(optical coherence tomography, OCT)及血管内超声检查(intravascular ultrasound, IVUS),并进一步用猪的心脏作为动物模型以确认与OCT图像相对应的组织学结构。结果 所有患者OCT检测均发现MB节段内一紧邻动脉管壁外的边界清晰、不均质的、低信号梭形区域;且在舒张期更易观察到这一特征性的图像表现。该梭形区域的最大弧度为176.3°±53.1°(106°~287.5°),最大厚度为(0.41±0.12)mm(0.25~0.69mm)。所有患者均在且只在肌桥节段外近段血管内检出动脉粥样硬化改变,仅1例患者在肌桥节段内发现了管壁内膜增厚。OCT所发现的梭形区域不同于IVUS图像中代表MB肌束的半月形无回声区域。另外,线性相关分析发现梭形区域弧度与管腔受压迫程度呈负相关(r=-0.403,P=0.004)。进一步的动物模型的组织学检查结果发现这一梭形、低信号区域是位于肌肉与动脉血管之间的结缔组织。结论 在造影和IVUS确诊的MB患者中,OCT检查可在肌桥节段发现一紧邻动脉管壁外的边界清晰、不均质的、低信号梭形区域,进一步组织学检查结果发现这一区域为动脉周围结缔组织,而非IVUS中代表肌束的半月形无回声区域。
心肌桥; 血管内超声; 光学相干断层摄影技术
冠状动脉心肌桥(myocardial bridge, MB)是一种常见的冠状动脉走行变异,是指心外膜冠状动脉走行在心肌之间,从而在心肌收缩时对管腔造成了压迫。既往尸检、冠脉造影及IVUS研究中,MB发生率分别为40%~80%、 0.5%~16%及23%~ 43.2%[1-3]。冠脉造影上的图像特点是出现特征性的“挤奶现象”;在血管内超声(intravascular ultrasound, IVUS)中的特征图像表现为“半月现象”即: 环绕在动脉血管外呈“半月形”的无回声区域,且该节段血管随心动周期出现周期性的管腔变小现象[4]。
光学相干断层扫描技术(optical coherence tomography, OCT)利用光干涉的基本原理,通过对不同结构表面对光反射或衰减的时间延迟进行测量,其分辨率能够达到10μm级,因此OCT可作为观察近管腔面的接近组织学的影像工具。目前尚无研究应用OCT观察肌桥节段血管,肌桥节段在OCT中的特征性表现也从未具体进行描述。因此,本研究以OCT对冠脉造影确诊的MB患者进行观察,从而阐明它在OCT图像中的特征性表现。
1 资料与方法
1.1 一般资料
该项研究包括2013年11月至2014年7月在同济大学附属东方医院行冠状动脉造影并且明确诊断为MB的36例患者。对靶节段血管(即MB节段及该节段以近、以远各10mm的参考节段)行血管内超声和光学相干断层摄影检查。排除标准为: (1) 靶节段有支架植入;(2) 终末期肝衰竭或肾衰竭;(3) 急性感染状态;(4) 恶 性肿瘤患者;(5) 血流TIMI 0~ 2级。
1.2 冠状动脉造影及定量冠脉造影图像分析
每位患者在术前12h内接受口服负荷剂量的阿司匹林300mg和氯吡格雷300mg。在导管进入体内前,于动脉内注入3000IU普通肝素。冠状动脉造影采用5F OUTLOOK Tiger造影导管。冠脉造影定量分析是由心内科两位介入医师在未知患者情况下,采用目前广泛应用的具备自动边缘检测系统的分析软件(CAAS-5, Pie Medical公司)进行读图、分析和测量。当两位医师对图像分析产生分歧时或差异时,交由第三方进行重新审读。待测量或待计算的分析内容包括平均参考节段管腔直径、收缩期/舒张期MB压迫节段内最小管腔直径(sMLD/dMLD)、压迫系数以及重构指数;其中负性重构定义为重构指数<0.85。
1.3 IVUS图像获得及图像分析
完成冠脉造影之后,动脉内追加2000IU普通肝素,交换6Fr指引导管,于冠状动脉内注入200μg 硝酸甘油后开始行IVUS检查,图像采集起点至少超过肌桥远端边缘10mm,然后以0.5mm/s进行自动回撤。所有定量定性分析依据美国心脏协会IVUS临床专家共识[5],由两位对患者情况未知的心内科介入医师进行独立读图,使用分析软件(EchoPlaque, INDEC Systems公司)进行定量分析。当两位医师对图像分析产生分歧时或差异时,交由第三方高年资进行重新审读。除常规定量分析内容外,特殊测量或计算分析内容包括: (1) 压迫系数= (平均参考节段EEM-CSA-sEEM-CSA)/(平均参考节段EEM-CSA)×100%;(2) 重构系数=dEEM-CSA/平均参考节段EEM-CSA×100%;(3) “半 月征无回声区域”的厚度。
1.4 OCT图像获得及图像分析
完成IVUS图像采集后,撤出超声成像导管,换用C7 OCT成像导管,OCT导管需达远端边缘 10mm。OCT图像采集包括两个部分: (1) 通过指引导管匀速推注碘帕醇的同时,以25mm/s的回撤速度采用系统自带的自动回撤功能进行图像采集;(2) 在完成自动回撤后将OCT导管头端光学探头所在处置于肌桥压迫最重处(判断标准为结合冠脉造影图像),在匀速推注碘帕醇的情况下手动截取10~20幅图像。
OCT的图像分析同样是由两位对患者情况的未知的介入医师完成,出现不一致的分析结果时交由第三方进行判断;图像分析采用的是目前常用的离线分析软件(iLightLab, St Jude Medical公司)。分析内容包括对肌桥最重处的收缩期(舒张期)管腔面积、EEM横截面积,血管及血管周围的特殊光学信号的改变,以及对近端(远端)参考节段的常规图像分析、测量。对参考节段的分析采用第1步中的自动回撤进行,对压迫最重处的测量选取的是第2步图像采集中的静态截图。而对于相同位置的IVUS和OCT图像比较的选取,采取以边支、钙化等特殊位点作为定标点。所有的测量分析依据美国心脏病学会关于OCT图像的获取、采集及报告的临床专家共识文件来进行[6]。
1.5 动物模型的建立和OCT图像采集
为了进一步证实OCT图像中的发现,鉴于猪的心脏在既往动物试验中证实有高达47.3%的MB检出率,本研究选取了10个猪的心脏进行离体OCT检测。在完成OCT检测后,将包含肌桥节段的冠脉包括其表面覆盖的心肌组织进行分离,以10%的福尔马林溶液填充离断的冠状动脉内,并完全浸入至福尔马林溶液中过夜。处理过的标本以4~ 5μm的厚度为标准进行切片,后分别进行H-E染色和Masson’s染色,最后以光学显微镜进行组织切片的观察。
1.6 统计学处理

2 结 果
2.1 基线临床及冠脉造影资料
总共有36名符合入选标准且冠脉造影检查诊断MB的患者。这部分患者中,有69.4%患者同时诊断了急性冠脉综合征(acute coronary syndrome, ACS),其中包含了1例临床表现为NSTEMI的患者,所有MB均发生在左LAD。冠脉造影定量分析结果显示,造影中以直径计算MB段血管受压程度为18%~76%,平均(38±19)%,肌桥长度为4.3~ 36.8mm,平均(18.6±9.2)mm。收缩期压迫最重处最小管腔直径(sMLD)为0.41~2.1mm,平均为(1.06±0.45)mm。舒张期压迫最重处的最小管腔直径(dMLD)为和1.28~2.71mm,平均为(1.98±0.38)mm。舒张期肌桥节段管腔显著小于近端和远端参考节段(P<0.05),舒张期管腔重构指数为0.72~0.99,平均(0.77±0.11)。以远端参考节段计算,53%的病例肌桥节段舒张期管腔的重构指数<0.9。
2.2 IVUS图像的定性和定量分析资料
在所有入选的确诊MB患者进行血管内超声检查时在MB节段血管根均可见“半月征”,且随心动周期管腔有明显的大小变化。血管内超声的测量结果见表1。
几乎所有的IVUS测量数据与QCA测量结果间高度相关,但在IVUS中以EEM-CSA计算时的重构系数与在QCA中以管腔直径计算的重构系数间无明显相关(P=0.357)。
2.3 OCT图像的定性和定量分析资料
在所有冠脉造影确诊MB的患者中,其LAD的MB在接受OCT检查时均可见一紧邻动脉管壁外的边界清晰、不均质的、低信号梭形区域,见图 1~3;该梭型区域在且只在肌桥节段被观察到。在所有患者的OCT长轴图像中,该梭型区域都是呈连续性的,但在截面图像上可见该区域的形态随心动周期的变化而变化,即在舒张期梭型区域的边界清晰,而在收缩期则边界及其内信号都相对模糊。需要注意到的是,在其他非肌桥节段的血管,尤其是无病变的正常血管外膜外也可见到类似的图像信号,但这些节段的图像形态通常是边界模糊,形状不定的,见图4。
将OCT探头置于依据造影图像所得到的MB受压最重处进行人工采图时,可以明显观察到在收缩期,该梭型区域变薄、变小且较为模糊;而在舒张期该区域的轮廓则逐渐清晰,呈现出一种随心动周期改变的周期性变化。OCT测量数据见表1。
另外,在OCT图像中,MB节段血管受压时可以观察到管腔的两种形态变化,一种是在受压时呈卵圆形(22/36,占61.1%),或是呈分叶型(14/36,占38.9%)。
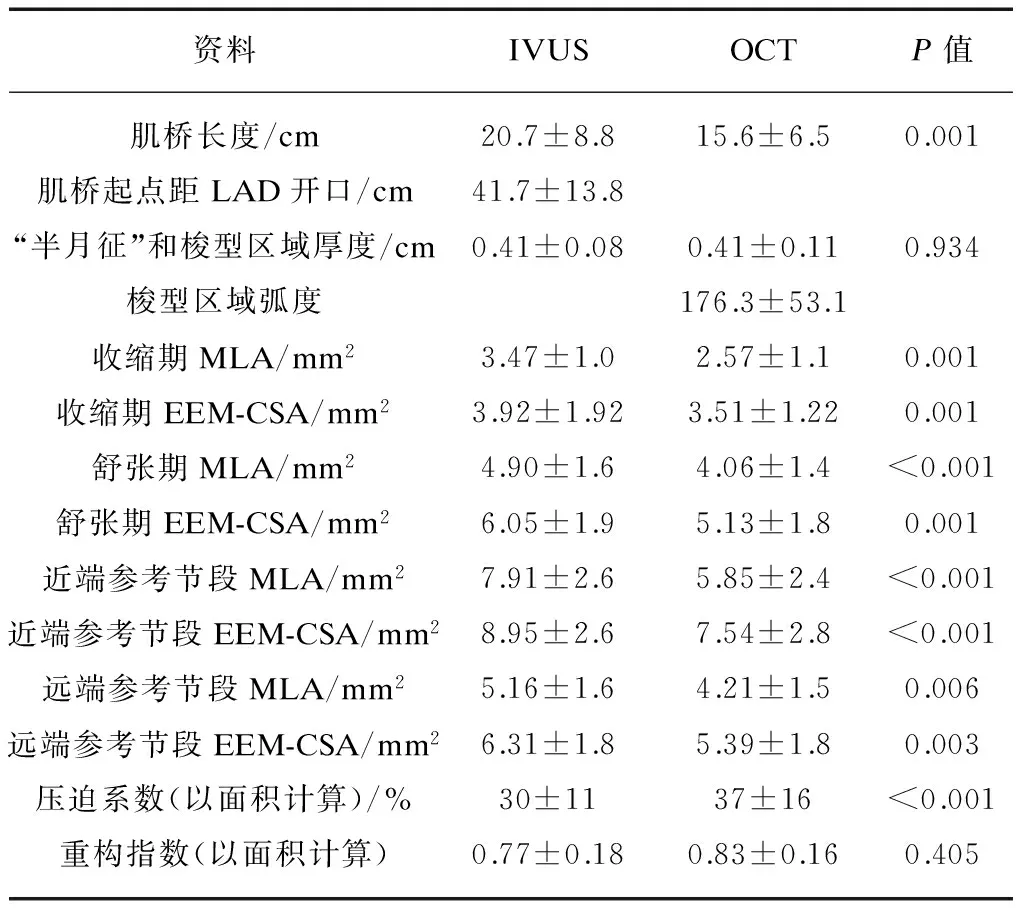
表1 MB患者的IVUS和OCT资料

图1 OCT自动回撤图像中的MB影像Fig.1 Pullback OCT imaging of myocardial bridgingA~E为截面图像,依据间隔支的位置(白色三角所示)将管腔划分为近近心肌面和近心包面(图中白色虚线划分),图中所见沿长轴分布的梭型区域在不同截面形态不同(白色星号所标示);白色箭头所示为MB位置,G为B的局部放大图像

图2 对应冠脉造影中压迫最重位置处的OCT人工采集图像Fig.2 Manual OCT image capture at the angiographically most-compressed site in the MB segment梭型区域(星号标示)位于血管外膜与心肌条带之间(A、B中白色箭头所示),这一区域在舒张期时清晰可见,而在收缩期时变模糊(C)
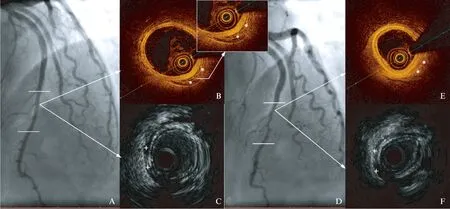
图3 MB的多种影像表现Fig.3 Multimodality imaging of diastolic and systolic MB segmentA~C为MB节段血管舒张期时的造影、OCT以及IVUS表现,D~F为收缩期时的造影、OCT和IVUS表现;星号标示的是梭型区域,B、C、E、F可见梭型区域与“半月征区域”形态截然不同
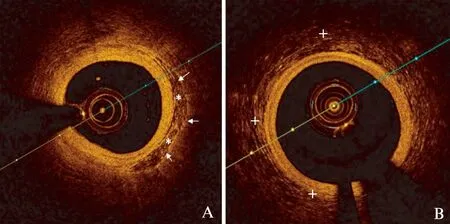
图4 MB节段血管周围组织与无肌桥节段血管周围组织的图像对比Fig.4 Imaging of perivascular tissue in MB segment vs. an artery without a MB segmentA为肌桥节段血管的OCT影像,可见由于肌束的存在(白色箭头)梭型区域的边界清晰;B为无肌桥节段血管的OCT影像,其血管外组织的影像为不均质、无明确轮廓的
2.4 QCA、IVUS及OCT结果比较
通过对比OCT和IVUS图像的形态学特点、计算数据发现,在IVUS图像中并无对应于该梭形区域的部分。在QCA、IVUS和OCT的测量数据中,OCT测得的MB长度明显短于IVUS的测量结果及QCA的测量结果。在管腔测量方面,OCT测量结果与IVUS测量结果保持了较好的一致性(P=0.001)。针对梭形区域的测量结果,其厚度与IVUS测得的半月征厚度无相关性(r=-0.029,P=0.934)。而压迫程度与IVUS测量结果中的半月征厚度以及OCT观察到的梭形区域的厚度均无相关性(r=0.031,P= 0.9;r=-0.074,P=0.7)。值得注意的是,在MB节段受压最重处的压迫程度与这一异质性、梭形区域的弧度呈现负相关,差异有统计学意义(r=-0.49,P=0.003),见图5~6。
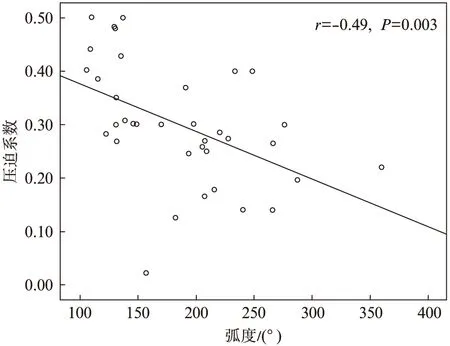
图6 受压最重处管腔的压迫程度与梭型区域弧度间的相关性Fig.6 The correlation between compression ratio and the arc of the heterogenous fusiform area at the most compressed tunneled artery
2.5 猪心脏的MB模型的组织学资料
在待检的10个猪心脏中,有5个猪心上的冠状动脉肉眼可见部分走行于肌肉之间的现象,均位于猪冠状动脉系统中右冠状动脉的后室间隔支上。组织学病理切片检查发现,在肌桥节段的截面可见位于MB肌肉和其下冠状动脉之间数量不等的脂肪组织和纤维组织。结合组织学病理切片结果,认为OCT图像中的梭形区域为位于肌肉与动脉之间的疏松结缔组织,主要成分是脂肪组织和纤维组织,见图7。
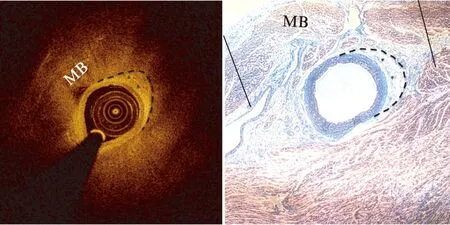
图7 猪MB的OCT图像及相应部位的病理学切片Fig.7 MB with Masson’s staining and the corresponding OCT imaging from a pig heart with a MB黑色虚线围成的区域为OCT中的梭型区域,马松染色可见脂肪及纤维组织
3 讨 论
本研究得出了以下结论: (1) OCT检测发现MB节段内一紧邻动脉管壁外的边界清晰、不均质的、低信号梭形区域,且这一图像与IVUS中所能观察到的无回声的“半月征现象”并不一致;(2) 在舒张期更易观察到这一特征性的图像表现;(3) 当梭形区域与动脉外管壁接触弧度越大,肌束对血管的压迫程度越轻。以上的图像学特征性表现,在以猪心脏为模型的动物试验中得到了证实。
通常认为MB是一种良性的冠状动脉走形变异,但也有病例报道发现,MB的存在与心肌缺血、心肌梗死甚至心源性猝死相关[7-8]。关于MB的诊断,早期主要是依赖冠状动脉造影进行诊断,表现为冠脉造影图像上随心动周期变化,在收缩期出现的“挤奶现象”[9]。1994年,研究[8]报道了MB在IVUS图像中的特征表现,其特点为环绕在壁冠状动脉外的无回声“半月”区域,且肌桥节段的管腔大小随心动周期而出现周期性的缩小。本研究首次将OCT应用在对肌桥血管,甚至血管周围组织的观察中。尽管OCT具有极高的分辨率,但它可能不是观察MB的最佳腔内影像学手段,主要是因为其有限的穿透力和过快的回撤和成像速度(OCT为20mm/s,而IVUS为0.5mm/s)。因为对于肌桥的观察是需要对靶点进行一个完整的心动周期的观察,因此在临床应用时,除非采取定点采集图像的方法,否则很难对MB的周期变化进行完整观察。即便有以上的缺点,但本研究也提供了相对新颖的观察MB的视角,与既往的检测手段所获得的信息不同,可以说是对既往研究结果的部分补充,即发现了冠脉外膜外一紧贴血管的梭形区域,虽然与IVUS中的半月征有类似之处,但数据分析结果及组织学切片结果证实这两种图像实际上是分别代表了两种组织。
在本研究中,IVUS中的半月征还是OCT图像中的的梭形区域的性质和定量分析上的差距,包括形态、与血管的相对关系还是图像信号特点均不一致,提示它们不同的组织成分。近期有组织病理学研究也发现,在肌桥肌束下,受压的LAD外存在有血管周围组织,这一组织主要包括脂肪组织和其他结缔组织,功能上类似“冠状动脉脂肪垫(coronary cushion)”[10],可以帮助血管对抗收缩期肌束的压迫。依据先前的病理学证据,OCT所观察到的该梭形区域就是这一血管周围组织。这一假设主要是基于对OCT图像数据的分析,主要是随着梭形区域与血管接触弧度的增加压迫程度减小以及猪心组织学病理结果。
本研究在有明显胸闷、痛等症状的患者或其他一些特殊情况疑诊冠心病的患者中应用OCT和IVUS检查,且入选的患者在冠脉造影中已有明显的受压表现,对于一些造影上不明显的的肌桥患者的图像特点无法获得。另外,在一些肌桥压迫严重的患者,IVUS和OCT导管均无法到达肌桥远端,或虽能到达远端则立刻引起患者明显症状而终止了图像采集,造成了部分数据的缺失。
在一些造影和IVUS明确证实的LAD MB患者中,OCT检查可以观察到MB节段内一紧邻动脉管壁外的边界清晰、不均质的、低信号梭形区域;且在舒张期更易观察到这一特征性的图像表现;且这一图像与IVUS中所能观察到的无回声的“半月征现象”并不一致。
[1] Tsujita K, Maehara A, Mintz GS, et al. Comparison of angiographic and intravascular ultrasonic detection of myocardial bridging of the left anterior descending coronary artery[J]. Am J Cardiol, 2008,102: 1608-1613.
[2] Lee BK, Lim HS, Fearon WF, et al. Invasive evaluation of patients with angina in the absence of obstructive coronary artery disease[J]. Circulation, 2015,131: 1054-1060.
[3] Mohlenkamp S, Hort W, Ge J, et al. Update on myocardial bridging[J]. Circulation, 2002,106: 2616-2622.
[4] Ge J, Erbel R, Rupprecht HJ, et al. Comparison of intravascular ultrasound and angiography in the assessment of myocardial bridging[J]. Circulation, 1994,89: 1725-1732.
[5] Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology clinical expert consensus document on standards for acquisition, measurement and reporting of intravascular ultrasound studies(IVUS). A report of the American College of Cardiology Task Force on clinical expert consensus documents[J]. J Am Coll Cardiol, 2001,37: 1478-1492.
[6] Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies: a report from the International Working Group for Intravascular Optical Coherence Tomography Standardi-zation and Validation[J]. J Am Coll Cardiol, 2012,59: 1058-1072.
[7] Bestetti RB, Costa RS, Zucolotto S, et al. Fatal outcome associated with autopsy descending coronary artery[J]. Eur Heart J, 1989,10: 573-576.
[8] Chambers JD Jr, Johns JP, Berndt TB, et al. Myocardial stunning resulting from systolic coronary artery compression by myocardial bridging[J]. Am Heart J, 1994,128: 1036-1038.
[9] Irvin RG. The angiographic prevalence of myocardial bridging in man[J]. Chest, 1982,81: 198-202.
[10] Saidi H, Ongeti WK, Ogeng’o J. Morphology of human myocardial bridges and association with coronary artery disease[J]. Afr Health Sci, 2010,10: 242-247.
Morphology of myocardial bridging shown on optical coherence tomography
YEZi1,LAIYan2,YAOYi-an2,TANGJia-ni1,LUOYu1,LIUXue-bo2
(1. Dept. of Cardiology, East Hospital, Tongji University, Shanghai 200120, China;2. Dept. of Cardiology, Tongji Hospital, Tongji University, Shanghai 200065, China)
Objective To assess the feasibility of optical coherence tomography(OCT) in diagnosis of myocardial bridging(MB). Methods OCT and intravascular ultrasound(IVUS) were performed in 36 patients whose angiograms showed typical “milking effects” indicating MB. A porcine model was used to confirm the correlation of OCT image with histopathologic features of the disease. Results In all patients OCT showed specific fusiform, heterogeneous signal-poor tissue with a sharply delineated border surrounding the tunneled artery in the MB segment; which was more clear during diastole than systole and was not detected in non-MB segments. The maximal surrounding arc and thickness of this area measured (176.3±53.1)°(range from 106° to 287.5°) and (0.41±0.12)mm(range from 0.25mm to 0.69mm), respectively. Atherosclerosis occurred proximal to the MB segment in all patients, but intimal thickening in MB segment was observed only in one case. This OCT-detected fusiform area was distinct from the IVUS-detected echolucent crescent representing the myocardium surrounding the artery. Furthermore, a negative correlation between the fusiform arc and the compression ratio was found(r=-0.403,P=0.004). In addition, histological examination in porcine heart model confirmed that the fusiform, heterogeneous signal-poor area was mainly composed of connective tissue and was located at the junction of MB myocardium and epicardium. Conclusion In patients with angiographically and IVUS documented MB, the OCT-detected sharp border, heterogeneous, signal-poor fusiform area is indicative of arterial tunneling through myocardium that is distinct from the echolucent muscle band found in IVUS and that represents peri-arterial connective tissue.
myocardial bridging; optical coherence tomography; intravascular ultrasound
10.16118/j.1008-0392.2016.05.010
2016-04-27
叶 梓(1990—),女,硕士.E-mail: leafapple8848@hotmail
刘学波.E-mail: liuxuebo70@126.com
R 541.4
A
1008-0392(2016)05-0047-07

