艾纳香萜类物质生物合成途径分析
官玲亮 夏奇峰 庞玉新 赵致 胡远鹏 白琳 王鸿发


[摘要]为了全面了解艾纳香中萜类物质的代谢途径,以及具体的基因和催化酶类,以期为从分子水平调控艾纳香中萜类活性成分提供理论依据。基于艾纳香的转录组数据,将艾纳香的转录组测序结果同KEGG数据库中其他多种高等植物萜类合成途径的研究结论进行比对,预测出艾纳香中萜类代谢的具体途径。结果表明艾纳香在KEGG数据库中比对上4条萜类代谢通路:萜类骨架代谢途径、单萜代谢途径、二萜代谢途径、倍半萜与三萜代谢途径,对应基因的数目分别为103,10,29,59条。通过对催化酶与活性产物进行总结分析,结果显示,单萜活性产物为8种、二萜3种、三萜和倍半萜3种。在萜类代谢途径过程中的关键酶主要为脱氧木酮糖5磷酸合酶、HMGCoA还原酶、烯丙基转移酶系。艾纳香中与单萜类物质合成的酶类相对较少,而产物种类较多,这可能与单萜合酶催化产物的不专一性有关。通过对艾纳香中萜类调控途径的整体分析,并对其中关键酶基因的调控,有望整体提高艾纳香中萜类活性物质的产量。
[关键词]艾纳香;转录组;萜类代谢途径;限速酶
[Abstract]In order to provide a theoretical basis for the regulation of active ingredient, the terpenoids metabolic pathway and specific enzymes in Blumea balsamifera are investigated Basing on transcriptome information, B balsamifera terpenoids metabolic pathway was analyzed in KEGG data base Four metabolic pathway of terpenoids were found in KEGG data base They were terpenoid backbone biosynthesis, monoterpenoid biosynthesis, diterpenoid biosynthesis, sesquiterpenoid and triterpenoid biosynthesis, contained 103, 10, 29,59 genes, respectively Through the analysis of the enzyme and product in the pathway, the result showed that there were 8 kinds of monoterpenes, 3 kinds of diterpenes, 3 kinds of triterpenes and sesquiterpenes The mainly key enzymes were deoxyxylulose 5phosphate synthase, HMGCoA reductase and allyl transferase system In B balsamifera, there were relatively few monoterpenes synthetic enzymes, while the type of products was much more than other terpenes This may be relate to the nonspecific catalytic characteristic of monoterpene synthase It is expected to improve the yield of terpenoids in B balsamifera by analysis the pathways and regulation the key enzymes
[Key words]Blumea balsamifera; transcription group; metabolic pathway of terpenoids; ratelimiting enzyme
doi:104268/cjcmm20160903
艾納香Blumea balsamifera L.DC.为菊科艾纳香属多年生木质草本植物,最早记载于公元741年(唐开元二十九年)陈藏器所编著 《本草拾遗》,此后宋代刘翰等编著《开宝本草》(公元 973—974 年)也曾记载[1]。艾纳香以根、嫩枝、叶入药,其性微温,味辛、微苦,具有祛风消肿、活血散瘀之功效,可用于治疗感冒、风湿性关节炎、产后风痛、痛经、 外用跌打损伤、疮疖痛肿、湿疹皮炎。另外,艾纳香还具有抗氧化、抗癌和抗病毒的作用[2]。主要分布于我国海南、贵州、广西、广东、云南、台湾等省。在黎族、苗族、壮族等少数民族地区有着悠久的药用历史,是一种重要的民间药物[3]。
萜类化合物(terpenoids)是植物体内一大类由异戊二烯为基本结构单位所组成的化合物,萜类物质是自然界种类最多、分布最广泛的一类天然产物[45]。前人的研究成果显示,目前在自然界已发现的萜类物质有近3万种之多,其中有一半的物质是在植物体内发现[6]。植物体内的萜类化合物大多与植物的代谢过程密切相关,对植物的正常生理活动发挥着重要的作用。从萜类的化学结构上可以将其分为单萜、二萜、倍半萜、三萜等类别[7]。植物体内的萜类物质除了对植物体本身具有重要作用之外,有许多的萜类物质还具有巨大的药用价值,是许多中药材的药理活性成分[810]。比如,抗肿瘤的紫杉醇、长春新碱;抗疟的青蒿素;主要能阻断副交感神经节后纤维的托品类生物碱等。左旋龙脑(L龙脑)又名艾片,是艾纳香中重要的次生代谢产物,是艾纳香主要的药用活性成分,L龙脑属于双环单萜化合物[11]。现代药理学研究证实,L龙脑具有抗炎、抗氧化、镇痛、促进药物吸收、提神醒脑等作用[12]。
本文基于艾纳香的转录组信息,将艾纳香的转录组数据在KEGG数据库中进行检索比对,找到并进一步梳理了艾纳香中萜类物质的生物合成途径。对艾纳香中萜类合成具体步骤进行了具体的分析,对位到了每一个反应步骤的催化酶。将艾纳香转录组的基因信息与酶的表达合成联系起来,有望在将来从分子调控的水平对艾纳香萜类代谢的过程进行调控,提高艾纳香萜类活性物质的生物合成量,从而增大艾纳香的药用价值。
1材料
艾纳香B. balsamifera栽培于海南省儋州市,中国热带农业科学院热带作物品种资源研究所南药种质资源圃,根据前期对艾纳香全年不同月份,叶片中L龙脑的含量进行的研究结果,显示在6月和11月为L龙脑积累的高峰期,为此本研究中试验材料选取的为6月份艾纳香长势良好的成熟叶片。
2方法
用总RNA提取试剂盒(Plant RNA Kit)提取艾纳香叶片的总RNA,由上海美吉(Majorbio)生物工程技术服务有限公司进行转录组测序。实验采用 Illumina TruseqTM RNA sample prep Kit 方法构建文库,真核生物以 5 μg total RNA 起始量建库;磁珠法分离 mRNA后,离子打断 mRNA(TruseqTM RNA sample prep Kit);双链 cDNA合成、补平、3′端加 A、连接 index 接头(TruseqTM RNA sample prep Kit);文库富集,PCR扩增15个循环;2%琼脂糖胶回收目的条带(Certified Low Range Ultra Agarose);TBS380(Picogreen)定量,按数据比例混合上机;cBot上进行桥式 PCR扩增,生成clusters;Hiseq2000测序平台进行测序。数据分析流程如下:数据产出统计、数据去杂、转录组拼接、SSR分析及SNP分析、基因功能注释等。本文基于转录组测序信息以及KEGG数据库比对结果,对艾纳香的萜类代谢代谢途径进行了整理与分析。
3结果与分析
31转录组测序结果本研究以艾纳香长势良好的成熟叶片为材料进行了转录组测序。对原始数据进行除杂之后,共获得98 341 536个reads片段,包含了8 477 385 401個核苷酸序列信息;将质控后得到的高质量序列进行de novo拼接,得到了100 341个Unigene片段。Unigene和COG数据库进行比对表明,艾纳香叶片转录组中的Unigene根据功能可以大致分为25类;根据GO功能大致可分为生物过程、细胞组分和分子功能3大类43分支;利用KEGG数据库作为参考,依据代谢通路可以将转录组中的数据分成111类,包括生化代谢通路、植物病原体互作、DNA剪切、植物激素生物合成、苯丙氨酸生物合成、萜类化合物与类固醇类化合物合成、脂类代谢、RNA降解等。
32代谢途径与涉及基因转录组数据比对结果显示,在KEGG数据库中比对分析之后,艾纳香中与萜类相关的代谢通路有4条,分别是:萜类骨架代谢途径,编号为Ko00900,艾纳香转录组中与之相关的基因有103条;单萜代谢途径,编号为Ko00902,艾纳香转录组中与之相关的基因有10条;二萜代谢途径,编号为Ko00904,艾纳香转录组中与之相关的基因有29条;倍半萜与三萜代谢途径,编号为Ko00909,艾纳香转录组中与之相关的基因有59条。艾纳香中主要的酶与酶的功能、酶所涉及基因数目见表1。
官玲亮等:艾纳香萜类物质生物合成途径分析表1艾纳香萜类代谢途径的酶与相关基因
Table 1Metabolic pathway of terpenoids and genes in Blumea balsamifera
代谢途径途径编号总基因数量主要酶与酶编号酶涉及基因数目酶的功能萜类骨架生物合成Ko00900103乙酰CoA转乙酰基酶(K00626)6催化乙酰基转移,介导乙酰CoA与乙酰乙酰CoA的互变HMGCoA合酶(K01641)4催化三分子乙酰CoA聚合生成HMGCoAHMGCoA还原酶(K00021)7以NADPH为辅酶,催化HMGCoA发生加氢还原反应甲羟戊酸激酶(K00869)2催化甲羟戊酸磷酸化磷酸甲羟戊酸激酶(K00938)3催化磷酸甲羟戊酸磷酸化,形成焦磷酸甲羟戊酸异戊二烯焦磷酸异构酶(K01823)2催化IPP与DMAPP转化互变焦磷酸甲羟戊酸脱羧酶(K01597)1催化焦磷酸甲羟戊酸脱羧生成IPP1脱氧木酮糖5磷酸合酶(K01662)25催化3磷酸甘油醛与丙酮酸合成1脱氧木酮糖5磷酸1脱氧木酮糖5磷酸还原酶(K00099)3催化氢化还原反应磷酸胞苷转移酶(K00991)2催化胞苷转移形成糖苷磷酸胞苷二甲基赤藓醇激酶(K00919)1催化底物磷酸化2甲基D赤藓醇2,4环磷酸合酶(K01770)1催化2甲基D赤藓醇2,4环磷酸合成4羟基3甲基2己烯焦磷酸合酶(K03526)1催化底物焦磷酸化4羟基3甲基2己烯焦磷酸还原酶(K03527)4催化底物氢化还原异戊二烯合酶(K12742)5催化异戊二烯合成法尼烯焦磷酸合酶(FDPS)(K00787)5催化法尼烯焦磷酸合成香叶基香叶基焦磷酸合酶(GGPS)(K13789)4催化香叶基香叶基焦磷酸合成香叶基焦磷酸合酶(GPS/GPPS)1催化香叶基焦磷酸合成单萜代谢Ko0090210(3S)芳樟醇合酶(K15086)4催化芳樟醇合成新薄荷醇脱氢酶(K15095)6催化脱氢氧化反应二萜代谢Ko0090429柯巴基焦磷酸合酶(K04120)4催化合成柯巴基焦磷酸对映贝壳杉烯合酶(K04121)1催化贝壳杉烯合成贝壳杉烯酸羟化酶(K04123)1合成赤霉素类物质的基本结构,赤霉素是重要的二萜类激素三萜倍半萜Ko0090959法尼酰二磷酸酯法尼酰基转移酶(K00801)5催化原角鲨烯二磷酸合成鲨烯单加氧酶(K00511)12催化合成环氧角鲨烯,其为各种三萜、倍半萜类化合物的前体物质
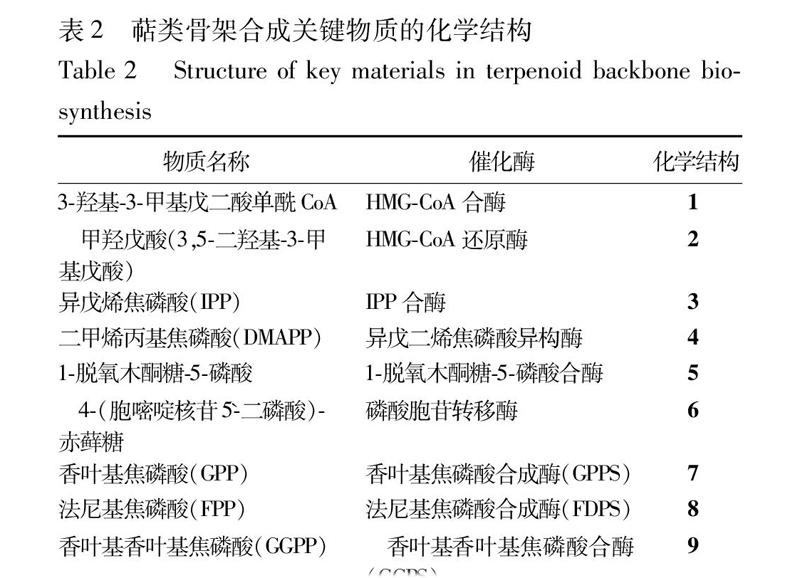
33萜类骨架代谢途径分析基于前人对大量植物萜类物质生物合成途径的研究,发现萜类物质基本骨架的生物合成途径都是大体相似的。在植物体中,异戊烯焦磷酸(IPP)与二甲烯丙基焦磷酸(DMAPP)的生物合成途径被称为萜类物质的骨架合成途径。在高等植物不同物种中,萜类物质总骨架的生物合成途径大体相似,都可以从2条途径合成IPP与DMAPP,分别是甲羟戊酸途径与脱氧木酮糖5磷酸途径[13]。脱氧木酮糖5磷酸途径研究得相对比较少,该途径是在植物的质体(叶绿体、有色质体、白质体)内发生的,以丙酮酸和磷酸甘油醛原料,在转酮酶的催化作用下聚合生成脱氧木酮糖5磷酸。IPP在异戊二烯焦磷酸异构酶的催化下转化为二甲烯丙基焦磷酸(DMAPP)。在甲羟戊酸途径与脱氧木酮糖5磷酸途径中,IPP与DMAPP一起都被称为“活性异戊二烯”,是萜类合成真正的前体[14]。香叶基焦磷酸合成酶(GPPS)催化1分子IPP和1分子DMAPP合成香叶基焦磷酸(GPP),香叶基焦磷酸又被称为牻牛儿基焦磷酸。GPP与单萜的生物合成密切相关,芳樟醇合酶催化GPP生成芳樟醇,在芳樟醇的基础上合成一系列单萜化合物。法尼基焦磷酸合酶(FDPS)催化GPP生成法尼基焦磷酸(FPP),FPP又在香叶基香叶基焦磷酸合酶(GGPS)的催化下合成了香叶基香叶基焦磷酸(GGPP)。萜类骨架合成途径见图1。
34单萜生物合成途径分析单萜(monoterpenoids)是指由二分子异戊二烯聚合而成的萜类化合物及其含氧衍生物。单萜按分子的基本碳骨架可分为:无环单萜、单环单萜、双环单萜及三环单萜4大类[15]。本次分析显示在艾纳香中与单萜合成相关的基因最少,仅有10条基因在KEGG数据库中比对上。单萜类物质是萜类家族中结构相对简单的物质,单萜类物质一般的特点是分子量较小、种类较多。因此导致催化单萜类物质合成的酶在催化活性上的专一性较低,其专一性不如其他催化结构复杂的高级萜类合成的酶高。单萜合酶在不同的植物种类中催化合成的单萜类物质种类差别较大,这也体现了单萜类物质在不同植物中的个性差异。因此,艾纳香中单萜合酶基因种类少,并不意味着就是单萜物质种类或含量少。庞玉新等[13]分析了艾纳香中包含的物质种类,通过化学分析证明艾纳香中含有21种单萜类物质,其中包括了左旋龙脑(L龙脑)、异龙脑、柠烯外消旋体、蒎烯等物质。艾纳香中主要的单萜类物质见图3。
35二萜生物合成途径分析二萜(diterpenoid)是含有4个異戊二烯单位的萜类化合物[15]。香叶基香叶基焦磷酸合酶(GGPS)催化法尼基焦磷酸合成的香叶基香叶基焦磷酸(GGPP)与二萜的生物合成关系密切,合成的二萜类化合物主要是赤霉素(GA),GA是高等植物体内广泛存在的植物激素,化学结构属于二萜类酸,是植物体内极为重要的一大类二萜化合物。二萜的合成途径见图4。
其中,赤霉素(GA)是一大类物质,已经发现的赤霉素有38种,相互之间具有同样的基本结构,仅仅是局部化学基团的修饰造成彼此的差异。以赤霉素A12的结构作为代表。
36三萜、倍半萜生物合成途径分析三萜(triterpenoid)由30个碳原子构成基本碳架,大多数可看作是由6个异戊二烯单体联结而成;倍半萜(sesquiterpenes)是指分子中含15个碳原子的天然萜类化合物[1516]。法尼基焦磷酸(FPP)与三萜、倍半萜生物合成密切相关,FPP在法尼酰二磷酸酯法尼酰基转移酶的催化下合成原角鲨烯二磷酸、鲨烯,鲨烯又在鲨烯单加氧酶的催化下合成环氧角鲨烯,鲨烯和环氧角鲨烯能够转化为各种三萜、倍半萜类化合物,合成途径见图5。
37艾纳香萜类合成途径中的关键酶分析由于萜类结构各异种类复杂,所以萜类合成相关的酶数量繁多。但是在萜类合成相关的众多酶当中,前人对萜类骨架合成的酶研究得相对透彻。萜类骨架合成途径有甲羟戊酸途径脱氧木酮糖5磷酸途径,目前科研工作者对催化甲羟戊酸途径发生的酶研究得相对深入,而对催化木酮糖5磷酸途径发生的酶却知之甚少[17]。
在脱氧木酮糖5磷酸途径中,脱氧木酮糖5磷酸合酶是研究得相对较多的酶,它以维生素B1作为辅酶,催化丙酮酸与3磷酸甘油醛缩合形成脱氧木酮糖5磷酸,它也是在植物萜类合成途径中相对重要的一个酶。在甲羟戊酸途径中,甲羟戊酸是在HMGCoA还原酶的催化下合成的,热力学分析表明甲羟戊酸生成的过程是一个不可逆的过程,所以HMGCoA还原酶是萜类合成的限速酶[17],是萜类合成重要的调控位点。HMGCoA还原酶是一个基因家族,在植物体中多拷贝。
烯丙基转移酶系也是萜类合成途径中的关键酶。烯丙基转移酶系是由基因超家族编码合成的酶,其中包括香叶基焦磷酸合成酶(GPPS)、法尼基焦磷酸合成酶(FDPS)、香叶基香叶基焦磷酸合酶(GGPS)。GGPS是二萜合成途径的重要控制位点,而GPPS是仅次于HMGCoA还原酶的第二个限速酶。
4结论与讨论
本研究是基于艾纳香的转录组数据,将艾纳香的转录组测序结果同KEGG数据库中科研工作者对其他多种高等植物萜类合成途径研究得出的所有结论进行比对,从很大程度上能够预测出艾纳香中萜类代谢的具体途径。从基因比对上的条数可以推测艾纳香中单萜类物质的合成可能相对较少(比对上的基因条数最少仅有10条),而二萜、三萜、倍半萜的合成相对丰富。
由于单萜类物质种类的复杂性,导致催化单萜类物质合成的酶在催化活性上的专一性较低,其专一性不如其他催化结构复杂的高级萜类合成的酶高。单萜合酶在不同的植物种类中催化合成的单萜类物质种类差别较大,这也体现了单萜类物质在不同植物中的个性差异。被子植物单萜合酶基因系统发育和谱系分化与植物的自然分类系统有较紧密联系,与其功能即催化产物种类没有必然联系。相同物种来源的单萜合酶基因间的相似性远远高于不同物种来源而具有相同功能的单萜合酶基因,尽管前者催化产物不同。前期研究工作表明,同科属植物的单萜合酶通常被聚为一类,如唇型科Lamiaceae紫苏属、薄荷属和鼠尾草属等都聚为一类。因此,单萜合酶基因进化频率较高,基于序列相似性仅可粗略推测该基因是否属于单萜合酶,却不能准确预测其产物。根据前人对艾纳香活性成分的研究,可以确定左旋龙脑(L龙脑)是艾纳香中的主要活性成分,对L龙脑的波谱分析显示L龙脑是双环单萜类化合物。本研究中,检测到单萜合酶基因10条,可能与L龙脑的合成有关。目前本课题组正在对艾纳香单萜合酶基因的功能进行进一步的验证。
本研究结果表明艾纳香中萜类骨架生物合成的途径与其他物种中的合成途径大体相似,在艾纳香中也预测到甲羟戊酸途径与木酮糖5磷酸途径。根据其他多种植物目前的研究成果推测,艾纳香萜类骨架生物合成途径中的限速酶很可能也是HMGCoA还原酶与香叶基焦磷酸合酶(GPPS),GPPS属于烯丙基转移酶超家族的成员,其中还包括了法尼基焦磷酸合酶(FDPS)和香叶基香叶基焦磷酸合酶(GGPS),FDPS是与三萜倍半萜合成密切相关的酶,GGPS是与二萜合成密切相关的酶。从分子生物学的角度,HMGCoA还原酶,GPPS,FDPS,GGPS可以成为分子调控的重要靶点,有望从分子水平提高艾纳香中萜类活性物质的生物合成产量,从而提高艾纳香的药用价值。
[参考文献]
[1]袁媛,庞玉新,王文全,等. 艾纳香属系统分类研究进展[J]. 热带农业科学,2011,31(3):81.
[2]官玲亮,庞玉新,王丹,等. 中国民族特色药材艾纳香研究进展[J]. 植物遗传资源学报,2012,13(4):695.
[3]庞玉新,谢小丽,陈振夏,等. 艾纳香本草考证[J]. 贵州农业科学,2014,42(6):10.
[4]梁会,曹佩雪,邱净英,等. 艾纳香化学成分的研究[J]. 时珍国医国药,2011,22(2):308.
[5]黃永林,朱廷春,文永新,等. 艾纳香化学成分的分离与鉴定[J]. 广西植物,2010, 30(4): 560.
[6]韩军丽,李振秋,刘本叶,等. 植物萜类代谢工程[J]. 生物工程学报,2007(4):561.
[7]李为,余龙江,朱敏,等. 紫杉醇生物合成代谢调节方法的研究[J]. 华中理工大学学报,2000(7):107.
[8]张广晶,杨莹莹,徐雅娟,等. 中药萜类成分提取方法研究[J]. 长春中医药大学学报,2014(2):221.
[9]王斌,姜登钊,李国强,等. 柽柳抗肿瘤萜类成分研究[J]. 中草药, 2009, 40(5):697.
[10]陈国强,陈华. 山楂中三萜类有效成份的提取[J]. 黑龙江医药,2009, 22(5):656.
[11]郝小燕,余珍,丁智慧. 黔产艾纳香挥发油化学成分研究[J]. 贵阳医学院学报,2000,25(2):121.
[12]田徽. 艾片与合成冰片脑保护及其对血脑屏障影响机制的研究[D]. 成都:成都中医药大学,2013.
[13]Pang Yuxin, Wang Dan, Yu Fulai. Blumea balsamifera—a phytochemical and pharmacological review[J]. Molecules,2014(19): 9453.
[14]黄瑛,曾庆平. 萜类生物合成的基因操作[J]. 中国生物工程杂志,2006(1):221.
[15]吴勇. 萜烯类化合物与茶叶香气[J]. 化学工程与装备,2009(11):182.
[16]沈芊,许先栋,顾慧儿. 茯苓三萜成分及其衍生物的构效关系研究[J]. 中国药物化学杂志,1999, 9(4):87.
[17]罗永明,黄璐琦,刘爱华,等. 植物萜类化合物的生物合成途径及其关键酶的研究进展[J]. 江西中医学院学报,2003,15(2):45.
[责任编辑吕冬梅]

