不同真空干燥温度对海南番木瓜粉香气成分SPME/GC—MS分析的影响
杨保刚 潘永贵 陈文学 钟秋平 张伟敏 黄午阳
摘 要 运用顶空固相微萃取结合气质联用技术对不同温度下真空干燥制得的番木瓜粉中香气成分进行分析。结果表明:共确定了121种挥发性成分,主要包括醇、酸、酮、酯、醛、烃等化合物。芳樟醇相对含量在室温(25 ℃)干燥时最高,为14.382%,但在真空热干燥条件(大于室温,50~100 ℃)下未检出;乙酸的相对含量会随着干燥温度的升高而升高;大部分酮类物质在25 ℃和60 ℃干燥时相对含量最高;在25 ℃下干燥的产品中异硫氰酸苄酯的相对含量高达34.617%,但在真空热干燥条件下均未检出;真空热干燥会使一些具有不良气味的醛类如糠醛、5-羟甲基糠醛的相对含量升高。
关键词 番木瓜粉;真空干燥;固相微萃取;香气成分
中图分类号 Q949.759.6 文献标识码 A
番木瓜(Carica papaya Linn.)为番木瓜属番木瓜科(Caricaceae)植物的果实,原产于热带和亚热带的美洲和非洲[1-2]。目前,番木瓜是世界上产量增幅最大的热带水果,年增长率达4%,已成为第四大热带、亚热带畅销水果,被列为香蕉枯萎病产区的香蕉替代产业[3]。据FAO统计,全球番木瓜年产量超1 000万t[4],2011年海南番木瓜种植面积为4 960 km2,产量达11.67万t,且在逐年增长[5]。
Eksotika品种番木瓜因其具有产量高、味清甜、口感好、品质优和适应性较强等特点而成为了当前海南的主栽品种之一,果实呈圆柱形,大而长,单果可重达1.5~2.0 kg,果肉为红橙色,细嫩汁多,清甜可口。但由于皮薄、肉厚和汁多,导致该品种熟果保存期短,易腐烂、不耐贮藏和不便于长途运输,而作为水果鲜食的消耗量较小,常导致大量番木瓜积压和腐烂,造成了严重浪费,从而给果农造成了严重的经济损失,因此研究如何保持Eksotika品种番木瓜品质、延长其贮存期对其种植与发展具有重大意义[6-7]。
干燥是现代食品工业中最常用和最重要的加工操作单元之一,其可通过降低食品中的水分含量,阻碍食品内部微生物的生长及减少以水为介质的化学反应的发生,从而延长食品货架期和降低货运成本[1]。将番木瓜干燥成番木瓜粉是当前番木瓜深加工利用的主要途径之一,然而不同干燥方式对番木瓜主要营养成分、色泽、风味等的影响也不同[2,8]。番木瓜在干燥过程中,不仅会导致其营养品质下降,特别是会引起番木瓜在加热条件下产生让人不愉快的异味[3],从而影响番木瓜粉的品质。挥发性香气成分是决定番木瓜粉品质和大众接受度的重要因素之一,已有研究结果表明,番木瓜粉中挥发性香气成分主要包括萜类化合物、醛类、酯类、酸类、酮类和醇类化合物,不同加工方式其所含的风味成分均有所差异[5,9]。
目前,仅有孔祥琪等[10]采用HS-SPME/GC-MS技术分析了热处理前后对海南“solo”番木瓜汁挥发性香气成分的影响,但尚无文献针对真空干燥处理对番木瓜香气成分变化影响进行研究的报道。同时,众多研究结果表明,固相微萃取技术、气相色谱-质谱联用仪(GC-MS)已广泛用于分析挥发性和半挥发性风味成分组成[11],对研究干燥过程中香气成分形成和变化机理亦非常有用。鉴于此,本研究利用固相微萃取结合气相色谱质谱联用技术,采取逐步提高对番木瓜粉真空干燥的温度,对比分析挥发性香气成分的变化,了解不同真空干燥温度对番木瓜粉挥发性香气成分的影响程度,以此确定最佳真空干燥温度的同时,为真空干燥对番木瓜香气成分影响机理的研究提供理论基础与依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 番木瓜(Eksotika品种),产于海南,样品去皮去籽后用切片机横切成厚度为8 mm的扇形片状,采用25、50、60、80、100 ℃真空干燥的方法制成番木瓜干片,然后用中药材粉碎机进行粉碎打粉,再将番木瓜粉过80目标准筛,分装好置于干燥器中备用。
1.1.2 仪器与设备 真空干燥箱(SHELLAB 1445-2),分析天平(DENVER INSTRUMENT),中药材粉碎机(江阴万达药机DG160C型),气相色谱-质谱联用仪(Agilent 7890N-5975C),手动固相微萃取装置(美国Supelco公司),萃取纤维头为2 cm~50/30 μm DVB/CAR/PDMS StableFlex。
1.2 方法
1.2.1 样品处理 取样品约2.0 g,置于顶空瓶中,在80 ℃下平衡30 min,插入萃取头的探针,平衡20 min后进样,解析时间3 min[9]。
1.2.2 GC-MS操作条件 色谱条件:色谱柱为ZB-5MSI(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,载气为高纯He(99.999%),汽化室温度为250 ℃,不分流进样,溶剂延迟时间为1.5 min。
升温程序:45 ℃保留2 min,以4 ℃/min升温至220 ℃,保持2 min;載气流量为1.0 mL/min。
质谱条件:离子源为EI源,电子能量为70 eV,离子源温度为230 ℃,四极杆温度为160 ℃,接口温度为280 ℃,采集模式为scan,质量范围为20~450 amu。
1.3 数据处理与分析
挥发性成分通过系统自带NIST标准谱库,选择匹配度最高的物质进行定性。挥发性物质的相对含量用峰面积归一法计算。
2 结果与分析
2.1 不同真空干燥温度对番木瓜粉香气成分种类的影响
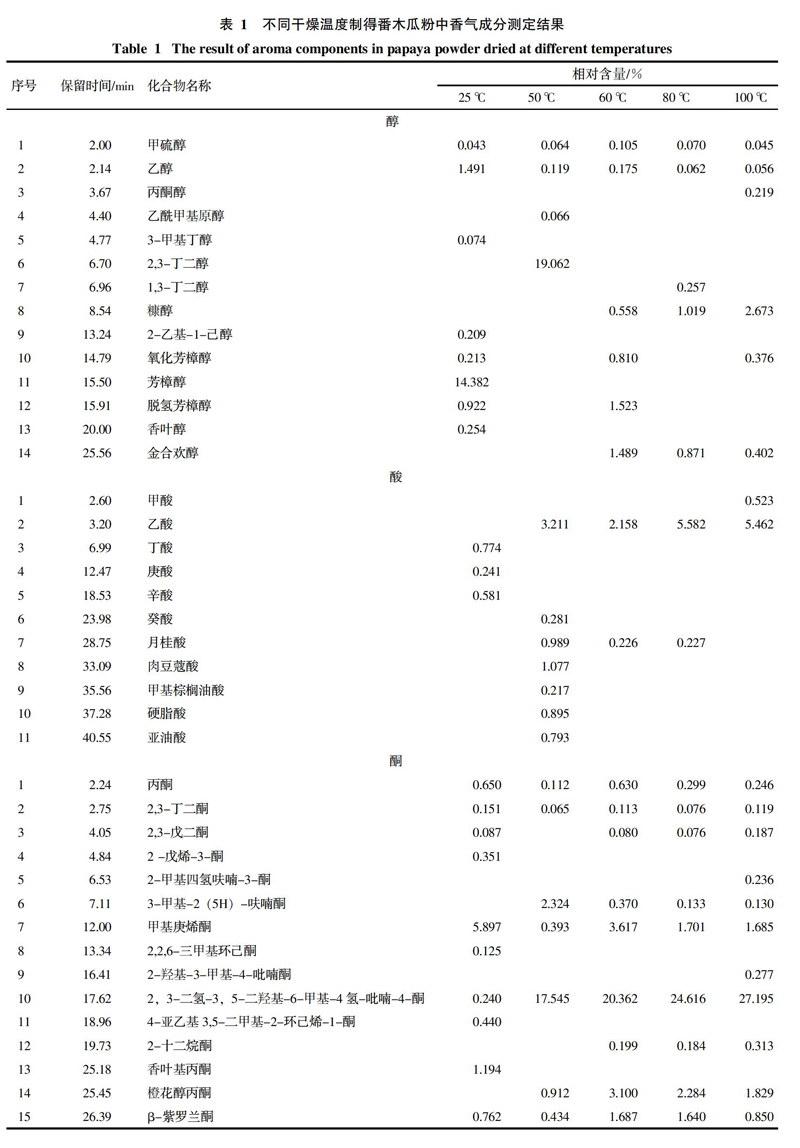
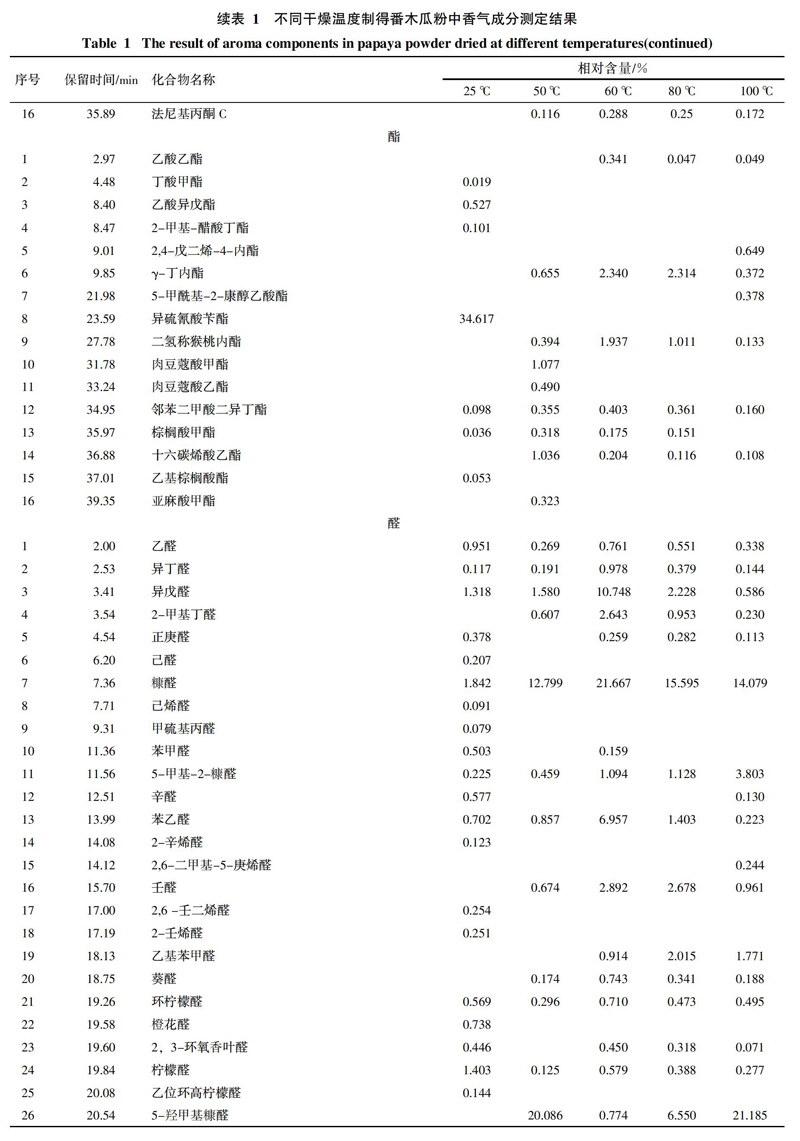
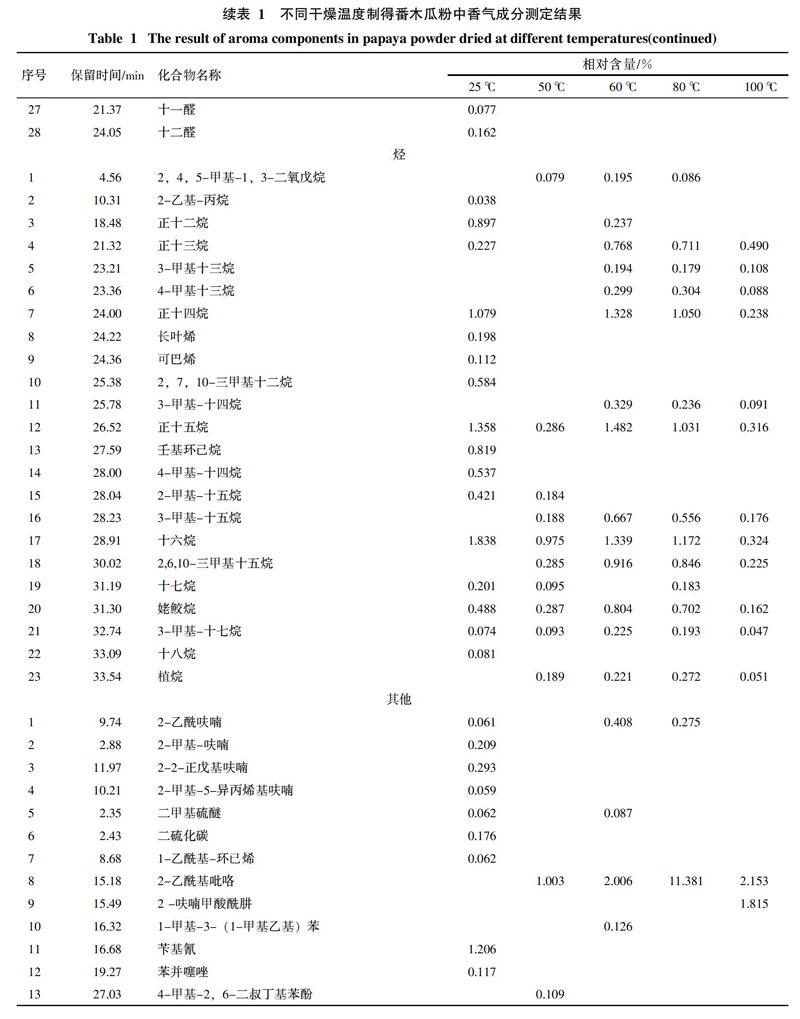
通过对番木瓜粉中挥发性成分的分析,对总离子流图中的各峰经计算机数据系统检索及核对Nist2008标准质谱库,共确定了121种香气成分,结果见表1,各类挥发性成分数量变化趋势见图1。番木瓜粉中共检出醇类化合物14种,酸类化合物11种,酮类化合物16种,酯类化合物16种,醛类化合物28种,烃类化合物23种,其它化合物13种。
25 ℃条件下干燥制得的番木瓜粉中检出化合物种类最多,共有75种;50、60、80、100 ℃真空干燥条件下制得的番木瓜粉中分别检出了50种、58种、54种、58种香气成分。由表1和图1可知,随着干燥温度的升高,番木瓜粉中香气成分的相对含量和种类都会发生变化,部分化合物相对含量会随着干燥温度的升高而降低甚至消失,另一些化合物的变化趋势则相反,还有些化合物的相对含量随着温度的升高呈现先升高后降低的趋势,并且一些新化合物会被检出。
2.2 不同真空干燥温度对番木瓜粉中各类挥发性成分的影响
在25 ℃条件下干燥的产品中检出的醇类物质种类最多,共检出8种。其中带有玫瑰木香气的芳樟醇相对含量最高,达14.382%。但芳樟醇在真空热干燥的产品中未检出。50 ℃真空干燥条件下2,3-丁二醇的含量达19.062%,但在其它干燥条件下均未检出。干燥温度高于60 ℃后产品可检出糠醇,其含量随干燥温度的升高逐渐升高,干燥温度为100 ℃时,康醇含量达2.673%。具有铃兰花香气的金合欢醇在60 ℃干燥条件下相对含量达到最高,为1.489%,之后呈下降趋势。
25 ℃干燥条件下制得的番木瓜粉中主要检测出了具有刺激性气味的丁酸、庚酸、辛酸等低级酸,但相对含量较低,结果见表1。在50 ℃真空干燥条件下制得的番木瓜粉中检测到的酸类物质种类最多,达7种,主要包括月桂酸、肉豆蔻酸、硬脂酸、亚油酸等,其中月桂酸具有月桂油香味。而当干燥温度达60 ℃以上时,大部分酸类物质都会损失殆尽。但乙酸的相对含量会随着干燥温度的升高而升高,在干燥温度为80 ℃时相对含量最高,为5.982%。
酮类物质通常具有各种独特香气,如香叶基丙酮具有清淡的花香,甲基庚烯酮具有柠檬草和乙酸异丁酯般的香气。番木瓜粉中酮类物质随干燥温度的变化趋势比较复杂。2,3-二氢-3,5-二羟基-6-甲基-4氢-吡喃-4-酮在25 ℃条件下干燥的产品中相对含量只有0.240%,但随着干燥温度的升高,其相对含量急剧升高,干燥温度为100 ℃时相对含量达到最高值27.195%。3-甲基-2(5H)-呋喃酮在干燥温度为50 ℃时含量最高,达到了2.324%。其它大多数酮类物质的相对含量在25 ℃和60 ℃干燥条件下最高,其他干燥温度下相对含量均会降低。
酯类物质通常具有特殊的香气。番木瓜粉中多数酯类(如γ-丁内酯、二氢称猴桃内酯、乙酸乙酯等)的相对含量随干燥温度的升高呈现先升高后降低的趋势。异硫氰酸苄酯具有典型的番木瓜香气,是番木瓜特征香气的重要组成部分[12],在25 ℃条件下干燥的产品中异硫氰酸苄酯的相对含量高达34.617%,但在真空热干燥番木瓜粉中均未检出。丁酸甲酯、乙酸异戊酯、2-甲基-醋酸丁酯只在25 ℃条件下干燥的番木瓜粉中被检出。
番木瓜粉中醛类物质种类众多,对番木瓜粉香气的构成具有重要的作用。例如苯乙醛具有风信子的香气,异戊醛具有苹果气味,他们的相对含量随温度的升高呈现先升高后降低的趋势,在60 ℃干燥时含量最高,分别达到了6.957%和10.748%。柠檬醛具有浓郁的柠檬香味,在25 ℃和60 ℃干燥时,相对含量较高,分别为1.403%和0.579%。同时真空热干燥会使一些具有不良气味的醛类相对含量升高。如糠醛有苦杏仁的味道,其相对含量会随着干燥温度的升高而升高,在60 ℃时达到最大值21.667%,继续升高干燥温度则开始下降。5-羟甲基糠醛具有菊花的气味,其相对含量在50 ℃和100 ℃干燥时含量极高,分别达到了20.086%和21.185%,而在其他干燥温度下相对含量较低。
番木瓜粉中烃类物质种类较为丰富,大部分烃类的碳链长度均在10~20个碳之间。番木瓜粉中的烃类物质在25 ℃条件下干燥时含量较高,当干燥温度为50 ℃时,相对含量均会大幅度降低甚至不能检出。而当干燥温度升至60 ℃时,相对含量又会上升,继续升高干燥温度,烃类的相对含量再度开始下降。
番木瓜粉中还含有其他一些化合物,这些化合物具有各自特有的气味,是番木瓜粉香气的重要组成部分。例如苄基氰具有芳香气味,在25 ℃条件下干燥的产品中相对含量达1.206%。2-戊基呋喃具有豆香、果香的香韵,在25 ℃干燥产品中相对含量达0.293%。2-乙酰基吡咯具有核桃、甘草、烤面包、炒榛子的香气,他的相对含量随着干燥温度的升高而升高,在干燥温度为80 ℃时达到最高值11.381%,继续提高干燥温度则会降低。
3 讨论与结论
本研究结果表明,番木瓜粉中挥发性成分主要以醛类、酮类、酯类、不饱和烃类和醇类为主。在25 ℃下干燥制得的番木瓜粉中,芳樟醇、甲基庚烯酮、异硫氰酸苄酯的相对含量最高,结果同皋香等[13]和孔祥琪等[10]测定的新鲜番木瓜香气成分基本吻合。番木瓜粉中挥发性成分的相对含量随着干燥温度的上升呈现多种不同变化趋势,表明干燥过程中原料会发生复杂的化学反应。小分子香气成分的相对含量随干燥温度的上升呈下降趋势;部分香气成分在真空热干燥过程中会消失,这可能是由于这些物质沸点较低或热稳定性较差,在真空热干燥过程中随真空泵抽走或分解为其它物质[14-15]。另一些香气成分随着干燥温度的上升呈上升趋势,还有一些物质随着干燥温度的升高呈先升高后降低的趋势,可能是由于在特定温度下生成该物质的累积速度大于消耗速度所致,而随着干燥温度的升高,化学反应可能向着更复杂的方向发展,且高温下低沸点物质更容易挥发,导致部分化合物含量开始下降。
在干燥过程中可能發生的化学反应包括但不限于以下2类[16]。首先,干燥过程中可能发生美拉德反应。美拉德反应(Maillard reaction)是一种非酶褐变,广泛存在于食品加工和贮藏等环节中,主要是指具有羰基的物质(如还原糖、脂质、醛、酮)和具有氨基的物质(如胺、氨基酸及蛋白质)之间经过复杂反应历程最终生成棕色甚至是黑色大分子物质的过程。该反应初期阶段氨基酸与还原糖在加热的条件下缩合生成席夫碱,再经环化生成糖基胺,该物质通过葡糖胺重排形成1-氨基-1-脱氧-2-酮糖;第二阶段葡糖胺重排化合物在酸性条件下经烯醇化反应生成羟甲基糠醛,而在碱性条件下则产生还原酮类和脱氢还原酮类,产物可以继续分解为乙酸、丙酮醛、丁二酮等,另外还可通过Strecker分解反应生成还原酮、糠醛和不饱和羰基化合物等部分香气物质。第二阶段的产物与氨基化合物反应除生成类黑精外,还生成大量杂环类化合物,如吡嗪、吡啶、吡咯、糠醛、呋喃酮等,它们使番木瓜粉产生了新的气味[17-18]。番木瓜在不同温度下干燥过程中所发生的具体反应途径和所得产物有待进一步研究。
其次,番木瓜粉香气成分的变化可能由脂肪氧合酶(LOX)途径引起[19]。LOX是一类广泛存在于动植物中的酶,可催化含有顺, 顺-1、4-戊二烯结构的多不饱和脂肪酸的加氧反应,生成氢过氧化物[20-21]。脂肪酸氢过氧化物又可继续被氢过氧化物裂解酶(Hydroperoxide lyase,HPL)分解,产生具有独特气味的低级醛类和酸类,根据LOX和HPL的特异性不同生成的产物也不同[22]。番木瓜中LOX的特性及其对干燥过程中番木瓜的香气成分有何影响仍需进一步研究。
本研究首次采用SPME/GC-MS技术对不同干燥温度下番木瓜粉产品中挥发性成分进行了测定。结果表明,25 ℃干燥条件下番木瓜粉的香气成分种类最多,在真空热干燥的工艺条件下,干燥温度为60 ℃时,产品香气成分保留种类最多,产品香气自然,具有不愉快气味的物质相对含量较低。因此建议60 ℃为真空热干燥的最佳温度。本研究的实验结果提示了番木瓜粉香气成分的组成结构及主要香气成分随真空干燥温度的变化规律,为进一步研究番木瓜在真空热干燥生产过程中呈香物质的变化机理及干燥工艺流程的优化和参数控制提供了依据。
参考文献
[1] 唐秋实, 刘学铭, 池建伟,等. 不同干燥工艺对杏鲍菇品质和挥发性风味成分的影响[J]. 食品科学, 2016, 37(4): 25-30.
[2] Chong C H, Law C L, Figiel A, et al. Colour, phenolic content and antioxidant capacity of some fruits dehydrated by a combination of different methods[J]. Food Chemistry, 2013, 141(4): 3 889-3 896.
[3] Rawson A, Hossain M B, Patras A, et al. Effect of boiling and roasting on the polyacetylene and polyphenol content of fennel(Foeniculum vulgare)bulb[J]. Food Research International, 2013, 50(2): 513-518.
[4] Food and Agriculture Organization of The United Nations-FAO. FAOSTAT Agriculture[EB/OL]. FAO, 2008, http://faostat.fao.org/site/567/default.aspx.
[5] Chan Jr H T, Flath R A, Forrey R R, et al. Development of off-odors and off-flavors in papaya puree[J]. J Ag Food Chem,1973, 21(4): 566-570.
[6] 楊培生, 钟思现, 杜中军,等. 我国番木瓜产业发展现状和主要问题[J]. 中国热带农业, 2007, 4(4): 8-9.
[7] 刘学文, 王圣俊. 海南番木瓜产业发展的优势及政策建议-兼谈世界番木瓜产业[J]. 农业现代化研究, 2013, 34(4): 451-455.
[8] Almora K, Pino J A, Hernández M, et al. Evaluation of volatiles from ripening papaya(Caricapapaya L., var. Maradol roja)[J]. Food Chemistry, 2004, 86(1): 127-130.
[9] 汤慧民, 熊 华, 熊小青,等. 干燥工艺对苦瓜粉品质的影响[J]. 食品与发酵工业, 2005, 31(4): 90-92.
[10] 孔祥琪, 施瑞城, 张彦军, 等. HS-SPME/GC-MS技术分析热处理前后番木瓜汁挥发性香气[EB/OL]. 食品与发酵工业, http://www.cnki.net/kcms/detail/11.1802.TS.20151211.1131.024.html.
[11] Rega B, Fournier N, Guichard E. Solid phase microextraction(SPME)of orange juice flavor: odor representativeness by direct gas chromatography olfactometry(D-GC-O)[J]. J Agric Food Chem, 2003, 51(24): 7 092-7 099.
[12] Pino J A. Odour-active compounds in papaya fruit cv. Red Maradol[J]. Food Chemistry, 2014, 146(1): 120-126.
[13] 皋 香, 施瑞诚, 谷风林, 等. 固相微萃取结合气相色谱-质谱测定海南番木瓜香气成分[J]. 食品工业科技, 2013, 34(14): 148-155.
[14] 刘 璇, 赖必辉, 毕金峰,等. 不同干燥方式芒果脆片香气成分分析[J]. 食品科学, 2013, 34(22): 179-184.
[15] 吴 迪, 谷 镇, 周 帅,等. 不同干燥技术对香菇和杏鲍菇风味成分的影响[J]. 食品工业科技, 2013, 34(22): 188-191.
[16] 李宝玉, 杨 君, 尹凯丹,等. 应用SPME-GC-MS分析变温压差膨化干燥香蕉脆片香气成分[J]. 食品科学, 2014, 35(14):184-188.
[17] Yu X. Antioxidants in volatile Maillard reaction products:Identification and interaction[J]. LWT-Food Science and Technology, 2013, 53(1): 22-28.
[18] Owen R F. 食品化学[M]//王 璋, 许时英, 江 波, 等. 译(3版). 北京: 中国轻工业出版社, 2003: 632.
[19] 汪晓鸣, 陆兆新. 脂肪氧合酶在农产食品中应用的研究进展[J]. 核农学报, 2013, 27(10): 1 547-1 552.
[20] Cumbee B, Hildebrand D F, Addo K. Soybean .flour lipoxygenase isozymes effects on wheat flour dough bread making properties[J]. J Food Sci, 2006, 2(62): 281-283.
[21] Tappel A C, Boyer P D, Lundberg W O. The reaction mechanism of soybean lipoxidase[J], J Biol Chem, 1952, 199(2): 267-281.
[22] Noordermeer M A, Dijken A J H V, Smeekens S C M, et al. Charancterization of three cloned and expressed 13-hydroperoxde lyaseisoenzymes form alfalfa with unusual N-terminal sequences and different enzyme kinetics[J]. FEBS Lett, 2000, 267(12): 2 473-2 482.

