香蕉β—淀粉酶基因家族的系统进化分析
董晨 李伟才 魏永赞 王弋 郑雪文 胡会刚
摘 要 β-淀粉酶(beta-amylase,Bmy)是一类关键的淀粉水解酶,在香蕉果实成熟淀粉降解转化为可溶性糖的过程中发挥着重要的作用。为了全面了解Bmy基因在香蕉基因组中的特征,研究基于香蕉基因组数据,通过生物信息学的方法对香蕉Bmy基本理化性质、二级结构预测、亚细胞定位、内含子和外显子结构和保守结构域进行初步的预测与分析,并构建系统发育树。结果表明:编码香蕉β-淀粉酶的基因有15个,根据在染色体的位置命名为MaBmy1~15,MaBmy基因家族编码的氨基酸范围在68~1 453 aa,编码的蛋白相对分子量介于7.8~162.6 ku之间,15个MaBmy蛋白中有10个偏酸性,5个偏碱性。不稳定指数分析发现6个MaBmy蛋白为稳定蛋白;疏水性分析表明,所有的MaBmy蛋白为亲水性蛋白;香蕉MaBmy家族内含子最少含有2个,最多的含有10个;进化分析表明,MaBmy家族分4个亚家族,且与水稻的亲缘关系较近。研究结果为深入探讨MaBmy基因的功能及调控香蕉果实成熟的应用奠定基础。
关键词 香蕉;β-淀粉酶;基因家族;系统进化分析
中图分类号 S668.1 文献标识码 A
Bmy(EC3.2.1.2)是一种外切酶,作用于α-1,4-线性糖苷链的非还原末端,逐次以麦芽糖为单位切断α-1,4-葡聚糖链,从而产生麦芽糖和有限糊精[1]。Bmy属于糖苷水解酶家族14,含有一个保守结构域Glyco_hydro_14结构域(PF01373)。这个保守结构域含有2个高度保守的区域,分别位于N端以及另外一个相对中心的位置[2]。研究证明,Bmy在许多植物中表现为多基因家族。例如,拟南芥基因组中可能含有9个Bmy基因(AtBmy1~9)[3]。水稻有10个,玉米13个,二穗短柄草11个,高粱和谷子各10个Bmy基因[4]。其中,AtBmy1~AtBmy4为叶绿体质类型,在淀粉降解中发挥不同的作用;AtBmy3是夜间叶片淀粉降解主要的催化基因;而AtBmy4对AtBmy1和AtBmy3基因编码的酶活起到调控作用。拟南芥中2个在根系生长发育过程中起关键作用的转录因子AtBmy7和AtBmy8分别结合一个顺式作用元件,其中都包含一个Gbox和一个类似BR-反应元件[5]。通过分子克隆等生物学方法已分别从水稻、大麦、黑麦、小麦、玉米中克隆出多个Bmy编码基因[6]。
淀粉的降解是由α-淀粉酶和Bmy协同作用的结果;淀粉是香蕉果实以及其他许多肉质果实发育过程中碳同化物的一种过渡形式,其降解代谢同果实发育过程密切相关[7-11]。汪永保研究菠萝蜜成熟过程中Bmy基因的表达时发现,Bmy参与调控菠萝蜜果实成熟中淀粉粒被降解成可溶性糖的过程,但Bmy基因相对于ɑ-淀粉酶基因来说表达量相对较低,推测二者可能共同影响着菠萝蜜果实质地和品质的形成[12]。在香蕉中,未成熟的果实果肉中有大量的淀粉存在,而在成熟期的果肉中这些淀粉被Bmy催化降解为可溶性糖[13]。王永章等[14]认为Bmy可能参与了苹果果实内淀粉的降解,与果实成熟有一定关系。
香蕉是热带亚热带最重要的水果之一,在果实发育过程中淀粉的合成和降解是其重要的生理过程,这个过程不仅影响香蕉的产量,同时也影响香蕉果实的品质。2012年已完成并公布了香蕉全基因组测序结果,在全基因组范围内对家族基因进行分析鉴定和进化分析以及相关基因功能推测提供了数据支持[15]。迄今为止,香蕉全基因组水平上E2基因家族[16]和ARF基因家族[17]已先后被鉴定出来,而关于Bmy家族的报道较少。本研究通过对香蕉全基因组的分析,鉴定出其Bmy家族的全部基因,并且对鉴定出的家族基因进行基本理化性质分析、基因结构分析、序列比对分析、进化分析及保守基序进行分析,为更深入开展MaBmy基因的功能及调控香蕉果实成熟的应用奠定基础。
1 材料与方法
1.1 材料
以香蕉(Musa acuminata)为研究对象,基因数据来源于Phytozome11基因组数据库(https://phytozome.jgi.doe.gov/pz/portal.html)及The Banana Genome Hub數据库(http://banana-genome.cirad.fr/)。
1.2 方法
1.2.1 拟南芥、水稻和玉米Bmy基因序列的获取
利用拟南芥TAIR数据库(http://www.arabidopsis.org/)和水稻RAP数据库(http://rapdb.dna.affrc.go.jp/)以及Phytozome11基因组数据库(https://phytozome.jgi.doe.gov/pz/portal.html)通过基因查找和Blast序列比对,最终找出拟南芥、水稻和香蕉中所有Bmy基因序列并编号。
1.2.2 香蕉Bmy基因的氨基酸序列属性分析
将获得的香蕉Bmy的氨基酸序列投入ExPASy(http://www.expasy.org/)站点,利用其中的ProtParam tool软件分析Bmy蛋白的分子量、等电点、不稳定系数、脂肪指数和疏水性等基本的理化性质。香蕉Bmy蛋白亚细胞定位采用Plant-mPLoc Server(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/#)分析。二级结构分析采用在线SOPMA程序(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析。所有参数均为默认值。
1.2.3 香蕉Bmy基因结构分析 从香蕉基因组数据库得到的香蕉Bmy的基因序列和cDNA序列,利用Gene Structure Display Server(http://gsds.cbi.pku.edu.cn/index.php)分析内含子和外显子组成。MaBmy保守结构域采用PFAM(http://pfam.xfam.org/search)在线工具查找。
1.2.4 多序列比对和系统进化分析 利用Clustal X1.83对香蕉、水稻和拟南芥中所有Bmy蛋白序列进行比对,结合MEGA6.0软件构建香蕉Bmy蛋白以及拟南芥、水稻蛋白的系统发育进化树,系统发育进化树生成采用邻接法(neighbor joining,NJ),参数设置:使用neighbor-joining法则的P-距离(P-distance)模型构建,选择了成对删除(pairwise deletion)空位(gap)的选项,Bootstrap method取值1 000。
1.2.5 香蕉Bmy蛋白的结构和保守基序查找与注释
香蕉Bmy蛋白家族蛋白的保守基序采用MEME4.0(http://meme.nbcr.net/meme/)分析,基序的最大数目设置为10,基序长度设为6~200个氨基酸。对得到的保守基序运用SMART(http://smart.embl-heidelberg.de/)在线工具进行功能注释,并且参照拟南芥和水稻的命名模式进行命名。
2 结果与分析
2.1 β-淀粉酶全基因组鉴定及基本理化性质分析
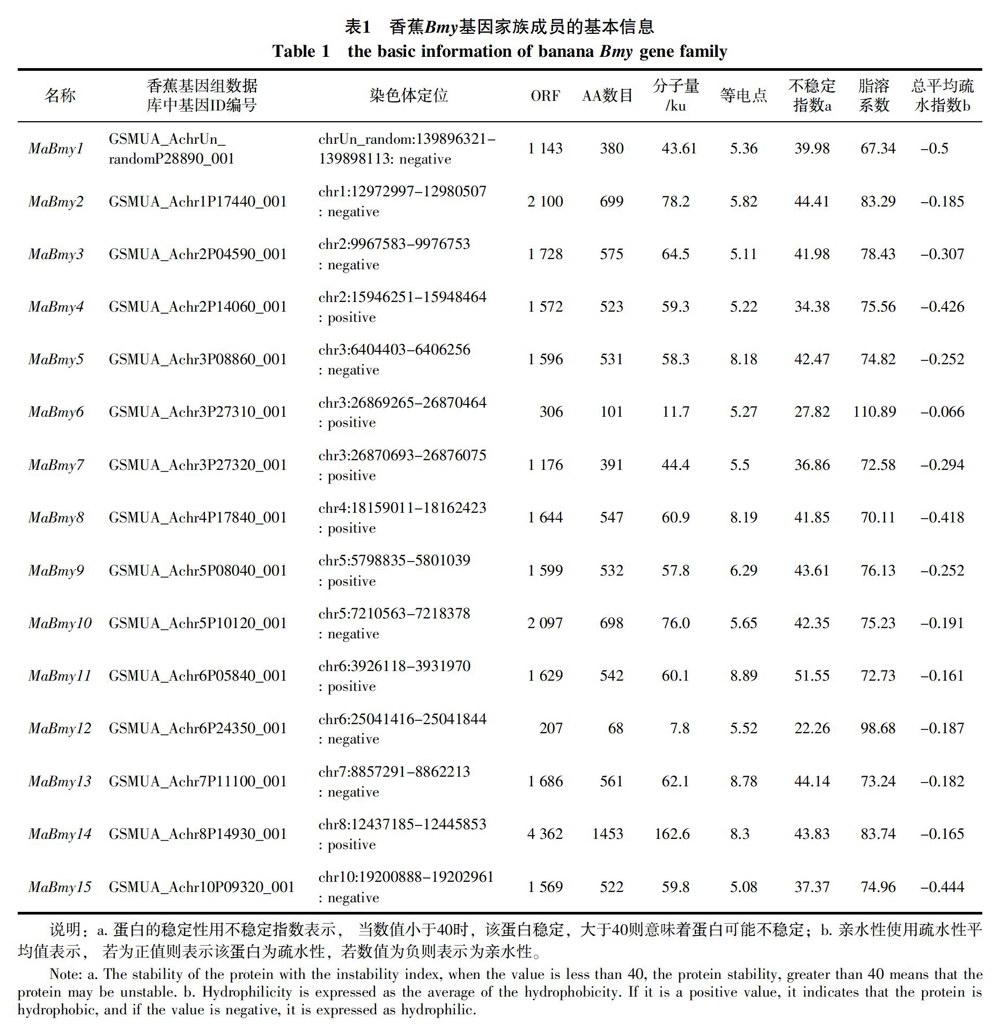
通过分析验证共获得编码淀粉酶的基因15个,分别根据它们在每个物种中的染色体位置命名(MaBmy1-15)。MaBmy均匀的分布在1/2/3/4/5/6/7/8/10号染色体上,其中有一条在染色体上无法定位,命名为MaBmy1。除了3号染色体上有3个MaBmy,2/5/6号染色体上有2个MaBmy,其余的染色体上均为1个,详见表1。对序列的分析结果显示,香蕉MaBmy基因的编码区域(ORF)长度范围跨度较大,在 207(MaBmy12)~4362 bp(MaBmy14) 之间,对应编码蛋白的氨基酸数目为68~1453个,对应的编码蛋白分子量在7.8~162.6 ku之间。等电点分析发现:5个MaBmy蛋白等电点大于8.0显碱性;10个MaBmy蛋白等电点小于6.5显酸性,其中MaBmy15最小,为5.08。不稳定指数分析发现6个香蕉MaBmy(MaBmy-1,-4,-6,-7,-12,-15)蛋白不稳定指数小于40,为稳定蛋白,9个MaBmy大于40,为不稳定蛋白。疏水性分析表明,所有的MaBmy蛋白为亲水性蛋白。
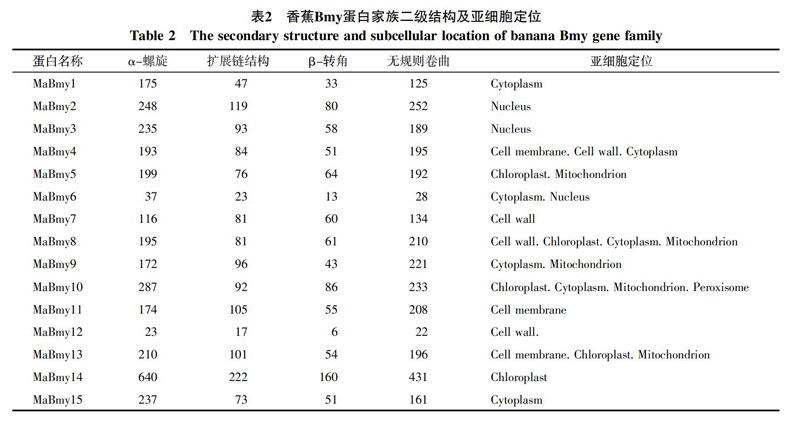
对香蕉Bmy的15个蛋白二级结构分析(表2)发现:MaBmy蛋白二级结构均由α-螺旋、扩展链结构、β-转角和无规则卷曲4种形式组成,且全部氨基酸序列的二级结构都以α-螺旋和无规则卷曲为主。在MaBmy-2,-4,-7,-8,-9,-11中各组成的百分比为无规则卷曲>α-螺旋>扩展链结构>β-转角,其余的9个MaBmy-1,-3,-5,-6,-10,-12,-13,-14,-15蛋白组成的百分比均为α-螺旋>无规则卷曲>扩展链结构>β-转角。用Plant-mPLoc对MaBmy基因家族的蛋白质进行亚细胞定位分析,不同的MaBmy蛋白定位于细胞核、细胞质、细胞膜、细胞壁及线粒体、叶绿体、过氧化物酶体中。
2.2 香蕉Bmy家族基因结构、结构域及系统进化分析
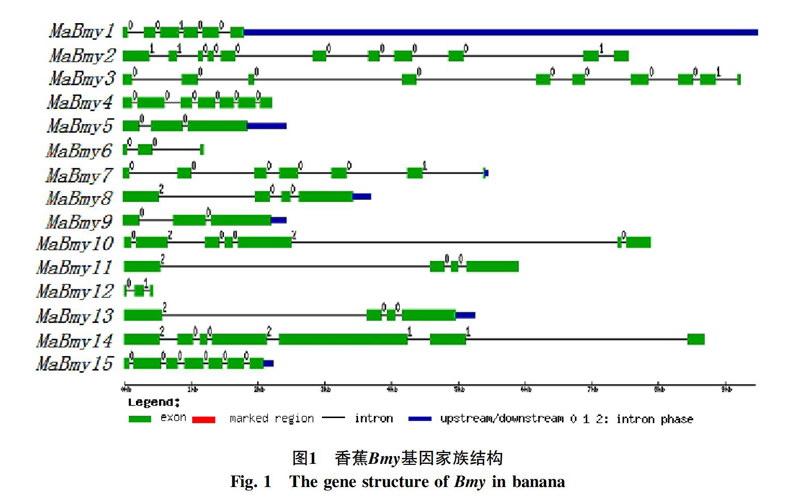
利用GSDS基因结构作图软件对香蕉Bym家族基因成员的基因结构进行分析,见图1所示,香蕉15个Bmy基因均由外显子和内含子组成。内含子数目范围在2~10之间,其中MaBmy-5,-6,-9,-12内含子数目最少,含有2个內含子;内含子数目最多的是MaBmy2。利用Pfam工具鉴定MaBmy基因编码的蛋白均含有保守结构域Glycosyl hydrolase family 14 domain(PF01373),结果见图2黄色方框所示。
对香蕉Bmy进行的基因结构分析表明,该家族基因间发生了明显的分化。为进一步了解香蕉Bmy各基因之间的系统进化关系,本研究利用香蕉15个Bmy基因编码的蛋白质序列及双子叶模式植物拟南芥、单子叶模式植物水稻的Bmy蛋白序列构建系统发育树。结果见图3所示,15个MaBmy分为4个亚家族,且与水稻的亲缘关系较近,聚类聚在一起。香蕉Bmy进化关系较近的在基因长度大小,基因结构等方面相似,例如MaBmy-5,-9均含有3个外显子,氨基酸数目分别为-531,-547。
2.3 Bmy蛋白的结构和保守基序分析
通过MEME软件预测拟南芥、水稻、香蕉Bmy蛋白的保守基序, 结果见图4所示;用SMART软件对预测的保守基序进行命名,结果见表3所示。结果显示, 3个物种 Bmy蛋白家族中共有34个Bmy蛋白,其中有16个蛋白拥有9个基序(基序1,3~ 10);拟南芥中9个Bmy蛋白其中有5个(AtBmy-1,-4,-5,-6,-7)含有9个基序,AtBmy-2,-3含有5个基序,其余2个AtBmy-9,-8蛋白分别含有8和4个基序;水稻中10个Bmy蛋白有6个(OsBmy-3,-5,-6,-7,-9,-10)含有9个基序,其余4个(OsBmy-1,-4,-8,-2)分别含有-8,-6,-5,-4个基序。15个香蕉Bmy蛋白有5个(MaBmy-8,-10,-13,-14,-15)含有9个基序,4个(MaBmy-4,-5,-9,-11)含有8个基序,其余的MaBmy-1,-2,-3,-7,-6,-12分别含有-6,-5,-4,-3,-2,-1个基序。在基序分析中,通过SMART在线工具进行基序命名,详见表4,基序-1,-2,-3,-6,-7,-8均注释为为糖苷水解酶家族14(Glyco_hydro_14)。
3 讨论与结论
香蕉作为重要的热带亚热带水果,被世界粮农组织列为第四大作物,淀粉作为采前香蕉果实的主要组成成分,后熟过程中淀粉降解为可溶性糖。淀粉水解酶在淀粉降解过程中发挥着重要的作用。然而目前为止,关于香蕉全基因鉴定Bmy基因家族尚未见报道。目前,植物全基因组测序的完成加速对植物基因的全面了解,由单个基因研究上升到了基因组学以及功能基因组学的水平[18]。随着植物基因组研究的深入,利用比较基因组学研究策略,通过广泛的基因家族分析,奠定基因功能研究的基础,现已成为基因功能研究的热点。2012年香蕉的基因组已经测序完成,为研究者深入发掘关键基因提供了大量的数据。本研究通过对香蕉进行全基因组生物信息学分析,成功鉴定得到15个香蕉Bmy蛋白家族成员,该基因家族均含有糖苷水解酶家族14的保守结构域Glycosyl hydrolase family 14 domain(PF01373),家族基因数目以及亚家族分类与拟南芥、水稻类似[3-4],说明Bmy不论是在单子叶植物还是双子叶植物中是一类植物进化中相对较保守的家族。
基因家族是由祖先基因在基因的復制过程中通过重复和变异产生,研究基因家族的系统进化,分析家族基因的基因结构组成具有重要意义。为了探索MaBmy基因家族的多样性,笔者使用GSDS在线软件预测MaBmy基因结构。结果显示,香蕉Bmy基因家族成员均由外显子和内含子组成。香蕉Bmy基因家族内含子数目范围在2~10之间,而拟南芥家族成员内含子数目范围在2~9之间,水稻的内含子数目范围在1~10之间[3-4];进化分析表明,在4个亚家族中,进化关系较近家族成员的聚在一起,其基因结构和氨基酸组成相似,例如:Group I中MaBmy-11,-13,OsBmy1均含有3个内含子,氨基酸组成分别为-542,-561,-566 aa,这类基因在进化过程中保守,这与杨泽峰等对禾本科Bmy基因的研究结果一致[4]。然而,还有一类基因虽然在进化过程中亲缘关系较近,但是在基因结构及氨基酸组成差异较大,产生这类分化的原因是基因在进化过程中产生了新的生物学功能。
本研究基于香蕉gene bank database在全基因水平上鉴定分析了MaBmy基因家族,并对其氨基酸序列、基因结构、系统进化、染色体定位以及保守基序进行了全面分析,为今后进一步研究香蕉Bmy基因家族的功能和调控机理奠定基础。
参考文献
[1] Scheidig A, Frohlich A, Schulze S, et al. Downregulation of a chloroplast-targeted β-amylase leads to a starch-excess phenotype in leaves[J]. The Plant Journal, 2002, 30(5): 581-591.
[2] Totsuka A, Nong H, Kadokawa H, et al. Residues essential for catalytic activity of soybean β‐amylase[J]. European Journal of Biochemistry, 1994, 221(2): 649-654.
[3] Valerio C, Costa A, Marri L, et al. Thioredoxin-regulated β-amylase(BAM1)triggers diurnal starch degradation in guard cells, and in mesophyll cells under osmotic stress[J]. Journal of experimental botany, 2011, 62(2): 545-555.
[4] 杨泽峰, 徐暑晖, 王一凡, 等. 禾本科植物 β-淀粉酶基因家族分子进化及响应非生物胁迫的表达模式分析[J]. 科技导报, 2014, 32(31): 29-36.
[5] Reinhold H, Soyk S, simková K, et al. β-Amylase-like proteins function as transcription factors in Arabidopsis, controlling shoot growth and development[J]. The Plant Cell, 2011, 23(4): 1 391-1 403.
[6] Mason-Gamer R J. The β-amylase genes of grasses and a phylogenetic analysis of the Triticeae(Poaceae)[J]. American Journal of Botany, 2005, 92(6): 1 045-1 058.
[7] Sarikaya E, Higasa T, Adachi M, et al. Comparison of degradation abilities of α-and β-amylases on raw starch granules[J]. Process Biochemistry, 2000, 35(7): 711-715.
[8] Berüter J. Sugar accumulation and changes in the activities of related enzymes during development of the apple fruit[J]. Journal of plant physiology, 1985, 121(4): 331-341.
[9] Ohmiya A, Kakiuchi N. Quantitative and morphological studies on starch of apple fruit during development[J]. Journal of the Japanese Society for Horticultural Science, 1990, 59(2): 417-423.
[10] Wang F, Sanz A, Brenner M L, et al. Sucrose synthase, starch accumulation, and tomato fruit sink strength[J]. Plant Physiology, 1993, 101(1): 321-327.
[11] Berüter J, Feusi M E S. The effect of girdling on carbohydrate partitioning in the growing apple fruit[J]. Journal of plant physiology, 1997, 151(3): 277-285.
[12] 汪永保. 菠萝蜜成熟软化相关酶基因表达及β-半乳糖苷酶基因克隆和序列分析[Z]. 廣东海洋大学, 2014.
[13] Cordenunsi B R, Lajolo F M. Starch breakdown during banana ripening: sucrose synthase and sucrose phosphate synthase[J]. Journal of agricultural and food chemistry, 1995, 43(2): 347-351.
[14] 王永章, 张大鹏. 发育过程中苹果果实的β-淀粉酶, 活性, 数量变化和亚细胞定位[J]. 中国科学: C 辑. 2002, 32(3): 201-210.
[15] D Hont A, Denoeud F, Aury J, et al. The banana(Musa acuminata)genome and the evolution of monocotyledonous plants[J]. Nature. 2012, 488(7410): 213-217.
[16] Dong C, Hu H, Jue D, et al. The banana E2 gene family: Genomic identification, characterization, expression profiling analysis[J]. Plant Science, 2016, 245: 11-24.
[17] Hu W, Zuo J, Hou X, et al. The auxin response factor gene family in banana: genome-wide identification and expression analyses during development, ripening, and abiotic stress[J]. Frontiers in plant science, 2015, 6, 742.
[18] Arabidopsis G I. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana.[J]. nature, 2000, 408(6814): 796.

