Duchenne型肌营养不良T2mapping成像与临床运动功能的相关性
王梅慧,董玉茹,辛 婧,牛亚运,吴士文
Duchenne型肌营养不良T2mapping成像与临床运动功能的相关性
王梅慧1,董玉茹2,辛婧1,牛亚运1,吴士文1
【摘要】目的通过分析Duchenne型肌营养不良(Duchenne muscular dystrophy,DMD)患者骨盆及大腿肌肉T2mapping成像结果,探讨T2值与临床运动功能的相关性。方法对12名DMD患者进行临床运动功能评估(9 m步行时间、四阶梯时间、卧立位时间)和T2mapping成像研究。通过Pearson相关和Spearman秩相关分析骨盆和大腿15块肌肉T2值与临床运动功能相关性。结果9 m步行中位时间为7.72 s(四分位间距时间为1.19 s);四阶梯中位时间为4.0 s(四分位间距时间为2.92 s);卧立位平均时间(7.73±1.21)s。大收肌拥有最高的T2值,长收肌拥有最短的T2值。长收肌(rs=0.818,P=0.001)、缝匠肌(rs=0.645,P=0.016)与9 m步行时间成正相关。股中间肌(rs=0.879,P<0.001)、股直肌(rs=0.867,P=0.001)、大收肌(rs=0.855,P=0.001)、臀大肌(rs=0.818,P=0.002)、股外侧肌(rs=0.709,P=0.011)、股二头肌长头(rs=0.612, P=0.030)、股二头肌短头(rs=0.924, P=0.017)、半腱肌(rs=0.576,P=0.041)均与四阶梯时间成正相关。大收肌(rs=0.776,P=0.014)、臀大肌(rs=0.760,P=0.017)、股内侧肌(rs=0.790,P=0.011)、股二头肌长头(rs=0.803,P=0.009)均与卧立位时间成正相关。 结论T2mapping成像技术是一个客观定量敏感的评估DMD患者疾病进展的方法,大收肌可能是反应临床运动功能最理想的指标。
【关键词】Duchenne型肌营养不良;T2mapping;运动功能评估
作者单位:100039北京,武警总医院:1.神经内科;2.核磁室
DMD是儿童最常见的神经肌肉疾病,主要发生于男孩,临床表现为进行性肌无力,属于X染色体隐性遗传病[1],是dystrophy基因突变和缺失的结果[2]。抗肌萎蛋白缺陷使肌细胞膜稳定性差,肌纤维收缩时更易受到损伤[3]。在疾病早期出现肌肉损伤、修复和炎性改变,随后出现不可逆的脂肪浸润[4]。脂肪浸润情况和运动功能评估是反应疾病严重程度的指标。常规核磁T2加权像和肌肉病理活检可以反映肌肉脂肪浸润情况[5],但主观、局限。临床运动功能评估(9 m步行时间、四阶梯时间、卧立位时间)准确性差,在不配合的患者中局限性更大。因此,一种无创定量客观的疾病评估方法至关重要。
T2mapping可通过测量组织T2值来定量分析组织内部成分的变化[6],理论上可以从分子水平反映组织代谢与生化信息的改变,在疾病早期准确诊断、病情发展程度和疗效的判断上发挥重要作用[7]。为了研究DMD患者双下肢肌肉组织的脂肪浸润程度及T2mapping成像的早期诊断价值,本课题组进行了其T2mapping成像研究及与临床运动功能相关性分析。
1 对象与方法
1.1对象连续选取2015-09至2015-12武警某部三甲医院DMD联合门诊就诊的基因诊断明确并自愿进行下肢肌肉磁共振成像(magnetic resonance imaging,MRI)扫描的DMD患者12例,年龄4~10岁,平均(7.08±1.98)岁。
1.2T2mapping成像研究采用光纤1.5 T Optix MRI扫描仪(美国GE公司),扫描范围为髂前上棘至膝关节。重复时间1372 ms,回波时间8.5、17.1、25.6、34.1、42.7、51.2、59.8、68.3 ms,视野350 mm×350 mm,分辨率 350 ×256,层厚8 mm,层间距8 mm。因为T2值易受运动影响,要求患者核磁检查前12 h限制运动,包括跑、跳、长时间行走。整个磁共振持续时间约20 min。
1.3影像处理3个兴趣区的选择:选择目标肌肉面积最大、最清晰的3个层面,因为他们可以包含可获得肌肉的最大区域。采用ADW 4.6软件工具描绘出肌肉形状,直接读出T2值,求取平均值。
1.4运动功能评估所有患者由同一神经内科医师进行运动功能评估,主要包括9 m步行时间、四阶梯试验时间、卧立位时间。9 m步行时间:患者尽力行走9 m所需要的最短时间。四阶梯试验时间:患者登上4个台阶所需要的最短时间(可扶扶手)。卧立位时间:患者由平躺到完全直立所需要的最短时间。
1.5统计学处理采用SPSS 13.0统计软件进行数据处理和分析。符合正态分布的资料,以±s表示,相关性分析采用Pearson相关;不符合正态分布的数据,以中位数(四分位间距)[M(Q)]描述,采用Spearman秩相关分析其相关性。以P<0.05为差异具有统计学意义。
2 结 果
2.1患者运动功能评估整体情况9 m步行中位时间为7.72 s(四分位间距时间为1.19 s);四阶梯中位时间为4.0 s(四分位间距时间为2.92 s);卧立位平均时间(7.73±1.21)s。
2.2骨盆和大腿15块肌肉T2值大收肌拥有最高的T2值,其次是臀大肌、股内侧肌、股外侧肌;长收肌拥有最短的T2值,其次是股薄肌、缝匠肌、半膜肌(表1)。
表1 骨盆和大腿15块肌肉T2值(ms,±s)
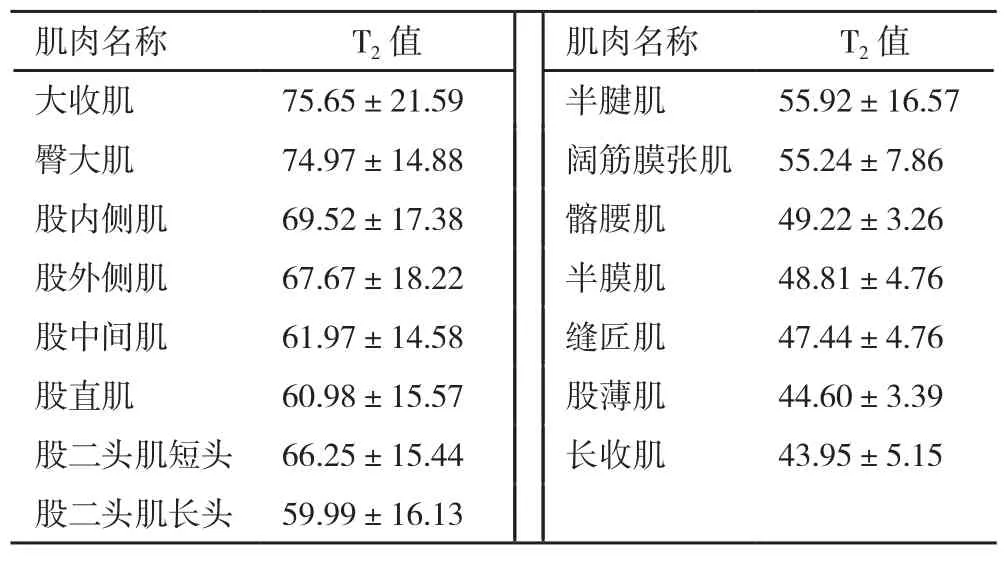
表1 骨盆和大腿15块肌肉T2值(ms,±s)
肌肉名称 T2值 肌肉名称 T2值大收肌 75.65±21.59 半腱肌 55.92±16.57臀大肌 74.97±14.88 阔筋膜张肌 55.24±7.86股内侧肌 69.52±17.38 髂腰肌 49.22±3.26股外侧肌 67.67±18.22 半膜肌 48.81±4.76股中间肌 61.97±14.58 缝匠肌 47.44±4.76股直肌 60.98±15.57 股薄肌 44.60±3.39股二头肌短头 66.25±15.44 长收肌 43.95±5.15股二头肌长头 59.99±16.13
2.3骨盆和大腿15块肌肉T2值与临床运动功能的相关性分析长收肌、缝匠肌T2值与9 m步行时间成正相关;股中间肌、股直肌、大收肌、臀大肌、股外侧肌、股二头肌、半腱肌T2值均与四阶梯时间成正相关;股内侧肌、大收肌、臀大肌、股二头肌长头T2值均与卧立位时间成正相关(表2)。

表2 骨盆和大腿15块肌肉T2值与运动功能相关性分析
3 讨 论
不同组织拥有不同含量的自由水和结合水,拥有不同的T2值[8]。T2mapping 技术就是通过测量组织T2值来定量分析组织内部成分变化的 MRI 新技术[6],在对疾病诊断和疗效的评估上较常规 MRI 更为敏感[9],是一种无创定量客观的疾病评估方法。
DMD患者肌肉内脂肪浸润程度可以准确反映疾病进展[10]。脂肪组织等大分子可以限制水分子的运动,使相应肌肉组织水分子的T2值增加[6,11]。T2mapping已经被用来评估DMD患者下肢肌肉情况,但国内外研究结果存在一定差异。梁颖茵等[12]进行DMD患者大腿肌肉T2mapping成像研究,指出只有大收肌T2值与临床严重程度成正相关,大收肌是反应疾病进展最理想的指标;而国外研究却认为臀大肌拥有最高的T2值,与临床严重程度呈正相关,推断臀大肌可作为早期诊断的指标[13]。为了进一步探究T2mapping成像的早期诊断价值,本研究进行了DMD患者T2mapping成像与临床运动功能(9 m步行时间、四阶梯时间、卧立位时间)的相关性分析。
本研究结果表明,DMD患者下肢脂肪受累存在一定的分布规律:大收肌拥有最高的T2值,其次是臀大肌;长收肌拥有最低的T2值。本试验结果与前期国内研究结果一致,而与国外研究结果存在一定差异,推测患者脂肪受累分布规律存在种族和个体差异,且因T2值会因患者肥胖而增加推测饮食习惯不同可能是种族差异存在的原因[13]。个体差异除与基因有关外,还可能与患者运动习惯相关,因为DMD患者肌肉组织T2值与临床运动功能存在显著相关性,进而推断上下楼梯或蹲起过多的患者也许更容易造成肌肉损伤,加重疾病进展。
在临床运动功能评估方面,本试验结果表明长收肌、缝匠肌与9 m步行时间呈正相关;股中间肌、股直肌、大收肌、臀大肌、股外侧肌、股二头肌、半腱肌均与四阶梯时间成正相关;大收肌、臀大肌、股内侧肌、股二头肌长头与卧立位时间成正相关。大收肌拥有最高的T2值,且只有大收肌与运动功能各项指标均呈正相关,可以认为大收肌是我国反应DMD患者最理想的指标,且可辅助进行DMD早期诊断。
总之,T2mapping成像技术是一个客观定量的评估DMD患者疾病进展的方法,对轻微结构变化敏感,可以对患者进行临床评估,对不配合和失去行走能力的患者尤其适用。
【参考文献】
[1]Li X, Zhao L, Zhou S, et al. A comprehensive database of Duchenne and Becker muscular dystrophy patients( 0-18 years old) in East China [J]. Orphanet J Rare Dis, 2015,10: 5.
[2]Monaco A P. Molecular human genetics and the Duchenne/ Becker muscular dystrophy gene [J] . Mol Cell Biol Hum Dis Ser, 1993, 3: 1-11 .
[3]朱珠, 王毅, 赵重波. 诱导多能干细胞治疗Duchenne型肌营养不良研究进展[J] . 中华神经医学杂志, 2014, 13(1): 90-92.
[4]李婷婷, 邹丽萍. 糖皮质激素治疗Duchenne肌营养不良的研究进展[J]. 中华神经医学杂志, 2012, 11(11): 1182-1185.
[5]Schreiber A, Smith W L, Ionasescu V, et al. Magnetic resonance imaging of children with Duchenne muscular dystrophy [J]. Pediatr Radiol, 1987, 17(6): 495-497.
[6]Glaser C. New techniques for cartilage imaging: T2relaxation time and diffusion-weighted MR imaging [J]. Radiol Clin North Am, 2005, 43(4): 641-653.
[7]孙露露, 张祥林, 潘诗农. MR T2mapping 在肌肉疾病中的应用价值[J]. 国际医学放射学杂志, 2014, 37(5): 422-426.
[8]Prior B M, Foley J M, Jayaraman R C, et al. Pixel T2distribution in functional magnetic resonance images of muscle [J]. J Appl Physiol, 1999, 87(6): 2107-2114.
[9]Yan D, Zhang J, Liang W, et al. Magnetic resonance imaging and histopathological analysis of experimental muscle injuries in a rabbit [J]. Biomed Environ Sci, 2013,26(10): 841-848.
[10]Liu G C, Jong Y J, Chiang C H, et al. Duchenne muscular dystrophy: MR grading system with functional correlation [J]. Radiology, 1993, 186(2): 475-480.
[11]Fullerton G D, Cameron I L, Hunter K, et al. Proton magnetic resonance relaxation behavior of whole muscle with fatty inclusions [J]. Radiology, 1985, 155(3): 727-730.
[12]梁颖茵, 操基清, 凌坚, 等. Duchenne型肌营养不良症患儿大腿肌肉T2mapping成像研究[J].中国现代神经疾病杂志, 2015, 15(6): 437-441.
[13]Kim H K, Laor T, Horn P S, et al. T2mapping in Duchenne muscular dystrophy: distribution of disease activity and correlation with clinical assessments [J]. Radiology, 2010,255(3): 899-908.
(2016-02-01 收稿2016-04-21修回)
(责任编辑张亚丽)
Correlation between T2mapping in Duchenne muscular dystrophy and clinical motor function
WANG Meihui1, DONG Yuru2, XIN Jing1, NIU Yayun1, and WU Shiwen1. 1. Department of Neurology, 2. Nuclear Magnetic Resonance Laboratory, General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China
Corresponding author: WU Shiwen, E-mail: wu_shiwen@yahoo.com
【Abstract】ObjectiveTo explore the correlation between T2value and clinical motor function by analyzing T2mapping of pelvic and thigh muscles in Duchenne muscular dystrophy (DMD). MethodsClinical motor function (9 m walking time, four step time, timed Gower score) in 12 patients with DMD and T2mapping imaging were evaluated. Pearson correlation and spearman rank were used to analyze correlation between T2value and clinical motor function of 15 pelvic and thigh muscles. ResultsThe median time of 9 m walking time was 7.72 s (quarterback interval time was 1.19 s); the median time of four steps time was 4.0 s (quarterback interval time was 2.92 s); timed Gower score was (7.73±1.21) s. Great adductor had the highest T2value, and long adductor had the shortest T2value. Both long adductor (rs=0.818,P=0.818) and sartorius (rs=0.645, P=0.645) had a positive correlation with 9 m walking time. Vastus intermedius (rs=0.879, P<0.001), rectus femoris (rs=0.867, P=0.001), great adductor (rs=0.855, P=0.001), gluteus maximus (rs=0.818, P=0.002) and vastus lateralis muscle (rs=0.709,P= 0.011), biceps femoris muscle (rs=0.924, P=0.017) and semitendinosus (rs=0.576, P=0.041) were positively correlated with four steps time. Great adductor (rs=0.776, P=0.014), gluteus maximus (rs=0.760, P=0.017), medial vastus muscle (rs=0.790, P=0.011) and long head of biceps (rs=0.803, P=0.009) were positively correlated with timed Gower score. ConclusionsT2mapping imaging is an objective, quantitative and sensitive technology in assessing disease progression of DMD, and great adductor is probably the most ideal index in assessment of clinical movement function.
【Key words】Duchenne muscular dystrophy; T2mapping; clinical motor function assessments
【中国图书分类号】R746
DOI:10.13919/j.issn.2095-6274.2016.05.004
作者简介:王梅慧,硕士研究生在读,E-mail:huimeiw@163.com
通讯作者:吴士文,E-mail:wu_shiwen@yahoo.com

