二氧化碳跨生物膜的传递机制研究进展
姜忠义,张宁,黄彤,任燕雄,王磊,王少飞
(1天津化学化工协同创新中心,天津 300072;2天津大学化工学院绿色合成与转化教育部重点实验室,天津300072)
二氧化碳跨生物膜的传递机制研究进展
姜忠义1,2,张宁1,2,黄彤1,2,任燕雄1,2,王磊1,2,王少飞1,2
(1天津化学化工协同创新中心,天津 300072;2天津大学化工学院绿色合成与转化教育部重点实验室,天津300072)
摘要:二氧化碳(CO2)作为生物体内的代谢产物和反应底物,其与外界环境的气体交换是保证生物体正常生命活动的重要基础。CO2在生物体尤其是细胞内的传递对于控制碳排放、构建高效碳循环、开发新型碳捕集技术具有重要意义。本文对生物体内CO2的传递机制进展进行了综述,重点介绍了CO2跨膜运输的不同方式与相应机制,针对水通道蛋白对CO2的促进传递作用进行了较为详细的分析,指出在膜对CO2自渗透性低时水通道蛋白对CO2的跨膜运输才能发挥重要作用。近期研究进展表明,水通道蛋白四聚体的中央孔道和水通道赋予其对CO2的促进传递作用。此外,碳酸酐酶和HCO3–-Cl–转运蛋白的存在能加速细胞内酸化过程,提高CO2的传递速率。期望本综述能够为开发新的仿生膜材料及其碳捕集技术提供理论方面的一些参考。
关键词:二氧化碳;生物膜;溶解扩散;水通道蛋白;促进传递
第一作者及联系人:姜忠义(1966—),教授,博士生导师,主要从事仿生与生物启发下的膜与膜过程研究。E-mail zhyjiang@tju.edu.cn。
碳是生物体的物质骨架,也是化石燃料的核心元素。1850年以来,化石燃料的快速消耗以及CO2的累积排放正在引发日益严重的全球气候变化及环境问题[1]。如何解决工业生产中产生的CO2的大规模捕集、贮存和转化,从而构建绿色、高效的碳循环是世界各国政府迫切关心的重大问题[2]。
CO2在细胞与内环境之间以及生物与外界环境之间存在气体交换,动物、植物和绝大多数细菌进行呼吸作用产生的CO2需要排出体外,含叶绿素的生物进行光合作用需要CO2作为碳源,生物通过水合CO2的方式形成H2CO3–-HCO3–酸碱缓冲对,酸碱缓冲对所产生的CO2浓度梯度为其交换提供驱动力[3]。可以说,CO2的有效传递对生物体生理机能的实现不可或缺,生物体的各个部位、每时每刻都在发生着CO2的不同方式的传递。
CO2在生物体内的传递可以分为两类。一是CO2的相际传递与均相扩散;二是CO2的跨膜传递。前者如植物叶中CO2通过气孔进入疏松组织的细胞间隙,CO2通过毛细管孔道进入血浆等,其过程遵循菲克第一定律。后者如CO2穿过质膜、叶绿体、线粒体膜进出等,CO2在生物体的传递阻力主要集中在这一部分[4]。跨膜传递过程的实际传递速率比基于传统的气体传递机制(主要为自由扩散)或者理论计算的传递速率低几个数量级[5]。
近年来,许多研究认为水通道蛋白能促进CO2的跨膜运输[6-7],然而也有一些不同的学术观点。本文阐述了CO2在生物体内的传递机制研究进展,介绍了CO2在体内的传递途径,重点分析了CO2自由扩散和水通道蛋白对CO2的促进传递,同时也介绍了碳酸酐酶与HCO3–-Cl–转运蛋白对于CO2跨膜运输的促进作用,以期为碳捕集技术和先进膜材料的研究开发提供一些可供参考的基础理论。
1 CO2在生物体内的传递途径
在健康动物体内,细胞和外界环境之间CO2浓度梯度很大[8];相比之下,在进行光合作用的植物体内,CO2浓度梯度并不甚显著。因此,在正常生理条件下,CO2由外界环境运输至细胞内化学反应特定位点的过程中,相同的阻力对植物体内CO2传递产生的影响要大于其对动物体内CO2传递产生的影响。所以这里以植物体内CO2的传递为例来叙述CO2在生物体内的传递过程。
光合作用是植物体最基本也是最重要的生理活动[9]。一方面,气孔的存在是CO2传递阻力的一个来源;另一方面,CO2由气孔运输至叶绿体内部存在内导(gi,也称叶肉导度),这是CO2传递的另一个限制步骤,而后者对光合作用的阻碍作用通常比前者更为显著。尽管gi受诸多因素影响,但最新的一些研究证明水通道蛋白是其中最为重要的影响因素[10]。HvPIP2;1是大麦体内的一种水通道蛋白,将HvPIP2;1引入水稻植株体内,这种转基因水稻大量表达HvPIP2;1,其内导和普通水稻相比增加了40%[11]。这是第一个证明内导和水通道蛋白有直接关系的研究发现。
由外界环境运输至叶绿体基质内化学反应的特定位点是CO2传递的全部途径(图1),它受限于细胞不同部位的阻力[12]。1为叶片中的气孔;2为细胞间隙;3为细胞壁;4为细胞膜;5为细胞质基质;6为叶绿体。2至6步共同组成了CO2传递的内导gi。环境中的CO2必须经过细胞间隙、细胞壁、细胞膜,透过叶绿体被膜,进而运输至叶绿体基质。图中表示了CO2的自由扩散(左侧)和依靠水通道蛋白进行传递(右侧)两种路径。表1给出了每项阻力的大小和CO2从一个部位运输至另一部位后对CO2浓度产生的影响。由表1可见,CO2在细胞膜和叶绿体被膜等膜结构中的传递阻力为总阻力的主要构成部分。此外,叶肉导度还与叶的形态、细胞壁厚度、胞质层结构、叶绿体表面积等因素有关,也会随叶片温度或水压的变化而变化[13]。叶肉阻力能显著减少叶绿体中CO2的浓度并因而降低净光合作用,各阻力项的改变会直接影响CO2传递速率的大小。
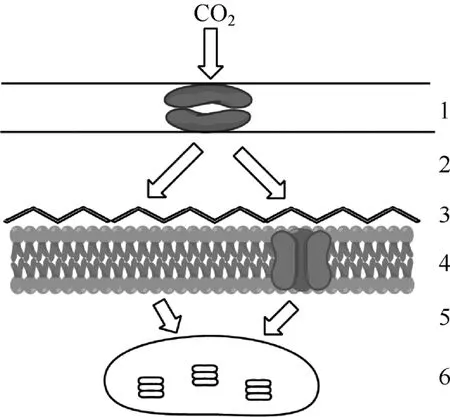
图1 CO2由外界环境运输至叶绿体内部的传递途径
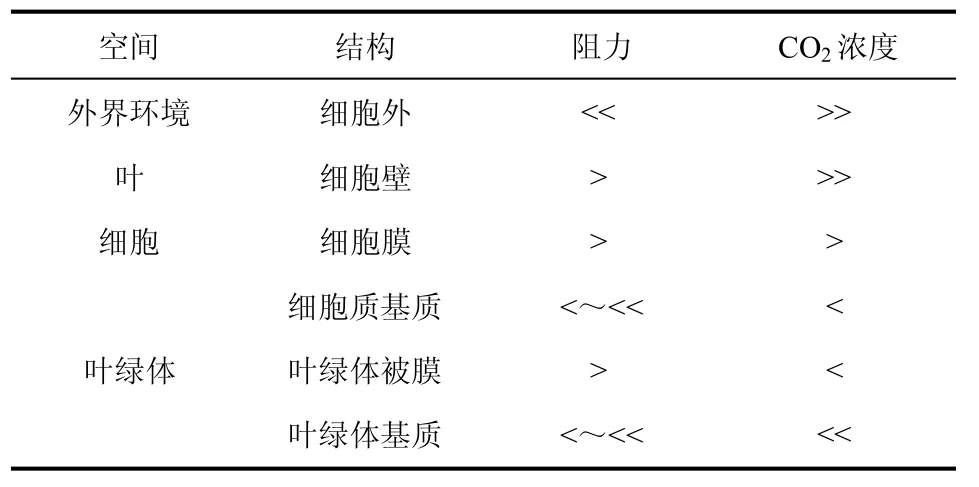
表1 CO2在植物体内的传递阻力及浓度变化
由CO2的传递途径可发现,CO2的跨膜运输方式主要为被动运输,包括CO2的自由扩散和借助于水通道蛋白的促进传递。CO2的跨膜运输主要由两种机制调控:一是依靠具有疏水性的生物膜磷脂双分子层,遵循溶解扩散机制;二是依靠一类特殊的膜转运蛋白(如水通道蛋白),遵循促进传递机制。
2 CO2的自由扩散
CO2分子属于非极性小分子,其热运动使CO2分子以自由扩散(又称简单扩散)的方式,沿浓度梯度降低的方向,通过生物膜从一侧到达另一侧。一般认为,该跨膜运输方式属于物理过程,遵循溶解扩散(solution-diffusion)机制,即CO2首先溶解在磷脂双分子层中,再从膜一侧扩散至另一侧。因此,CO2渗透性的大小,不仅取决于CO2在磷脂双分子层中的溶解性大小,还取决于其在磷脂双分子层中的扩散阻力。生物膜对CO2的渗透性可以用渗透系数(P)来表示[14],渗透系数可根据CO2在脂类和水中的溶解度系数(S)及在膜内的扩散系数(D)来计算,关系式为P=S×D。
研究者针对CO2在膜中的溶解扩散机制,建立了溶解扩散模型[15]。该模型认为CO2在膜中的自由扩散分为3个步骤,包括CO2在膜表面吸附溶解、CO2在浓度梯度的推动下向渗透侧扩散、CO2在膜渗透侧解吸。其中,吸附溶解和解吸过程能迅速达到平衡,而扩散过程往往较慢,构成CO2在膜内传递的控制步骤[16]。此模型中的溶解机制仅涉及物理溶解,不包括化学溶解。扩散机制由气体分子性质和膜结构特性两方面因素决定:在气体分子性质层面,CO2分子为线性分子,动力学直径约为0.33nm,因此在生物膜中的扩散优先于N2、NH3等气体;在膜结构特性层面,生物膜的自由体积孔穴越多、自由体积分数越大,CO2的扩散速率就越大[17]。
在生物膜中,胆固醇的含量会在很大程度上影响膜对CO2的渗透性。随着生物膜中胆固醇含量的增加,CO2的渗透性下降。实验发现,当胆固醇的含量由0增加至50%时,CO2的渗透系数降低了2~3个数量级,而CO2的溶解度系数只降低了25%[18]。因此认为,CO2的扩散系数对其渗透性的影响比溶解度系数对渗透性的影响要大,胆固醇含量的增加降低了生物膜的流动性,使膜中CO2的扩散系数降低。细胞可以通过控制胆固醇的含量在较大范围内调节CO2的渗透性,以满足相应的生理功能。
3 水通道蛋白对CO2的促进传递
除了自由扩散外,CO2在生物膜内还存在其他传递途径,其传递机制也明显区别于溶解扩散机制。ZEIDEL等[19]考察了细胞膜的流动性对CO2渗透性的影响,发现不同流动性的膜对CO2渗透性相似,表明此情形下自由扩散不应该是CO2传递的主要方式。只依靠溶解扩散机制来传递CO2难以满足细胞内对CO2高传递速率的需求,研究发现CO2的另一种跨膜运输方式是促进传递(facilitated transport)需要生物膜上转运蛋白的协助,其中最主要的一种就是前面提及的水通道蛋白。
水通道蛋白(也称水孔蛋白,aquaporin,简称AQPs),是指具有水、不带电小分子(尿素、硼酸、硅酸)或气体(氨、CO2)等底物特异双向渗透性的一类膜通道蛋白(26~34kDa)[20],也称MIPs,普遍存在于动物、植物及微生物中。对于AQPs是否能显著促进CO2的跨膜运输,研究者之间存在很大争议。一种观点认为,CO2的自由扩散本身十分快速,因此任何膜蛋白(如水通道蛋白)的存在都会减小CO2的传递速率,故水通道蛋白对CO2的传递现象不太可能真正存在[21]。另一种观点认为,实验测量得到的CO2传递速率比理论分析上低得多[22],水通道蛋白可作为一种传递CO2的载体,可能与CO2分子之间发生可逆的化学反应,进而促进CO2通过生物膜的传递,此谓促进传递现象[23]。水通道蛋白对CO2的促进传递为生物体内CO2的高传递速率提供了保证。
尽管对AQPs是否能促进CO2的跨膜运输依然存在争论,但许多研究证明水通道蛋白能显著促进CO2的跨膜运输。1995年,TYERMAN等[24]发现,AQPs能促进CO2通过细胞膜,同时表明这对于减少CO2在细胞内的传递阻力和在1,5-二磷酸核酮糖羧化酶的光合作用中是重要的。1998年,BORON 等[25]发现在爪蟾卵母细胞中引入水通道蛋白(AQP1)后CO2的渗透系数得到了明显提升,使用HgCl2(水通道抑制剂)后水通量和CO2通量明显降低,从而认为AQP1可以作为CO2通道。2003年,UEHLEIN等[26]的研究发现,不仅在爪蟾卵母细胞中表达的烟草NtAQP1能促进CO2跨膜运输,在烟草植株中表达的NtAQP1也有该促进作用。2010年,SKELTON等[27]将AQP1引入肾脏中,发现AQP1可将周围的CO2迅速传递,具有良好的平衡酸碱能力。2012年,NORBERT等[28]通过在嵌段共聚物(不透CO2)中引入水通道蛋白,从而验证了CO2在膜中的促进传递。
在水通道蛋白对CO2跨膜运输作用的研究中,AQP1是众多研究者研究最多的一种水通道蛋白,又因各水通道蛋白的三维结构相似,故以AQP1为代表阐述水通道蛋白对CO2的传递。水通道蛋白对底物的选择性取决于其内部氨基酸的性质[29]。在脂质双分子层中,AQP1运输CO2可能的途径有两种:一是通过AQP1四聚体形成的中央孔道;二是通过AQP1单体中的水通道。其中更多研究者认同的传递方式为通过四聚体中央孔道的传递。
3.1 四聚体中央孔道对CO2的传递
在细胞膜中,AQP1主要以同源四聚体的形式存在,且每一个单聚体是一个独立的功能单元。图2为水通道蛋白分子的拓扑结构示意图。一个AQP1单体分子是一条单肽链,由6个贯穿细胞膜两侧的长α螺旋构成基本骨架,6个长α螺旋由5条环(A~E loop)相连。4个单体衔接处中心形成一个缝隙,即四聚体的中央孔道。图3为AQP1四聚体的结构简图,由于疏水性,中央孔道不能传递水分子[30]。

图2 水通道蛋白分子的拓扑结构示意图
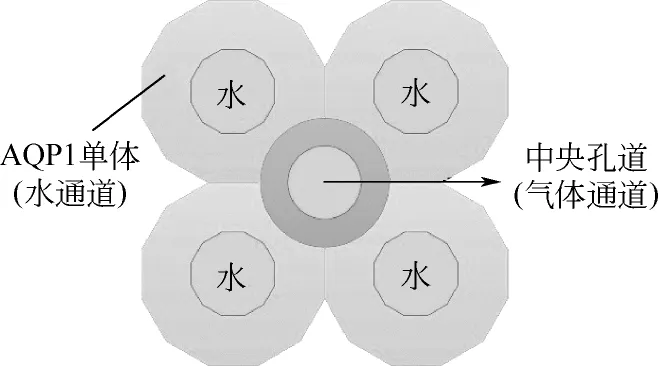
图3 AQP1四聚体结构简图
一些研究者的模拟结果[31]发现,CO2在水通道蛋白内的传递有两道阻力屏障:第一道屏障位于靠近细胞表层的位置,周围有4个Val-50(来自于4个单体);第二道屏障距离第一道屏障约为7 Å,周围有4个Asp-48。CO2和水在与Asp-48形成氢键的过程中产生竞争关系,且CO2分子和Asp-48之间的氢键作用力是可逆的,故CO2得以透过中央孔道。
另外,一旦中央孔道内存在离子或有机分子,那么CO2通过中央孔道的阻力就会大大增加。DE-GROOT等[32]认为,在红细胞、哺乳动物肺部或其他组织中,AQP1对于CO2的促进传递主要依赖于膜结构自身对CO2的渗透性。只有当膜对CO2的活化能垒超过20 kJ/mol或者四聚体的中央孔道内不存在离子或有机分子时,AQP1的促进传递方式才在所有跨膜运输方式中发挥主要作用。换言之,只有在膜对CO2自渗透性很低的情况下,AQP1的促进传递才发挥出重要的生理作用[33]。
3.2 水通道对CO2的传递
水通道蛋白的三维结构——“沙漏模型”[34]指出:B环和E环具有高度保守的天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,又称NPA)特征性序列,B环、E环折返进入双分子层,2个NPA序列在膜中间位置相互结合,6个跨膜螺旋包围在四周,共同构成AQP1的水通道。NPA序列的两个脯氨酸残基之间存在范德华力,此作用力对于短螺旋HB和HE的折叠有稳定作用[35]。水通道最窄处称为芳香/精氨酸(ar/R:aromati/arginine)保守域,由4个残基构成,包括亲水His180、Arg195、Cys189和疏水Phe56(图4)。
HUB等[36]模拟了磷脂双分子层中AQP1对CO2的渗透性,研究发现,CO2分子在ar/R保守域中的传递阻力为23±4 kJ/mol;在NPA结构域中的传递阻力较小,为9±1 kJ/mol。在ar/R保守域中,水分子和Arg-195之间形成很强的氢键,这在一定程度上对CO2的传递存在不利影响。在晶体结构中,Arg-195的胍基正好伸入孔道,使其成为通道中最窄的部位[37]。CO2要通过此部位,须破坏水分子和Arg-195的N原子之间的氢键,如此一来,CO2的传递阻力会大大增加。然而,Arg-195的结构多变性对ar/R保守域的阻力有很大影响,即Arg-195的位置和残基结构可在一定范围内有微小变动,这种结构多变性很可能源于C环的结构多变性[38]。Arg-195依靠邻近的Asn-127与Gly-125形成的氢键维持稳定性,如果在CO2的跨膜传递过程中,水分子和Arg-195形成的氢键不发生断裂,CO2通过ar/R保守域的传递阻力会相应降低。BEITZ等[39]的研究发现,在短螺旋HB和HE末端的两个天冬酰胺可作为氢供体,可能与底物分子(如CO2)中的氧原子相互作用,降低CO2传递的能垒。

图4 AQP1的ar/R保守域和NPA结构域示意图
水通道的限域效应也为CO2的选择性透过提供了一定的保证。AQP1水通道中ar/R保守域的4个氨基酸残基构成的狭口直径大约为2.8Å (1Å=0.1nm),恰好为一个水分子的大小,而CO2分子为线性分子,且一个CO2分子的直径比水略小[40],故CO2可能通过水通道。据模拟计算,CO2通过AQP1水通道的传递阻力与在水相中比较要大一到两个数量级。
OTTO等[41]对表达NtAQP1的酵母细胞进行了研究,发现AQP1的四聚体相比于单体有更高的CO2传递速率,这与CO2通过四聚体中央孔道进行传递的观点相一致,此传递方式也是目前研究者较为认同的一种。关于AQP1内是否还有其他CO2通道的疑问还有待进一步证实[42]。
4 其他蛋白质对CO2传递的作用
4.1 碳酸酐酶对CO2传递的促进作用
碳酸酐酶(carbonic anhydrases,简称CA),在生物体内广泛存在,如哺乳类动物、植物、藻类和细菌。它是一类含锌金属酶,能可逆地催化CO2与HCO3–的相互转化[43]。反应见式(1)。
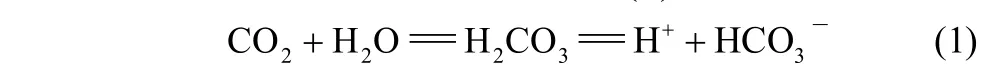
其作用主要通过碳酸酐酶活性区域一系列氨基酸残基及与这些残基配位的Zn2+来实现。因此,CO2的传递速率取决于传递路径长度(如曲折度、体积排阻)和碳酸酐酶CA的活性[44]。
以CAⅡ的结构为例,其活性区域位于β链形成的约15Å的空腔中,Zn2+位于活性区域底部,且与氨基酸残基His94、His96和His119的季铵氮原子配位,并与H2O或OH–连接形成四面体结构[45]。这些Zn2+的直接配体能通过氢键供体与CA中具有氢键受体的残基相连,这些氢键受体称为非直接配体。直接配体与非直接配体相互作用,形成一个氢键网状结构,该结构能够增强Zn2+的稳定性,加强H2O、OH–对CO2的亲核作用,更好地固定CO2,从而使酶的催化作用更高效。
CAⅡ的水合机制如图5所示。CAⅡ对CO2的催化分为两步[46]:①与Zn2+相连的H2O去质子化形成EZnOH,EZnOH–能亲核进攻CO2,形成EZnHCO3–,HCO3–被H2O取代形成EZnH2O;②EZnH2O经酶中的质子转运体将H+转运至溶剂中,其转运是通过活性区域的His-64来实现的,同时还原生成有催化活性的EZnOH–。
4.2 HCO3–-Cl–转运蛋白对CO2传递的促进作用
对人体红细胞膜的研究发现,Cl–通道阻断剂DIDS(4,4‚-diisothiocyanato- stilbene-2,2‚-disulfonic acid)降低了红细胞膜的CO2渗透性[47],这表明,红细胞膜中的HCO3–-Cl–转运蛋白与CO2的传递有关。
图6为CO2进入人体红细胞的不同路径,包括自由扩散、通过AQP1和通过HCO3–-Cl–转运蛋白3种方式。CO2进入红细胞以后,HCO3–-Cl–转运蛋白末端的CAⅡ催化CO2水合,进而转化成HCO3–和H+。H+通过Na+-H+载体蛋白转运出细胞膜,而HCO3–通过HCO3–-Cl–转运蛋白转运出红细胞[48]。HCO3–-Cl–转运蛋白的转运作用提高了CO2的传递速率,加速了细胞内的酸化过程。
综上所述,在CO2浓度梯度较小的情况下,水通道蛋白和HCO3–-Cl–转运蛋白有可能成为CO2的高亲和位点,同时碳酸酐酶CA的存在加速了CO2的催化过程,三者对于CO2的跨膜运输均具有重要作用。
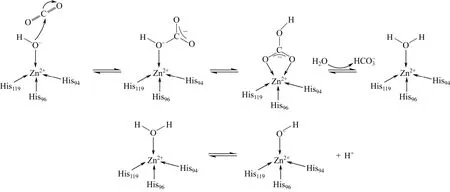
图5 CAⅡ的水合机制

图6 CO2进入人体红细胞的不同路径示意图
生物膜中的活性载体可以选择性地促进CO2的传递,受生物膜中促进传递现象的启发,可在分离膜中引入具有促进传递效果的载体,通过待分离组分(如CO2)与载体之间发生可逆化学反应而实现分离强化的目的,这样的膜称为促进传递膜[49]。促进传递膜在一定程度上更接近于生物膜,与传统分离膜相比具有很高的选择性和较高的渗透性。因此,CO2促进传递膜在碳捕集领域具有重要应用前景[50]。
5 结 语
CO2在生物体内的传递速率依赖于生物体细胞不同部位的传递阻力,其中跨膜运输的阻力在总传递阻力中占主要地位。尽管CO2跨膜运输的机制仍存在科学上的较大争议且很难在短期内得出统一性的结论,但研究发现脂质双分子层运输CO2的规律并不适用于所有生物体内的所有生物膜。CO2的跨膜运输既包含物理机制(溶解扩散机制),同时包含化学机制(促进传递机制)。换言之,除了自由扩散以外,很大程度上还与水通道蛋白有关,且只有在膜对CO2自渗透性低的情况下,水通道蛋白对CO2的促进传递才显示出重要作用。水通道蛋白运输CO2有两种可能的途径,即四聚体的中央孔道和水通道,其中研究者更为认可的途径为四聚体的中央孔道,关于水通道蛋白内是否存在其他的CO2通道还有待证实。此外,碳酸酐酶能催化CO2的水合反应,某些细胞膜(如红细胞膜)中的HCO3–-Cl–转运蛋白的转运作用也提高了CO2的传递速率,促进了CO2的跨膜运输。
从分子层面上揭示CO2的传递机制,分析气体分子如CO2如何进出细胞、组织和生物体,需要借助实验技术、分析表征技术与模拟计算技术的共同发展来实现。上述研究进展对于设计新型仿生膜材料、开发高效的碳捕集技术具有重要和深远的意义。
参 考 文 献
[1] 季劲钧,黄玫,李克让. 21世纪中国陆地生态系统与大气碳交换的预测研究[J].中国科学D辑(地球科学),2008,38(2):211-223.
[2] 国家科技部.“十二五”国家碳捕集利用与封存科技发展专项规划[R]. 北京:国家科技部,2013.
[3] 孙媛媛,季宏兵,罗建美,等. 气候驱动的中国陆地生态系统碳循环研究进展[J].首都师范大学学报(自然科学版),2006,27 (5): 90-95.
[4] HIKOSAKA K. Mechanisms underlying interspecific variation in photosynthetic capacity across wild plant species[J].Plant Biotechnology,2010,27(3):223-229.
[5] WAISBREN S J,GEIBEL J P,MODLIN I M,et al. Unusual permeability properties of gastric gland cells[J].Nature,1994,368 (6469): 332-335.
[6] COOPER G J,OCCHIPINTI R,BORON W F. CrossTalk proposal:physiological CO2exchange can depend on membrane channels[J].Journal of Physiology,2015,593(23):5025-5028.
[7] JI H T,DONG H S. Biological significance and topological basis of aquaporin-partnering protein-protein interactions[J].Plant Signaling & Behavior,2015,10(12):e1011947.
[8] KALDENHOFF R,KAI L,UEHLEIN N. Aquaporins and membrane diffusion of CO2in living organisms[J].Biochimica EtBiophysica Acta:General Subjects,2014,1840(5):1592-1595.
[9] 叶子飘. 光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(06):727-740.
[10] HORNG J L,CHAO P L,CHEN P Y,et al. Aquaporin-1 is involved in acid secretion by ionocytes of zebrafish embryos through facilitating CO2transport[J].Plos One,2015,10(8):e0136440.
[11] 刘迪秋,王继磊,葛锋,等. 植物水通道蛋白生理功能的研究进展[J].生物学杂志,2009,26(5):63-66.
[12] KATSUHARA M,HANBA Y T. Barley plasma membrane intrinsic proteins(PIP Aquaporins)as water and CO2transporters[J].Pflügers Archiv - European Journal of Physiology,2008,456(4):687-691.
[13] KALDENHOFF R.Mechanisms underlying CO2diffusion in leaves[J].Current Opinion in Plant Biology,2012,15(3):276-281.
[14] 张萌,孙祥军,罗居杰,等. CO2与CH4膜分离的发展与现状[J].化工新型材料,2014,42(5):26-29.
[15] 赵薇,贺高红,刘红晶,等. 离子液体二氧化碳分离膜研究进展[J].化工进展,2014,33(12):3292-3298.
[16] 王志,袁芳,王明,等. 分离CO2膜技术[J].膜科学与技术,2011,31(3):11-17.
[17] 滕一万,武法文,王辉,等. CO2/CH4高分子气体分离膜材料研究进展[J].化工进展,2007,26(8):1075-1079.
[18] ENDEWARD V,AL-SAMIR S,ITEL F,et al. How does carbon dioxide permeate cell membranes?A discussion of concepts,results and methods[J].Frontiers in Physiology,2014,4:382-382.
[19] PRASAD G,COURY L,FINN F,et al. Reconstituted aquaporin 1 water channels transport CO2across membranes[J]. Journal of Biological Chemistry,1998,273(50):33123-33126.
[20] 冉昆,魏树伟,王宏伟,等. 22种植物水孔蛋白理化性质及其结构特征的生物信息学分析[J].植物生理学报,2015,51(1):97-104.
[21] ANDREAS M,PHILIPP K,SAPAROV S M,et al. Carbon dioxide transport through membranes[J].Journal of Biological Chemistry,2008,283(37):25340-25347.
[22] NORBERT U,BEATE O,HANSON D T,et al. Function of nicotiana tabacum aquaporins as chloroplast gas pores challenges the concept of membrane CO2permeability[J].Plant Cell,2008,20(3):648-657.
[23] 黄湛,贺高红,代岩,等. 咪唑鎓化聚醚砜CO2固定载体分离膜的初探[J].化工进展,2014,33(12):3313-3317.
[24] KALDENHOFF R,KOLLING A,MEYERS J,et al. The blue light-responsive AthH2gene of Arabidopsis thaliana is primarily expressed in expanding as well as in differentiating cells and encodes a putative channel protein of the plasmalemma[J].The Plant Journal:for Cell and Molecular Biology,1995,7(1):87-95.
[25] NAKHOUL N L,BORON D A,ROMERO M F,et al. Effect of expressing the water channel aquaporin-1 on the CO2permeability of Xenopus oocytes[J].American Journal of Physiology,1998,274(2):C543-548.
[26] UEHLEIN N,LOVISOLO C,SIEFRITZ F,et al. The tobacco aquaporin NtAQP1 is a membrane CO2pore with physiological functions[J].Nature,2003,425(6959):734-737.
[27] SKELTON L A,BORON W F,ZHOU Y. Acid-base transport by the renal proximal tubule[J].Journal of Nephrology,2010,23( s16):s4-s18.
[28] UEHLEIN N,OTTO B,EILINGSFELD A,et al. Gas-tight triblock-copolymer membranes are converted to CO2permeable by insertion of plant aquaporins[J].Scientific Reports,2012,2(7):3597-3610.
[29] HERRERA M,GARVIN J L. Aquaporins as gas channels[J].Pflugers Archiv-European Journal of Physiology,2011,462(4):623-630.
[30] 卓加金.水通道蛋白与植物水分平衡[J].科学新闻,2008(11):8.
[31] LUDEWIG U,DYNOWSKI M. Plant aquaporin selectivity:where transport assays,computer simulations and physiology meet[J].Cellular & Molecular Life Sciences,2009,66(19):3161-3175.
[32] HUB J S,DE-GROOT B L. Does CO2permeate through aquaporin-1?[J].Biophysical Journal,2006,91(3):842-848.
[33] LI G,SANTONI V,MAUREL C. Plant aquaporins: roles in plant physiology[J].Biochimica Et Biophysica Acta,2014,1840(5):1574-1582.
[34] 王晶,桑建利. 水通道蛋白的基本结构与特异性通透机理[J].生物学通报,2011,46(2):19-22.
[35] MARTINEZ-BALLESTA M,CARVAJAL M. New challenges in plant aquaporin biotechnology[J].Plant Science,2014,217:71-77.
[36] HUB J S,DE GROOT B L. Mechanism of selectivity in aquaporins and aquaglyceroporins[J].Proceedings of the National Academy of Sciences,2008,105(4):1198-1203.
[37] WANG M Q,WANG Z N,WANG X D,et al. Layer-by-layer assembly of aquaporin z-incorporated biomimetic membranes for water purification[J].Environmental Science & Technology,2015,49(6):3761-3768.
[38] SUSANNA T H,KRISTINA H,GERHARD F,et al. Structural insights into eukaryotic aquaporin regulation- FEBS Letters[J].Febs Letters,2010,584(12):2580-2588.
[39] WU B,BEITZ E. Aquaporins with selectivity for unconventional permeants[J].Cellular & Molecular Life Sciences Cmls,2007,64 (18):2413-2421.
[40] 田志章,李奕帆,姜忠义,等. 用于生物气提纯的促进传递膜[J].化工学报,2014,65(5):1594-1601.
[41] OTTO B,UEHLEIN N,SDORRA S,et al. Aquaporin tetramer composition modifies the function of tobacco aquaporins[J].Journal of Biological Chemistry,2010,285(41):31253-31260.
[42] KALDENHOFF R. A revised view on cellular CO2transport mechanisms:biophysics, physiology and genomics of aquaporin-facilitated CO2transport in plants[J].Biophysical Journal,2012,102(3):627a.
[43] 王静. 碳酸酐酶用于二氧化碳捕集的研究进展[J].化学工业与工程技术,2012(6):40-43.
[44] HULIKOVA A,SWIETACH P. Rapid CO2permeation across biological membranes: implications for CO2venting from tissue[J].Faseb Journal,2014,28(7):2762-2774.
[45] 李春秀,姜笑辰,邱勇隽,等. 碳酸酐酶的生理功能、多样性及其在CO2捕集中的应用[J].生物加工过程,2013,11(1):94-103.
[46] WINUM J Y,SUPURAN C T. Recent advances in the discovery of zinc-binding motifs for the development of carbonic anhydrase inhibitors [J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2015,32(2):321-324.
[47] FORSTER R E,GROS G,LIN L,et al. The effect of 4,4'-diisothiocyanato-stilbene-2,2'-disulfonate on CO2permeability of the red blood cell membrane[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(26):15815-15820.
[48] CETINKAYA A,ERDOGAN S. Changes of HCO3-/Cl-exchanger activity during meiotic maturation in Balb/c strain mouse oocytes and zygotes[J].Journal of Reproduction & Development,2008,54(6):492-495.
[49] LI Y F,WANG S F,HE G W,et al. Facilitated transport of small molecules and ions for energy-efficient membranes[J].Chemical Society Reviews,2015,44(1):101-118.
[50] NOBLE R D,GIN D L. Designing the next generation of chemical separation membranes[J].Science,2011,332(6030):674-676.
Research progress on the transfer mechanisms of CO2across biological membranes
JIANG Zhongyi1,2,ZHANG Ning1,2,HUANG Tong1,2,REN Yanxiong1,2,WANG Lei1,2,WANG Shaofei1,2
(1Collaborative Innovation Center of Chemical Science and Engineering(Tianjin),Tianjin 300072,China;2Key Laboratory for Green Chemical Technology of Ministry of Education,School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
Abstract:CO2,as a vital metabolic product and reaction substrate in living organisms,can make gas exchange with external environment,which is crucial to ensure the normal physiological activities of living organisms. The transfer of CO2in organisms,especially in cells,is of great significance for controlling the emission of CO2,constructing efficient carbon cycle and exploring the carbon capture technology. This review presents a brief overview of the research progress on CO2transport mechanisms in organisms,including the detailed analysis of different models about the CO2transmembrane transport mechanisms,and in particular the facilitated transport of CO2by aquaporin protein,with the conclusion that the aquaporin-mediated CO2permeation plays an important role in membrane with a low intrinsic CO2permeability. Recent researches also show that the water channels and central pore along the fourfold axis of the tetramer of aquaporin are supposed to function in the CO2transmembrane transport. Moreover,the existence of carbonic anhydrase and HCO3–-Cl–transporter can accelerate intracellular acidification process,thus increase the CO2transmembranetransport rate. This review could offer theoretical reference for developing newbiomimetic membrane materials and carbon capture technology.
Key words:carbon dioxide;biofilm;solution-diffusion;aquaporin;facilitated transport
中图分类号:Q 241
文献标志码:A
文章编号:1000–6613(2016)06–1845–07
DOI:10.16085/j.issn.1000-6613.2016.06.026
收稿日期:2016-01-29;修改稿日期:2016-03-12。
基金项目:国家自然科学基金(91534126)、国家高技术研究发展计划(2012AA03A611)及国家杰出青年科学基金(21125627)项目。

