生物制造过程中的微生物生长与调控
侯慧,李春
(北京理工大学生命学院生物工程系,北京 100081)
生物制造过程中的微生物生长与调控
侯慧,李春
(北京理工大学生命学院生物工程系,北京 100081)
摘要:提高生物基产品的产量和生产效率是生物制造发展的目标。由于微生物具有生长快、营养要求简单和基因操作简便等特点,常用作生物基产品制造过程中的底盘宿主,因此,产品制造过程中微生物细胞的生长与调控尤为重要,其生长调控会直接或间接地影响生物基产品的合成效率。微生物的生长不仅受外界环境如温度、溶氧量、pH等的影响,而且还受微生物本身的生长与调控机制如细胞分裂调控、必需基因表达调控、程序化死亡等的影响。本文综述了利用分子生物学、合成生物学和系统生物学等方法对微生物细胞生长和分裂过程进行分子调控,以提高生物反应速率和目标产物的产量,为化工、食品、生物医药以及环境保护等领域构建高效的生物制造工艺提供新思路。
关键词:生物制造;细胞生长;分裂调控;必需基因;程序化死亡;生物产业
第一作者:侯慧(1989—),女,硕士研究生。E-mail 39houhui@sina.com。
联系人:李春,教授,研究方向为生物催化、酶工程、生物反应、生物能源。E-mail lichun@bit.edu.cn。
随着科学技术的不断发展,生命科学和生物制造技术取得突破性进展,生物基产品的生产技术不断进步,产品质量不断提高,生物制造产业快速发展。生物制造是生物技术与工业制造技术相融合交叉形成的一个新兴制造领域,将现代生物技术和生命科学应用于生产和经济社会相关领域,为社会提供商品和服务,主要包括生物基化学品、生物医药、生物能源和食品等。我国已建成与生物制造研发相关的20家国家工程研究中心、15家国家工程实验室和40家国家级企业技术中心,并逐渐形成一定规模的生物制造体系。我国科研人员在微生物基因组工程技术、代谢工程技术、合成生物技术等方面不断取得创新突破,一批大宗发酵产品的国际竞争力实现了大幅提升,创造了巨大的经济与环境效益,多种生物产品的生产技术达到了国际领先水平,生物制造的发展正在为世界经济增长注入新的活力,加速了生物产业化发展进程,预计到2025年,全球生物基产品的产值将超过5000亿美元[1-3]。
但是在生物制造发展过程中,还有许多关键问题和技术难点没有得到很好的解决,有待于进一步去探讨。生物制造过程涉及动物、植物和微生物细胞的生长与调控,其中90%以上利用微生物代谢用于生产。微生物生长快、种类多、特性广,在长期进化过程中形成了完整的代谢调节系统[4],为生物制造的发展提供了基础材料和丰富的基因资源。另外,微生物基因组较小、简单易操作,以微生物代谢为基础的生物制造可以巧妙地通过基因组的设计、改造和再设计来创造新的工艺和合成更多的产品,为生物制造过程开辟了新天地。由于微生物的生长调控与高效生物制造密切相关,是生物制造过程中的关键控制点,因此,通过调控微生物生长可以直接、高效地提高其代谢过程中酶的活性和物质转化效率,进而提高生物制造过程中产品的产量和生产效率。然而,微生物细胞的生长不仅受外界环境如温度、溶氧量、pH等的影响,而且还受微生物本身的生长与调控机制如细胞分裂调控、必需基因表达调控、程序化死亡等的影响,本文将从微生物细胞生长与调控的分子机制来综述如何调节和提升生物制造水平。
1 产物合成与微生物生长

表1 生物制造产品举例
随着当代生物科学特别是生物化学、分子生物学、基因工程、细胞生物学等学科技术与理论的成熟,人们对核酸、蛋白质、多糖、生物膜等大分子的研究已经达到新的广度和深度,如果将上述成果应用到工程制造领域,那么人们将进入一个全新的生物技术时代——生物制造。生物制造产品举例见表1。生物制造应用现代生物技术进行大规模物质加工与转化,以微生物细胞或酶蛋白为催化剂进行化学品合成,并应用于化工、食品、医药、材料、能源和环保等领域。近年来,全球生物材料和化学品迅猛发展,生物基产品合成的基础研究已经具良好的基础,关键技术已经初步形成,DNA测序和快速合成、蛋白组学技术尤其是合成生物学的发展加快了生物制造的产业化进程,特殊微生物、酶的开发使得生物资源的利用趋于多样化、智能化和集成化,越来越多的大宗化学品、精细化学品正在逐步向生物基产品的生产模式过渡,生物制造的产业化发展格局趋于形成。1,3-丙二醇、3-羟基丙酸、丁二酸、类异戊二烯、1,4-丁二醇、异戊醇、丙烯酸等传统化工产品的生物制造路线已经建立,生化纤维及生物塑料等产品已进入产业化应用,生物制造以其原料来源广泛、可再生、加工方式清洁、高效并且环境友好的优势,将成为传统化工产业的有益的补充和完善。
生物制造过程控制在生产中发挥着掌控全局的作用,并且对微生物代谢过程中关键酶的活性、中间产物合成、代谢流的平衡和产品合成效率等有重要影响,因此,科学可行的过程控制措施是生物制造的重要内容之一。生物制造的过程控制包括环境参数如温度、pH、溶氧量和营养等以及细胞内部的代谢参数如关键酶的改造、代谢途径的重构与优化、细胞生长与调控等,其中微生物细胞生长与调控是主要的影响因素,是微生物代谢变化的反映和单细胞生产能力的衡量标志,对目标产物的合成效率有显著影响。因此,在生物制造过程中微生物细胞生长的可控调节是生物制造过程控制的关键,通过调控微生物细胞生长地快慢来有效控制生物制造过程,以达到提高生物反应速率和目标产物产量的目的。细胞分裂是一切生物体生长、发育和繁殖的基础,与细胞生长密切相关;必需基因是微生物不可或缺的基因,其突变或丢失通常会导致细胞死亡;微生物程序化死亡是维持其种群延续的一种方式。因此,在对微生物本身的生长调控机制进行研究的基础上,采用分子生物学、合成生物学、系统生物学等方法对微生物细胞生长过程中关键基因进行调节,灵活地调控微生物细胞分裂、生长和死亡,以提高反应速率和目标产物的产量在生物制造领域具有广泛应用。
2 微生物细胞的分裂调控与产物合成
细胞分裂是一个细胞分裂为两个细胞的过程,是一切生物体生长、发育和繁殖的基础,它保证遗传物质在前后代细胞中的连续性和稳定性。大多数细菌、古细菌和单细胞真菌以二分裂方式进行分裂,图1为细菌二分裂过程的一个周期[5]。细胞分裂过程中的功能蛋白已经被发现,但是这些蛋白的相互作用关系和精确控制细胞分裂的机制还有待进一步探索。
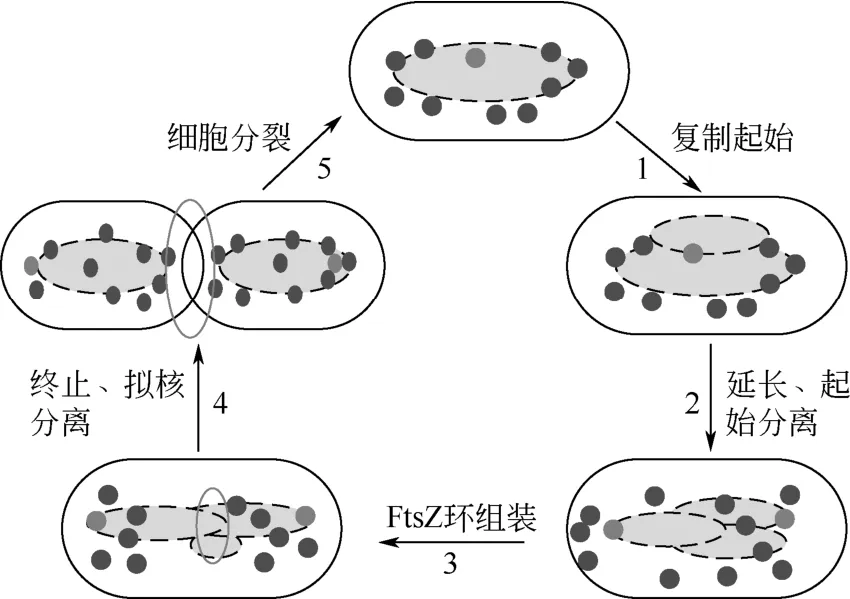
图1 细菌细胞分裂周期[5]
在原核生物细胞分裂中起核心作用的是FtsZ蛋白,它由383个氨基酸组成,是细胞分裂的起始蛋白,并且发挥着细胞骨架的核心作用[6]。细胞正常分裂时,GTP能够诱导FtsZ蛋白聚合,在细胞中部聚集形成Z环状骨架,随后FtsZ招募其他十多种膜结合蛋白在细胞中部组装成环状复合物,使一个细胞压缩分裂成两个子细胞,介导细胞分裂顺利完成。2014年,荷兰代尔夫特理工大学的MASHAGHI 等[7-8]研究了微生物细胞分裂过程中蛋白质之间的相互作用,这些蛋白质包括FtsA、EzrA、ZapA、SepF、ZipA、FtsE、FtsX、FtsK、FtsQ、FtsB、FtsL、FtsW、FtsI、FtsN、AmiC、EnvC等,表明正是这种复杂的蛋白网络关系使得研究人员能够利用现有的蛋白对细胞分裂进行调控,将这些蛋白质通过与FtsZ相互作用对Z环形成的影响可以分为正调控因子和负调控因子。
2.1 正向调控因子对细胞分裂的精细调控
微生物细胞分裂的正调控是指对分裂过程起稳定和促进作用。图2为细胞分裂蛋白相互作用示意图。正向调控因子包括FtsA、ZipA、ZapA、SepF、FtsE、FtsX和EzrA,它们通过与FtsZ蛋白相互作用参与细胞分裂的调节,稳定Z环的形成,促进细胞正常分裂。例如,ABC运载体FtsE和FtsX可以促进大肠杆菌细胞分裂,它们向大肠杆菌分裂位置的募集需要FtsZ、FtsA和ZipA,但不需要FtsK、FtsQ和FtsI[9]。而FtsA 和ZipA都是通过诱导FtsZ原丝形成集束来稳定Z环的形成,如缺乏其中任何一个蛋白会使细胞存活率降低,细胞变长。EzrA不是通过与FtsZ而是与FtsA相互作用来行使功能的,当细胞内EzrA蛋白含量下降时,枯草芽孢杆菌细胞长度明显变长[10]。
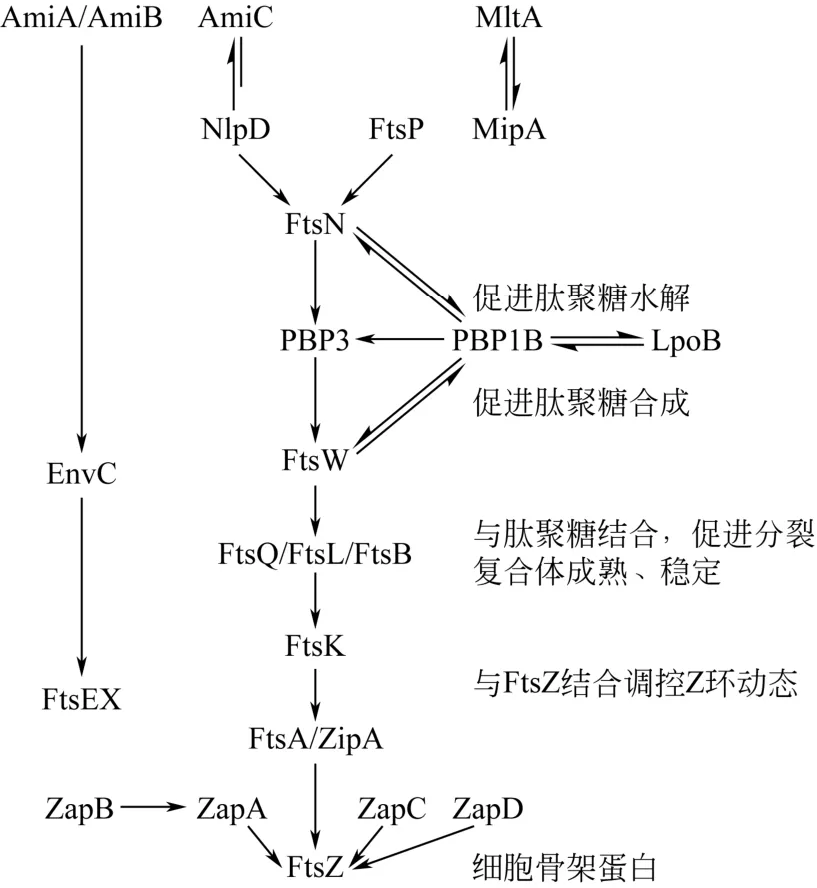
图2 细胞分裂蛋白相互作用
2.2 负向调控因子对细胞分裂的精细调控
微生物细胞分裂的负调控是指对细胞分裂过程起抑制作用。负向调控因子包括SulA蛋白、FtsH蛋白和Min系统,它们通过与FtsZ蛋白相互作用,阻止其聚合和Z环形成,细胞停止分裂变成长的丝状。在研究SOS介导的细菌分裂时首次发现SulA对细胞分裂具有抑制作用[11],它由169个氨基酸组成,是一个高度保守的细胞分裂抑制因子,可以直接与FtsZ相互作用导致GTP水解无法进行,阻止FtsZ聚合,产生不分裂的长丝状细胞从而抑制细胞分裂[12],当细胞暴露在逆境下时会产生SOS反应,诱导大量SulA蛋白表达,以避免受损的DNA传给子代细胞。而FtsH是一种膜结合的、需要ATP的Zn2+金属蛋白,是ATP酶家族中的一员,广泛存在于真细菌、古细菌及真核细胞中,能够降解膜蛋白和细胞质蛋白[13],SRINIVASAN等[14]构建了7种FtsZ的N端或C端结构缺失的突变株,证明FtsH对突变株均有降解作用。
细菌细胞的分裂还受到Min系统的精细调控[15]。Min系统包括MinC、MinD和MinE基因,它们在细胞两极上阻止FtsZ聚合,影响细胞分裂位点的确定,导致Z环定位异常,细胞不对称分裂产生不含染色体的小细胞,同时还会使细胞分裂受到抑制,产生不分裂的长丝状细胞。MinC蛋白由231个氨基酸组成,其N端含有FtsZ结合结构域,直接与FtsZ蛋白相互作用,抑制FtsZ蛋白的聚合,从而抑制细胞分裂[16]。MinC蛋白的C端含有MinD结合结构域,与其结合形成MinCD复合物,MinD蛋白由270个氨基酸组成,也可以与ATP结合形成复合体结合到细胞膜上[17]。2013年,DILLON等[18]发现oxyR基因能够调控MinD的表达,其突变使MinD表达增加,导致细胞分裂隔膜无法形成,细菌细胞变长。MinE是一个小的功能蛋白,由88个氨基酸组成[19-21],它在细胞中形成螺旋环状结构,从细胞一极向细胞另一极移动,并驱动MinCD复合物在细胞两极间移动。
2.3 细胞分裂调控产物的合成
聚羟基脂肪酸酯是一种可生物降解的环境友好型塑料,2014年,清华大学陈国强课题组[22]为提高聚3-羟基丁酸脂PHB和3-羟基,4-羟基脂肪酸共聚酯P(3HB-co-4HB)的产量,在大肠杆菌中过表达sulA使得大肠杆菌细胞形态呈长丝状,不仅增大了细胞空间,而且使目标产物PHB和P(3HB-co-4HB)的产量与对照相比分别提高了104%和10%。另外,外界添加某些化合物如3-甲氧基苯甲酰胺能够抑制ADP-核糖转移酶,并作用于FtsZ,微弱地抑制枯草芽孢杆菌的分裂,导致细胞溶解[23];血根碱能够阻止FtsZ的聚集,干扰大肠杆菌和枯草芽孢杆菌细胞分裂过程中Z环的形成,具有抗菌活性[24];紫杉烷类化合物能使结核分枝杆菌细胞形成长丝状菌体,具有显著的抗肺结核活性[25];PARADIS-BLEAU 等[26]合成了一系列GTP类似物GAL,能够像GTP一样结合到FtsZ上,使得GTP水解无法进行,大肠杆菌生长受到抑制。
3 必需基因的调控与微生物代谢
必需基因是组成细胞结构、信息传递和加工不可或缺的,其突变或丢失通常会导致细胞死亡[27]。必需基因的数量和功能在不同种类的微生物中差别显著,HUTCHISON等[28]通过基因定位插入失活分析,证明肺炎支原体中有387个必需基因,但其中28%的功能未知。日本和欧盟研究组[29]用相同的方法证明芽胞杆菌中有271个必需基因,它们是细胞生长、分裂、DNA复制、转录、翻译、蛋白质折叠、能量转化和物质代谢必不可少的。MORI课题组[30]通过单基因敲除证明大肠杆菌K12的4288个基因中有341个必需基因,其中有59个功能未知,具体见表2。
甾醇是酿酒酵母细胞膜的重要成分之一,也是细胞生长的重要物质,甾醇合成途径是多酶体系参与的复杂过程,其中的角鲨烯合成酶编码基因Erg9是酿酒酵母的必需基因,其敲除会导致细胞死亡。然而,PARADISE研究组[31]通过下调青蒿酸合成中分支途径关键基因Erg9的表达,将目标产物青蒿酸的产量提高到了100mg/L。必需基因敲除或丢失对细胞生长通常是致死的,但是2014年清华大学陈国强课题组[32]对大肠杆菌中的细胞呼吸必需基因hemD进行敲除,发现大肠杆菌细胞并没有全部死亡,而是仍有少量生长。2015年,哈佛医学院MANDELL等[33]将大肠杆菌改造成营养缺陷体,在其基因组很多位置掺入了人工合成的氨基酸,使其必须依赖这些氨基酸存活,通过这种方法最终使得大肠杆菌的逃逸率降低到10–12。

表2 大肠杆菌K12的必需基因及功能
4 程序化死亡调控与微生物代谢
微生物在不良生长环境下可以自发地抑制生长速度,甚至会自发性死亡以维持整个种群的生存。1997年,德国蒂宾根大学的MADEO等[34]在研究酿酒酵母的细胞分裂周期基因cdc48时首次发现了这种现象,并称之为真菌细胞凋亡;与真菌相似,细菌在生长繁殖过程中会表现出群体行为,为了维持菌群生存表现出与真菌细胞凋亡相似的特点,命名为细菌程序性细胞死亡。细菌和真菌的这两种机制都是为了维持种群延续采取的一种利他方式,但是由于细菌和真菌的结构差异和生存环境的不同,它们程序化死亡的机制是有区别的。
4.1 真菌细胞凋亡
真菌细胞凋亡机制与细菌不同之处在于不存在细菌特有的毒素-抗毒素系统,研究发现,大约40%是由胱天蛋白酶介导的,而胱天蛋白酶非依赖的凋亡途径主要与线粒体内的凋亡诱导因子和核酸内切酶有关。
4.1.1 细胞凋亡正调控机制
细胞凋亡的正调控是指对凋亡过程起促进作用。正调控因子包括细胞色素C、肌动蛋白、NADH氧化酶、核酸内切酶和活性氧自由基等,大部分通过激活胱天蛋白酶引起凋亡,它在真菌凋亡中起核心作用[35]。例如,细胞色素C是线粒体电子传递链的重要组成部分,通常位于线粒体膜间隙,在凋亡因素刺激下从线粒体释放到胞浆与凋亡蛋白酶激活因子结合,诱导其变构并寡聚化形成寡聚体,进一步结合前胱天蛋白酶,激活胱天蛋白酶引发级联反应,导致细胞凋亡[36]。肌动蛋白是构成细胞骨架的主要成分,其表达水平与细胞形态变化密切相关,细胞凋亡时,肌动蛋白网络结构遭到破坏,导致线粒体膜电位去极化,细胞内活性氧自由基累积,而肌动蛋白稳定性的提高能明显降低细胞内活性氧自由基水平,延长细胞寿命[37]。NADH氧化酶在能量代谢和氧化还原代谢中发挥作用,在凋亡因素的刺激下被某些蛋白酶水解,从线粒体释放到细胞质中,然后被转移到细胞核中,降解核DNA和质粒 DNA,引起DNA断裂和染色体凝集,NADH氧化酶过表达可以促进过氧化氢所致的细胞凋亡[38]。活性氧自由基不仅可以氧化细胞内的生物大分子引起细胞损伤,而且可以激活胱天蛋白酶引起细胞凋亡[39]。
4.1.2 细胞凋亡负调控机制
细胞凋亡的负调控是指对细胞凋亡过程起延缓作用,凋亡抑制蛋白通过与胱天蛋白酶结合,抑制其与底物的结合,发挥抗凋亡作用。负调控因子包括凋亡抑制蛋白和超氧化物歧化酶等,例如,Bir1p是真菌中唯一的凋亡抑制蛋白家族成员[40],其过表达可以保护细胞免受过氧化氢或衰老导致的细胞凋亡,在纺锤体稳定及细胞分裂中发挥重要作用。同样,超氧化物歧化酶过表达可降低细胞中活性氧自由基的含量,延长细胞寿命[39]。
4.2 细菌程序性细胞死亡
细菌的程序性细胞死亡是由其自身的基因调控的,分为两类:一类发生在细菌功能性分化时,另一类是由毒素-抗毒素系统介导的,近几年的研究工作主要针对后者。
毒素-抗毒素系统由一对编码特定组分的基因组成,下游基因编码的毒素稳定,可以抑制细菌生长导致细胞死亡;上游基因编码的抗毒素不稳定,可以使毒素失活。正常情况下这两种物质在细菌体内维持动态平衡,不会对细胞产生毒害。毒素-抗毒素系统中的毒素是蛋白质,它通过影响细菌DNA的复制、mRNA稳定性、细胞分裂和ATP合成等多种方式发挥毒性作用,根据抗毒素种类的不同可以分为五种类型。类型Ⅰ中的抗毒素为不稳定的反义RNA分子,2013年NATALIE等[41]证实在枯草芽孢杆菌中,抗毒素SR4不仅会抑制毒素bsrG mRNA的翻译,而且会促进毒素bsrG mRNA的降解。类型Ⅱ中的抗毒素为不稳定的蛋白质[42],与毒素结合形成复合物抑制它的毒性作用。类型Ⅲ中的抗毒素为RNA,2013年SAMSON等[43]证实AbiQ蛋白是一种核糖核酸内切酶,在体内特异的切割其同源的抗毒素RNA。类型Ⅳ中的抗毒素为蛋白质,但是它不是和毒素形成复合物,而是直接抑制毒素在细胞靶点的作用来抑制它的毒性,2013年MASUDA 等[44]在大肠杆菌中发现了第一个Ⅳ型系统,毒素CbtA能抑制细菌骨架蛋白MreB和细胞分裂蛋白FtsZ的聚合,而抗毒素YeeU能够增强它们的聚合。类型Ⅴ中的抗毒素为稳定的蛋白质,2012年WANG 等[45]首次发现了Ⅴ型系统,毒素GhoT可导致细胞死亡,抗毒素作为一种序列特异性的核酸内切酶切割GhoT的mRNA从而阻止其翻译。
4.3 微生物程序化死亡调控群体数量
2015年,美国耶鲁大学的GALLAGHER等[46]在大肠杆菌中构建了一个毒素-抗毒素基因线路,诱导型启动子pBAD调控表达的EcoRI核酸内切酶通过剪切大肠杆菌基因组EcoRI位点使细胞死亡,同理,pLtetO调控表达的EcoRI甲基化酶能保护基因组上的EcoRI甲基化位点免受EcoRI核酸内切酶的切割,最终大肠杆菌的逃逸率仅为9.4×10–7,成功实现了对大肠杆菌细胞生长的调控。细菌程序性细胞死亡也是一种细菌群体感应调节产生的行为,细菌密度达到一定阈值时通过信号分子来启动相关基因的表达,在合成生物学领域,群体感应被广泛用来调节细菌的很多生理功能,例如毒素产生、质粒转移和抗生素合成等。目前最普遍的群体感应分子是高丝氨酸内酯AHL,如图3所示。1997年DENNY等[47]发现在青枯菌中存在一种群体感应分子3-羟基棕榈酸甲酯可以调节青枯菌的密度;2000年DONG等[48]在芽孢杆菌240B1中克隆到了世界上第一个AHL内酯酶基因aiiA,它表达的蛋白可以水解AHL的内酯键,钝化其活性并破坏病原菌群体感应信号传导,使病原菌死亡;2005年PARK等[49]从链霉菌M664菌株中克隆到了能够降解AHL的基因ahlM,表达的蛋白也能够降低病原菌的毒性。

图3 革兰氏阴性菌的群体感应系统
5 外界环境对微生物生长的调控
影响微生物细胞生长的环境因素主要包括温度、pH、溶氧量等,适宜的环境条件对细胞生长起促进作用,提高产品的合成速率和产量,而不良环境条件对微生物细胞的影响表现在以下几个方面:抑制细胞的分裂及其生长,影响蛋白质合成使其变性聚集,破坏细胞骨架,阻断细胞代谢,降低细胞活力等,最终导致细胞死亡。例如,在微生物呼吸过程中,氧气还原为水的同时形成某些有毒的中间产物如过氧化氢、超氧阴离子等[50],它们可直接作用于代谢途径中关键基因的复制与转录,对微生物功能产生不利影响,使细胞处于死亡的边缘。然而好氧微生物由于具有降解这些产物的酶,如过氧化氢酶、过氧化物酶、超氧化物歧化酶使得细胞不受破坏,严格厌氧菌由于缺乏这些酶,容易受其毒害致死。生物制造过程控制如图4所示。
6 结 语
微生物细胞的生长与调控在产物合成过程中有着举足轻重的作用。目前,利用分子生物学、合成生物学等相关技术已经初步阐明了细胞生长机制,在细胞生长机制的基础上灵活地调控细胞密度,控制细胞生长速率和产品合成效率,在推动我国生物制造业向规模化、集成化、智能化、绿色化发展方面具有广阔的应用前景。

图4 生物制造过程控制
参 考 文 献
[1] 刘水英,李新生,杨智勇,等. 中国生物制造研究现状与展望[J]. 安徽农业科学,2013,41(24):9930-9933.
[2] 石维忱. 生物制造产业“十二五”时期发展展望[J]. 北京工商大学学报(自然科学版),2011,29(5):1-5.
[3] 陈达,戎志梅. 绿色生物制造产业迎来发展新机遇[J]. 精细与专用化学品,2013,21(12):1-4.
[4] ROBERT S, NICOLA Z, MATTIA Z,et al. Multidimensional optimality of microbial metabolism[J]. Science,2012,336(6081):601-604.
[5] ANCHUN C,HILL N S,PETRA A L. Cell size control in bacteria[J]. Current Biology,2012,22(9):340-349.
[6] MOAT A G,FOSTER J W,SPECTOR M P. Bacterial cell division[J]. Annual Review of Cell and Developmental Biology,1997,13(1):395-424.
[7] MASHAGHI A,DEKKE C. Systems and synthetic biology approaches to cell division[J]. System and Synthetic Biology,2014,8(3):173–178.
[8] EGAN A J F,VOLLMER W. The physiology of bacterial cell division[J]. Annals of the New York Academy of Sciences,2013,1277(12):8-28.
[9] LOCK R L,HARRY E J. Cell-division inhibitors:new insights for future antibiotics[J]. Nature Reviews Drug Discovery,2008,7(4):324-338.
[10] SINGH J K,MAKDE R D,KUMAR V,et al. A membrane protein,EzrA,regulates assembly dynamics of FtsZ by interacting with the C-terminal tail of FtsZ[J]. Biochemistry,2007,46(38):11013–11022.
[11] CORDELL S C,ROBINSON E J H,JAN L. Crystal structure of the SOS cell division inhibitor SulA and in complex with FtsZ[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(13):7889-7894.
[12] DAJKOVIC A,MUKHERJEE A L J. Investigation of regulation of FtsZ assembly by SulA and development of a model for FtsZ polymerization[J]. Journal of Bacteriology,2008,190(7):2513–2526.
[13] KIHARA A,AKIYAMA Y,ITO K. FtsH is required for proteolytic elimination of uncomplexed forms of SecY,an essential protein translocase subunit[J]. Proceedings of the National Academy of Sciences of the United States of America,1995,92(10):4532-4536.
[14] SRINIVASAN R,RAJESWARI H,AJITKUMAR P. Analysis of degradation of bacterial cell division protein FtsZ by the ATP-dependent zinc-metalloprotease FtsH in vitro[J]. Microbiological Research,2008,163(1):21-30.
[15] PICHOFF S,LUTKENHAUS J. Escherichia coli division inhibitor MinCD blocks septation by preventing Z-ring formation[J]. Journal of Bacteriology,2001,183(22):6630-6635.
[16] HU Z,MUKHERJEE A,PICHOFF S,et al. The MinC component of the division site selection system in Escherichia coli interacts with FtsZ to prevent polymerization[J]. Proceedings of the National Academy of Sciences of the United States of America,1999,96(26):14819–14824.
[17] HU Z,LUTKENHAUS J. Topological regulation of cell division in Escherichia coli:spatiotemporal oscillation of MinD requires stimulation of its ATPase by MinE and phospholipid[J]. Molecular Cell,2001,7(6):1337–1343.
[18] PARTI R P,HORBAY M A,LIAO M,et al. Regulation of minD by oxyR in Neisseria gonorrhoeae[J]. Research in Microbiology,2013,164(5):406-415.
[19] HOUMAN G,THIERRY D,HART C T,et al. Appropriation of the MinD protein-interaction motif by the dimeric interface of the bacterial cell division regulator MinE[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107 (43):18416-18421.
[20] KING G F,ROEL S L,PAN B,et al. The dimerization and topological specificity functions of MinE reside in a structurally autonomous C-terminal domain[J]. Molecular Microbiology,1999,31(4):1161–1169.
[21] PAOLA B,SENTHIL A,PETRA S,et al. MinC,MinD,and MinE drive counter-oscillation of early-cell-division proteins prior to Escherichia coli septum formation[J]. mBio,2013,4(6):644-646.
[22] WANG Y,WU H,JIANG X,et al. Engineering Escherichia coli for enhanced production of poly(3-hydroxybutyrate-co-4- hydroxybutyrate) in larger cellular space[J]. Metabolic Engineering,2014,25:183-193.
[23] OHASHI Y,CHIJIIWA Y. The lethal effect of a benzamide derivative,3-methoxybenzamide,can be suppressed by mutations within a cell division gene,ftsZ,in Bacillus subtilis[J]. Journal of Bacteriology,1999,181(4):1348-1351.
[24] BEURI T K,SANTRA M K,DULAL P. Sanguinarine blocks cytokinesis in bacteria by inhibiting FtsZ assembly and bundling[J]. Biochemistry,2005,44(50):16584-16593.
[25] HUANG Q,KIRIKAE F,KIRIKAE T,et al. Targeting FtsZ for antituberculosis drug discovery:noncytotoxic taxanes as novel antituberculosis agents[J]. Journal of Medicinal Chemistry,2005,49 (2):463-466.
[26] PARADIS-BLEAU C,BEAUMONT M,SANSCHAGRIN F,et al. Parallel solid synthesis of inhibitors of the essential cell division FtsZ enzyme as a new potential class of antibacterials[J]. Bioorganic & Medicinal Chemistry,2007,15(3):1330-1340.
[27] D’ELIA M A,PEREIRA M P,BROWN E D. Are essential genes really essential[J]. Trends in Microbiology,2009,17(10):433-438.
[28] HUTCHISON C A,PETERSON S N,GILL S R,et al. Global transposon mutagenesis and a minimal mycoplasma genome[J]. Science,1999,286(5447):2165-2169.
[29] KOBAYASHI K,EHRLICH S D,ALBERTINI A,et al. Essential Bacillussubtilis genes[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(8):4678-4683.
[30] BABA T,MORI H. The construction of systematic in-frame,single-gene knockout mutant collection in Escherichia coli K-12[M]. Microbial Gene Essentiality:Protocols and Bioinformatics,2008:171-181.
[31] PARADISE E M,JAMES K,ROSSANA C,et al. Redirection of flux through the FPP branch-point in Saccharomyces cerevisiae by down-regulating squalene synthase[J]. Biotechnology and Bioengineering,2008,100(2):371–378.
[32] WANG Y,LI Y,XU T,et al. Experimental evidence for growth advantage and metabolic shift stimulated by photophosphorylation of proteorhodopsin expressed in Escherichia coli at anaerobic condition[J]. Biotechnology and Bioengineering,2015,112(5):947-956.
[33] MANDELL D J,LAJOIE M J,MEE M T,et al. Biocontainment of genetically modified organisms by synthetic protein design[J]. Nature,2015,518:55-60.
[34] MADEO F,FROHLICH E,FROHLICH K U. A yeast mutant showing diagnostic markers of early and late apoptosis[J]. Journal of Cell Biology,1997,139(3):729-734.
[35] MADEO F,HERKER E,MALDENER C,et al. A caspase-related protease regulates apoptosis in yeast[J]. Molecular Cell,2002,9(4):911-917.
[36] ZHIVOTOVSKY B,ORRENIUS S,BRUSTUGUN O T,et al. Injected cytochrome c induces apoptosis[J]. Nature,1998,391(6666):449-450.
[37] GOURLAY C W,AYSCOUGH K R. The actin cytoskeleton in ageing and apoptosis[J]. Fems Yeast Research,2005,5(12):1193-1198.
[38] MIRAMAR M,COSTANTINI P L,SARAIVA L,et al. NADH oxidase activity of mitochondrial apoptosis-inducing factor[J]. Journal of Biological Chemistry,2001,276(19):16391-16398.
[39] PAOLA F,LUISA B,RAFFAELLO V,et al. Superoxide is a mediator of an altruistic aging program in Saccharomyces cerevisiae[J]. Journal of Cell Biology,2004,166(7):1055-1067.
[40] LI F,FLANARY P L,ALTIERI D C,et al. Cell division regulation by BIR1,a member of the inhibitor of apoptosis family in yeast[J]. Journal of Biological Chemistry,2000,275(10):6707-6711.
[41] NATALIE J,SABINE B. One antitoxin-two functions:SR4 controls toxin mRNA decay and translation[J]. Nucleic Acids Research,2013,41( 21):9870-9880.
[42] OTSUKA Y,YONESAKI T. Dmd of bacteriophage T4 functions as an antitoxin against Escherichia coli LsoA and RnlA toxins[J]. Molecular Microbiology,2012,83(4):669-681.
[43] SAMSON J E,SPINELLI S,CAMBILLAU C,et al. Structure and activity of AbiQ,a lactococcal endoribonuclease belonging to the type Ⅲtoxin-antitoxin system[J]. Molecular Microbiology,2013,87(4):756 -768.
[44] MASUDA H,TAN Q,AWANO N,et al. YeeU enhances the bundling of cytoskeletal polymers of MreB and FtsZ,antagonizing the CbtA (YeeV) toxicity in Escherichia coli[J]. Molecular Microbiology,2012,84(5):979-989.
[45] WANG X,LORD D M,CHENG H Y,et al. A new type V toxin-antitoxin system where mRNA for toxin GhoT is cleaved by antitoxin GhoS[J]. Nature Chemical Biology,2012,8(10):855-861.
[46] GALLAGHER R R,PATEL J R,INTERIANO A L,et al. Multilayered genetic safeguards limit growth of microorganisms to defined environments[J]. Nucleic Acids Research,2015,43:1945-1954.
[47] FLAVIER A B,SCHELL M A,DENNY T P,et al. Identification of 3-hydroxypalmitic acid methyl ester as a novel autoregulator controlling virulence in Ralstonia solanacearum[J]. Molecular Microbiology,1997,26(2):251-259.
[48] DONG Y H,XU J L,LI X Z,et al. AiiA,an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(7):3526-3531.
[49] PARK S Y P,KANG H O,TANG H S,et al. Identification of extracellular N-acylhomoserine lactone acylase from a streptomyces sp. and its application to quorum quenching[J]. Applied and Environmental Microbiology,2005,71(5):2632-2641.
[50] MORANO K A,GRANT C M,MOYE-ROWLEY W S. The response to heat shock and oxidative stress in Saccharomyces cerevisiae[J]. Genetics,2011,190(4):1157-1195.
Regulation and control of microbial growth in bio-manufacturing processes
HOU Hui,LI Chun
(Department of Biological Engineering,School of Life Science,Beijing Institute of Technology,Beijing 100081,China)
Abstract:Improving the yield and production efficiency of bio-based products is the goal of bio-manufacturing and bio-industry. Because of the advantages of fast growth,simple nutritional requirement and convenient gene manipulation,microorganisms are often used as chassis of bio-based products. Thus,the growth regulation and control of microbial cells are particularly important in the process of bio-manufacturing,as the microbial cell growth will directly or indirectly affect the synthesis efficiency of bio-based products. The growth of microorganisms can be affected not only by external conditions such as temperature,dissolved oxygen and pH,but also by their own cell growth mechanism. The cell growth mechanism can be referred to cell division regulation,essential genes expression regulation and programmed cell death. This paper reviewed the molecular regulation of microbial cell growth and division through molecular biology,synthetic biology and systematic biology methods to improve the biological reaction rate and the yield of target products,which provides new insights for the development of efficient bio-manufacturing process in chemical engineering,food industry,bio-pharmaceuticals,environmental protection and other fields.
Key words:bio-manufacturing;cell growth;cell division regulation;essential genes;programmed cell death;bio-industry
中图分类号:Q 81
文献标志码:A
文章编号:1000–6613(2016)06–1837–08
DOI:10.16085/j.issn.1000-6613.2016.06.025
收稿日期:2015-11-26;修改稿日期:2015-12-15。
基金项目:国家杰出青年科学基金项目(21425624)。

