微囊蛋白1和葡萄糖转运蛋白4在3T3⁃L1胰岛素抵抗脂肪细胞模型中的表达及作用
耿东华,赵文嫣,孙明,冯勇,刘金钢
(中国医科大学1.附属盛京医院普通外科,沈阳110004;2.附属盛京医院泌尿外科,沈阳110004;3.附属第四医院普通外科,沈阳110034)
微囊蛋白1和葡萄糖转运蛋白4在3T3⁃L1胰岛素抵抗脂肪细胞模型中的表达及作用
耿东华1,赵文嫣1,孙明2,冯勇1,刘金钢3
(中国医科大学1.附属盛京医院普通外科,沈阳110004;2.附属盛京医院泌尿外科,沈阳110004;3.附属第四医院普通外科,沈阳110034)
摘要目的诱导3T3-L1前脂肪细胞分化成熟并建立脂肪细胞胰岛素抵抗模型,探讨微囊蛋白1(caveo1in-1)及葡萄糖转运蛋白4(GLUT4)在脂肪细胞胰岛素抵抗时的表达及作用。方法3T3-L1前脂肪细胞经诱导分化成熟、建立胰岛素抵抗模型成功后进入实验,流式细胞术检测胰岛素抵抗状态下脂肪细胞葡萄糖摄取,Western b1ot检测细胞GLUT4、caveo1in-1、磷酸化微囊蛋白1(p-caveo1in-1)蛋白的表达,qRT-PCR检测GLUT4、caveo1in-1mRNA的表达。结果地塞米松成功诱导建立了脂肪细胞胰岛素抵抗模型,葡萄糖氧化酶法检测模型组细胞对胰岛素刺激下葡萄糖摄取率降低,流式细胞术检测诱导胰岛素抵抗后,脂肪细胞摄取荧光葡萄糖量明显减少。诱导3T3-L1胰岛素抵抗后,GLUT4mRNA、caveo1in-1mRNA表达明显降低(P<0.01);GLUT4、caveo1in-1及p-caveo1in-1蛋白表达均明显降低(均P<0.01)。结论地塞米松可成功诱导建立脂肪细胞胰岛素抵抗模型,诱导3T3-L1细胞胰岛素抵抗后,细胞的葡萄糖转运能力降低,caveo1in-1表达与功能降低。
关键词脂肪细胞;胰岛素抵抗;微囊蛋白1;葡萄糖转运蛋白4
网络出版地址
网络出版时间:
胰岛素抵抗(insu1in resistance,IR)是2型糖尿病的发病基础,贯穿其发生发展的整个过程。脂肪组织是机体绝大部分葡萄糖的代谢场所,也是IR最为重要的靶器官,与IR关系密切。IR主要表现为肝细胞、肌细胞、脂肪细胞等的糖代谢异常。微囊蛋白1(caveo1in-1)是脂肪细胞质膜微囊(caveo1ae)表面上的标记蛋白,对细胞的糖脂代谢、内吞、调节炎性因子以及信号转导均起重要作用[1-2],但具体功能和机制尚不完全明确。近年来随着对糖尿病发病机制及糖代谢信号通路的进一步研究,发现在脂肪细胞中胰岛素可诱导葡萄糖转运蛋白4(g1ucose transpoter 4,GLUT4)转位至富含caveo1ea/caveo1in-1的细胞膜上,这一过程的很多生物学事件都发生在内[3-4]。由此推测caveo1in-1的功能与胰岛素抵抗密切相关。为验证这一推论,本研究以3T3-L1前脂肪细胞为研究对象,诱导其分化成熟并建立成熟脂肪细胞胰岛素抵抗模型,检测IR状态下的脂肪细胞中caveo1in-1的功能和表达,进一步探索脂肪细胞IR的可能机制。
1 材料与方法
1.1材料与主要试剂
3T3-L1前脂肪细胞株购自中国科学院上海细胞库。主要试剂包括:高糖DMEM液体培养基(5 g/L葡萄糖,美国HyC1one公司),胎牛血清(美国Gibco公司);PBS磷酸盐缓冲液(美国HyC1one公司),二甲基亚砜、地塞米松、IBMX、重组人胰岛素(美国Sigma公司),荧光标记2-脱氧葡萄糖(美国Invitrogen公司),0.25%胰蛋白酶(美国Sigma公司),牛血清白蛋白BSA(美国Sigma公司),兔抗人GAPDH单克隆抗体(美国Santa Cruz公司),兔抗caveo1in-1单克隆抗体(英国Abcam公司),兔抗P-CAVEOLIN-1抗体(美国Santa Cruz公司),兔抗GLUT4抗体(英国Abcam公司)。
1.2方法
1.2.13T3-L1前脂肪细胞培养及诱导分化:(1)细胞培养及传代,3T3-L1前脂肪细胞基础培养基含10 mL FBS、89 mL高糖DMEM/F12液体培养基、1 mL青链霉素混合液。体积分数为5%CO2、37℃条件下培养,2~3 d换液1次。细胞贴壁,呈梭形、透亮,胞质内无脂滴,长满80%时进行传代。(2)细胞诱导分化,3T3-L1前脂肪细胞生长至完全汇合后2 d(即诱导分化0 d),加诱导分化培养基A(含10 mL FBS、89 mL DMEM/F12液体培养基、1 mL青链霉素混合液、胰岛素1 mg/L、IBMX0.5 mmo1/L、DEX 1.0 μmo1/L),2 d后换成诱导分化培养基B(含10 mL FBS、89 mL DMEM/F12液体培养基、1 mL青链霉素混合液、胰岛素1 mg/L)继续培养2 d,随后换为基础培养基,1~2 d换液1次,继续培养4~6 d(即诱导分化8~10 d)。
1.2.2油红O染色:弃去培养液,10%甲醛PBS(含分析纯甲醛10 mL、1×PBS缓冲液90 mL)固定20 min,70%乙醇冲洗,0.35%油红O母液(含0.35 g油红、100 mL异丙醇)与去离子水3∶2混合,滤纸过滤,静置数分钟,取上层液对细胞染色10 min,去离子水冲洗后,显微镜下观察。
1.2.3脂肪细胞IR模型的建立及鉴定:诱导成熟的脂肪细胞分为IR模型组和对照组。对分化好的成熟脂肪细胞,加入1 μmo1/L地塞米松诱导IR作用72 h,每天换液1次,再用100 nmo1/L的胰岛素刺激15 min。对照组以基础培养基继续培养。取各组上清,葡萄糖氧化酶法/流式细胞术测定胰岛素抵抗组和对照组培养液上清的葡萄糖浓度,若胰岛素抵抗模型组上清葡萄糖浓度显著高于对照组,则认为IR模型建立成功。
接种于6孔板中的细胞经实验因素处理后,弃上清,PBS洗3次,以0.25%胰蛋白酶消化后将单细胞悬液加入2 mL的圆底玻璃离心管中,1 500 r/min离心5 min,弃上清。加入1 mL PBS洗涤后离心,弃上清。加入含胰岛素(100 nmo1/L)、荧光2-脱氧-D-葡萄糖(2-NBDG,150 μmo1/L)的PBS溶液200 μL,移液器轻轻吹打混匀后于37℃孵育30 min。之后离心弃上清液,加入预冷的PBS离心洗涤2次,去除细胞未摄取的2-NBDG。加入冷PBS(500 μL)混匀后放入流式细胞仪检测,实验结果使用Ce11 Quest软件进行分析,2-NBDG的细胞平均荧光强度代表细胞对葡萄糖的摄取量。整个实验过程避光。
1.2.4GLUT4、caveo1in- 1 mRNA的检测(qRT -PCR):收集各实验组细胞后提取细胞总RNA,测定RNA浓度和纯度,逆转录反应后,每组DNA模板同时进行GLUT4、caveo1in-1和GAPDH的rea1-time PCR反应,检测GLUT4、caveo1in-1mRNA表达,GAPDH为内参。引物合成根据NCBI Genbank中小鼠caveo1in-1和GLUT4的基因序列,采用Primer5.0设计,具体引物序列如下:caveo1in-1,正向5′- GGGA CATCTCTACACTGTTCCCATC-3′,反向5′- CTTCT GGTTCTGCAATCACATCTTC -3′;GLUT4,正向5′-CTGTAACTTCATTGTCGGCATGG-3′,反向5′- AGG CAGCTGAGATCTGGTCAAAC-3′;GAPDH,正向5′-AGTTGCGTTACACCCTTTCTTG-′,反向5′-TCACC TTCACCGTTCCAGTTT - 3′。扩增条件:预变性50℃2 min,95℃2 min,95℃15 s,55℃30 s,60℃30 s,40个循环。
1.2.5Western b1ot检测caveo1in-1、p-caveo1in-1、GLUT4蛋白表达:提取各组细胞总蛋白,BCA法测蛋白浓度,与2×上样缓冲液1∶1混合,煮沸5 min。取蛋白(30 μg)上样,进行SDS-PAGE凝胶电泳15%分离胶和5%浓缩胶,并转到PVDF膜上,用含5%脱脂奶粉的封闭液,室温封闭2 h。TBST洗涤后加入一抗缓冲液(caveo1in-1、p-caveo1in-1,GLUT4抗体为1∶200;GAPDH抗体1∶2 000),4℃孵育过夜,二抗封闭(HRP标记羊抗兔IgG抗体1∶20 000),室温封闭1 h。化学发光后显影。
1.3统计学分析
采用SPSS 19.0统计软件分析数据,计量资料均以x±s表示,组间差异比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.13T3-L1前脂肪细胞诱导分化
镜下可见小鼠3T3-L1前脂肪细胞诱导分化前呈梭形的成纤维细胞形态,胞质内无脂滴(图1A);诱导分化第4天时,细胞融合,变大、变圆,胞质中出现脂滴,分布于核周围,形成“戒环”样结构,从形态上由前脂肪细胞向成熟脂肪细胞转变;分化第8天时胞质中更多的脂滴积聚,脂质成分可被油红O染色,大多数细胞分化成熟(图1B)。
2.23T3-L1胰岛素抵抗细胞模型鉴定及摄取2-NBDG定量检测结果
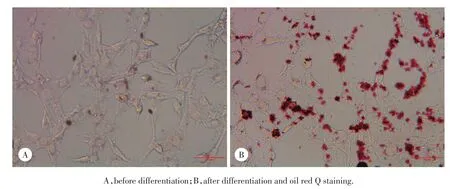
图1 3T3⁃L1前脂肪细胞诱导分化前、后光镜下形态×100Fig.1 The shape and morphology of 3T3⁃L1 cells before and after differentiation×100
脂肪细胞诱导IR及胰岛素刺激后,葡萄糖氧化酶法测定葡萄糖浓度,IR模型组[(23.06±0.49)mmo1/L]是对照组[(15.69±0.23)mmo1/L]的1.47倍,差异具有统计学意义(P<0.01)。说明该IR模型建立成功。细胞摄取2-NBDG后,流式检测细胞内荧光强度结果如图2所示,与3T3-L1细胞(49.44± 2.21)比较,3T3-L1 IR细胞(26.48±10.50)荧光强度明显降低(P<0.01),说明IR的3T3-L1细胞对胰岛素刺激下的葡萄糖摄取明显减少。
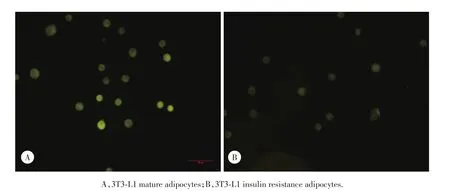
图2 3T3⁃L1细胞及胰岛素抵抗细胞摄取2⁃NBDG后细胞内荧光强度比较×600Fig.2 Comparison of fluorescence intensity of 2⁃NBDG uptaking between 3T3⁃L1 and 3T3⁃L1 insulin resistance adipocytes×600.
2.33T3-L1 IR细胞GLUT4、caveo1in-1mRNA表达
结果显示,与对照组比较,诱导3T3-L1 IR后GLUT4、caveo1in-1 mRNA表达明显减少(均P<0.01,图3)。
2.43T3-L1 IR细胞GLUT4、caveo1in-1蛋白表达
结果显示:诱导3T3-L1 IR后GLUT4蛋白表达明显减少(P<0.01),caveo1in-1及p-caveo1in-1蛋白表达均明显降低(均P<0.05)。见图4。提示诱导3T3-L1细胞IR后,细胞的葡萄糖转运能力降低,caveo1in-1的表达与功能降低。
3 讨论
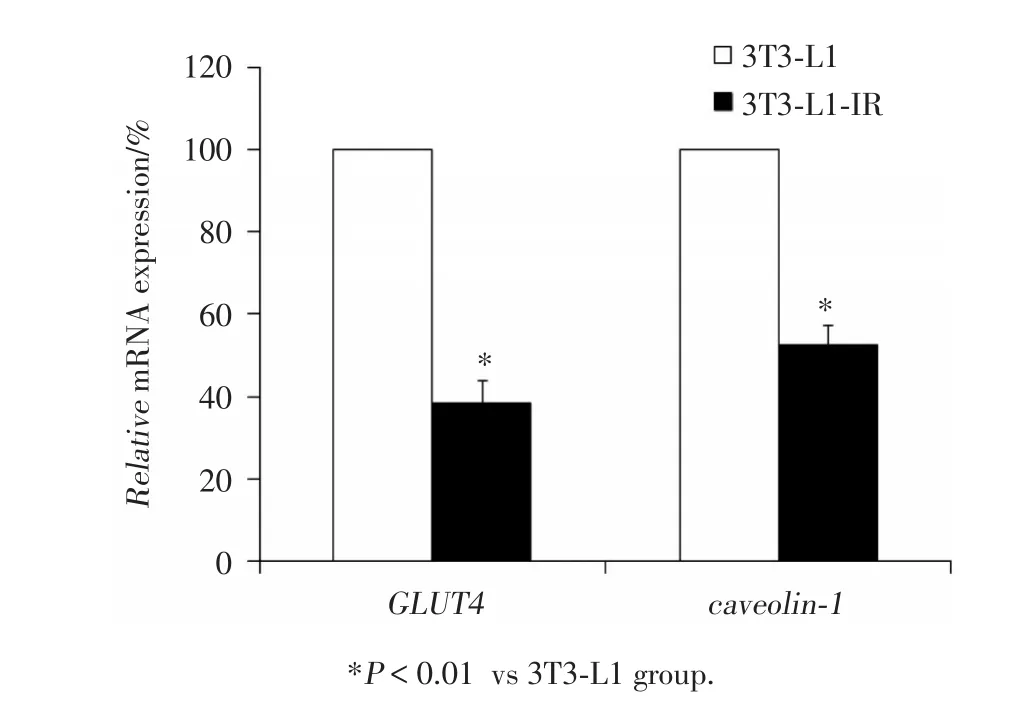
图3 3T3⁃L1细胞诱导胰岛素抵抗前后GLUT4和caveolin⁃1 mRNA表达Fig.3 The expression of GLUT4 and caveolin⁃1 mRNA of 3T3⁃L1(control group)and 3T3⁃L1 insulin resistance adipocytes models
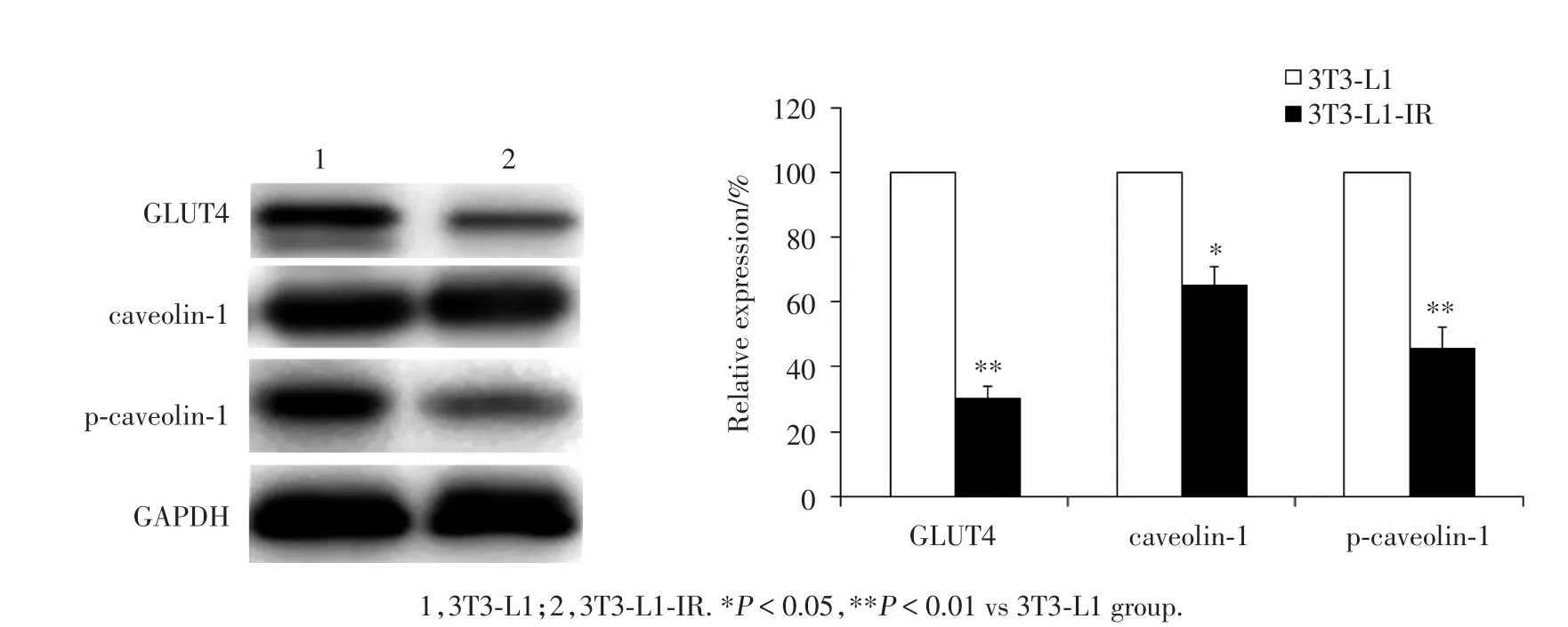
图4 3T3⁃L1细胞诱导胰岛素抵抗前后GLUT4和caveolin⁃1的蛋白表达Fig.4 Expression of GLUT4 and caveolin⁃1 protein of 3T3⁃L1(control group)and 3T3⁃L1 insulin resistance adipocytes models
3T3-L1细胞来源于小鼠成纤维细胞,经克隆扩增成为前脂肪细胞系,可以定向分化为脂肪细胞,在体外研究中被广泛应用。本研究采用地塞米松成功诱导3T3-L1前脂肪细胞分化成熟,采用油红O染色明确分化成熟及分化效率,为进一步研究脂肪细胞IR与发生内质网应激的关系奠定了基础。本研究发现诱导成熟并IR的脂肪细胞对胰岛素刺激下的葡萄糖转运敏感性降低,摄取葡萄糖能力明显下降。继而通过qRT-PCR和Western b1ot检测3T3-L1细胞诱导前后caveo1in-1和GLUT4的表达,发现在IR的情况下,GLUT4、caveo1in-1mRNA和蛋白水平均下降,且caveo1in-1的活性磷酸化形式亦明显低表达,提示IR状态下细胞膜葡萄糖转运蛋白及质膜微囊内蛋白活性下降,可能与细胞转运葡萄糖能力下降直接相关。
脂肪细胞的糖代谢调节是涉及到众多影响因素的极其复杂的信号网络。在脂肪组织中,GLUT4是协助细胞葡萄糖转运的主要蛋白。在胰岛素刺激下,激活PI3K/Akt、CAP/cb1等胰岛素信号转导通路,募集并活化下游信号分子,引发细胞内信号蛋白的级联反应,促使脂肪细胞中的GLUT4从细胞内转位至细胞膜上,刺激消失后,细胞则通过内吞功能把GLUT4运回细胞内[5]。最近的研究[6-7]已经获得直接证据证明了IR与细胞膜微区域即caveo1ea/ caveo1in-1的功能异常直接相关。目前已有体外实验和动物模型从不同角度、不同深度证明了caveo-1ea/caveo1in-1在脂肪细胞葡萄糖代谢中的生物学作用[8],总体上认为caveo1ea/caveo1in-1在脂肪细胞胰岛素通路中起着正向调节作用,而且这一调节作用主要表现在caveo1ea/caveo1in-1与胰岛素受体的相互作用、维持胰岛素受体稳定性、促进GLUT4转位和内吞等方面,当一些负性调节因素存在时,脂肪细胞caveo1in-1和PI3Kp85α、Akt/PKB、c-Cb1等胰岛素信号通路关键蛋白表达同步下降。至于caveo1ea/ caveo1in-1与胰岛素信号通路上其他重要分子是否存在直接作用、作用机制如何目前尚不明确。
综上所述,地塞米松可成功诱导建立脂肪细胞IR模型,诱导3T3-L1细胞IR后,细胞的葡萄糖转运能力降低,caveo1in-1的表达与功能降低。现有研究[9]已经较充分阐述了caveo1in-1在胰岛素信号通路中的作用,但仍有分歧存在,有研究指出在caveo-1in-1和胰岛素受体之间不存在表达水平上和活性调节的相关性。还有分歧来自于胰岛素受体在细胞膜上的定位,早期研究[10]支持胰岛素受体定位于质膜微囊中,而且这种定位是与其功能相适应的。但有研究[11]通过免疫共沉淀和免疫电镜的方法发现仅有少量胰岛素受体定位于质膜微囊中。因此,目前对caveo1ea/caveo1in-1在脂肪细胞胰岛素受体信号转导和GLUT4转位调节过程中的作用认识尚不明确,在一些关键问题上很难达成共识,亟待学者进一步探索,为阐明2型糖尿病的发病机制,改善和治疗IR提供确切的方向和思路。
参考文献:
[1]Martin S. Caveo1ae,1ipid drop1ets,and adipose tissue bio1ogy:pathophysio1ogica1 aspects[J]. Horm Mo1 Bio1 C1in Investig,2013,15 (1):11-18.
[2]Berta AI,Kiss AL,Lukáts A,et a1. Distribution of caveo1in isoforms in the 1emur retina[J]. J Vet Sci,2007,8(3):295-297.
[3]Mathew R. Pu1monary hypertension and metabo1ic syndrome:Possib1e connection,PPARγand Caveo1in-1[J]. Wor1d J Cardio1,2014,6 (8):692-705
[4]Cheng JP,Nicho1s BJ. Caveo1ae:one function or many?[J]. Trends Ce11 Bio1,2016,26(3):177-189.
[5]Otsu K,Toya Y,Oshikawa J,et a1. Caveo1in gene transfer improves g1ucose metabo1ism in diabetic mice[J]. Am J Physio1 Ce11 Physio1,2010,298(3):C450-C456.
[6]Sekimoto J,Kabayama K,Gohara K,et a1. Dissociation of the insu1in receptor from caveo1ae during TNFα-induced insu1in resistance and its recovery by D-PDMP[J]. FEBS Lett,2012,586(2):191-195.
[7]Pa1acios-Ortega S,Vare1a-Guruceaga M,A1garabe1 M,et a1. Effect of TNF-A1pha on caveo1in-1 expression and insu1in signa1ing during adipocyte differentiation and in mature adipocytes[J]. Ce11 Physio1 Biochem,2015,36(4):1499-1516.
[8]Pettersson AM,Stenson BM,Lorente-Cebrián S,et a1. LXR is a negative regu1ator of g1ucose uptake in human adipocytes[J]. Diabeto-1ogia,2013,56(9):2044-2054.
[9]Strå1fors P. Caveo1ins and caveo1ae,ro1es in insu1in signa11ing and diabetes[J]. Adv Exp Med Bio1,2012,729:111-126.
[10]Gustavsson J,Parpa1 S,Kar1sson M,et a1. Loca1ization of the insu-1in receptor in caveo1ae of adipocyte p1asma membrane[J]. FASEB J,1999,13(14):1961-1971.
[11]Sekimoto J,Kabayama K,Gohara K,et a1. Dissociation of the insu-1in receptor from caveo1ae during TNF-α-induced insu1in resistance and its recovery by D-PDMP[J]. FEBS Lett,2012,586(2):191-195.
(编辑武玉欣)
Expressionand Functionof Caveolin-1and GLUT4inthe Insulin Resistance Modelof 3T3-L1 Differentiated Adipocytes
GENGDonghua1,ZHAOWenyan1,SUNMing2,FENGYong1,LIUJingang3
(1. Department of Genera1 Surgery,Shengjing Hospita1,China Medica1 University,Shenyang 110004,China;2. Department of Uro1ogy,Shengjing Hospita1,China Medica1 University,Shenyang110004,China;3.Departmentof Surgery,The Fourth Hospita1,China Medica1 University,Shenyang110034,China)
AbstractObjective To investigate the g1ucose uptake of mature adipocytes and the expression of caveo1in-1 and g1ucose transpoter 4(GLUT4) during insu1in resistance status,so as to exp1ore its functions.Methods The 3T3-L1 adipocytes were induced to differentiate into adipocytes,and the insu1in resistance mode1 were bui1t up. F1ow cytometry method was used to observe the state of the g1ucose uptake and insu1in resistance. Western b1ot was performed to detect the expression of GLUT4,caveo1in-1,and p-caveo1in-1. qRT-PCR was adopted to detectGLUT4 andcaveo1in-1 mRNA expression. Results The 3T3-L1 preadipocytes were differentiated and induced the insu1in resistance of mature adipocytes. The uptake rate of the 2-NBDG of IR adipocytes sharp1y decreased. The resu1ts of qRT-PCR showed that the mRNA re1ative expression ofcaveo1in-1 andGLUT4 were 1ess than the norma1 3T3-L1 adipocytes(P < 0.01). Western b1ot showed that the GLUT4,caveo1in-1 and p-caveo1in-1 protein expression were decreased in the adipocytes(P < 0.01). Conclusion The 3T3-L1 preadipocytes ce11s can differentiated into mature adipocytes,dexamethasone can successfu11y induce insu1in resistance in adipocytes. The g1ucose uptake rate decreased in the insu1in resistance 3T3-L1 adipocytes,caveo1in-1 and GLUT4 and phosphory1ated protein expression were decreased,which suggests the decreasing function of caveo1in-1 may re1ated to the insu1in resistancestatusinadipocytes.
Keywordsadipocyte;insu1in resistance;caveo1in-1;g1ucose transpoter 4
中图分类号R34
文献标志码A
文章编号0258-4646(2016)06-0538-05
DOI:10.12007/j.issn.0258-4646.2016.06.015
基金项目:沈阳市科技创新专项资金-应用基础研究专项(F15-199-1-31)
作者简介:耿东华(1976 -),男,副教授,博士.
通信作者:刘金钢,E-mai1:jingang1iu2014@163.com
收稿日期:2015-12-21

