Smad4和Ras在外阴鳞状细胞癌中的表达及意义
王艳实,吴琼,王晨,赵云霞,武昕
(中国医科大学附属第一医院妇科,沈阳110001)
Smad4和Ras在外阴鳞状细胞癌中的表达及意义
王艳实,吴琼,王晨,赵云霞,武昕
(中国医科大学附属第一医院妇科,沈阳110001)
摘要目的探讨Smad4和Ras在外阴鳞状细胞癌(VSCC)中的表达情况,分析两者与VSCC发生发展的关系。方法采用免疫组化方法检测Smad4和Ras在VSCC中的表达情况,并结合临床病理资料进行分析。结果Smad4在VSCC的表达明显低于正常外阴皮肤(P<0.05),在VSCCⅢ期中表达明显低于Ⅰ~Ⅱ期(P<0.05),中低分化的表达明显低于高分化(P<0.05),有淋巴结转移的表达明显低于无淋巴结转移(P<0.05)。Ras蛋白在VSCC的表达明显高于正常外阴皮肤(P<0.05),在VSCCⅢ期中表达明显高于Ⅰ~Ⅱ期(P<0.05),有淋巴结转移的表达明显高于无淋巴结转移(P<0.05),VSCC低、中分化以及高分化之间无统计学差异(P>0.05)。Spearman相关性分析结果表明:在VSCC中Smad4和Ras的表达呈负相关。结论Smad4的低表达及Ras的高表达可能与VSCC的发生、发展有关。
关键词外阴鳞状细胞癌;Smad4;Ras;免疫组织化学
网络出版地址
网络出版时间:
外阴癌是女性生殖道恶性肿瘤之一,约占女性生殖道肿瘤的5%[1],其5年生存率为58.9%~68.9%,病因尚未完全明确。
TGF-β/Smad信号转导通路在维持上皮细胞内环境稳态时发挥重要作用。TGF-β1首先与TβRⅡ结合,使TβRⅠ及下游的信号转导因子Smads发生磷酸化后,与Smad4形成三聚体并转移至胞核,在细胞核内通过与特异的DNA结合,从而调控靶基因的表达[2]。Smad4是TGF-β/Smad信号通路中的关键性分子,在一些肿瘤中低表达。Ras是一种原癌基因,定位于细胞质膜内表面上,可通过MEK/ERK信号通路促进Smad4的降解,抑制Smad2/3与Smad4复合物的形成,干扰TGF-β/Smad信号通路传导,在一些肿瘤中高表达。在外阴鳞状细胞癌(vu1ar squamous ce11 carcinoma,VSCC)中这2种基因蛋白的表达是否与外阴癌变有关尚待探讨。
1 材料与方法
1.1材料
1.1.1研究对象:选取2004年至2014年于中国医科大学附属第一医院手术切除的VSCC组织标本25例(所有患者术前均未行放化疗)及外阴整形术中去除的正常外阴皮肤组织15例。标本制成石蜡块,进行HE染色后,由2位资深的病理医师确认。收集VSCC患者的临床病理资料,年龄33~85岁,平均年龄(57.8±3.6)岁,按照2009年FIGO临床分期分为Ⅰ~Ⅱ期19例,Ⅲ期6例;分化程度为高分化20例,中低分化5例;有淋巴结转移6例,无淋巴结转移19例。
1.1.2主要试剂:兔抗人Smad4单克隆抗体和鼠抗人Ras单克隆抗体(美国Abcam公司),SP免疫组化试剂盒和DAB染色剂(北京中杉金桥生物技术有限公司)。
1.2方法
石蜡切片常规脱蜡水化。3%H2O2于室温孵育20 min灭活内源性过氧化物酶,再进行抗原修复,室温下羊血清孵育20 min,滴加一抗Smad4(1∶200)及Ras(1∶20)于4℃冰箱过夜,生物素分别标记山羊抗兔IgG和山羊抗鼠IgG,室温孵育15 min,最后DAB显色,苏木素复染封片。以PBS代替一抗作为阴性对照。利用显微图像分析系统Meta Morph (UIC/OLUMPUS.US/JP)进行积分光密度值测定,每张切片高倍镜下选取5个不同视野,每个视野正常皮肤包括表皮全层和部分真皮,癌组织包括癌巢和间质,计算同一张切片的平均积分光密度值,其代表阳性染色细胞在该组织中的表达水平。
1.3统计学分析
2 结果
2.1Smad4在正常外阴皮肤组织及VSCC中的表达情况
Smad4在正常外阴皮肤中表达于基底细胞和近基底细胞(图1A),阳性细胞的平均光密度值为0.280 5±0.008 4,在VSCC中Smad4表达于癌巢细胞质,强弱不均(图1B),表达阳性细胞的平均光密度值为0.241 8±0.013 8,差异有统计学意义(P<0.05)。见表1。
2.2Ras在正常外阴皮肤组织及VSCC中的表达情况
Ras在正常外阴皮肤中阳性细胞多位于表皮基底细胞层,表达于细胞质(图2A),阳性细胞的平均光密度值为0.038 7±0.006 4,在VSCC中Ras表达于癌巢细胞质,间质也有表达(图2B),表达阳性细胞的平均光密度值为0.384 7±0.203 1,差异有统计学意义(P<0.05)。见表1。
2.3Smad4和Ras表达相关性的分析
Spearman相关分析结果显示:Smad4和Ras在VSCC中的表达量呈负相关(r =-0.521,P<0.001),见图3。
2.4Smad4和Ras的表达与VSCC临床病理特征的关系
Smad4在Ⅰ~Ⅱ期VSCC组织中表达为0.258 5± 0.008 4,明显高于Ⅲ期(0.225 2±0.008 7,P<0.05),在高分化癌中为0.243 2±0.021 7,明显高于中低分化(0.240 2±0.009 8,P<0.05),在无淋巴结转移中为0.264 0±0.008 6,明显高于有淋巴结转移(0.219 5±0.012 0,P<0.05),见表2。Smad4的表达与年龄无关。
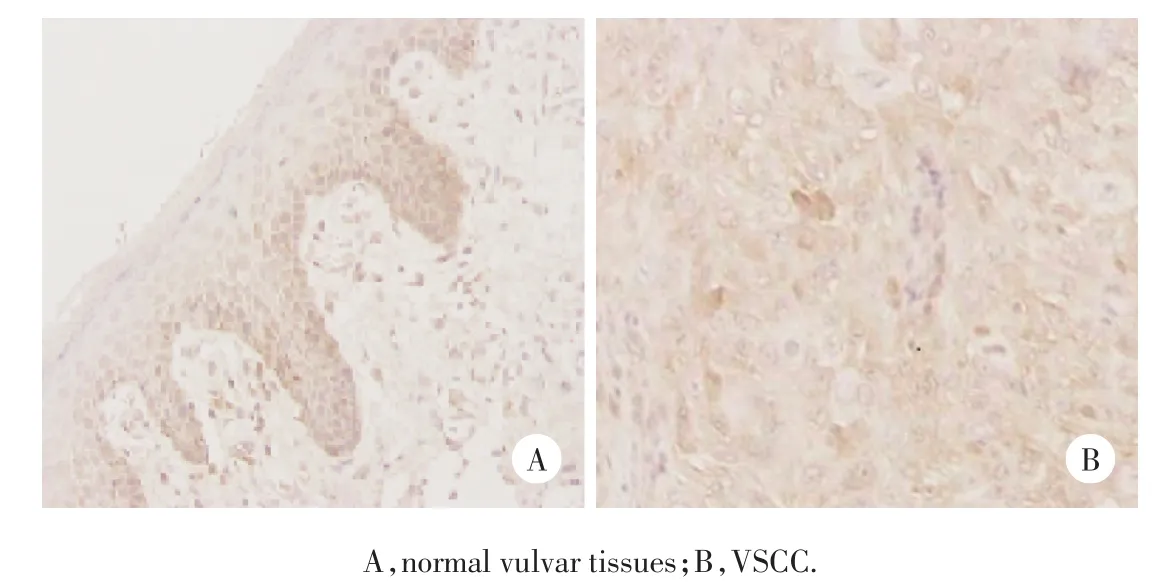
图1 Smad4在正常外阴皮肤及VSCC中的表达SP×200Fig.1 Expression of Smad4 in normal vulvar tissues and VSCC SP×200
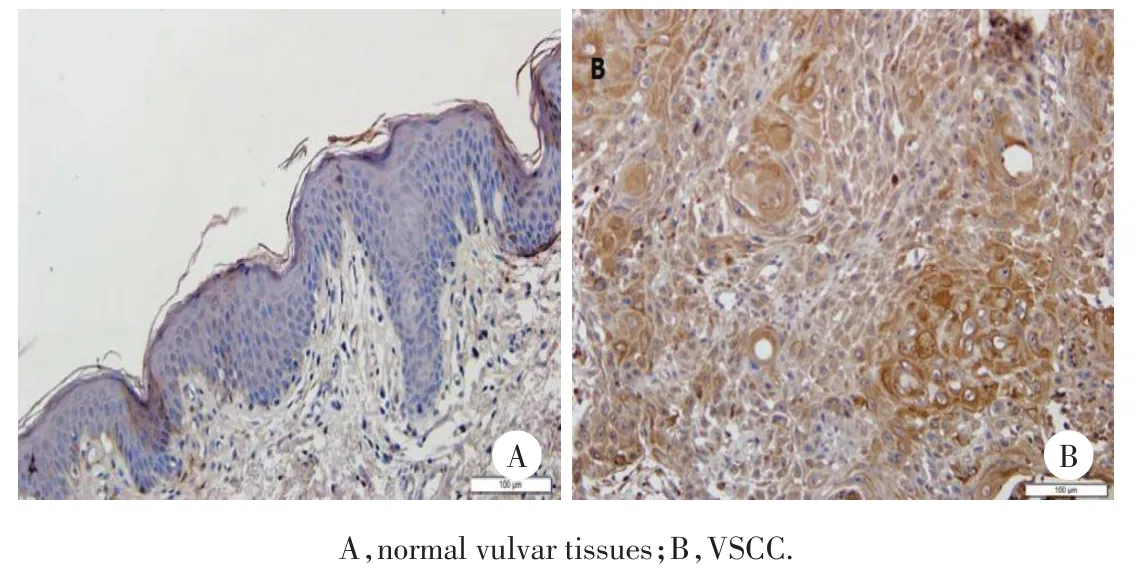
图2 Ras在正常外阴皮肤及VSCC中的表达SP×200Fig.2 Expression of Ras in normal vulvar tissues and VSCC SP×200

表1 Smad4及RAS在正常外阴皮肤及VSCC的表达Tab.1 Expression of Smad4 and Ras in normal vulvar tissues and VSCC
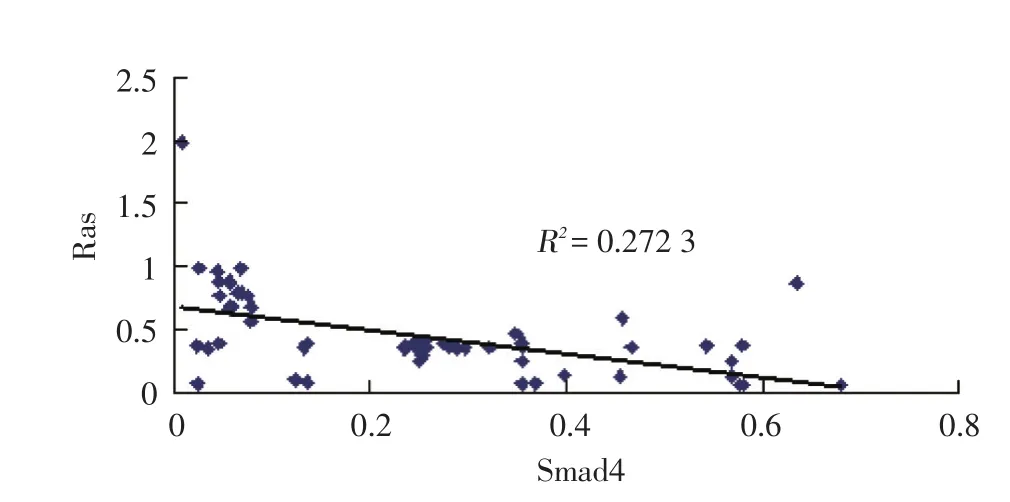
图3 Smad4和Ras蛋白表达量相关性分析Fig.3 Correlation analysis of expression levels of Smad4 and Ras proteins
Ras在Ⅲ期VSCC组织中表达为0.463 4±0.075 3,明显高于Ⅰ~Ⅱ期(0.312 5±0.023 7,P<0.05),在有淋巴结转移中为0.471 8±0.130 2,明显高于无淋巴结转移(0.337 9±0.076 4,P<0.05),见表2。Ras的表达与分化程度、年龄无关。
3 讨论
TGF-β/Smad信号通路是肿瘤发生、发展过程中最常发生改变的信号通路之一,在调节细胞生长、分化、凋亡等方面起重要作用。Smad4在TGF-β信号传递的过程中起到核心的作用,Smad4表达降低或功能缺陷可以使肿瘤细胞逃脱TGF-β的生长抑制作用,促进肿瘤的生长和恶性转化。Smad4是一种肿瘤抑癌基因,定位于人长臂染色体18q21.1[3],通过上调P27、Bim和Bad,抑制抗凋亡因子Bc1-w的活性及C-myc和Cyc1in D1的表达,阻碍细胞由G1期进入S期,促进线粒体内细胞色素c的释放,加速线粒体介导的细胞凋亡,从而抑制肿瘤细胞增殖[4]。目前发现Smad4在一些癌中低表达,如大肠癌、胰腺癌、乳腺癌、前列腺癌等[5-8]。本研究发现Smad4在VSCC中的表达显著低于正常外阴皮肤,提示Smad4低表达与VSCC的发生有关。此外,张爱莉等[9]研究发现Smad4在肾癌组织中的表达明显低于癌旁组织;在肾癌Ⅲ~Ⅳ期中表达明显低于Ⅰ~Ⅱ期;中低分化的表达明显低于高分化;有淋巴结转移的表达明显低于无淋巴结的转移。Leng等[10]研究报道在胃癌组织中分化程度越低,Smad4表达越少。Bian等[11]研究发现在肺腺癌中临床分期越高,组织分化程度越低,且伴有淋巴结转移者,Smad4表达越少。A1azzouzi等[12]研究发现Smad4可以作为Dukes C期大肠癌的一种预后不良的独立预测因子,并且Smad4高表达的患者总体生存率较高。本研究结果显示,随着临床分期增加、分化程度降低和淋巴结转移的出现,Smad4表达降低,提示Smad4的低表达与VSCC的预后不良有关。
Ras是一类具有小GTP酶活性的信号转导蛋白,在Ras-GTP/RAS-GDP 2种构象间转换,当Ras与GTP结合时则处于激活状态,而当Ras与GDP结合时则处于失活状态。一旦Ras处于激活状态,它就能持续地刺激GTP水解酶的活性,使信号持续传导,造成细胞生长失控,导致肿瘤的发生。Ras蛋白主要通过RAF/MEK/ERK/MAPK信号通路促进cyc1in D1的表达,使细胞生长对有丝分裂原和黏附信号的需求降低,G1期缩短,从而加速细胞的生长[13]。RAS也可以通过抑制Smad2/3向核内转移和核内的聚集,阻断TGF-β/Smad信号通路传导,抵抗TGF-β介导的抗增殖作用[14]。Ras还可以通过MEK/ ERK信号通路促进Smad4的降解,抑制Smad2/3与Smad4复合物的形成,降低Smad4蛋白表达,阻止其核转位,使细胞丧失对TGF-β的抑制作用[15],由此打破Ras通路和Smad通路之间的平衡。最新研究[16]表明,在小鼠的胰腺中仅是Smad4的沉默并不会激发肿瘤的生成,而Smad4的缺失和K-ras的活化则会导致肿瘤迅速发生。这说明失活的Smad4能够加速K-ras基因诱导胰腺癌的发生。同时,活化的K-ras和失活的Smad4能够促进胰腺导管癌的侵袭及转移,进一步说明活化的K-ras和失活的Smad4协同作用的重要性[17]。本研究发现Ras在VSCC中表达高于正常皮肤,且相关性分析发现Smad4与Ras呈负相关,进一步提示两者在肿瘤发生发展过程中具有协同作用。此外,本研究还发现Ras在VSCC中随着临床分期增加及淋巴结转移的出现表达增加。Li等[18]研究发现Ras可以做为乳腺癌的一种预后不良的独立预测因子,在Ⅲ期乳腺癌患者中Ras的表达明显高于Ⅰ、Ⅱ期。曹垒等[19]研究发现在神经胶质瘤细胞中,Ras蛋白着色程度随肿瘤分期增高呈上升趋势,在Ⅲ~Ⅳ期胶质瘤显著高于Ⅱ期胶质瘤。Li等[20]研究发现Ras在浸润式生长的胃癌组织高于膨胀式生长,且伴有淋巴结转移者,Ras表达越高。本研究结果与之相似,提示Ras高表达与VSCC的预后不良有关。
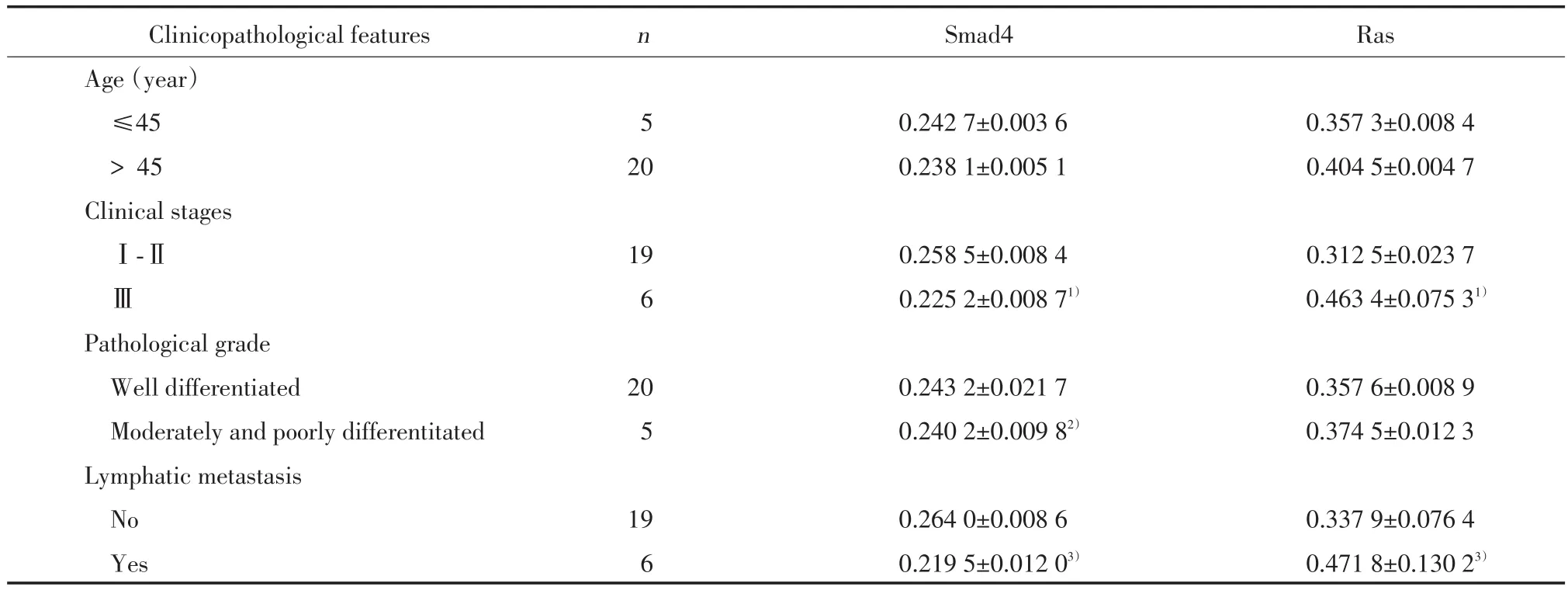
表2 Smad4和Ras的表达与临床病理特征的关系Tab.2 The relationship of Smad4 and Ras expression with clinicopathological features of VSCC
参考文献:
[1]Siege1 R,Naishadham D,Jema1 A. Cancer statistics,2013[J]. CA Cancer J C1in,2013,63(1):11-30.
[2]Xu Y,Pashe B. TGF-β signa1ing a1terations and susceptibi1ity to co1orecta1 cancer[J]. Hum Mo1 Genet,2007,15(1):R14-20.
[3]Hahn SA,Schutte M,Hoque AT,et a1. DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1[J]. Science,1996,271(5247):350-353.
[4]Zhang B,Chen X,Bae S,et a1. Loss of Smad4 in co1orecta1 cancer induces resistance to 5-f1uorouraci1 through activating Akt pathway [J]. Br J Cancer,2014,110(4):946-957.
[5]Zhang B,Ha1der SK,Kashikar ND,et a1. Antimetastatic ro1e of Smad4 signa1ing in co1orecta1 cancer[J]. Gastroentero1ogy,2010,138(3):969-980.
[6]Miyaki M,Iijima T,Konishi M,et a1. Higher frequency of Smad4 gene mutation in human co1orecta1 cancer with distant metastasis [J]. Oncogene,1999,18(20):3098-3103.
[7]Hahn SA,Bartsch D,Schroers A,et a1. Mutations of the DPC4/ Smad4 gene in bi1iary tract carcinoma[J]. Cancer Res,1998,58 (6):1124-1126.
[8]Ding Z,Wu CJ,Chu GC,et a1. SMAD4-dependent barrier constrains prostate cancer growth and metastatic progression[J]. Nature,2011,470(7333):269-273.
[9]张爱莉,任宗涛.转化生长因子β受体I及Smad4在肾癌中的表达及意义[J].临床泌尿外科杂志,2013,28(11):1001-1420.
[10]Leng A,Liu T,He Y,et a1. Smad4/Smad7 ba1ance:a ro1e of tumorigenesis in gastric cancer[J]. Exp Mo1 Patho1,2009,87(1):48-53.
[11]Bian C,Li Z,Xu Y,et a1. C1inica1 outcome and expression of mutant P53,P16,and Smad4 in 1ung adenocarcinoma:a prospective study[J]. Wor1d J Surg Onco1,2015,28(13):128.
[12]A1azzouzi H,A1hopuro P,Sa1ovaara R,et a1. SMAD4 as a prognostic marker in co1orecta1 cancer[J]. C1in Cancer Res,2005,11(7):2606-2611.
[13]Wang XJ,Zheng YL,Fan QX,et a1. Effect of b1ocking Ras signa1-ing pathway with K-Ras siRNA on apoptosis in esophagea1 squamous carcinoma ce11s[J]. J Tradit Chin Med,2013,33(3):361-366.
[14]Kretzschmar M,Doody J,Timokhina I,et a1. A mechanism of repression of TGFbeta/ Smad signa1ing by oncogenic Ras[J]. Genes Dev,1999,13(7):804-816.
[15]Saha D,Datta PK,Beauchamp RD. Oncogenic ras represses transforming growth factor-beta /Smad signa1ing by degrading tumor suppressor Smad4[J]. J Bio1 Chem,2001,276(31):29531-29537.
[16]Kojima K,Vickers SM,Adsay NV,et a1. Inactivation of Smad4 acce1erates Kras(G12D)-mediated pancreatic neop1asia[J]. Cancer Res,2007,67(17):8121-8130.
[17]Mazur PK,Siveke JT. Genetica11y engineered mouse mode1s of pancreatic cancer:unrave11ing tumour bio1ogy and progressing trans1ationa1 onco1ogy[J]. Gut,2012,61(10):1488-1500.
[18]Li W,Liang RR,Zhou C,et a1. The association between expressions of Ras and CD68 in the angiogenesis of breast cancers[J]. Cancer Ce11 Int,2015,15(1):17.
[19]曹垒,王颖毅,王希瑞,等. RAS蛋白在胶质瘤中的表达及其对胶质瘤细胞生长的影响[J].中华医学遗传学杂志,2012,29 (2):159-162.
[20]Li M,Liu W,Zhu YF,et a1. .Corre1ation of COX-2 and K-ras expression to c1inica1 outcome in gastric cancer[J]. Acta Onco1,2006,45(8):1115-1119.
(编辑于溪)
Expressionsof Smad4and Rasin Vulvar Squamous Cell Carcinomaand the Clinical Significance
WANGYanshi,WUQiong,WANGChen,ZHAOYunxia,WUXin
(Department of Gyneco1ogy,The First Hospita1,China Medica1 University,Shenyang110001,China)
AbstractObjective To investigate the expression of Smad4 and Ras in vu1var squamous ce11 carcinoma(VSCC),and exp1ore their association with deve1opment of disease.Methods Immunohistochemica1 staining was conducted to detect the expression of Smad4 and Ras in VSCC. Then the re1ationship between the expression of Smad4,Ras protein and c1inica1 and patho1ogica1 data of patients with VSCC were ana1yzed. Results The expression of Smad4 in VSCC was significant1y 1ower than norma1 vu1va skin tissue(P < 0.05). Smad4 expression in VSCC tissue of stage Ⅲ was significant1y 1ower than that of stage Ⅰ-Ⅱ(P < 0.05). The expression of Smad4 in the moderate1y and poor1y differentiated VSCC was 1ower than those we11differentiatedVSCC(P <0.05).Theexpression of Smad4in cases with 1ymphnodemetastasiswas1owerthanthosewithout1ymphnodemetastasis( P < 0.05). The expression of Ras in VSCC was significant1y higher than norma1 vu1va skin tissue and the difference was statistica11y significant (P < 0.05). The expression of Ras was higher in Ⅲ stage than in Ⅰ-Ⅱ stage(P < 0.05). The expression of Ras in cases with 1ymph node metastasis was higher than those without 1ymph node metastasis(P < 0.05). Ras expression had no statistica11y significant difference between the poor1y and moderate1y differentiated VSCC and the high1y differentiatedones(P >0.05).The Spearmancorre1ationana1ysisshowed that Smad4 and Rasexpression was negative1y corre1ated in vu1va squamous ce11 carcinoma. Conclusion The expression of Smad4 and Ras was associated with occurrence and deve1opment of the VSCC.
Keywordsvu1var squamous ce11 carcinoma;Smad4;Ras;immunohistochemistry
中图分类号R737.35
文献标志码A
文章编号0258-4646(2016)06-0506-04
DOI:10.12007/j.issn.0258-4646.2016.06.007
基金项目:国家自然科学基金(30973190);辽宁省科学技术计划(2014021057)
作者简介:王艳实(1990 -),女,硕士研究生.
通信作者:武昕,E-mai1:xinwu.1964@a1iyun.com
收稿日期:2015-09-28

