慢性高原病患者默认网络改变:基于后扣带回的功能连接研究
孔德民,鲍海华,李超伟,李伟霞,王芳芳
慢性高原病患者默认网络改变:基于后扣带回的功能连接研究
孔德民,鲍海华*,李超伟,李伟霞,王芳芳
[摘要]目的 运用种子点相关的功能连接分析方法探讨慢性高原病(chronic mountain sickness, CMS)患者静息状态下默认网络(default mode network, DMN)的功能连接改变,为CMS患者脑部病变的发病机制做初步影像学探究。材料与方法 收集2012年12月至2015年1月根据CMS诊断和排除标准确诊的24例CMS患者,选择海拔高度、年龄、受教育年限、性别相匹配的25例正常志愿者作对照组,以上均选取男性作为被试,对其行全脑扫描,获取平面回波成像(echo planar imaging, EPI)数据。运用基于MATLAB平台的DPARSF2.2及REST 1.8软件包处理,应用种子点相关的功能连接分析方法,以后扣带回(posterior cingulate cortex, PCC)为种子点,分析静息状态下DMN改变。组内比较采用单样本t检验,组间采用两样本t检验。结果 与正常对照者相比,CMS患者在静息状态时与PCC功能连接强度增加的脑区有:左侧海马旁回、左侧角回、左侧额中回、右侧小脑9区、左侧小脑脚2区。未发现相比正常组功能连接减低脑区。结论CMS患者多个脑区与PCC功能连接强度增加,这为探究CMS患者多种神经精神症状的发病机制提供了重要的影像学依据。
[关键词]慢性高原病;静息状态;磁共振功能成像;默认网络;功能连接
作者单位:青海大学附属医院影像中心,西宁810001
接受日期:2016-01-08
孔德民, 鲍海华, 李超伟, 等. 慢性高原病患者默认网络改变: 基于后扣带回的功能连接研究. 磁共振成像, 2016,7(2): 107–112.
*Correspondence to: Bao HH, E-mail: baohelen2@sina.com
Received 10 Nov 2015, Accepted 8 Jan 2016
ACKNOWLEDGMENTS This work was part of National Natural Science Foundation of China (No. 81060117); International cooperation project of Qinghai provincial science and Technology Department(No. 2012-H-807).
慢性高原病(chronic mountain sickness, CMS)是高海拔习服失败(海拔高度>2500 m)所导致的血红蛋白增多症和动脉低氧血症[1]。该病是影响高原地区居民健康的重要疾病,常见症状有:头痛、气短、乏力、心悸、记忆力减退、耳鸣、食欲差等[2]。本课题前期对CMS患者脑灰质运用基于体素的形态学测量的研究显示,CMS患者较正常对照组多个脑区体积存在差异,其中包括前、后扣带回等默认网络的重要节点[3],故本研究拟对默认网络进行分析。静息态功能磁共振(resting state functional magnetic resonance imaging, rsfMRI)技术是一种能活体无创地反映脑功能活动的技术[4]。Raichle[5]提出大脑功能“默认模式(default mode)”的概念,指当大脑不加工外在任务时回归到基线状态(baseline state),并将支持这一功能的脑区称之为“默认网络”(default mode network,DMN),该网络与静息状态下脑功能活动密切相关。国内外以往的研究中,对高原低氧环境对脑功能影响的功能磁共振研究罕有报道[4]。目前,关于高原低氧环境下CMS患者多种神经系统症状的神经病理学机制还不清楚。本研究采用静息态fMRI技术初步探讨CMS患者默认网络连接的改变,旨在为CMS的影像学研究提供更多的手段和方法,对其临床症状及其发病机制提供更多的影像学依据。
1 材料与方法
1.1研究对象
收集2013年5月至2015年5月于青海大学附属医院确诊的CMS患者25例,其中一例因头动较大而剔除,CMS组共24例,CMS组诊断标准采用慢性高原病国际诊断标准(青海标准主要包括血红蛋白指标以及多种体征评分)[2]。血红蛋白(haemoglobin,Hb)平均值为(233.37±15.63) g/L,年龄平均(41.53±5.40)岁,受教育年限平均(10.30±5.60)年,居住海拔高度平均(3760± 240.30) m,所有患者在检查前均未进行相关治疗。对照组选择年龄、受教育程度和居住海拔高度与CMS组相匹配的正常自愿者,共25例,体格检查均无阳性体征,血常规及血压正常。所有受试者均为右利手,居住海拔均>3000 m,居住年限均为5年以上,没有创伤性脑损伤、脑血管意外、精神病、药物滥用、高血压、糖尿病等病史。由于CMS发病率男性明显高于女性[6],因此两组均选取男性作为研究对象。本项研究经我院伦理委员会审查通过,所有受试者均在试验前被告知相关情况并同意,均签订知情同意协议书。
1.2磁共振数据采集
采用Philips Achieva3.0 T TX多源发射磁共振扫描系统,标准头颅8通道线圈完成扫描。扫描前告知被试者在扫描过程中保持静息状态:放松、安静闭目,不思考问题。静息态fMRI数据采用平面回波成像(echo planar imaging, EPI)序列,扫描参数为:TR/TE=2500 ms/30 ms,翻转角90°,层厚3.5 mm,层间隔0.35 mm,层数为35层,视野224 mm×224 mm,扫描时长6分25秒。并对所有受试者进行常规头部磁共振成像扫描,获取T2WIFlair序列图像用于诊断,扫描参数为:TR/TE= 10000 ms/120 ms,层厚5.5 mm,层间隔1.0 mm,视野220 mm×181 mm,层数为18层。
1.3数据处理及功能连接分析
采用静息态fMRI数据处理软件助手(data processing assistant for resting-state fMRI,DPARSF)对静息态fMRI数据进行预处理。去除最初10个时间点,再进行时间校正和头动校正,头动大于1.5 mm和角度大于1.5度的均剔除,CMS组有一例头动较大剔除,处理完的数据标准化到蒙特利尔神经病学研究所(montreal neurological institute, MNI)标准脑模板上,每个像素被重新采样为3 mm×3 mm×3 mm,高斯平滑采用半高全宽为8 mm×8 mm×8 mm。随后用REST(resting-state fMRI data analysis toolkit)软件,首先对预处理后的数据进行去线性漂移,并对每个时间序列进行带通滤波(0.01~0.08 Hz)。因为以往的静息态fMRI研究中证实后扣带回(posterior cingulate cortex, PCC)为默认网络的重要节点[7],一般认为种子点相关分析方法做默认网络选取PCC为种子点[8],PCC选取采用斯坦福大学FIND lab网站提供的DMN-ROIS模板[9],分析PCC与全脑各体素时间序列的相关性,计算相关系数r,并将相关系数r通过Fisher Z转换成符合正态分布的Z值,最后,利用REST软件分别对CMS组、对照组进行单样本t检验(P<0.001,cluster size≥50,AlphaSim校正)。然后进行双样本t检验(P<0.05, cluster size≥100,未校正),并选取两组数据单样本检验结果并集作为两样本t检验的mask。使用REST及xjview软件呈现功能连接异常脑区,所有结果均采用多重比较校正,满足统计阈值的像素点被投射到蒙特利尔标准模板空间,x、y、z代表其三维空间坐标。
2 结果
静息状态下对照组和CMS组都表现出了默认网络所包括多个脑区与PCC的显著相关,分布区域和以往的国内外研究基本一致[5, 7, 9],主要包括后扣带回、楔前叶、内侧前额叶、前扣带回、双侧部分顶叶、部分颞叶和部分小脑区。与对照组相比,CMS组与PCC功能连接强度显著增加的区域主要有:左侧海马旁回、左侧角回、左侧额中回、右侧小脑9区、左侧小脑脚2区(P<0.05,cluster size≥100)。见表1、图1。
3 讨论
默认网络是近几年脑功能研究中最被关注的静息态网络之一。默认网络是静息状态下活动较高的大脑系统,它包含多个功能联系紧密的脑区。这些脑区主要包括后扣带回/前楔叶、内侧前额叶、双侧角回、双侧外侧颞叶、双侧海马[5, 10]。默认网络在大脑处理静息状态时活动会增强,当任务状态时其活动反而会减低,其与人脑对内外环境的监测、情绪的加工、以及自我内省、维持意识觉醒、情景记忆的提取等高级功能密切相关。国内外学者研究发现,在阿尔茨海默病[11]、癫痫[12]、抑郁症[13]、肝性脑病[14]等多种疾病下默认网络功能连接均存在异常。
脑是对缺氧最敏感的靶器官之一,脑在人体器官中耗氧量较高,并对缺氧非常敏感,因此低氧对大脑功能的影响备受关注[15]。长期缺氧状态下大脑会表现出结构和代谢方面的调节[16-18]。研究发现,前脑岛、前额皮质和前扣带皮层灰质体积减少可能与高海拔居民在缺氧环境下心血管反馈调节,以及有氧代谢能力下降和食欲下降的机制有关[18]。有学者认为,高原低氧环境下代谢减退可能是一种对慢性缺氧的防御机制[19],而且高海拔地区居民的认知[17]、嗅觉功能也会发生改变[20]。CMS患者脑部血流缓慢,脑组织缺氧,而灰质较白质对缺氧更敏感[21]。本研究对默认网络相关的脑区进行研究,探究在慢性高原低氧环境下CMS患者相关脑区改变是否与心血管、呼吸反馈调节以及临床症状的发生有关。
本研究发现静息态下CMS组相对于对照组默认网络多个脑区呈现功能连接度增加。邻近脑区功能代偿性增加的现象可以被视为一种“补偿”(代偿机制)[14],通过有效调动代偿脑资源,在一段时间内可以阻止或者减缓病程的进展,这其中涉及特定脑区神经营养因子分泌增多以及胆碱能活动增加[22]。与对照组相比,CMS组在左侧海马旁回、左侧角回、左侧额中回、右侧小脑9区、左侧小脑脚2区的功能连接度增加。海马旁回在学习、记忆以及应激调节过程中具有的重要作用。而研究表明,长时间暴露于高海拔低氧环境对记忆力是有损害的[23],缺氧主要影响短时记忆[24],其机制可能为海马胆碱系统功能障碍所致[25]。该区连接度增加可能为CMS患者学习、记忆功能下降后的一种延缓损伤的代偿机制。角回是人类视觉性语言中枢,又称阅读中枢,也是默认网络的重要节点,与传入的听觉、视觉与触觉信息的整合有关[26]。该脑区功能连接增加可能与CMS患者阅读能力、信息整合能力以及对外界刺激反应能力改变有关。近年来研究发现,小脑还参与认知、语言及情感调节等功能[27-28]。右侧小脑9区、左侧小脑脚2区脑区功能连接增加,可能与CMS患者认知功能改变、情绪紊乱、易激惹等有关。前额叶皮层是大脑中最复杂的脑区之一,它是人体发育中成熟较晚的新皮层,研究表明与认知、自发反应等高级功能密切相关[29]。前额叶皮层还参与调节交感神经活动、心率和血压的调节[30],因此该区域的改变可能与CMS患者心悸、气促以及高血压发病率增高有关。额中回不仅参与默认网络的组成,而且还参与了认知执行网络,而CMS患者该脑区的激活还可能为了增强认知执行网络功能来弥补运动网络功能减弱的不足[31-32]。
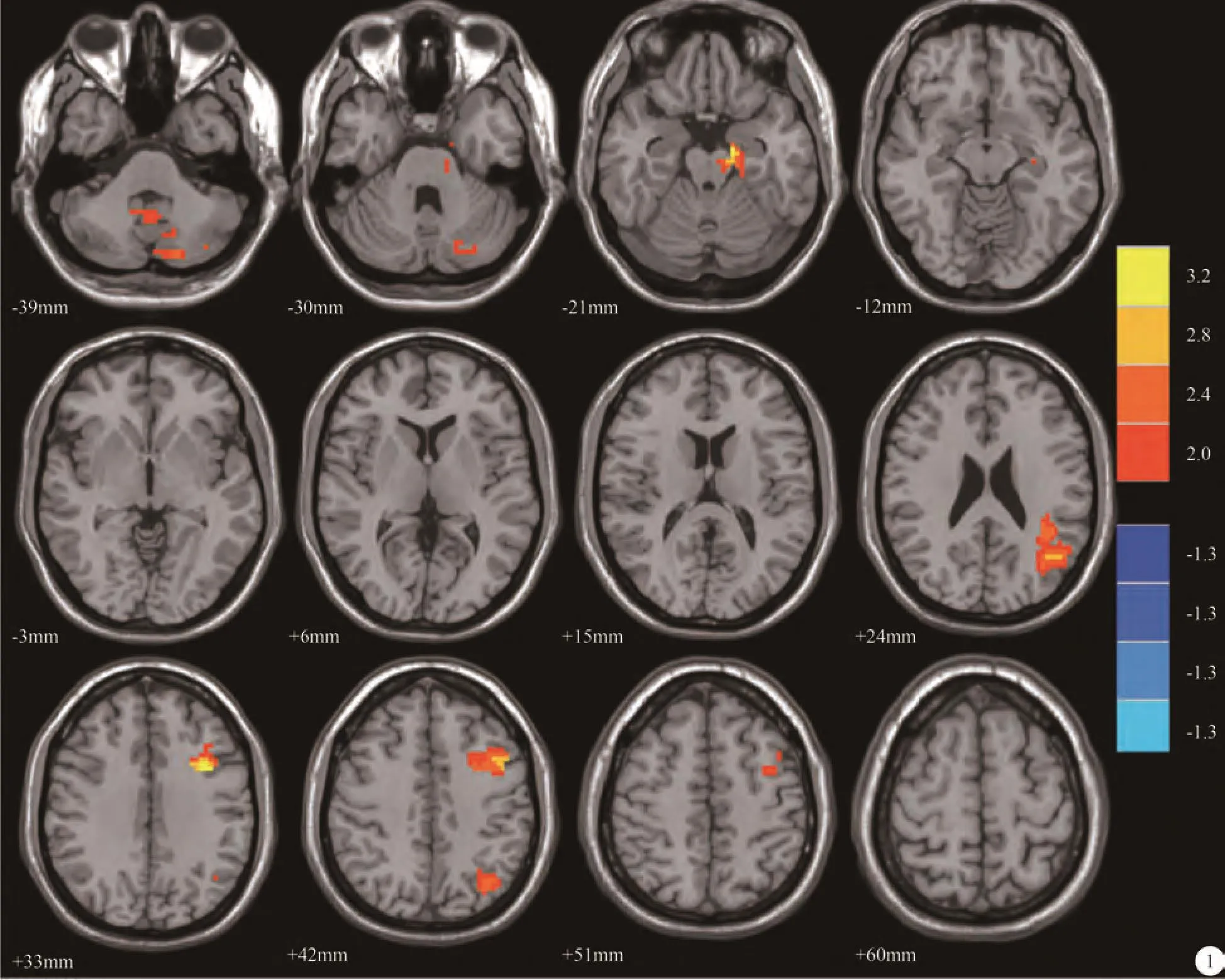
图1 与正常对照者相比,CMS患者在静息状态时与PCC功能连接强度增加的脑区有:左侧海马旁回、左侧角回、左侧额中回、右侧小脑9区、左侧小脑脚2区(P<0.05,cluster size>100)Fig. 1 Compared with normal control group, CMS patients show increased functional connectivity in left parahippocampal gyrus, left angular gyrus, left medial frontal gyrus, right cerebellum 9 area and left Cerebellum Crus 2 with posterior cingulate gyrus(P<0.05, cluster size>100).
本研究还存在一些局限性,主要有:(1)样本量还不够大,可能存在统计学误差;(2)没有进行认知相关的神经量表评估,不能进行和认知改变的相关性分析。(3)本研究的被试者均为男性,可能存在一定的局限性,在后续研究中会考虑加入女性被试。而且从结果来看,两样本比较的激活区多位于左侧,CMS患者默认网络损害是否存在偏侧化问题还需进一步研究。
总之,慢性高原病脑部损害的病理生理改变的机制目前还有很多尚不清楚,许多问题的机制还需进一步研究。本研究采用种子点相关分析方法对慢性高原病患者与PCC相关的网络改变进行了分析,慢性高原病患者默认网络多个区域与PCC功能连接度增加,提示慢性高原病患者在长期慢性低氧环境下脑部默认网络多个脑区改变主要为代偿机制,本课题的多项研究为慢性高原病脑病发病机制研究在影像学方面做了一些基础工作,但是还有很多的问题有待进一步深入研究。
参考文献[References]
[1]Julian CG, Vargas E, Gonzales M, et al. Sleep-disordered breathing and oxidative stress in preclinical chronic mountain sickness (excessive erythrocytosis). Respir Physiol Neurobiol,2013, 186(2): 188-196.
[2]Leon-Velarde F, Maggiorini M, Reeves JT, et al. Consensus statement on chronic and subacute high altitude diseases. High Alt Med Biol, 2005, 6(2): 147-157.
[3]Liu CX, Bao HH, Li WX, et al. Voxel-based morphometry MRI study of gray Matter’s alteration in patients with chronic mountain sickness. Chin J Magn Reson Imaging, 2014, 5(3): 211-215.刘彩霞, 鲍海华, 李伟霞, 等. 慢性高原病患者脑灰质变化的VBM-MRI研究. 磁共振成像, 2014, 5(3): 211-215.
[4]Yang CS, Bao HH. Pathophysiology and neuroimaging development of brain alterations in chronic mountain sickness. Chin J Magn Reson Imaging, 2015, 6(2): 151-154.杨丛珊, 鲍海华. 慢性高原病脑部改变的病理生理及神经影像学进展. 磁共振成像, 2015, 6(2): 151-154.
[5]Raichle ME, MacLeod AM, Snyder AZ, et al. A default mode of brain function. Proc Natl Acad Sci U S A, 2001, 98(2): 676-682.
[6]Wu TY. Chronic mountain sickness on the Qinghai-Tibet plateau. Chinese Journal of Practical Internal Medicine, 2012,32(5): 321-323.吴天一. 我国青藏高原慢性高原病研究的最新进展. 中国实用内科杂志, 2012, 32(5): 321-323.
[7]Shao HL, Du XX. Progress of the research on the role of key
node of precuneus/posterior cingulated cortex in default brain functional network. Chin J Magn Reson Imaging, 2011, 2(3): 215-217.邵辉丽, 杜小霞. 楔前叶/后扣带皮层在静息态功能网络中起关键节点作用的研究进展. 磁共振成像, 2011, 2(3): 215-217.
[8]Liu P, Zhang Y, Zhou G, et al. Partial correlation investigation on the default mode network involved in acupuncture: an fMRI study. Neurosci Lett, 2009, 462(3): 183-187.
[9]Greicius MD, Krasnow B, Reiss AL, et al. Functional connectivity in the resting brain: a network analysis of the default mode hypothesis. Proc Natl Acad Sci U S A, 2003,100(1): 253-258.
[10]Fox MD, Snyder AZ, Vincent JL, et al. The human brain is intrinsically organized into dynamic, anticorrelated functional networks. Proc Natl Acad Sci U S A, 2005, 102(27): 9673-9678.
[11]Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping,assessment of stability, and relation to Alzheimer's disease. J Neurosci, 2009, 29(6): 1860-1873.
[12]Zhang ZQ, Lu GM, Zhong Y, et al. Changes in default-mode network connectivity in temporal lobe epilepsy: a functional MRI study. Journal of Medical Postgraduates, 2009, 22(1): 36-39.张志强, 卢光明, 钟元, 等. 内侧颞叶癫痫患者脑缺省模式网络改变的功能MRI研究. 医学研究生学报, 2009, 22(1): 36-39.
[13]Zhu JJ, Peng DH, Li JQ, et al. Default-mode network connectivity in depression: a resting-state fMRI study. Chin J Nerv Ment Dis, 2014, 40(8): 454-458.朱俊娟, 彭代辉, 李建奇, 等. 静息态功能磁共振下抑郁症默认网络功能连接的研究. 中国神经精神疾病杂志, 2014,40(8): 454-458.
[14]Qi RF, Zhang ZJ, Lu GM, et al. Brain altered default-mode network in hepatic encephalopathy patients. J Clin Radiol, 2010,29(6): 734-737.戚荣丰, 张宗军, 卢光明, 等. 肝性脑病患者静息状态下脑缺省模式网络的改变. 临床放射学杂志, 2010, 29(6): 734-737.
[15]Davis PR, Pattinson KT, Mason NP, et al. High altitude illness. J R Army Med Corps, 2011, 157(1): 12-17.
[16]Yan X, Zhang J, Gong Q, et al. Cerebrovascular reactivity among native-raised high altitude residents: an fMRI study. BMC Neurosci, 2011, 12(39): 94.
[17]Yan X, Zhang J, Gong Q, et al. Prolonged high-altitude residence impacts verbal working memory: an fMRI study. Exp Brain Res, 2011, 208(3): 437-445.
[18]Zhang J, Yan X, Shi J, et al. Structural modifications of the brain in acclimatization to high-altitude. PLoS One, 2010, 5(7): e11449.
[19]Hochachka PW, Clark CM, Brown WD, et al. The brain at high altitude: hypometabolism as a defense against chronic hypoxia?. J Cereb Blood Flow Metab, 1994, 14(4): 671-679.
[20]Yan X, Zhang J, Gong Q, et al. Appetite at high altitude: an fMRI study on the impact of prolonged high-altitude residence on gustatory neural processing. Exp Brain Res, 2011, 208(4): 495-499.
[21]Wang DY, Bao HH, Zhao XP, et al. Multi-slice spiral computed tomography manifestations of brain and cerebral hemodynamics inchronic mountain sickness. J Pract Radiol, 2011, 27(3): 322-326.王铎尧, 鲍海华, 赵希鹏, 等. 慢性高原病脑部MSCT表现与血流动力学研究. 实用放射学杂志, 2011, 27(3): 322-326.
[22]Li H, Tao L, Ni P, et al. Resting-state functional magnetic resonance imaging study of alzheimer’s patients. China Medical Devices, 2014, 29(11): 15-18.李辉, 陶磊, 倪萍, 等. 阿尔茨海默病患者静息态功能磁共振研究. 中国医疗设备, 2014, 29(11): 15-18.
[23]Zhang J, Liu H, Yan X, et al. Minimal effects on human memory following long-term living at moderate altitude. High Alt Med Biol, 2011, 12(1): 37-43.
[24]He JC, Xia YZ. Effect of chronic hypoxia and APP/PS1 gene for alzheimer's disease. Zhejiang Medical Association. Zhejiang Psychosomatic Medicine Academic Conference, Quzhou, 2013.何金彩, 夏叶子. 慢性低氧及APP/PS1基因对阿尔茨海默病发病的影响. 浙江省医学会. 2013年浙江省心身医学学术年会,衢州, 2013.
[25]Lin YY, Chen KY, Huo XL, et al. Cholinergic dysfunctions are correlated with memory deficits in rats exposed to chronic hypoxia hypercapnia. Chin J Neurol, 2013, 46(1): 47-50.林盈盈, 陈轲扬, 霍鑫龙, 等. 慢性低氧高二氧化碳大鼠记忆障碍与脑内胆碱能失调的关系. 中华神经科杂志, 2013,46(1): 47-50.
[26]Zhao XH, Wang PJ, Li CB, et al. Preliminary fMRI explore of the wernieke-geschwind model of language. Chin J Med Imaging Technol, 2004, 20(12): 1836-1838.赵小虎, 王培军, 李春波, 等. Wernicke-Geschwind语言模型的fMRI初步检验. 中国医学影像技术, 2004, 20(12): 1836-1838.
[27]Timmann D, Drepper J, Frings M, et al. The human cerebellum contributes to motor, emotional and cognitive associative learning. Cortex, 2010, 46(7): 845-857.
[28]Murdoch BE. The cerebellum and language: historical perspective and review. Cortex, 2010, 46(7): 858-868.
[29]Lv XF. Multimode MRI research on brain of patients with HBV-related cirrhosis without overt hepatic encephalopathy in the resting state. Guangzhou: Southern Medical University,2012.吕晓飞. 无明显肝性脑病的乙肝肝硬化患者脑静息态下多模态MRI研究. 广州: 南方医科大学, 2012.
[30]Wager TD, Waugh CE, Lindquist M, et al. Brain mediators of cardiovascular responses to social threat: part I: Reciprocal dorsal and ventral sub-regions of the medial prefrontal cortex and heart-rate reactivity. Neuroimage, 2009, 47(3): 821-835.
[31]Yu C, Zhou Y, Liu Y, et al. Functional segregation of the human cingulate cortex is confirmed by functional connectivity based neuroanatomical parcellation. Neuroimage, 2011, 54(4): 2571-2581.
[32]Ursu S, Clark KA, Aizenstein HJ, et al. Conflict-related activity in the caudal anterior cingulate cortex in the absence of awareness. Biol Psychol, 2009, 80(3): 279-286.
Changes of default mode network in patients with chronic mountain sickness: evidence from PCC functional connectivity
KONG De-min1, BAO Hai-hua1*, LI Chao-wei1, LI Wei-xia1, WANG Fang-fang1
Department of Radiology, Affiliated hospital of Qinghai University, Xi’ning 810001,China
Key wordsChronic mountain sickness; Resting state; Functional magnetic resonance imaging; Default mode network; Functional connection
AbstractObjective: To explore the changes of default mode network (DMN) in CMS patients, to investigate the pathogenesis of brain lesions in patients with CMS. Materials and Methods: Twenty-four patients with clinically diagnosed CMS and age, sex, years of education, altitude matched 25 cases of normal volunteers underwent whole brain scan, and EPI images were acquired. The difference in DMN between the two groups was analyzed by defining posterior cingulate cortex (PCC) as seed region. Results: Compared with normal control group, posterior cingulate showed increased function connectivity with left parahippocampal gyrus, left angular gyrus, left medial frontal gyrus, right cerebellum 9 area and left cerebellum crus 2 area of CMS patients. Conclusion: CMS patients had changed functional connection in many regions, it might be associated with the pathogenesis of CMS patients .
基金项目:国家自然科学基金项目(编号:81060117);青海省科技厅国际合作项目(编号:2012-H-807)
通讯作者:鲍海华,E-mail: baohelen2@sina.com
收稿日期:2015-11-10
中图分类号:R445.2;R555
文献标识码:A
DOI:12015/j.issn.1674-8034.2016.02.005

